间隙连接蛋白43对胰腺癌细胞株BxPC3凋亡的作用及其机制研究
2009-11-27孙燕姚玮艳张永平乔敏敏袁耀宗
孙燕 姚玮艳 张永平 乔敏敏 袁耀宗
·论著·
间隙连接蛋白43对胰腺癌细胞株BxPC3凋亡的作用及其机制研究
孙燕 姚玮艳 张永平 乔敏敏 袁耀宗
目的研究间隙连接蛋白43(Cx43)在胰腺癌细胞凋亡中的作用,并探讨其机制。方法采用脂质体2000法将pcDNA-Cx43、pcDNA-Cx43N、空质粒pcDNA3.0、siRNA-Cx43和对照siRNA-NC分别转染BxPC3细胞。Western blotting检测细胞Cx43蛋白表达、细胞色素C(Cyt C)含量;流式细胞仪检测细胞凋亡、线粒体膜电位;荧光分光光度计检测细胞Caspase-9和Caspase-3活性;染料传递法测定细胞间间隙连接(GJ)。结果Cx43转染BxPC3细胞后, Cx43蛋白表达明显上调,细胞凋亡从空质粒转染组的(6.35±0.43)%增加到(14.29±1.24)%,经H2O2处理后,从(20.34±2.47)%增加到(31.27±2.56)%(Plt;0.05),同时线粒体膜电位下降,Cyt C从线粒体释放增多,Caspase蛋白酶活性增加;而siRNA43干扰细胞后,细胞凋亡从(7.42±0.47)%减少到(5.19±1.37)%,经H2O2处理后,从(19.43±1.71)%减少到(11.67±1.97)%(Plt;0.05),线粒体膜电位去极化,Cyt C从线粒体释放减少,Caspase酶活性下调。细胞间间隙连接指数在无GJ抑制剂β-GA情况下从对照组的14.52±0.57增加到pcDNA-Cx 43转染组的23.05±3.84,在存在β-GA情况下从1.70±0.24增加到3.84±0.45(Plt;0.05),但细胞凋亡率改变无显著差异。结论Cx43可通过线粒体凋亡途径促进BxPC3细胞凋亡,Cx43调节细胞凋亡存在间隙连接以外的机制。
胰腺肿瘤; 连接蛋白43; 间隙连接; 细胞凋亡
间隙连接(gap junction,GJ)由间隙连接蛋白(connexins,Cx)构成,相邻细胞通过间隙连接所介导的细胞间间隙连接通讯(gap junction intercellular communication,GJIC)进行信息、能量和物质的交换[1],在维持组织内环境稳态中起重要作用[2]。目前已确定人类有21种连接蛋白[3]。研究发现,许多促癌物通过抑制Cx的途径阻断GJIC,使细胞增殖和凋亡的调控信号传递失控,而凋亡诱导剂可以增强Cx表达和GJIC功能,从而抑制肿瘤的生长和恶性转化[4]。Cx43 作为最常见的一种连接蛋白,主要在心肌、平滑肌、胰腺等多种组织细胞表达。本实验将插入Cx43的载体和针对Cx43的siRNA转染胰腺癌细胞株BxPC3,观察转染细胞凋亡的变化,探讨Cx43在细胞凋亡中的作用机制。
材料与方法
一、siRNA-Cx43、siRNA-NC和pcDNA-Cx43、pcDNA-Cx43N载体的构建和细胞转染
针对Cx43的siRNA(siRNA-Cx43)和阴性对照siRNA(siRNA-NC)合成及转染BxPC3细胞由我们前期工作完成[5]。
按Homo sapiens Cx43基因序列使用primer5软件设计Cx43引物。上游序列为5′-CCCAAGCTTGGGATGGGTGACTGGAGCGCC-3′,下游序列为5′-CGCGGATCCGCGCTAGATCTCCAGGTCATC-3′,上游序列引入HindⅢ酶切位点,下游序列引入BamHⅠ酶切位点,引物由上海生工公司合成。目的产物1173 bp。将PCR扩增的产物通过酶切,再连接至质粒pcDNA3.0。重组质粒pcDNA-Cx43常规转化DH5a,涂布在含有氨苄青霉素的LB固体培养基培养12 h,挑取单克隆摇菌,菌液经测序鉴定正确后大量制备。同时,根据Cx43第130~136位氨基酸残基缺失突变可抑制GJ生成[6]的原理,设计Cx43突变体(Cx43N)的引物。上游为5′-GACATGCACTTGAAGCAGTACGGTATTGAAGAGCAT-3′,下游为5′-CTGTACGTGAACTTCGTCATGCCATAACTTCTCGTA-3′。以pcDNA-Cx43载体DNA为模板,根据基因定点突变试剂盒(碧云天公司)操作手册进行PCR扩增。突变产物同样插入pcDNA3.0,重组质粒pcDNA-Cx43N转化大肠杆菌、测序鉴定和质粒大量制备。
人胰腺癌细胞株BxPC3购自美国ATCC,以3×105/孔接种于6孔板中,置无抗生素的培养基中培养至90%~95%融合时,按LipofectamineTM2000转染试剂盒(Invitrogen公司)说明书,将pcDNA-Cx43、pcDNA-Cx43N和空载体pcDNA3.0分别转染BxPC3细胞。同样,当细胞融合达30%~50%时,将siRNA-Cx43和siRNA-NC分别转染BxPC3细胞。
二、转染细胞Cx43蛋白表达的检测
抽提各转染组BxPC3细胞蛋白,常规Western blotting检测Cx43蛋白表达。
三、细胞凋亡检测
采用AnnexinⅤ/PI双染法。将5个转染组BxPC3细胞以1×105/孔接种于24孔板培养,每组设6个复孔。24 h后其中3个孔加凋亡诱导剂H2O2400 μmol/L,3个孔不加,继续培养24 h。收集细胞,调整细胞浓度为1×106细胞/ml,加入5 μl AnnexinⅤ-FITC(20 mg/L)和5μl PI(50 mg/L),避光室温反应15 min,流式细胞仪分析。以亲本BxPC3细胞作为对照。
将pcDNA-Cx43 、pcDNA3.0转染的BxPC3细胞在24孔板中培养,设6个复孔,每孔加入H2O2400 μmol/L。24 h后其中3个孔加50 μmol/L GJ抑制剂β-GA,3孔不加,继续培养24 h,同法测细胞凋亡率。
四、线粒体膜电位检测
按照线粒体膜电位检测试剂盒Invitrogen公司说明书操作。设6个复孔的pcDNA-Cx43、pcDNA-Cx43N、pcDNA3.0、siRNA-Cx43和siRNA-NC转染组细胞培养24 h后,其中3个孔加400 μmol/L H2O2,另3个孔不加,继续培养24 h。收集各组细胞,调节细胞浓度为1×106细胞/ml,加入10 μl 200 μmol/L的JC-1,继续培养15~30 min。以亲本细胞为阳性对照,加入1 μl CCCP (线粒体电子传递链抑制剂),37℃孵育5 min。各组细胞洗涤、重悬后用流式细胞仪分析。线粒体膜电位较高时,JC-1产生红色荧光,线粒体膜电位较低时,JC-1产生绿色荧光,以绿光/红光表示,比值高,膜电位低。
五、细胞色素C(Cyt C)释放水平检测
收集5个转染组培养48 h的细胞,加细胞裂解液, 750 g离心10 min,取上清,再10 000 g离心15 min,取上清。Western blotting法检测Cyt C的水平。
六、Caspase-9和Caspase-3酶活性检测
按Caspase-9和Caspase-3酶活性检测试剂盒(Biovision公司)说明书操作。收集培养48 h的5个转染组细胞,PBS洗涤后加荧光底物37℃反应1 h,应用荧光分光光度计分析。以亲本BxPC3测定值作为基数1,其他各组细胞以其的倍数表示。
七、细胞间间隙连接检测
采用Kapoor等[7]提出的染料传递实验方法进行。5个转染细胞组设6个复孔培养24 h,其中3孔加50 μmol/L GJ抑制剂β-GA(Sigma公司),3孔不加,继续培养24 h,用可穿过间隙连接的发绿色荧光染色的探针Calcein-AM(Invitrogen公司)标记作为供体细胞。用发红色荧光的细胞膜标记探针DiIC18处理的亲本BxPC3细胞作为受体细胞。以供体∶受体1∶5的比例共孵育2 h,用流式细胞仪分析。如果供体和受体细胞间存在间隙连接,绿色的calcein-AM将从供体细胞转移至红色的受体细胞使受体细胞变成橙色。细胞间间隙连接指数=发生细胞间间隙连接细胞数/总的受体细胞数/供体细胞数。
八、统计学分析

结 果
一、细胞Cx43蛋白表达的变化
pcDNA-Cx43和pcDNA-Cx43N组细胞Cx43表达增加,而siRNA-Cx43组细胞的Cx43表达较siRNA-NC组显著减少(图1)。
二、细胞凋亡率的变化
pcDNA-Cx43、pcDNA-Cx43N、pcDNA3.0、siRNA-Cx43、siRNA-NC组及亲本BxPC3细胞未经H2O2处理的细胞凋亡率分别为(14.29±1.24)%、(12.53±2.32)%、(6.35±0.43)%、(5.19±1.37)%、(7.42±0.47)%和(4.57±0.51)%;经H2O2处理的细胞凋亡率分别为(31.27±2.56)%、(29.41±2.86)%、(20.34±2.47)%、(11.67±1.97)%、(19.43±1.17)%和(18.63±1.29)%。pcDNA-Cx43、pcDNA-Cx43N组细胞凋亡率较pcDNA3.0组和亲本组显著增加(Plt;0.05);siRNA-Cx43与siRNA-NC组及亲本组的凋亡率在无H2O2处理时无显著差异,而在H2O2处理后,表达显著下调(Plt;0.05)。

图1 Cx43蛋白表达
三、转染细胞线粒体膜电位、Caspase-9,-3活性、Cyt C释放的变化
pcDNA-Cx43、pcDNA-Cx43N、pcDNA3.0、siRNA-Cx43、siRNA-NC组未经H2O2处理时细胞线粒体的比值分别为0.27±0.04、0.22±0.05、0.12±0.02、0.15±0.01、0.19±0.04;H2O2处理后分别为0.58±0.05、0.53±0.02、0.35±0.07、0.21±0.07、0.40±0.05。pcDNA-Cx43和pcDNA-Cx43N组细胞的线粒体膜电位较pcDNA3.0组显著降低(Plt;0.05),而siRNA-Cx43组细胞的膜电位较siRNA-NC组显著增加(Plt;0.05)。
pcDNA-Cx43、pcDNA-Cx43N、pcDNA3.0、siRNA-Cx43、siRNA-NC组未经H2O2处理时细胞的Caspase-9及Caspase-3活性分别为2.43±0.58、2.07±0.47、1.19±0.17、1.32±0.19、1.72±0.27以及1.35±0.32、1.17±0.21、0.84±0.24、1.12±0.27、1.47±0.11;经H2O2处理后分别为6.85±0.67、6.34±0.57、3.82±0.54、2.43±0.28、4.52±0.74以及5.41±0.67、4.93±0.17、2.44±0.47、1.52±0.09、2.54±0.17。pcDNA-Cx43和pcDNA-Cx43N组细胞的Caspase-9、-3活性明显高于pcDNA3.0组(Plt;0.05),而siRNA-Cx43组细胞的Caspase-9、-3活性较siRNA-NC组显著降低(Plt;0.05)。
pcDNA-Cx 43组细胞胞质CytC含量较其他几组显著增加;经H2O2处理后,pcDNA-Cx 43组胞质Cyt C含量依然明显升高,而低表达Cx43细胞胞质CytC含量明显减少(图2)。
四、BxPC3细胞凋亡与GJIC的关系
pcDNA-Cx43、pcDNA-Cx43N、pcDNA3.0、siRNA-Cx43、siRNA-NC组细胞间间隙连接指数在无β-GA情况下分别为23.05±3.84、13.11±0.68、14.52±0.57、5.45±0.24、13.20±2.31;存在β-GA情况下分别为3.84±0.45、1.24±0.22、1.70±0.24、0.45±0.17、2.31±0.27。pcDNA-Cx 43组的细胞间间隙连接指数明显高于其他各组,而siRNA-Cx43组明显下降(Plt;0.05)。但pcDNA-Cx43组在存在或不存在β-GA情况下的细胞凋亡率分别为(25.82±1.47)%和(31.12±1.38)%,pcDNA3.0组分别为(17.12±0.98)%和(20.04±1.25)%,无显著差异。提示GJIC与细胞凋亡无关联。
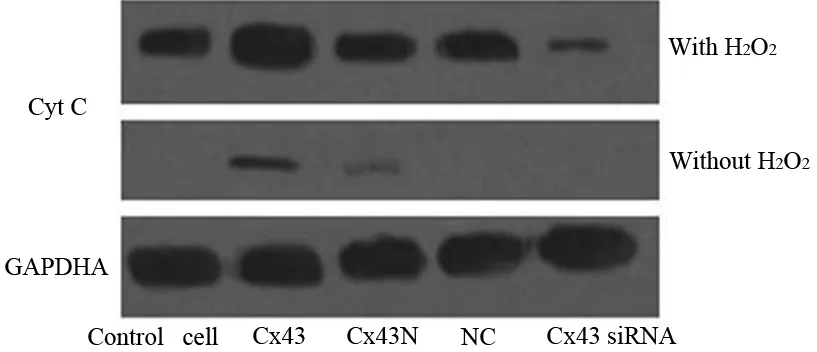
图2 各组细胞胞质中Cyt C蛋白含量
讨 论
多种恶性肿瘤细胞普遍存在着Cx基因表达的严重受抑、缺失和间隙连接通讯功能的缺陷,而且肿瘤的恶性程度与Cx43基因的表达呈负相关。这一功能的恢复又表现出肿瘤生长控制和转化表型抑制[8]。如用RNA干扰下调Cx43的表达可促进乳腺癌细胞的恶性表型[9];将Cx43 基因转染至Cx43基因缺陷的HeLa细胞,Cx43表达上调,癌细胞的生长明显缓慢、恶性表型受抑制[10]。本实验也显示了Cx43转染的BxPC3细胞凋亡增加,而下调Cx43的表达,能减少细胞凋亡,表明Cx43对BxPC3的凋亡具有保护作用。
Cx43及其组成的GJ与细胞周期和细胞死亡、生长的调控有着密切的关系。这一调控作用可以通过GJ也可以不通过GJ 起作用[11]。本文应用GJ抑制剂β-GA抑制细胞间间隙连接通讯。结果转染Cx43的BxPC3细胞的GJIC明显减少,但是由H2O2引起的凋亡却未明显受到抑制,表明可能有细胞间间隙连接以外的机制参与Cx43调节凋亡的过程。
线粒体凋亡是内源性细胞凋亡的主要原因,线粒体膜电位下降通常是线粒体凋亡过程中最早发生的事件。Cyt C从线粒体内释放至胞质是线粒体步入凋亡途径的一个标志,线粒体释放的CytC可以激活Caspase蛋白酶家族,从而引起细胞凋亡。Boengler等[12]报道,Cx43除可定位于细胞膜上,还可定位于线粒体膜上。本研究显示,Cx43转染BxPC3细胞后,细胞的线粒体膜电位下降,CytC从线粒体释放增加,Caspase酶活性上调;而用siRNA下调BxPC3的Cx43表达,如果相反,提示Cx43对细胞凋亡的调节作用依赖线粒体凋亡信号转导通路。但Cx43是通过何种信号分子作用从而激活线粒体凋亡途径的的机制目前尚未清楚,有待进一步研究。
[1] Krysko DV,Mussche S,Leybaert L,et al.Gap junctional communication and connexin43 expression in relation to apoptotic cell death and survival of granulosa cells.J Histochem Cytochem,2004,52:1199-1207.
[2] Vinken M,Vanhaecke T,Papeleu P,et al.Connexins and their channels in cell growth and cell death.Cell Signal,2006,18:592-600.
[3] Evans WH,Martin PE.Gap junctions: structure and function (Review),Mol Membr Biol,2002,19:121-136.
[4] Ogawa T,Hayashi T,Tokunou M,et al.Suberoylanilide hydroxamic acid enhances gap junctional intercellular communication via acetylation of histone containing connexin 43 gene locus.Cancer Res,2005,65:9771-9778.
[5] 孙燕,袁耀宗,万虹宇,等.下调间隙连接蛋白43表达促进人胰腺癌细胞的侵袭和血管形成.胃肠病学,2009,14::39-43.
[6] Wang M,Martinez AD,Berthoud VM,et al.Connexin43 with a cytoplasmic loop deletion inhibits the function of several connexins.Biochem Biophys Res Commun,2005,333:1185-1193.
[7] Kapoor P,Saunders MM,Li Z,et al.Breast cancer metastatic potential: correlation with increased heterotypic gap junctional intercellular communication between breast cancer cells and osteoblastic cells.Int J Cancer,2004,111:693-697.
[8] Su YA,Bittner ML,Chen Y,et al.Identification of tumor-suppressor genes using human melanoma cell lines UACC903,UACC903(+6),and SRS3 by comparison of expression profiles.Mol Carcinog,2000,28:119-127.
[9] Shao Q,Wang H,McLachlan E,et al.Down-regulation of Cx43 by retroviral delivery of small interfering RNA promotes an aggressive breast cancer cell phenotype.Cancer Res,2005,65:2705-2711.
[10] Giaume C,Venance L.Intercellular calcium signaling and gap junctional communication in astrocytes.Glia,1998,24:50-64.
[11] Plotkin LI,Bellido T.Bisphosphonate-induced,hemichannel-mediated,anti-apoptosis through the Src/ERK pathway:a gap junction-independent action of connexin43,Cell Commun Adhes,2001,8:377-382.
[12] Boengler K,Dodoni G,Rodriguez-Sinovas A,et al.Connexin 43 in cardiomyocyte mitochondria and its increase by ischemic preconditioning.Cardiovasc Res,2005,67:234-244.
2008-09-10)
(本文编辑:屠振兴)
Roleofconnexin43inapoptosisofpancreaticcancercelllineBxPC3
SUNYan,YAOWei-yan,ZHANGYong-ping,QIAOMin-min,YUANYao-zong.
DepartmentofGastroenterology,RuijinHospital,MedicalSchool,ShanghaiJiaotongUniversity,Shanghai200025,China
YUANYao-zong,Email:yyz28@medmail.com.cn
ObjectiveTo investigate the role of connexin 43 (Cx43) in the apoptosis of pancreatic cancer cell line BxPC and its possible mechanism.MethodspcDNA-Cx43, pcDNA-Cx43N, pcDNA3.0, siRNA-Cx43 and siRNA-NC were transfected into BxPC3 cells via liposome method. Cx43 protein and Cytochrome C (Cyt C) concentration was determined by Western blot,and the apoptosis was analyzed by Annexin V/PI binding assay. The mitochondria apoptosis pathway involved in Cx43 associated apoptosis was examined which contains the depolarization of mitochondrial membrane potential (MMP); fluorospectrophotometer was used to measure the activities of caspase-3 and caspase-9. Gap junction intercellular communication(GJIC) was determined by dye-transfer method.ResultsCx43 protein expression increased after BxPC3 transfection, apoptosis rate increased from (6.35±0.43)% in empty vector transfection group to (14.29±1.24)%; after H2O2 treatment, apoptosis rate increased from (20.34±2.47)% to (31.27±2.56)% (Plt;0.05). Meanwhile, mitochondrial membrane potential was decreased, Cyt C was increasingly released from mitochondria, caspases activities were increased; after siRNA43 interference, apoptosis rate decreased from (7.42±0.47)% to (5.19±1.37)%, after H2O2treatment, apoptosis rate decreased from (19.43±1.71)% to (11.67±1.97)% (Plt;0.05). Decreased mitochondrial membrane potential and Cyt C
release were observed, caspases activities were decreased. GJIC of pcDNA-Cx 43 transfection group increased from 14.52±0.57 to 23.05±3.84, and it increased from 1.70±0.24 to 3.84±0.45 in the presence of β-GA (Plt;0.05). But the apoptosis rate was not significantly different.ConclusionsCx43 could promote BxPC3 apoptosis via mitochondrial apoptotic signal pathway, and the possible mechanism included signal pathway other than GJIC.
Pancreatic neoplasms; Connexin 43; Gap junction; Apoptosis
10.3760/cma.j.issn.1674-1935.2009.06.009
200025 上海,上海交通大学医学院附属瑞金医院消化科
袁耀宗,Email:yyz28@medmail.com.cn
