头孢唑啉钠与莫西沙星配伍稳定性观察
2009-09-16066100北京军区北戴河疗养院宋畅张丽梅路凯华
066100 北京军区北戴河疗养院 宋畅 张丽梅 路凯华
头孢唑啉钠与莫西沙星配伍稳定性观察
066100 北京军区北戴河疗养院 宋畅 张丽梅 路凯华
莫西沙星(Moxifloxacin)为第四代新型8-甲氧基氟喹诺酮类抗菌药物,目前在我国上市的有莫西沙星片、胶囊及其注射液。本品既保持了早期喹诺酮类药物对G-菌的抗菌活性,同时又增强了对G+球菌,非典型病原体如支原体、衣原体,军团菌属和厌氧菌的抗菌活性,具有广谱、高效、低毒、呈低水平耐药、无光毒性等特点[1];头孢唑啉钠(Cefazolin sodium)为半合成的第一代头孢菌素[2],二者临床应用广泛,但在《306种注射剂临床配伍应用检索表》中莫西沙星并不在其列,二者能否配伍使用,迄今未见有文献报告[3,4]。为此,笔者对其配伍的稳定性进行了观察,旨在为临床安全、合理用药提供参考。
1 仪器与试药
1.1 仪器UV-VIS 8500型分光光度计(上海天美科学仪器有限公司),BS210S型电子天平(北京赛多利斯天平有限公司),奥立龙CHN828型酸度计(美国),仪表恒温水浴锅(黄骅市综合电器厂),JC303-3B电热(隔水)培养箱(上海嘉程仪器设备厂)。
1.2 试药注射用头孢唑啉钠(大连美罗大药厂,规格:0.5 g,批号68070701);盐酸莫西沙星氯化钠注射液(拜耳医药保健有限公司,规格:250 mL∶0.4 g,批号:BXC71X4)。
1.3 方法
1.3.1 供试液的配制模拟临床用药浓度,精密称取注射用头孢唑啉钠0.101 2 g,置于25 mL的量瓶中,用纯化水定容,得头孢唑啉钠质量浓度为4.048 g/L溶液为A液;盐酸莫西沙星氯化钠注射液为B液。
1.3.2 测定波长的选择精密量取“1.3.1”项下的A、B供试液各0.3 mL,分别用纯化水准确稀释至100 mL,配制12.144 mg/L的头孢唑啉钠和4.8 mg/L莫西沙星标准溶液,并以化水为空白,分别在200~400 nm波长内扫描(图1)。
从图1可知,头孢唑啉钠的最大吸收峰在271.7 nm处,与文献报告基本相符[5]。莫西沙星在288 nm处有最大吸收,且二者在271.7 nm、288 nm波长处相互重叠。
1.3.3 标准曲线的制作精密量取“1.3.1”项下的供试液A、B各0.1、0.2、0.3、0.4、0.5、0.6 mL,分别置于12个100 mL容量瓶中,用纯化水定容,配成不同浓度的系列溶液。以纯化水为空白,在271.7 nm和288 nm测定各自的吸收度,以浓度C和吸收度A进行线性回归分析,得出各自的回归方程为:

由此可见,头孢唑啉钠与莫西沙星分别在4.048~24.288 mg/L与1.6~9.6 mg/L范围内,在271.7 nm,288 nm波长处,浓度C与吸收度A线性关系良好。
1.3.4 回收率试验
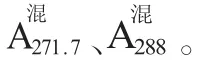
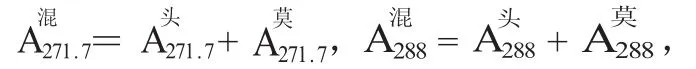
将“1.3.3”项下的回归方程代入,并联立方程组即得:
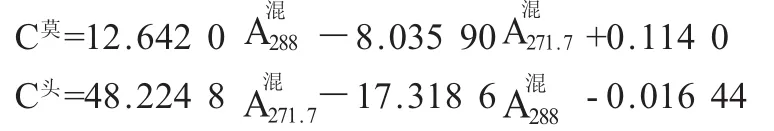
1.3.4.2 回收率试验取“1.3.1”项下供试液,分别配制成低、中、高不同浓度的混合液,按“1.3.3”项下方法,以纯化水为空白,在选定波长下测定吸收度,并代入“1.3.4.1”的公式中计算回收率(表1)。

图1 紫外吸收光谱
表1 注射用头孢唑啉钠与盐酸莫西沙星氯化钠注射液配伍回收率试验结果(±s,n=5)
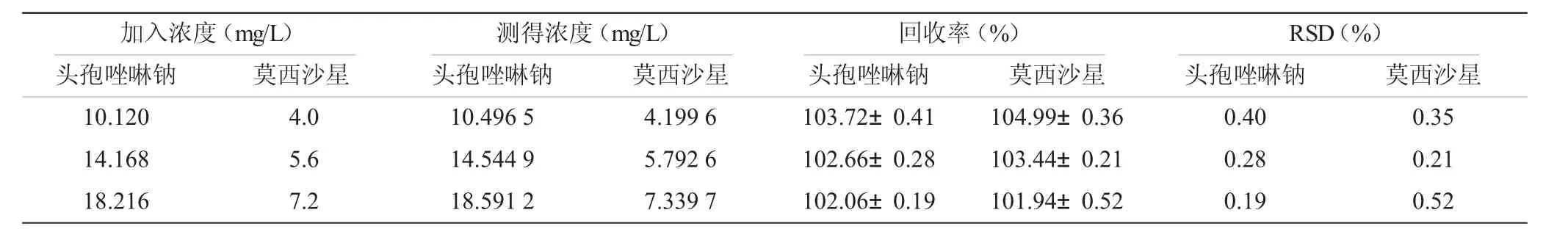
表1 注射用头孢唑啉钠与盐酸莫西沙星氯化钠注射液配伍回收率试验结果(±s,n=5)
加入浓度(mg/L)测得浓度(mg/L)回收率(%)RSD(%)头孢唑啉钠莫西沙星头孢唑啉钠莫西沙星头孢唑啉钠莫西沙星头孢唑啉钠莫西沙星10.120 4.0 10.496 5 4.199 6 103.72±0.41 104.99±0.36 0.40 0.35 14.168 5.6 14.544 9 5.792 6 102.66±0.28 103.44±0.21 0.28 0.21 18.216 7.2 18.591 2 7.339 7 102.06±0.19 101.94±0.52 0.19 0.52
1.3.5 配伍液的制备模拟临床用药浓度,称取注射用头孢唑啉钠100 mg,置25 mL的容量瓶中,用盐酸莫西沙星氯化钠注射液定容,得配伍液,分别放置于25℃、37℃的恒温水浴锅和电热培养箱中。
1.3.6 配伍变化观察取“1.3.5”项下的配伍液,于0、1、2、4、6、8 h观察溶液外观变化,测定其pH值。分别吸取配伍液0.3 mL,置于100 mL容量瓶中,以纯化水稀释,定容,并以纯化水为空白,在选定波长下测定吸收度,代入“1.3.4.1”的公式中。以0 h含量为100%,计算各时间点相对百分含量,同时在200~400 nm波长范围内行紫外扫描,观察吸收峰位及峰形变化。
2 结果
2.1 外观配伍液在8 h内均为浅黄色透明液体,无颜色变化,无气泡及沉淀生成。
2.2 pH值从0~8 h,配伍液的pH值没有显著性变化(表2)。
2.3 含量测定在选定波长处分别对头孢唑啉钠与莫西沙星进行测定,结果两药配伍后1 h头孢唑啉钠含量明显下降,莫西沙星37℃条件下,含量明显上升(表2)。
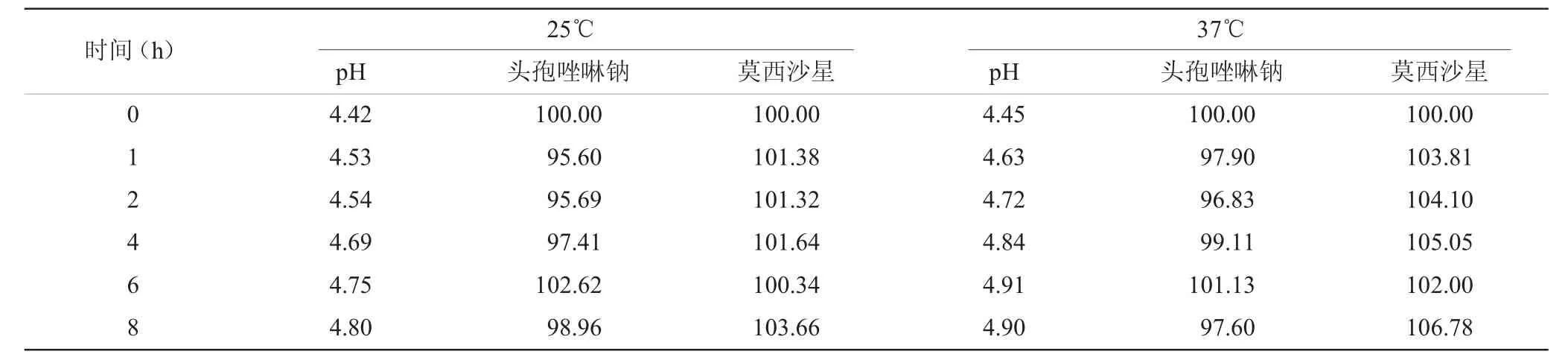
表2 注射用头孢唑啉钠与盐酸莫西沙星注射液配伍8 h内的pH和含量变化(%,n=5)
2.4 吸收曲线变化在测定含量的同时,对各混合液进行紫外扫描,结果吸收曲线在8 h内无明显变化,无新的吸收峰产生(图2)。
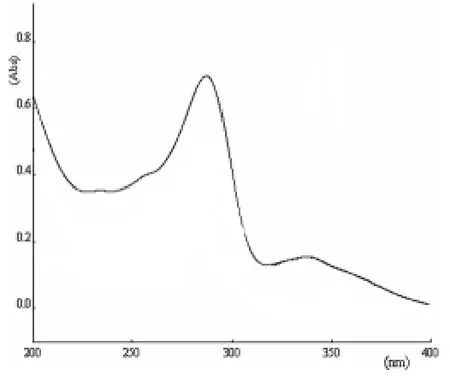
图2 注射用头孢唑啉钠与盐酸莫西沙星注射液配伍8 h紫外吸收图谱
3 讨论
1)头孢唑啉钠与莫西沙星在紫外区均有最大吸收,且吸收光谱互相重叠。本文采用联立方程分光光度法测定两个波长的吸收度,通过计算即可同时得到头孢唑啉钠与莫西沙星的含量。本法解决了两组分紫外吸收重叠问题,样品不经任何处理,可以避免样品处理过程中的误差。
2)本实验未使用对照品作标准曲线,而是直接采用同一批号实验药品。因实验是考察注射用头孢唑啉钠与盐酸莫西沙星氯化钠注射液配伍后8 h内的含量变化,是以0 h含量为参照观察其配伍后相对含量变化,因此对实验结果无影响,而且简便、快速。
3)在25℃和37℃避光条件下,注射用头孢唑啉钠与盐酸莫西沙星氯化钠注射液配伍后,8 h内无颜色变化,无气泡和沉淀生成,但配伍液pH逐渐升高。在25℃条件下1 h时头孢唑啉钠的含量明显下降,37℃条件下莫西沙星含量逐渐上升,其原因有待进一步研究。因此,在临床使用中,为了避免药物之间的相互作用,最大发挥药物的疗效,应尽可能将这两种药分组使用。
1 黄道秋,李家莉.莫西沙星的临床应用[J].中国医院药学杂志,2007,27(3):372-373
2 陈新谦,金有豫,汤光.新编药物学[M].第16版.北京:人民卫生出版社,2007.57-58
3 习丹,胡建新,张瑛.盐酸莫西沙星氯化钠与3种注射液配伍的化学稳定性考察[J].中国医药导报,2007,4(19):142-143
4 赵宝玲,习丹.盐酸莫西沙星氯化钠与维生素C注射液配伍的化学稳定性考察[J].江西医药,2007,42(4):338-339
5 张学农.头孢唑林钠与2种止血药配伍的稳定性考察.光谱仪器与分析,2003,17(3):38-39
1005-619X(2009)04-0371-02
2008-05-29)
