同种异体大鼠肝移植在不同免疫状态下的实验研究
2009-07-01程凯杨振林耿永志邹伟伟
程 凯 杨振林 耿永志 邹伟伟
【摘要】目的:观察不同免疫状态下大鼠同种异体移植肝早期的病理变化和受体生存状况的改变。方法:分三组:A组:n=36,同基因移植组(BN→BN);B组:n=36,异基因移植+环孢素A(CsA)组;C组:n=36,异基因移植组(Lewis→BN),另外各设亚组观察生存期。于移植后1、3、5、7、14天检测移植肝排斥反应病理分级,并观察移植鼠存活时间。结果:①A组;同基因移植肝无明显病理急性排斥反应发生;除第1天外,B组和C组各时间段的排斥分级明显高于A组(P<0.05或<0.01);而C组和B组相比亦有明显增高(P<0.05或<0.01)。②A组和B组的生存期平均大于100天,明显长于C组(34.3(3.56天)。结论:①同基因大鼠肝移植不发生明显的病理急性排斥反应,术后生存状况良好。②短期应用小剂量环孢素A(CsA)能明显抑制异基因同种大鼠移植肝的病理急性排斥反应,诱导免疫耐受的发生。③异基因大鼠移植肝早期出现明显的病理急性排斥反应,术后生存状况差,生存期较短。
【关键词】肝移植;排斥反应;免疫耐受;环孢素A
【中图分类号】R617【文献标识码】A【文章编号】1007-8517(2009)08-0028-02
临床器官移植的长期存活率得到明显提高,已成为终末期器官功能衰竭病人的最佳治疗方案。然而,同种异体排斥反应仍然是器官移植的主要障碍。大鼠肝移植是目前最常用的肝移植动物试验模型,为临床提供了大量宝贵的试验数据,下面是我们利用近交系Lewis和BN大鼠进行肝移植的一组试验数据。
1材料和方法
1.1实验动物
1.1.1供鼠近交系Lewis大鼠,雄性,SPF/VAF,体重200~250g,购于北京维通利华实验动物技术有限公司。
1.1.2受鼠近交系BN大鼠,雄性,SPF/VAF,体重200-250g,购于北京维通利华实验动物技术有限公司。我们采用改进的Kamada等袖套方法建立肝移植模型。动物均在标准条件下饲养。
1.1.3实验为同种异体移植另外各设亚组观察生存期。移植后1、3、5、7、14天切取移植肝脏用于病理学的检测。另外设亚组观察移植后一般情况和肝移植术后受体的存活时间。
1.2实验动物分组、标本采集
1.2.1实验动物分组实验为同种异体移植,分为三个组,另外每组设亚组6只肝移殖大鼠观察移植后一般情况和肝移植术后受体的存活时间。①A组:n=36,同基因移植组(BN→BN);②B组:n=36,异基因移植(Lewis→BN)+环孢素A(CsA)组;大鼠肝移植后用环孢霉素A(CsA)2.0mg/kg/d皮下注射0-7天;③C组:n=36,异基因移植组(Lewis→BN),
1.2.2标本采集在移植后1、3、5、7、14天时间段各杀死6只大鼠。取肝组织放入10%中性甲醛固定,制成蜡块并切片,用于排斥反应病理学检查。各个亚组在标准条件下喂养,观察移植鼠的一般生活状态和并记录其存活时间。参照Kemnitze的标准进行急性排斥反应分级:0级无排斥证据;0-1级有排斥倾向,但不足于诊断:轻度的汇管区混合性细胞浸润,胆管损伤,无静脉内皮炎;1级轻度急性排斥:汇管区轻度单个核细胞浸润,以淋巴细胞为主,部分可见混合性细胞。汇管区或/和中央静脉区可见静脉内皮炎;肝实质细胞坏死可以见到,10%以上的肝实质区域可见单个核细胞浸润,胆管损伤;2级中度急性排斥:汇管区可见更明确的单个核细胞浸润,肝实质细胞退行性改变。部分区域可见非桥接性坏死,肝实质区域可见混合性细胞浸润,以单个核细胞为主,约占整个肝实质区的10-30%,汇管区和中央静脉内皮炎,胆管损伤;3级重度急性排斥:汇管区和肝实质区可见明显的混合性细胞浸润,以单个核细胞为主,30%以上的整个肝实质区有明确的退行性变和坏死,部分为桥接坏死,汇管区和中央区静脉内皮炎,胆管损伤。
1.2.3统计学处理实验所得数据以±s表示,统计学处理用spss11.0软件完成。各组肝移殖受体存活率评估以Kaplan-Meier法检验,其它参数作One-way ANOVA分析及q检验,P<0.05为差异有显著性。
2结果
2.1各组大鼠术后一般状态及生存时间。见图1。A组及B组分别和C组比较,P<0.001。
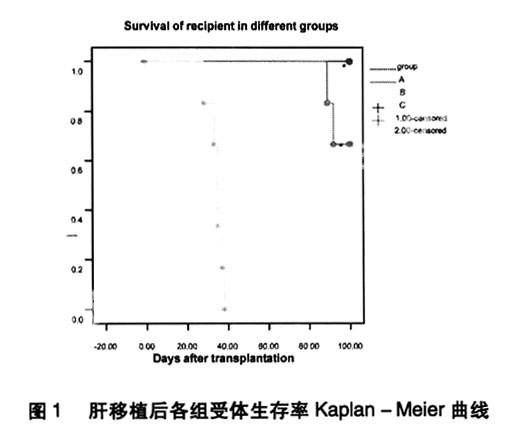
全部受者均于术后0.5-1小时内苏醒,一般1-3小时后可进水、一天后进食。A组,七天后皮毛正常,体重增加,均长期存活,(大于100天)。C组大鼠皮毛灰暗,进食差,体重进行性减轻,术后28-38天全部死亡,中位存活时间33.3天。 B组大鼠,6只中4只获得长期存活,用药期间一般状态差,进食少,体重不增加,但停药后好转,精神状态逐日好转,活动增加,生存时间明显延长,平均生存时间大于100天;A组和B组分别与C组比较,P<0.001。B组和A组比较差异没有显著性意义。
2.2移植肝病理表现及排斥分级见图2。
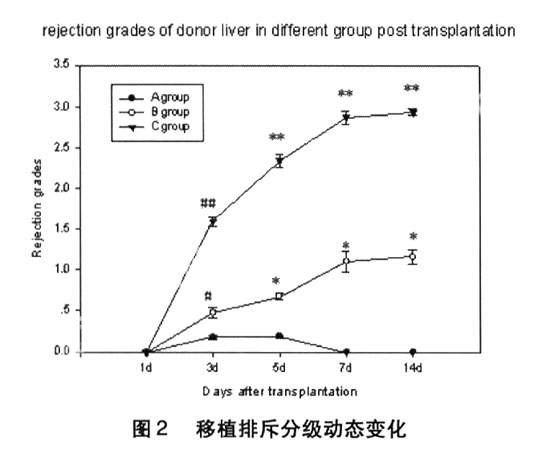
A组供肝各个时间段病理学检查(附图3-1),部分汇管区有少量炎性细胞浸润,术后第3天和第5天分级为0.18和0.19级,其他时间段均为0。B组(附图3-2)第1天未见有排斥表现,第3天可见淋巴细胞浸润,平均排斥分级分别为0.48,第5、7天淋巴细胞细胞浸润更加明显,平均排斥分级分别为0.67和1.10,14天淋巴细胞浸润,胆管增生存在,平均排斥分级1.16。C组(附图3-3)供肝术后第1天汇管区有少量炎性细胞浸润,可见门静脉和中央静脉内皮肿胀,未见排斥发生,术后第3天汇管区淋巴细胞细胞浸润明显,可见肝实质变性,平均排斥分级1.59级,术后第5天中度排斥表现,平均排斥分级为2.34级术后第7天和14天,出现严重急性排斥表现,静脉内皮炎明显,大量炎性细胞浸润,可见肝的变性坏死,胆管内皮炎或小小胆管消失,平均排斥分级分别为2.87和2.93;除第1天外,B组各时间段的排斥分级明显高于A组,差别显著(P<0.05或<0.01),而C组排斥分级升高更加明显,分别和B组及A组相比有显著性差别,(P<0.05或<0.01)。
3讨论
本实验研究表明同基因大鼠肝移植,移植肝不发生急性排斥反应,受鼠术后生存状况良好。此实验结果再一次为临床移植提供理论依据,同卵双生个体之间进行器官移植不会发生排斥反应,是最理想的供受体结合。但是这样的移植机会很少,所以尽量选择基因配型相近的供受体是临床移植努力争取的。同种异体之间进行器官移植是临床最常见的,由于非同基因之间进行移植,急性排斥反应是不可回避的难题,C组的实验结果进一步证明了急性排斥反应的发生,会造成受体内移植物结构的破坏,生活质量的下降和生命的短期丧失。所以,抑制急性排斥反应,诱导机体抗原特异性免疫耐受,是解决器官移植排斥的根本方法。我国肝移植发展迅猛,大鼠肝移植模型将为肝移植的基础和临床研究提供重要的实验手段。Lewis-BN大鼠肝移植是国际上通用的、用来研究急性排斥反应的动物模型。在本试验中,C组,第3天排斥分级较A组明显升高,两者比较P<0.05,在第5天排斥分级进一步升高,第7、14天达到高峰,和A组相比较P<0.001,组内比较P<0.01,是一个比较理想的急性排斥模型。
短期应用小剂量CsA能使排斥的大鼠肝移植导致耐受或者长期接受。CsA使多种移植模型达到长期接受或耐受的机理与其参与了多方面的免疫作用有关。CsA抑制已接触抗原的CTL产生,其受体为环孢素结合蛋白(cyclophilin);在基因水平,CsA抑制IL-2和IFN-γ生成与释放,IL-2是T细胞存活、分化、增殖的生长因子,IFN-γ是促进Th1细胞分化的关键性因子;Khanna等报道,CsA能刺激转化生长因子β(TGF-β)基因启动子的活性,从而使TGF-β表达增高;据报道,在体内或体外给予CsA,以NF-κB为目标靶,可抑制NF-κB核移位,从而抑制树突状细胞(DC)的成熟。成熟的DC则在同种移植物排斥反应中起关键作用;未成熟的DC则能延长移植器官存活。本研究应用近交系大鼠Lewis作为供体,BN大鼠作为受体实行原位肝移植,从0~7天给予CsA 2mg/kg/d,结果证明CsA能使受体BN的平均生存期明显延长,多数大于100天,而没有应用CsA的C组的平均生存期仅为33天,两组的生存率比较有明显的差别,P<0.001;和A组相比两组的生存率没有明显的差别,证明在短期小剂量应用CsA的情况下,此肝移植模型是用来研究移植肝脏长期被接受或者免疫耐受的比较理想的模型。
参考文献
[1]Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat[J]. Surgery,1983,Jan;93(1 Pt 1):64-69.
[2]杨振林,郑树森,沈克震,等.大鼠肝移植术中供肝再灌注不良的原因分析及预防措施[J].医学研究生学报,2006,19:221-224.
(收稿日期:2009.02.10)
