同型半胱氨酸诱导人血管平滑肌细胞氧化损伤的研究
2009-05-06苏娟王树人吴建新秦燕
苏 娟 王树人 吴建新 秦 燕
【摘要】 目的 探讨同型半胱氨酸(Hcy)对人脐静脉血管平滑肌细胞(VSMCs)氧化损伤的作用及机制。方法 用含不同剂量Hcy(50~1000 μmol/L)的培养基培养VSMCs 24 h后,以分光光度比色法分别测定细胞内丙二醛(MDA)含量和超氧化物酶(SOD)、过氧化氢酶(CAT)活力的改变。结果 随Hcy浓度增加,VSMCs内MDA的含量明显增加,SOD和CAT的活力也显著升高。Hcy明显促进了VSMCs的氧化。结论 Hcy可直接诱导VSMCs的氧化损伤。
【关键词】 同型半胱氨酸;平滑肌细胞;氧化损伤
同型半胱氨酸(homocysteine,Hcy)是近年来确定的致动脉粥样硬化(atherosclerosis,As)的新的独立的危险因子[1]。研究显示,Hcy含有巯基(-SH),易发生自身氧化,可生成如超氧化物、过氧化氢和羟自由基等多种强氧化物,启动脂质过氧化链式反应而损伤细胞[2]。Hcy对细胞的氧化作用,以往的研究主要集中在血管内皮细胞上。血管平滑肌细胞(vascular smooth muscle cells,VSMCs) 也是As发生的主要效应细胞,Hcy对其是否有氧化作用却少见报道。本研究旨在探讨Hcy对VSMCs的氧化作用及机制。
1 材料和方法
1.1 主要实验试剂 DMEM/F12培养基(Gibco)、新生牛血清(杭州四季清)、胰蛋白酶、青霉素、链霉素、D-Hanks液;同型半胱氨酸 (Sigma);MDA、SOD、CAT测定试剂盒(南京建成)。
1.2 人VSMCs的体外培养、鉴定与分组 采用组织贴块法培养。取无菌的新鲜的人脐带,剪取脐静脉血管中膜部分并剪成约(0.5 mm×1 mm×1 mm~1.0 mm×1 mm×1 mm大小的血管小块,以每3~5 mm2块密度均匀种植于培养瓶底。采用DMEM/F12培养液,在37℃、5%CO2培养箱(湿度100%)内静置进行原代培养和传代培养。在倒置显微镜下进行观察,并做α-actin肌动蛋白免疫组化检测。取3~6代细胞用于实验。将细胞分别置于终浓度为0、50、100、200、500、1000 μmol/L Hcy的培养液中孵育24 h,每组重复做5次。
1.3 方法 细胞用0.25%胰蛋白酶消化后制成细胞悬液,2000转/min离心5 min,弃上清液。加入无菌的三蒸水,采用反复冻融法裂解细胞。取上清液按说明书,用硫代巴比妥酸(TBA)比色法测定细胞内丙二醛(MDA)的含量,黄嘌呤氧化法比色测定细胞内超氧化物岐化酶(SOD)的活力,可见光法测定细胞内过氧化氢(CAT)的活力。
1.4 统计学方法 所有数据用(x±s)表示,进行t检验。采用SPSS 13.0软件操作,P<0.05表示差异有统计学意义。
2 结果
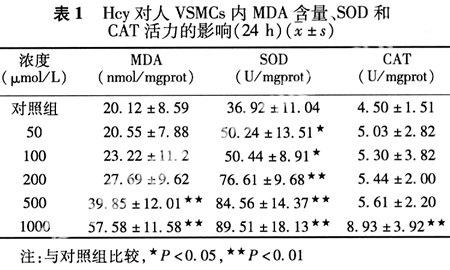
2.1 细胞内丙二醛(MDA)的含量 由表1可见:VSMCs内MDA的含量随Hcy浓度的增加而增加,当Hcy浓度达到 500 μmol/L以上与对照组有显著差异性。
2.2 细胞内超氧化物岐化酶(SOD)的活力 在Hcy作用下,VSMCs内SOD的活力明显升高,在低浓度(50 μmol/L)时就与对照组有差异性,并呈浓度依赖性升高。
2.3 细胞内过氧化氢(CAT)的活力 VSMCs内CAT活力也随着Hcy浓度的增加而增加,但在高浓度(1000 μmol/L)时才与对照组显示出差异性。
3 讨论
Hcy是体内蛋氨酸在代谢过程中经脱甲基等一系列反应形成的一种含硫氨基酸,在体内含量极少。在正常成人体内,血浆Hcy浓度大约为5~15 μmol/L。血浆中Hcy浓度>15 μmol/L称为高同型半胱氨酸血症(hyperhomocysteine,HHcy)。1969年,McCully发现由于维生素B12的代谢障碍以及胱硫醚-β-合成酶(CβS)缺陷均可导致HHcy和类似As的病变;随后他又通过动物模型证实Hcy在血中蓄积可导致类似As的血管病变。据此,McCully提出HHcy与As有关的假说[3]。近年大量的回顾性、前瞻性和实验性研究已确定,血浆中Hcy水平升高是As发病的一个新的独立的危险因素[4]。
Hcy诱发As的机制相当复杂,目前尚未完全明了,研究认为与氧化损伤、细胞凋亡、炎症反应、凝血纤溶异常等作用有关[5]。其中,氧化损伤作用一直是Hcy引发As的研究重点。Tyagi等研究发现,Hcy在过渡金属离子(Fe3+、Cu2+)的存在下易发生自身氧化,生成多种强氧化产物如超氧化物(O-2•)、过氧化氢(H2O2)和羟自由基(•OH)等,产生氧化应激反应,启动膜脂质过氧化链式反应,降低膜流动性并破坏细胞的完整性,导致细胞功能改变,甚至坏死脱落[6]。高键等研究显示,Hcy可促进内皮细胞内活性氧的生成,使血管内皮细胞处于一种氧化应激状态,进而使血管内皮细胞出现结构和功能上的损害。Hcy通过氧化损伤造成血管内皮细胞损害可能是HHcy导致As的始动环节 [7]。血管平滑肌细胞(VSMCs)也是As发生的主要效应细胞。VSMCs的增殖、炎症反应、凋亡等病理变化也参与了As病程的发生和发展。本研究结果显示,在Hcy作用下,VSMCs内MDA的含量明显增加,与对照组比较有显著性差异。MDA是脂质过氧化的产物,其含量能直接反映脂质过氧化的速率和强度。说明Hcy也可以直接引发VSMCs发生脂质过氧化反应,从而使VSMCs出现氧化损伤。
本研究结果还显示,在Hcy作用下,VSMCs内SOD和CAT的活力明显升高。SOD和CAT为体内活性氧的清除剂。SOD可催化O-2•生成H2O2,H2O2在CAT作用下生成H2O,从而消除自由基的毒性作用。本研究认为,SOD和CAT活力的升高对Hcy促VSMCs的氧化作用应该是一种代偿反应。Moat等报道,HHcy患者血液中SOD、GSH-PX等抗氧化酶的活性是升高的[8]。本研究发现,小剂量(50 μmol/L)Hcy作用下细胞内主要的抗氧化酶(SOD)的活力就有了明显改变,提示低浓度的Hcy就可促使VSMCs内活性氧生成。而在高浓度(500~1000 μmol/L)Hcy作用下活性氧增多显著,SOD和CAT活力的增高虽可拮抗活性氧的作用,但VSMCs内脂质过氧化反应明显,故MDA含量显著升高,Hcy诱发VSMCs出现了明显的氧化损伤,该作用可能也参与了HHcy致As的发生和发展过程。
参 考 文 献
[1] Guthikonda S,Haynes WG.Homocysteine:role and implications in atherosclerosis.Cur Athero Rep,2006,8(2):100-106.
[2] Perez AK,Foncea R,Leighton F.Reactive oxygen species mediates homocysteine-induced mitochondrial biogenesis in human endothelial cells:modulation by antioxidants.Biochemical,2005,338(2):1103-1109.
[3] Turhan H,Erbay AR.Plasma homocysteine levels in patients with isolated coronary arteryectasia.Int J Cardiol,2005,104(2):158-162.
[4] Stazka J,Luchowski P,Urbanska EM.Homocysteine,a risk factor for atherosclerosis,biphasically changes the endothelial production of kynurenic acid.Euro Pharm,2005,517(3):217-223.
[5] LENTZ S R.Mechanism of homocysteine induced atherothrombosis.Thromb,2005,3(8):1646-1654.
[6] Tyagi N,Sedoris KC,Steed M,at al.Mechanisms of homocysteine-induced oxidative stress. Cir Physiology,2005,289(6):2649-2656.
[7] 高键,薛安娜.同型半胱氨酸诱导ECV304细胞氧化损伤研究.卫生研究,2003,32(1):20-21.
[8] Moat SJ,Bonham JR,Cragg RA.Elevated plasma homocysteine elicits an increase in antioxidant enayme activity.Free Rad Res,2000,32(2):171-179.
