卵巢切除对大鼠关节内骨折后软骨愈合的影响
2009-04-11李晓林
王 磊 李晓林
卵巢切除对大鼠关节内骨折后软骨愈合的影响
王 磊 李晓林
目的探讨骨质疏松对大鼠关节内骨折后软骨愈合的影响。方法16只4.5月龄的雌性SD大鼠分为两组,实验组行双侧卵巢切除,对照组施行假手术。10周后,经手术制造右胫骨平台内髁劈裂骨折,克氏针交叉内固定。术后大鼠自由活动,6周后全部处死,标本行大体和组织学观察。结果所有标本骨折均愈合。实验组胫骨平台内侧关节软骨多不平整伴轻度塌陷,软骨裂隙依稀可辨,色泽稍暗;对照组内侧关节软骨多平整光滑,软骨裂隙消失。HE染色光镜观察发现,实验组关节软骨裂隙处可见较多纤维组织,透明样软骨呈岛状散在分布于关节表面;对照组多为透明样软骨,细胞排列较规则,但未见明显分层及潮线。结论卵巢切除导致大鼠骨质疏松,延缓了关节内骨折后软骨愈合的进程,且软骨愈合质量较差。
骨质疏松骨软骨骨折卵巢切除术
随着社会人口的日趋老龄化,临床上合并骨质疏松的关节内骨折病例也日益增多,其治疗较为棘手。近年来的研究提示,绝经后妇女体内雌激素水平低下,在发生骨质疏松的同时,其关节内软骨易发生退变。然而,对于骨质疏松同时伴发关节内骨折的愈合过程,相关研究报道较少。
本实验将大鼠双侧卵巢切除后,建立胫骨平台骨折模型,初步探讨骨质疏松症对关节内骨折后软骨愈合过程的影响。
1 材料与方法
1.1 动物模型
选用4.5月龄,体重280~310 g雌性SD大鼠共16只(上海西普尔-必凯实验动物有限公司提供),其中实验组(8只)行双侧卵巢切除,10周后经双能X线骨密度仪(HOLOGIC,QDR-4000)测量,证实实验组已发生骨质疏松。此时,实验组与对照组均行右膝下髌旁内侧切口,并显露胫骨平台内侧髁,于其内外1/2处的关节软骨下方1 cm范围用直径0.6 mm克氏针作邮票打孔,钻透前后骨皮质,11号尖刀片锐性切割软骨面并贯通软骨下孔洞,造成外侧皮质连续的胫骨平台内侧髁垂直劈裂骨折,骨折间隙约1~2 mm,随后在距关节面下0.5 mm处用两根直径0.8 mm克氏针由内向外作平行关节面的交叉内固定,尾端折弯埋于皮下(图1)。大鼠笼内饲养,术前30 min起,肌注青霉素钠盐(每公斤体重注射15万单位),连续3 d,术后自由活动。
1.2 观察指标
所有大鼠于造模6周后腹腔过量注射氯氨酮致死,将右胫骨平台取出后行大体观察。小心取出克氏针,标本用4%的多聚甲醛溶液(pH 7.4)固定24 h,10%EDTA溶液脱钙2~3周,石蜡包埋,冠状面切片,HE染色观察。
2 结果
2.1 大体观察
所有大鼠均未出现伤口感染,6周后顺利取材。膝关节离断时观察到关节内有不同程度粘连,标本取出后发现胫骨平台软骨及软骨下骨骨折均已愈合。
实验组胫骨平台内侧关节软骨轻度塌陷,关节面呈弹格子路样坑坑洼洼,多不平整且色泽苍白,软骨裂隙依稀可辨(图2);相比之下,对照组关节面多平整光滑无塌陷,色泽较光亮,软骨裂隙消失(图3)。

图1 大鼠胫骨平台内侧骨折的动物模型

图2 实验组关节面高低不平,苍白有裂隙

图3 对照组关节面平整光滑,且光亮
2.2 组织学观察
石蜡切片HE染色后光镜下观察发现,实验组关节软骨裂隙处可见数个团簇状软骨样组织充填,与周围正常软骨组织不连接,其中软骨细胞数量少且呈不规则聚集排列,其间有少量纤维组织间隔,关节表面多见软骨剥脱,软骨下骨板构建延缓(图4)。对照组多见透明样软骨形成,平整移行于软骨裂隙边缘,软骨细胞数量明显增多且排列较规则,但未出现明显分层,潮线消失,关节表面未见软骨剥脱,软骨下原始骨小梁形成较多(图5)。

图4 实验组软骨样组织团簇样排列,软骨细胞少(HE,100×)
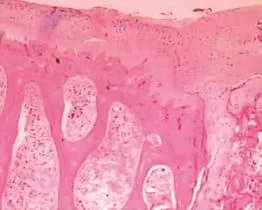
图5 对照组透明样软骨形成,软骨细胞多且排列规则(HE,40×)
3 讨论
3.1 雌激素缺乏影响关节内骨折修复的动物模型的建立
临床常见的关节内骨折多累及软骨下骨,即骨软骨骨折,其修复过程和局限于关节软骨内的单纯软骨损伤修复截然不同。由于骨折穿透软骨下骨,导致出血,纤维蛋白凝块充填骨折端,局部产生的炎性反应使骨髓中的间充质细胞趋化聚集,并在周围各种生长因子和局部微环境的作用下,特定地向成骨或成软骨分化,最终形成骨和软骨组织。而影响该过程的因素较多,包括骨折个体本身的年龄大小、损伤过程的机械刺激和修复的应力环境、损伤区域的范围和大小及内固定的稳定性等。
成年大鼠双侧卵巢切除已被作为经典的雌激素缺乏导致的骨质疏松动物模型,胫骨近端更是研究骨质疏松的代表部位,而位于胫骨平台内侧中点的关节内骨折能较好地模拟临床骨折修复的应力刺激。Shapiro等[1]在兔的股骨关节面上钻孔,深达软骨下骨,认为直径3 mm的钻孔,可以被新生透明软骨修复,而大于此直径的则不能自然修复。本实验采用邮票打洞后手术刀片锐性切割造模,骨折间隙小于3 mm,对照组实验结果证实,6周后也可观察到新生的透明样软骨形成。
Mitchell等[2]在成年兔股骨内髁制造关节内骨折,分别用拉力螺钉给予骨折块间不同的加压固定,结果发现软骨间隙在加压稳定的条件下,修复组织为透明软骨,未加压则导致纤维软骨的形成。Plaga等[3]在兔的股骨内髁前方制造关节内剪切样骨折,采用克氏针交叉固定后6周,发现骨折块固定稳定,骨折愈合,移位均小于1 mm。本实验在制作胫骨平台骨折时,骨折块之间尚留有完好的内侧皮质连接支撑,兼用交叉克氏针做内固定,提供了较好的内固定稳定性,因此能在对照组观察到了正常的软骨修复过程。
综合考虑上述各因素,本课题组认为,大鼠双侧卵巢切除后的胫骨平台骨折操作简便,骨软骨修复过程稳定可靠,可以用来研究雌激素缺乏对关节内骨折愈合过程的影响。
3.2 雌激素缺乏对关节内骨折软骨愈合的影响
Genesan等[4]研究发现,对卵巢切除大鼠使用雌激素后,可以有效缓解关节软骨的胶原降解。高峰等[5]分别对卵巢切除大鼠使用雌激素及雌激素受体调节剂,也发现尿中CTX-Ⅱ的代谢峰显著降低,同时关节软骨面的病损程度明显好转。上述研究均表明,雌激素水平影响着关节软骨的代谢。Oshima等[6]对不同周龄、性别以及去势大鼠的髋关节软骨做免疫荧光染色,发现雌激素受体(Estrogen receptor,ER)表达于成年大鼠关节软骨及软骨下骨中,且均分布在关节软骨细胞的胞浆和胞核中,提示了雌激素可以直接通过其受体介导关节软骨的代谢。同时发现,雄性幼年及老龄大鼠的ER表达水平无明显差异,但卵巢切除大鼠ER两种亚型(ER-α和ER-β)表达以及老年雌性大鼠的ER-α表达水平均有下降,提示了雌激素水平的降低也会导致软骨细胞中ER数量和功能的改变,从而进一步影响软骨的代谢。
关节软骨全层骨折的修复过程主要由骨髓来源的间充质干细胞在局部募集,通过各种因子诱导分化最终形成软骨细胞而完成。这些因子包括离子,低分子量复合物如类固醇激素,多肽激素,以及蛋白等,其中部分是由软骨外组织传递(旁分泌作用),但许多是由软骨细胞自分泌并起介导作用。Wang等[7]取成年雌性大鼠的骨髓基质干细胞做体外培养,运用免疫组花和RT-PCR观察ER-α的数量和分布,发现在胞核内出现一过性的波峰样表达,认为雌激素可能在调节干细胞分化阶段起一定的介导作用。此外,Takeuchi等[8]在软骨细胞体外培养过程中,检测到作为性类固醇激素前体的mRNA表达,提示了软骨细胞还可能通过自分泌介导激素类因子的作用。
本实验中,卵巢切除大鼠的关节软骨及软骨下骨愈合延缓,提示了雌激素缺乏延缓了关节内骨折愈合过程,而形成的软骨样组织外观高低不平且色泽苍白,镜下显示软骨细胞无规则排列,软骨外基质杂乱,提示了关节内骨折的愈合质量明显降低,其内在的调控机理尚有待进一步深入探讨。
[1]Shapiro F,Koide S,Glimcher MJ.Cell origin and differentiation in the repair of full-thickness defects of articular cartilage[J].J Bone Joint Surg Am,1993,75:532-553.
[2]Mitchell N,Shepard N.Healing of articular cartilage in intra-articular fractures in rabbits[J].J Bone Joint Surg Am,1980,62:628-634.
[3]Plaga BR,Royster RM,Donigian AM,et al.Fixation of osteochondral fractures in rabbit knees.A comparison of Kirschner wires,fibrin sealant,and polydioxanone pins[J].J Bone Joint Surg Br,1992, 74:292-296.
[4]Ganesan K,Tiwari M,Balachandran C,et al.Estrogen and testosterone attenuate extracellular matrix loss in collagen-induced arthritis in rats[J].Calcif Tissue Int,2008,83:354-364.
[5]高峰,杜宁.药物干预对去卵巢大鼠关节软骨代谢的影响[J].中国骨伤,2008,21:196-199.
[6]Oshima Y,Matsuda K,Yoshida A,et al.Localization of estrogen receptors α and β in the articular surface of the rat femur[J]. Acta Histochem Cytochem,2007,40(1):27-34.
[7]Wang Q,Yu JH,Zhai HH,et al.Temporal expression of estrogen receptor alpha in rat bone marrow mesenchymal stem cells[J]. Biochem Biophys Res Commun,2006,347:117-123.
[8]Takeuchi S,Mukai N,Tateishi T,et al.Production of sex steroid hormones from DHEA in articular chondrocyte of rats[J].Am J Physiol Endocrinol Metab,2007,293;E410-E415.
Histological Observation on the Healing of Osteochondral Fracture in Ovariectomized Rats
WANG Lei,LI Xiaoling.
Department of Orthopaedic Surgery,Shanghai Sixth People′s Hospital,Shanghai Jiaotong University School of Medicine, Shanghai 200233,China.
ObjectiveTo explore the healing process of osteochondral fracture in ovariectomized rats.MethodsSixteen female SD rats with a mean age of 4.5 months were involved in the study,eight of which underwent bilateral ovariectomy (OVX),while the others underwent sham operation(SHAM).Ten weeks later when the osteoporosis was confirmed,all the rats were suffered tibial plateau fracture(SchatzkerⅣ)in right hind limb and fixed with two Kirschner wires in the same time. The rats were sacrificed on 6 weeks after fracture,and the fractured tibial plateaus were taken for gross and histological observation.ResultsAll the fractures healed completely.The cartilage in medial side of tibial plateau in OVX rats was uneven and collapsed,and fracture line was obscure.On histological observation,there were fibrous tissue with scattered hyaline-like cartilage inside.In SHAM rats,the cartilage was congruity and smoothly,fracture line was almost disappeared. There was hyaline-like cartilage instead,with chondrocytes aligned regularly but no tidemark appeared.ConclusionIn ovariectomized rats,the process of the osteochondral fracture healing was delayed because of osteoporosis.
Osteoporosis;Osteochondral fracture;Ovariectomy
R711.75
A
1673-0364(2009)-01-0035-03
2008年12月25日;
2009年1月21日)
10.3969/j.issn.1673-0364.2009.01.010
200233上海市上海交通大学医学院附属第六人民医院骨科。
