高效液相色谱快速测定水果中的3种苯并咪唑类杀菌剂
2009-04-09李海飞李静徐国锋聂继云
李海飞 李 静 徐国锋 聂继云
摘要用高效液相色谱仪(HPLC)快速测定水果中苯并咪唑类农药(多菌灵、噻菌灵和甲基硫菌灵)残留量,样品经乙腈萃取后盐析,提取液经PSA和ODS吸附剂加无水硫酸镁净化后,过0.45μm滤膜,直接用HPLC-PDA(二极管阵列检测器)分离测定,外标法定量。采用乙腈/0.02moL/L磷酸缓冲盐(pH值7.4)=28/72体系为流动相,多菌灵、噻菌灵和甲基硫菌灵在苹果、梨、葡萄、香蕉、芒果、桔子等6种水果中杂质干扰少,分离度较好,灵敏度高,测定结果准确可靠。最低检出限分别为:多菌灵0.045 5mg/kg,噻菌灵0.042 1mg/kg,甲基硫菌灵0.068 6mg/kg。在添加0.2~1.0mg/kg浓度水平的回收率试验中,多菌灵、噻菌灵和甲基硫菌灵的平均添加回收率分别为82.0%~102.4%、87.6%~104.8%和79.6%~112.5%,RSD均在10%以下,满足残留分析的要求。
关键词苯并咪唑类农药;水果;高效液相色谱仪;残留;测定
中图分类号S66;S482.2文献标识码A文章编号 1007-5739(2009)01-0114-03
苯并咪唑类杀菌剂是一类高效、低毒和广谱的内吸性杀菌剂,兼具预防和治疗作用。该类杀菌剂常用于作物生长后期或采后的病害防治,在农产品中检出率较高,蔬菜、水果中尤为突出[1,2]。残留于果蔬中的苯并咪唑类杀菌剂对人体有一定的毒性。因此,检测其在果蔬中残留量,对保证人体健康有重要意义。多菌灵、噻菌灵是苯并咪唑类杀菌剂中的代表性农药,尤其是多菌灵,是苯菌灵、氰菌灵、硫菌灵及醚菌灵等多种农药的共同降解产物。实际上,在pH值接近中性时,果实上的苯菌灵在分析过程中几乎完全转化成多菌灵,而甲基硫菌灵仅有少量转化成多菌灵,故分析苯并咪唑类杀菌剂残留时,只需测定多菌灵、噻菌灵和甲基硫菌灵即可[3]。近年来,关于苯并咪唑类杀菌剂在不同作物中的残留测定已有报道[4-10],但样品前处理均需经过液—液萃取或固相萃取富集、净化,比较复杂。据统计,在农药残留分析中,有2/3的时间都花在提取和净化等预处理上,因此研究快速、有效的样品预处理方法在农药残留分析中具有重要的意义。笔者以苹果、梨、柑橘、葡萄、香蕉、芒果等6种代表性水果为试材,以多菌灵、噻菌灵和甲基硫菌灵等3种主要苯并咪唑类农药为对象,探索建立一种操作步骤较为简单、快速,结果准确、可靠,能满足水果中多菌灵、噻菌灵和甲基硫菌灵同时测定的分析方法。

1材料与方法
1.1仪器与试剂
高效液相色谱仪(日本岛津公司)LC-10A,二极管阵列检测器PDA,前处理仪器包括漩涡混匀器、离心机、pH计等;多菌灵、噻菌灵标样为Sigma公司产品,甲基硫菌灵由农业部农产品质量中心提供,PSA和ODS吸附剂(Agela Technologies Inc,农残级),无水硫酸镁(天津科密欧科技有限公司,优级纯),乙腈(美国TEDIA公司,HPLC级),磷酸二氢钾和磷酸氢二钾(天津市光复精细化工研究所,优级纯),氯化钠(北京益利精细化学品有限公司,分析纯),实验室用水为超纯水,0.45μm滤膜(天津市津腾实验设备有限公司)。
1.2色谱条件
流动相为乙腈/0.02moL/L磷酸盐缓冲液(pH值7.4)=28/72,用前经0.45μm滤膜过滤,超声脱气。色谱柱为Shim-Pack:VP-ODS C18(150.0mm×4.6mm,5μm),流速为0.8 mL/min,柱温35℃。进样量为10μL。检测波长:甲基硫菌灵为265nm,多菌灵为285nm,噻菌灵为300nm。外标法定量。
1.3试样制备
取不少于1 000g水果样品,将可食部分切碎,充分混匀放入食物加工机粉碎,制成待测样,装入容器中备用。
1.4提取
准确称取10.0g试样于50mL离心管中,加入10.0mL乙腈,旋涡混匀2min,加3~5g氯化钠到离心管中,旋涡混匀1min,5 500rpm离心3min。
1.5净化
从离心管中准确吸取2.0mL乙腈溶液到盛有50mg PSA、50mg ODS、100mg无水MgSO4的10mL离心管中,在旋涡混合器上混匀后,上清液用0.45μm滤膜过滤,待测。
2结果与分析
2.1检测波长的确立
经二极管阵列检测器波长扫描,多菌灵在225nm和285nm处有较大吸收峰,甲基硫菌灵在210nm和265nm处有较大吸收峰,噻菌灵在200nm和300nm处有较大吸收峰。但多菌灵在285nm、甲基硫菌灵在265nm、噻菌灵在300nm处杂质峰少,基线稳定,因此选择其为检测波长。
2.2流动相的选择
流动相的组成对样品中组分的分离有一定的影响。采用传统的甲醇/水作为流动相体系时,苹果、梨、香蕉、芒果等样品中多菌灵、噻菌灵和甲基硫菌灵与杂质峰基本可分开,但对于柑橘样品,无论采用何种比例的甲醇/水为流动相,多菌灵和噻菌灵峰均被杂质峰掩盖。采用乙腈/0.02moL/L磷酸缓冲盐(pH值7.4)= 28/72作为流动相体系,6种水果中多菌灵、噻菌灵和甲基硫菌灵与杂质峰的分离效果较好,均无杂质峰干扰,且峰形较好。流动相pH值影响被分析物的分离效果。考虑到多菌灵在酸性条件下会形成盐,故采用碱性的二乙胺调节流动相的pH值。分别调节流动相pH值为6.0、6.4、6.8、7.0、7.2、7.4,结果表明,pH值在7.0以下时,多菌灵响应值偏低,噻菌灵和甲基硫菌灵峰形较宽且有明显的拖尾现象;pH值在7.2~7.4时,多菌灵、噻菌灵和甲基硫菌灵的灵敏度高,峰形尖锐且对称性好。
2.3色谱分离
在所确定的试验条件下,多菌灵、噻菌灵和甲基硫菌灵三者分离良好,保留时间分别为5.710min、7.255min和17.255min。即使基质较为复杂的柑橘样品,也获得了良好的分离效果。标准样品色谱图和柑橘添加标样色谱图见图1。
2.4提取与净化
考虑到综合提取效率、选择性、与样品混合性以及溶剂化作用和渗透能力等因素,本方法采用乙腈作为苯并咪唑类农药残留量的提取剂,提取速度快,易于操作。对于蔬菜和水果类的农残分析,PSA吸附剂具有弱的阴离子交换能力,有利于吸附样品基质中的有机酸、糖及色素,并且对各种性能差异较大的农药具有较高的回收率。为更好地去除对色谱柱性能有影响的杂质,本方法采用前处理中在PSA加入一定量ODS和硫酸镁的净化方法,在去除水分、色素、蛋白质、脂肪、腊质等干扰物的同时又对色谱柱起到一定保护作用。
2.5线性关系与检测限
以0.1mg/L、0.5mg/L、1.0mg/L、2.0mg/L等4个标准系列绘制标准曲线,以浓度Y对峰面积X进行回归。结果表明,在0.1~2.0mg/L浓度范围内,苯并咪唑类农药的浓度与峰面积具有良好的线性关系,其回归方程和相关系数分别为:多菌灵Y=2.0×10-5X+0.013 2,r=0.999 3;噻菌灵Y=1.0×10-5X+0.009 4,r=0.999 9;甲基硫菌灵Y= 3.0×10-5X+0.009 3,r=0.999 0。最低检出限是以仪器基线噪声3倍所对应的质量浓度值计[13],在所确定的试验条件下,多菌灵、噻菌灵和甲基硫菌灵的最低检出限分别为0.045 5mg/kg、0.042 1mg/kg和0.068 6 mg/kg。
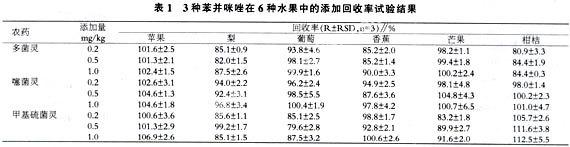
2.6添加回收率试验
水果种类繁多,不同水果其水分、糖、酸、色素等物质有较大的差异,本试验选择苹果、梨、葡萄、香蕉、芒果、柑橘等6种代表性水果为试材,进行3个水平(0.2mg/kg、0.5mg/kg、1.0mg/kg)的添加回收试验,每个水平各设3次重复,结果见表1。多菌灵、噻菌灵和甲基硫菌灵在6种水果中的平均添加回收率分别为82.0%~102.4%、87.6%~104.8%和79.6%~112.5%,RSD均在10%以下。方法的准确度和精密度均符合残留分析的要求[13]。
3结论与讨论
本方法采用乙腈为提取剂,PSA吸附剂和ODS吸附剂与无水硫酸镁组合的提取、净化方法,不仅可除去提取液中水分、色素、蛋白质、脂肪、腊质等干扰物,而且有助于去除对色谱柱性能有影响的杂质,延长色谱柱使用寿命。提取液净化后不需浓缩处理,过滤膜后直接进样检测,操作简便、快速,大大简化了样品前处理步骤,节约了时间。以乙腈/0.02moL/L磷酸盐(pH值7.4)=28/72体系作为流动相,多菌灵、噻菌灵和甲基硫菌灵在6种代表性水果中均有较好的峰形和分离度,杂质干扰少,平均回收率在79.6%~112.5%,RSD均在10%以下,最低检出限为0.042 1~0.068 6mg/kg。本方法操作简便、快速,对水果中多菌灵、噻菌灵、甲基硫菌灵等3种苯并咪唑类农药残留量能同时进行测定,结果准确可靠,灵敏度高,方法的准确度和精密度均符合残留分析的要求。
4参考文献
[1] OREELLID,EEDDER,PATREC.Pesticide residues survey in citrus fruits[J].Food Additives and Contaminant,2005,22(5):423-428.
[2] ATTILIOV,GIVANNIV,SWIZLYSA. Determination of carbendazim,thiabendazole and thiophanate-methyl in banana(Musa acuminate)sam-ples imported to Italy[J].Food chemistry,2004,87(3):383-386.
[3] TORRESCM,PICOY,MARIESJ. Determination of pesticide residues in fruit and vegetables[J]. Journal of chromatography:A,1996(754):301-331.
[4] RIAL O R,CANCHO G B,SIMAL G J. Multiresidue method for fourteen fungicides in white grapes by liquid—liquid and solid phase extraction followed by liquid chromatography—diode array detection[J].Journal of chromatography:A,2003(992):121-131.
[5] RODNEY J B,HEATHER L H,JASOTHA K,et al. Determination carbendazim in blue berries by reversed phase high-performance liquid chromatography[J].Journal of chromatography,1991(587):321-324.
[6] RODRYGUEZ R,PICO Y,FONT G,et al. Analysis of post—harvest fungicides by micellar electrokinetie chromatography[J].Journal of chromatography:A,200l(924):387-396.
[7] RODRYGUEZ R,PICO Y,FONT G,et al. Analysis of thiabendazole and procymidone in fruits and vegetables by eapillary eleetrophoresis-eleetrospray mass spectrometry[J]. Journal of chromatography:A,2002(949):359-366.
[8] CARLO BICCHI. 高效液相色谱法同时测定苹果、梨及其果肉中苯并咪唑类杀菌剂[J].农药,1989,28(5):39-40.
[9] HUR W,HENNION B,URRUTY L,et al.Solid phase microextraction of pesticide residues from strawberries[J].Food Additives and Contaminant,1999(16):111-116.
[10] NAVAAAO M,PICO Y,MARYN R,et al. Application of matrix solid-phase dispersion to the determination of a new generation of fungicides in fruits and vegetables[J]. Journal of chromatography:A,2002(968):201-209.
[11] BLASCO C,PICO Y,FONT G,et al. Determination of fungicide residues in fruits and vegetables by liquid chromatography atmospheric pressure chemical ionization mass spectrometry[J]. Journal of chromato-graphy:A,2002(947):227-235.
[12] 孔祥虹,何学文,张妮华.高效液相色谱法测定浓缩苹果汁中的多菌灵残留量[J].化学分析计量,2003,12(1):13-14.
[13] 李本昌.农药残留量实用检测方法手册[M].北京:化学工业出版社,2001.
