外源基因转化受体系统高效再生体系的建立
2008-04-29隋昌海张美萍王义
隋昌海 张美萍 王 义
[摘要]以紫花苜蓿无菌苗的茎段为外植体,通过正交试验,得到了以改良SH(SH大量元素+B5微量元素)+2,4-D1.5mg/L+KT1.0mg/L,蔗糖浓度为3%的培养基为最佳的脱分化培养基,最佳的胚状体培养基为改良SH+KT0.5mg/L.蔗糖浓度为2%,并建立了紫花苜蓿的高效再生体系,为后续外源基因的导入奠定了良好的基础。
[关键词]紫花苜蓿胚状体再生体系石蜡切片
随着生命科学的发展,利用植物生物反应器即通过基因工程途径,以常见的农作物作为“化学工厂”,通过大规模种植生产具有高经济附加值的医用蛋白、工农业用酶、特殊碳水化合物、生物可降解塑料、脂类及其它一些次生代谢产物等生物制剂的方法,越来越受到全世界各国科学家的重视,新功能基因的分离、克隆手段逐步完善,很多功能性状很好的基因被分离、克隆,但是目前受体系统高效再生体系不是十分理想,直接制约着生物反应器的发展。本文介绍了紫花苜蓿的高效再生体系建立的方法。
1材料与方法
1.1试验材料
紫花苜蓿(Medicago sativa L.)无菌苗的茎段,紫花苜蓿种子由吉林农业大学生物技术学院提供。
1.2试验方法
1.2.1愈伤组织的诱导:将饱满的紫花苜蓿种子在灭菌蒸馏水中浸泡40分钟后,用0.1%HgCl2溶液消毒20分钟,无菌水洗3-5次,接种在1/2MS培养基上,置于(23±2)℃下培养。光照强度为15001x,光照周期为12小时光照12小时黑暗。培养6天左右,待植株长至4~5厘米时取出植株,将茎段切成5毫米左右的小段接种到脱分化培养基上,进行愈伤组织的诱导,先在相同的激素条件下从MS、B5、N6、改良SH和white这5种基本培养基中筛选出最适合紫花苜蓿脱分化的基础培养基,再以这种培养基为基础培养基筛选出最适合的激素种类与浓度的组合,从而确定最佳的脱分化培养基,为此本试验决定采用设计一个4因素5水平的正交试验,并通过SPSSl2.0分析以确定最佳的激素组合和浓度,各因素及相应水平(详见表1)。

1.2.2胚状体的获得:将使用上述方法培养的外植体材料培养25天左右,转入胚状体培养基中,同样以正交试验的方法来确定最佳的激素浓度与种类的组合。根据前面的试验,设计3因素5水平的正交试验,各因素及相应水平(详见表2)。
1.2.3再生植株:将剥离后,接到1/2MS上进行生根培养。培养15天左右,大部胚状体可长出不定芽及4~5条粗根。炼苗,打开瓶盖室温放2天,小心取出幼苗用自来水将根部的培养基洗掉,再移至花盆中(蛭石:营养土:灰土=1:1:1)培养,即可获得再生植株。
1.2.4石蜡切片的制作
FAA固定液配方:福尔马林5mL,冰醋酸5mL.70%酒精90mL。
苏木精染色剂配方:0.5g苏木色精+10m195%酒精+90ml蒸馏水+2滴H2O2。
取不同发育阶段的愈伤组织,FAA固定1~2天→30%酒精过夜→50%酒精2小时→75%酒精2小时→85%酒精3小时→95%酒精3小时→纯酒精2小时两次→1/2纯酒精+1/2二甲苯过夜→纯二甲苯2小时两次→加碎蜡(不断加入)→45℃烘箱放置过夜(直到碎蜡达饱和为止)→60℃烘箱放置4小时→过纯蜡3小时两次→包埋→修蜡块→切片机切片→梅氏蛋白粘片→烘干备用。
制作好的切片自然干燥数天后就可进行脱蜡、染色。步骤如下:二甲苯脱蜡10分钟两次→1/2二甲苯+1/2酒精10分钟→纯酒精10分钟两次→95%酒精5分钟→85%酒精5分钟→70%酒精5分钟→50%酒精5分钟→30%酒精5分钟→蒸馏水1分钟→4%铁矾溶液1小时→蒸馏水5分钟→0.5%苏木精染色30~40分钟→馏水冲洗→4%铁矾溶液浸泡2分钟→50%酒精5分钟→70%酒精5分钟→85%酒精5分钟→95%酒精5分钟→纯酒精10分钟两次→二甲苯10分钟两次→中性树胶封片→烘箱烘干(温度不可过高)→石蜡切片照相观察。
2结果与分析
2.1最佳培养基的确定
由表3可知,最适合紫花苜蓿脱分化的基础培养基为改良的SH培养基,即SH无机物+MS有机物。

2.2脱分化培养基中激素浓度与种类的最佳组合:本试验以紫花苜蓿无菌苗的新生茎段为外植体,根据正交设计表在同一基础培养基上添加相应的激素,结果发现脱分化发生的时间和发生率均有所不同,试验结果经SPSS12.0统计软件的LSD分析,以愈伤组织的诱导率为考察指标表明,改良SH+2,4-D1.5Smg/L+KT1.0mg/L,蔗糖浓度为3%的培养基应该为最佳的脱分化培养基。为验证试验的准确性随机选择正交试验中的3组培养基与最佳培养基进行比较实验,(详见表4)中的数据表明改良SH+2,4-D1.5mg/L+KT1.0mg/L蔗糖浓度为3%的培养基确为最佳的脱分化培养基。
试验发现在不添加2,4-D,蔗糖浓度为2%时,愈伤组织生长状态较好,有时还能分化出同时具有根和芽的小植株。
试验结果经SPSS12.0统计软件的LSD分析表明,以胚状体的形成为考察指标,2,4-D的影响达到显著水平(P<0.05),KT、蔗糖的影响未达到显著水平(P>0.05),且蔗糖作用大于KT作用,即3种影响因素对胚状体形成的影响程度依次为2,4-D>蔗糖>KT,表明2A-D和蔗糖是影响紫花苜蓿胚状体形成的重要影响因子。故而可知最佳的胚状体培养基应为:改良SH+KT0.5mg/L,蔗糖浓度为2%。
3小结
3.1培养基的影响:在试验中发现改良SH培养基最适宜于紫花苜蓿脱分化,其它培养基虽然也可以使紫花苜蓿脱分化,但是脱分化的时间和比率均远不如改良SH,可见不同的养分组成的培养基对紫花苜蓿脱分化的诱导影响很大。
3.2激素的影响:在紫花苜蓿组织培养中常使用的生长素有2,4-D、NAA、IAA、IBA等,通常认为2,4-D是体细胞胚再生的关键激素;常用的细胞分裂素主要有KT、BA,其作用是促进细胞分裂,促进芽的分化等。本试验也充分证实了这一观点。

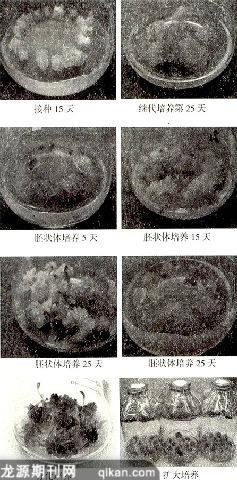
3.3胚性愈伤组织的细胞学观察
3.4体细胞胚发生各个阶段的细胞学观察
通过试验确定了外源基因转化受体系统高效再生体系建立的相关数据,建立了以紫花苜蓿为材料的外源基因转化受体系统高效再生体系。培养出了大量的胚状体,为后续外源基因的导人奠定了良好的基础,为植物生物反应器的发展提供条件。附图为紫花苜蓿外源基因转化受体系统高效再生体系建立的全过程。
