钠盐的图像及相关技巧分析
2025-03-03韦秋菊


摘 要:文章详细探讨了钠盐(碳酸钠和碳酸氢钠)与酸(盐酸)反应的图像及相关计算技巧,重点分析了这些反应在不同条件下的定性定量关系和反应历程,并通过详细解析化学反应原理、实验现象、图像特征以及具体计算过程,帮助学生深入理解并掌握高考化学中的这一重要知识点.
关键词:高中化学;钠盐;技巧分析
中图分类号:G632"" 文献标识码:A"" 文章编号:1008-0333(2025)01-0125-03
收稿日期:2024-10-05
作者简介:韦秋菊,本科,中学一级教师,从事化学教学研究.
钠盐图像指的是在碳酸钠、氢氧化钠或者碳酸氢钠溶液中,逐滴滴加稀盐酸,产生的二氧化碳体积和滴加的盐酸的体积图像问题[1].
1 基本原理分析
钠盐的图像问题,考查的实质是学生对钠盐和稀盐酸反应原理的理解,通过滴加顺序不同,反应现象不同,结合图像进行问题分析,考查了学生对知识的灵活运用及归纳、分析、推理能力,进而考查了学生的思维品质和学科素养[2].
NaOH+HClNaCl+H2O
当在NaOH溶液中加入稀盐酸时,反应只有一个阶段,没有气体生成.
当在Na2CO3溶液中加入稀盐酸时,反应存在两个阶段.第一阶段没有气体生成,第二阶段生成气体,且两个阶段消耗的盐酸量是相等的,其对应的钠盐图像如图1:
图像特点:Oa段、ab段消耗盐酸的体积相等.
反应原理:
Na2CO3+HClNaHCO3+NaCl
①
NaHCO3+HClNaCl+H2O+CO2↑ ②
当在NaHCO3溶液中加入稀盐酸时,反应只有一个阶段,直接生成大量气体(CO2).其对应的钠盐图像如图2:
图像特点:从O点开始即产生CO2气体.
反应原理:
NaHCO3+HClNaCl+H2O+CO2↑
2 解题技巧
2.1 长短定成分
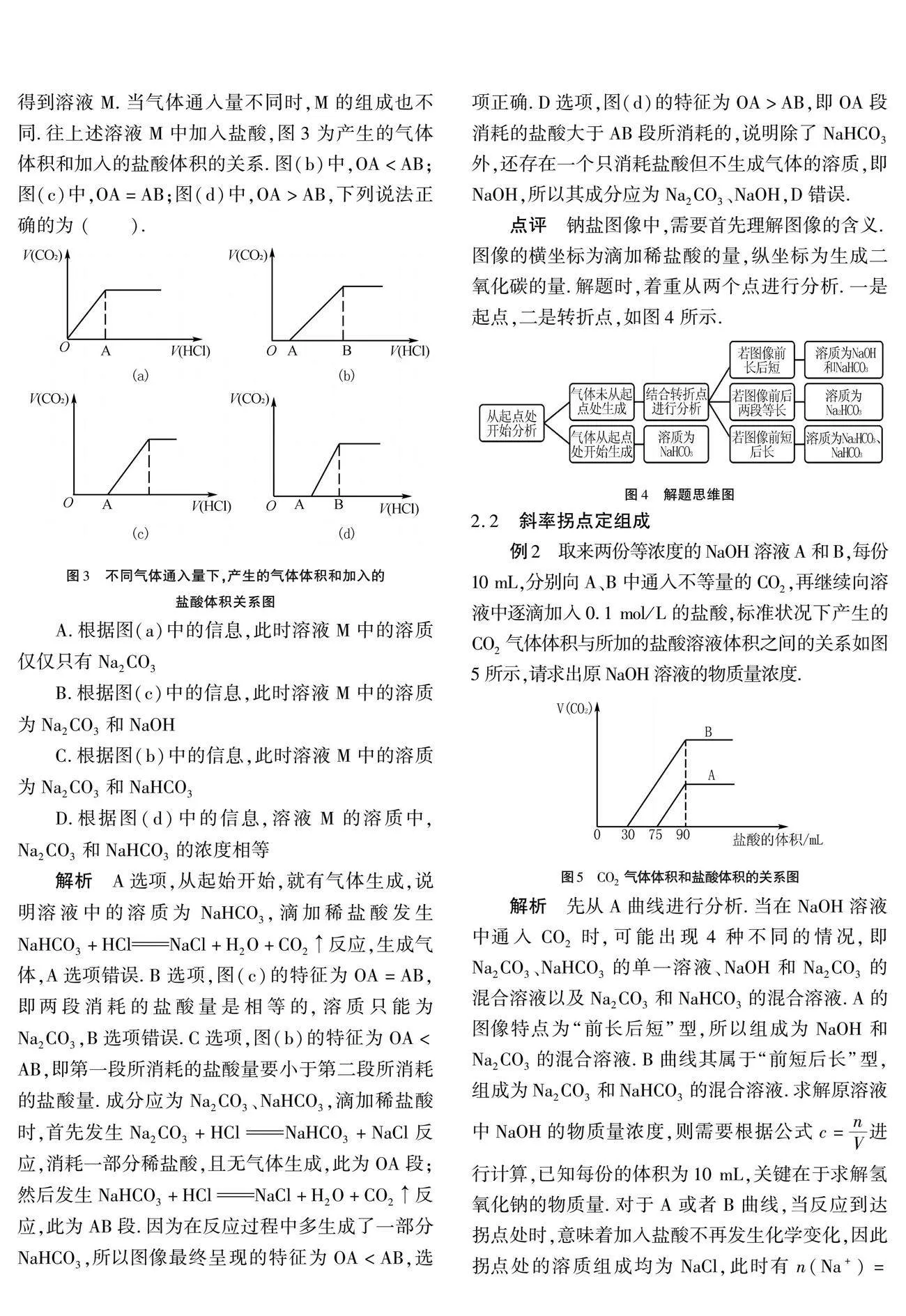
例1 将二氧化碳气体通入氢氧化钠溶液中,得到溶液M.当气体通入量不同时,M的组成也不同.往上述溶液M中加入盐酸,图3为产生的气体体积和加入的盐酸体积的关系.图(b)中,OA<AB;图(c)中,OA=AB;图(d)中,OA>AB,下列说法正确的为 (" ).
A.根据图(a)中的信息,此时溶液M中的溶质仅仅只有Na2CO3
B.根据图(c)中的信息,此时溶液M中的溶质为Na2CO3和NaOH
C.根据图(b)中的信息,此时溶液M中的溶质为Na2CO3和NaHCO3
D.根据图(d)中的信息,溶液M的溶质中,Na2CO3和NaHCO3的浓度相等
解析 A选项,从起始开始,就有气体生成,说明溶液中的溶质为NaHCO3,滴加稀盐酸发生NaHCO3+HClNaCl+H2O+CO2↑反应,生成气体,A选项错误.B选项,图(c)的特征为OA=AB,即两段消耗的盐酸量是相等的,溶质只能为Na2CO3,B选项错误.C选项,图(b)的特征为OAlt;AB,即第一段所消耗的盐酸量要小于第二段所消耗的盐酸量.成分应为Na2CO3、NaHCO3,滴加稀盐酸时,首先发生Na2CO3+HClNaHCO3+NaCl反应,消耗一部分稀盐酸,且无气体生成,此为OA段;然后发生NaHCO3+HClNaCl+H2O+CO2↑反应,此为AB段.因为在反应过程中多生成了一部分NaHCO3,所以图像最终呈现的特征为OAlt;AB,选项正确.D选项,图(d)的特征为OA>AB,即OA段消耗的盐酸大于AB段所消耗的,说明除了NaHCO3外,还存在一个只消耗盐酸但不生成气体的溶质,即NaOH,所以其成分应为Na2CO3、NaOH,D错误.
点评 钠盐图像中,需要首先理解图像的含义.图像的横坐标为滴加稀盐酸的量,纵坐标为生成二氧化碳的量.解题时,着重从两个点进行分析.一是起点,二是转折点,如图4所示.
2.2 斜率拐点定组成
例2 取来两份等浓度的NaOH溶液A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图5所示,请求出原NaOH溶液的物质量浓度.
解析 先从A曲线进行分析.当在NaOH溶液中通入CO2时,可能出现4种不同的情况,即Na2CO3、NaHCO3的单一溶液、NaOH和Na2CO3的混合溶液以及Na2CO3和NaHCO3的混合溶液.A的图像特点为“前长后短”型,所以组成为NaOH和Na2CO3的混合溶液.B曲线其属于“前短后长”型,组成为Na2CO3和NaHCO3的混合溶液.求解原溶液中NaOH的物质量浓度,则需要根据公式c=nV进行计算,已知每份的体积为10 mL,关键在于求解氢氧化钠的物质量.对于A或者B曲线,当反应到达拐点处时,意味着加入盐酸不再发生化学变化,因此拐点处的溶质组成均为NaCl,此时有n(Na+)=n(Cl-).无论原溶液在通入二氧化碳后发生了何种变化,其钠离子的来源均为NaOH.氯离子则全部由盐酸提供,此时则有n(NaOH)=n(HCl).则求解出盐酸的物质量大小,即为NaOH的物质量大小.盐酸的浓度已知,为0.1 mol/L,消耗的体积可以依据图像得到.A曲线和B曲线,盐酸的消耗体积均为90 mL,因此n(HCl)=cv=0.1 molL×90 mL=0.009 mol.所以原溶液中NaOH的物质量浓度c=nV=0.009 mol0.01 L=0.9 mol/L.
点拨 从最终的溶质为NaCl的角度出发,利用Na守恒和Cl守恒进行分析,在拐点处存在n(Na+)=n(Cl-)的关系.
当涉及“原溶液NaOH”相关量的判断,要根据图像的“拐点”盐酸的消耗量,方便快递地确定“Na”的量.
例3 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图6所示的关系(不考虑CO2在水中的溶解).下列说法不正确的是(" ).
A.滴加盐酸0-150 mL段发生的反应依次为
OH++H+H2O;CO2-3+H+HCO-3
B.所用盐酸的物质的量浓度为0.4 mol/L
C.CO2体积不再改变时,溶液中的溶质为NaCl
D.该样品中NaOH与Na2CO3物质的量之比为1∶2
解析 图像的特征为“前长后短”,属于NaOH和Na2CO3的混合溶液.当在该溶液中逐渐加入盐酸时,NaOH会先和HCl发生中和反应,然后是碳酸钠和HCl发生第一阶段的反应,生成NaHCO3,最后是碳酸氢钠进一步和盐酸反应,释放出CO2.A选项,问的是未产生气体的阶段,此时只发生中和反应以及碳酸根和氢离子结合,A选项正确.B选项,根据公式n=VVm,解得二氧化碳的物质量为0.02 mol,则该阶段对应的盐酸物质量为0.02 mol,体积为V=200 mL-150 mL=50 mL.根据公式求解得到盐酸的物质量浓度为0.4 mol/L,B选项正确.C选项,当达到拐点处时,所有的钠盐均通过转化生成NaCl,选项正确.D选项,分析两种溶质的比例关系,为该类题的常见考法.将图像分为“0-50”“50-100”“100-150”“150-200”四等份,代表有4份盐酸.由例2知道,可以通过“拐点”处盐酸的量,确定“Na”的总量.一共有4份盐酸,因此,原溶液中有4份“Na”;斜率处消耗了1份盐酸,则说明有1份的“C”因此与原溶液中有“1份C、4份的Na”,即C∶Na=1∶4.溶液的组成为“NaOH和Na2CO3”,则两物质之比为2∶1,D选项错误,答案为D.
点拨 确定钠碳比是求解钠盐混合溶液比例的关键所在.通过对拐点、斜率进行分析,依据盐酸的消耗量,运用守恒思想,确定出钠原子和碳原子的比例,然后再结合混合溶液中溶质的组成,则可分析出溶液的具体成分.在确定具体成分时,其中一种是进行未知数的设置,运用比例式进行求解运算.如在例3中,设NaOH物质量为x,Na2CO3的物质量为y,则可以有x+2yy=41,则xy=21.
3 结束语
钠盐的图像问题,实质分为两大类,一种是“溶质成分”的定性分析,此时需要依据图像的“长短”特征进行判断;另一种为溶液的定量分析,此时的解题思路是根据守恒思想,结合“拐点”和“斜率”处的等量关系进行分析判断.
参考文献:
[1] 张宝如.“钠及其化合物”常见考点例析与规律总结[J].理科考试研究(高中版),2019,26(6):53-58.
[2] 罗功举.钠及其化合物热点问题分析[J]
.数理化学习(高三版),2014(6):39-41.
[责任编辑:季春阳]
