HBV相关慢加急性肝衰竭恢复期患者肝组织HBV cccDNA水平及其临床意义
2025-02-27蔡哲凯徐龙刘文丽肖影群钟青梅张伟吴敏
摘要: 目的 观察HBV cccDNA在HBV相关慢加急性肝衰竭(HBV-ACLF)恢复期患者肝组织中的表达水平,并探讨其与HBV标志物、肝组织病理改变的关系。方法 选取2015年1月—2023年10月在南昌市第九医院住院的HBV-ACLF恢复期患者30例为肝衰竭组,另选取同期9例性别及年龄匹配的慢性乙型肝炎患者(CHB)作为对照组,检测肝组织HBV cccDNA水平,并分析其与临床资料、实验室检查指标的关联性。计量资料两组间比较采用成组t检验或Mann-Whitney U检验;多组间比较采用单因素方差分析或Kruskal-Wallis H检验。计数资料组间比较采用Fisher精确检验。相关性分析采用Spearman相关分析。结果 肝衰竭组肝组织 HBV cccDNA 水平显著低于对照组[(−0. 92±0. 70) log 10 copies/cell vs (−0. 13±0. 91)log 10 copies/cell,t=2. 761,P=0. 009]。肝衰竭组中,血清HBeAg阳性与阴性患者肝组织HBV cccDNA水平比较,差异无统计学意义(Pgt;0. 05);肝组织炎症活动度G0~G2级、G3级、G4级患者的肝组织HBV cccDNA水平比较,差异无统计学意义(Pgt;0. 05);肝组织纤维化程度S0~S2期、S3期、S4期患者的肝组织HBV cccDNA水平比较,差异无统计学意义(Pgt;0. 05);血清HBV DNA阴性与血清HBV DNA阳性患者肝组织HBV cccDNA水平比较,差异无统计学意义(Pgt;0. 05)。肝衰竭组肝组织HBV cccDNA水平与肝组织HBV DNA水平呈正相关(r=0. 426,P=0. 043),与血清HBV DNA水平无明显相关性(Pgt;0. 05)。
结论 肝组织HBV cccDNA水平在HBV-ACLF恢复期明显降低,肝组织HBV cccDNA持续稳定存在,较血清及肝组织HBVDNA更能反映HBV的持续感染与复制。
关键词: 乙型肝炎病毒; 慢加急性肝功能衰竭; 恢复期; 共价闭合环状DNA
The level of HBV cccDNA in liver tissue and its clinical significance in patients in the convalescence stage ofhepatitis B virus-related acute-on-chronic liver failure
CAI Zhekai a , XU Long a , LIU Wenli b , XIAO Yingqun b , ZHONG Qingmei b , ZHANG Wei a , WU Min aa. Department of Chronic Liver Diseases, b. Department of Pathology, The Ninth Hospital of Nanchang, Nanchang 330002, China
Corresponding author: XU Long, xulong791@126.com (ORCID: 0009-0004-9918-3237)
Abstract: Objective To investigate the expression level of HBV cccDNA in patients in the convalescence stage of hepatitis B virus-related acute-on-chronic liver failure (HBV-ACLF) and its correlation with HBV markers and liver histopathological changes. Methods Atotal of 30 patients in the convalescence stage of HBV-ACL who were hospitalized in The Ninth Hospital of Nanchang from January 2015to October 2023 were enrolled as liver failure group, and 9 patients with chronic hepatitis B (CHB), matched for sex and age, wereenrolled as control group. The content of HBV cccDNA in liver tissue was measured, and its correlation with clinical data and laboratorymarkers was analyzed. The independent-samples t test or the Mann-Whitney U test was used for comparison of continuous data betweentwo groups, and a one-way analysis of variance or the Kruskal-Wallis H test was used for comparison between multiple groups; the Fisher’s exact test was used for comparison of categorical data between groups. A Spearman correlation analysis was performed. Results Theliver failure group had a significantly lower content of HBV cccDNA in liver tissue than the control group (−0.92±0.70 log 10 copies/cell vs−0.13±0.91 log 10 copies/cell, t=2.761, P=0.009). In the liver failure group, there was no significant difference in the content of HBV cccDNA in liver tissue between the HBeAg-positive patients and the HBeAg-negative patients (Pgt;0.05); there was no significantdifference in the content of HBV cccDNA in liver tissue between the patients with different grades (G0-G2, G3, and G4) of liverinflammatory activity (Pgt;0.05); there was no significant difference in the content of HBV cccDNA in liver tissue between the patientswith different stages (S0-S2, S3, and S4) of liver fibrosis (Pgt;0.05); there was no significant difference in the content of HBV cccDNAin liver tissue between the patients with negative HBV DNA and those with positive HBV DNA (Pgt;0.05). For the liver failure group, thecontent of HBV cccDNA in liver tissue was positively correlated with the content of HBV DNA in liver tissue (r=0.426, P=0.043) andwas not significantly correlated with the content of HBV DNA in serum (Pgt;0.05). Conclusion There is a significant reduction in thecontent of HBV cccDNA in liver tissue in the convalescence stage of HBV-ACLF. HBV cccDNA exists continuously and stably in livertissue and can better reflect the persistent infection and replication of HBV than HBV DNA in serum and liver tissue.
Key words: Hepatitis B Virus; Acute-On-Chronic Liver Failure; Convalescence; Covalently Closed Circular DNA
慢加急性肝衰竭(ACLF)是一类以慢性肝病为基础,发生急性肝功能失代偿、肝外器官衰竭和短期高病死率为主要特征的严重临床综合征[1-2] 。HBV 的再活动是ACLF最常见的急性病因[3-4] 。2018年国内一项多中心、前瞻性研究[5]结果显示,71. 5%的患者为HBV相关ACLF(HBV-ACLF)。有研究[6] 发现,当血清HBV DNA水平降至检测值以下时,肝组织中仍能够检测到HBV cccDNA。
因此,肝内HBV cccDNA水平在病情监测和评估抗HBV治疗效果方面可作为更好的评价指标。本研究通过聚合酶链式反应(PCR)-荧光探针法定量检测HBV-ACLF恢复期患者肝组织的 HBV cccDNA 含量,并探讨其与HBV标志物、肝组织病理改变的关系,以期为cccDNA的稳定性与持久性相关研究提供新的见解。
1 资料与方法
1. 1 研究对象 选取 2015年 1月—2023年 10月在本院住院的HBV-ACLF恢复期患者纳入肝衰竭组,另随机选取同期住院、性别及年龄匹配的慢性乙型肝炎(CHB)患者作为对照组。肝衰竭患者符合《肝衰竭诊治指南(2018年版)》[2]的ACLF诊断标准;行肝穿刺活检时血清TBil≤85. 5 μmol/L,凝血酶原活动度(PTA)gt;60%,PLTgt;80×10 9 /L。CHB患者符合《慢性乙型肝炎防治指南(2022年版)》[7] 的诊断标准。所有研究对象均排除CHB以外的其他慢性肝病史,如酒精性肝病、脂肪性肝病等;排除伴有除肝炎相关以外的严重脏器功能损害、恶性肿瘤等;排除近期使用免疫抑制剂治疗者。所有研究对象入院时均给予核苷(酸)类似物(NUC)抗病毒治疗。
1. 2 资料收集 记录研究对象住院期间相关资料,包括年龄、性别、ALT、TBil、血肌酐(SCr)、PTA、血清 HBVDNA、肝组织HBV DNA、肝组织病理诊断结果等。MELD评分计算公式=3. 78ln[TBil(mg/dL)]+11. 2ln(INR)+9. 57ln[SCr (mg/dL)]+6. 4。
1. 3 标本采集与测定 研究对象通过彩色B超肝穿刺活检术定位,于病房行肝穿刺活检,保证肝组织常规病理检查要求,取剩余肝组织置入组织RNA保养液,−70 ℃冰箱保存备用。采用实时定量 PCR 检测肝组织 HBVDNA,使用广州海力特生物科技有限公司HBV cccDNA定量检测试剂盒,通过 PCR-荧光探针法测定肝组织HBV cccDNA。实验步骤:利用凯杰提取试剂盒提取肝组织核酸,使用蛋白酶K和组织裂解液对肝组织进行消化处理,提取纯化核酸后,取10 μL核酸加入40 μL PSAD酶切体系(1 μL PSAD酶+39 μL Buffer),进行37 ℃ 30 min孵育酶切,然后立即70 ℃ 30 min灭活酶系,酶切后的核酸作为PCR模板在FAM荧光通道扩增用于HBV cccDNA定量,未经酶切的核酸上样后选择VIC荧光通道扩增用于细胞定量。所有实验步骤均严格按照试剂说明书操作,确保检测结果的准确性和可靠性。
1. 4 统计学方法 应用SPSS 26. 0统计软件进行数据分析。正态分布的计量资料以 x ˉ ±s表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析;非正态分布的计量资料以M(P 25 ~P 75 )表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验。
计数资料组间比较采用Fisher精确检验。采用Spearman检验进行相关性分析。Plt;0. 05为差异有统计学意义。
2 结果
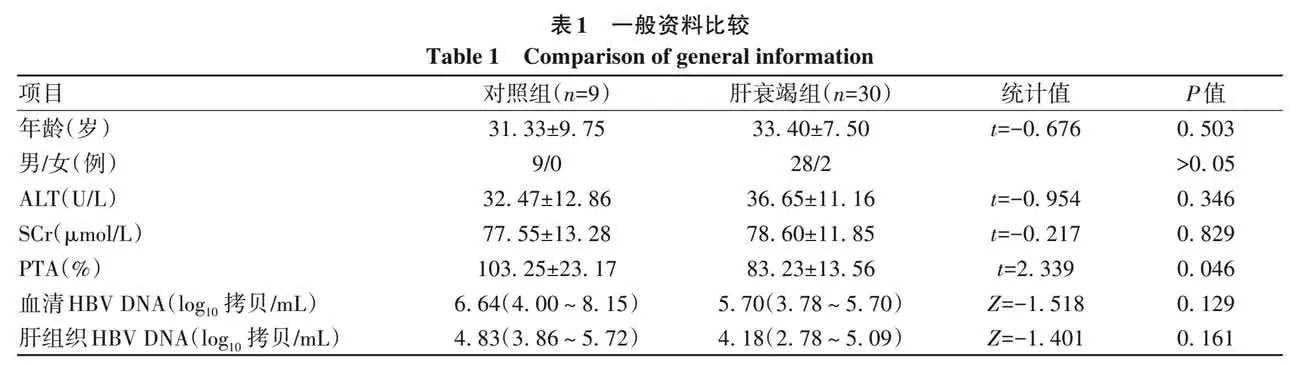
2. 1 一般资料 本研究共纳入 39 例患者,男 37 例(94. 87%),女2例(5. 13%),平均年龄(32. 92±7. 98)岁。其中HBV-ACLF恢复期患者30例,CHB患者9例,两组患者一般资料比较,年龄、性别、ALT、SCr、血清HBV DNA以及肝组织 HBV DNA 差异均无统计学意义(P 值均gt;0. 05),对照组患者 PTA 明显高于肝衰竭组(Plt;0. 05)(表1)。
2. 2 肝组织 HBV cccDNA 水平比较 肝衰竭组患者肝组织 HBV cccDNA 水平低于对照组[(−0. 92±0. 70)log 10 copies/cell vs (−0. 13±0. 91) log 10 copies/cell],差异有统计学意义(t=2. 761,P=0. 009)。
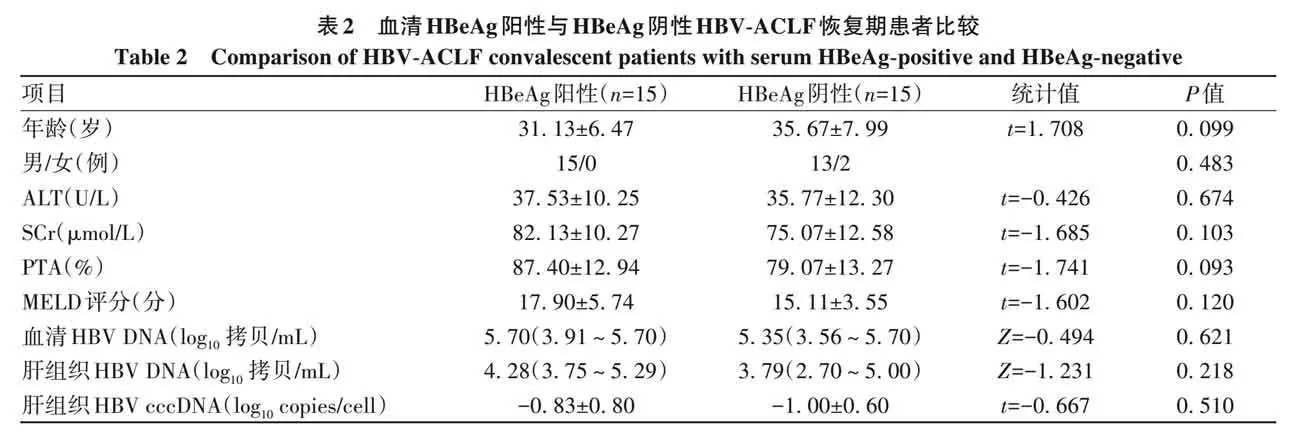
2. 3 肝组织 HBV cccDNA 水平与血清 HBeAg 的关系在肝衰竭组中,血清HBeAg阳性与HBeAg阴性各15例。HBeAg 阴性和阳性患者年龄、性别、ALT、SCr、PTA、MELD评分、血清HBV DNA、肝组织HBV DNA以及肝组织 HBV cccDNA 比较,差异均无统计学意义(P 值均gt;0. 05)(表2)。
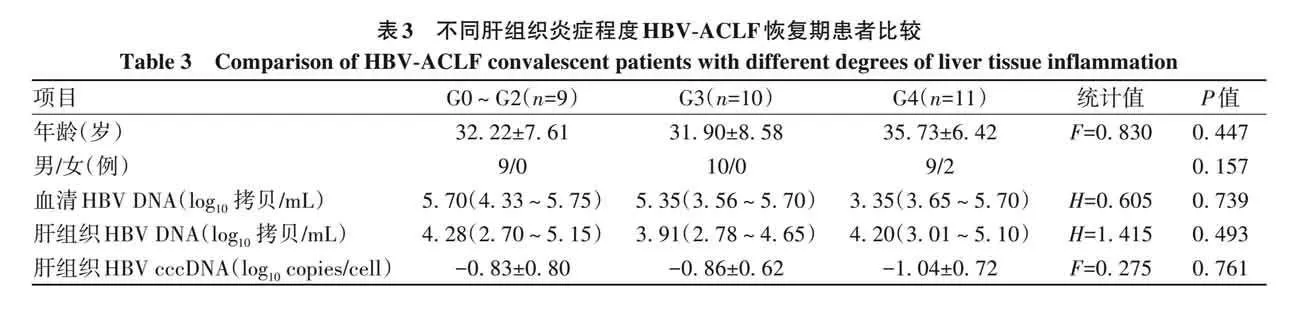
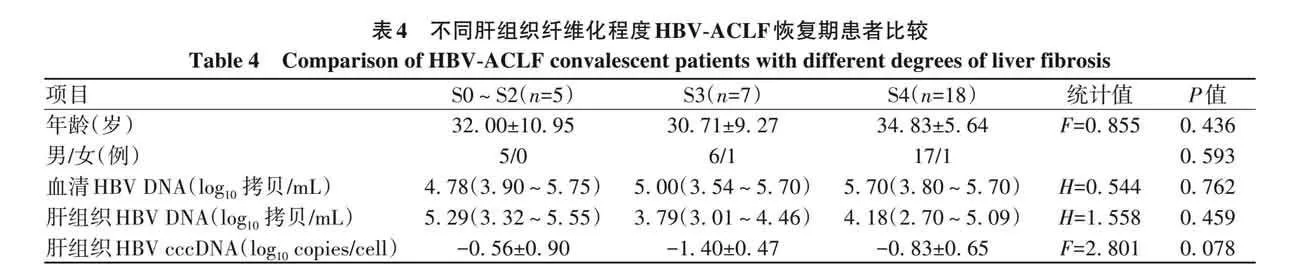
2. 4 肝组织HBV cccDNA水平与肝组织炎症程度及纤维化程度的关系 根据肝脏病理诊断对肝衰竭组患者进一步分析,结果显示,肝组织炎症活动度G0~G2级、G3级、G4级患者年龄、性别、血清和肝组织HBV DNA、肝组织HBV cccDNA比较,差异均无统计学意义(P值均gt;0. 05)(表3)。肝组织纤维化程度S0~S2期、S3期、S4期患者年龄、性别、血清和肝组织HBV DNA、肝组织HBV cccDNA比较,差异亦均无统计学意义(P值均gt;0. 05)(表4)。
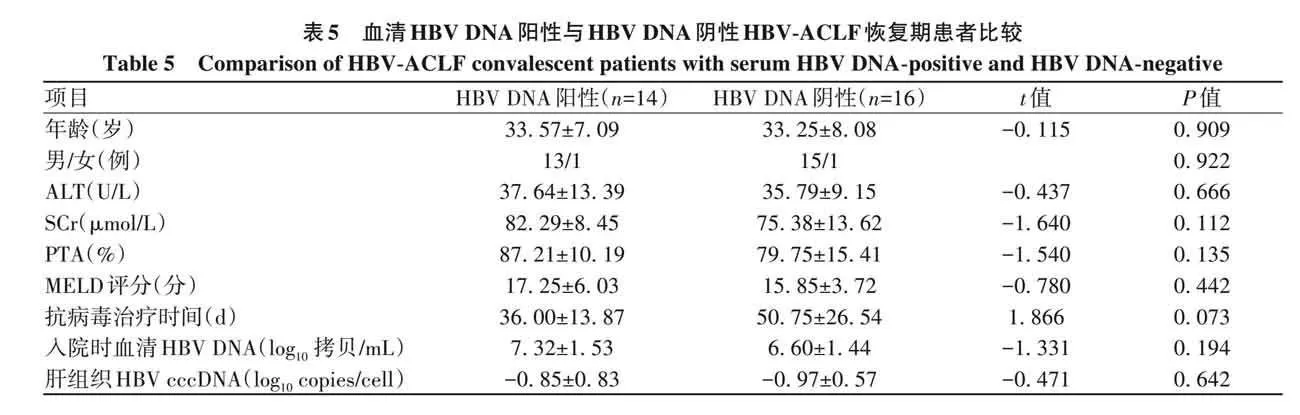
2. 5 肝组织 HBV cccDNA 水平与血清 HBV DNA 的关系 根据血清 HBV DNA 检测下限(5. 0×10 2 IU/mL)将HBV-ACLF恢复期患者分为血清HBV DNA阴性组和血清HBV DNA阳性组。结果显示,血清HBV DNA阴性组与阳性组患者年龄、性别、ALT、SCr、PTA、MELD评分、抗病毒治疗时间、入院时血清HBV DNA、肝组织HBV cccDNA比较,差异均无统计学意义(P值均gt;0. 05)(表5)。
2. 6 肝组织 HBV cccDNA 水平与血清及肝组织 HBVDNA的相关性分析 相关分析结果显示,肝衰竭组患者肝组织HBV cccDNA水平与血清HBV DNA水平无明显相关性(r=−0. 078,P=0. 688),与肝组织HBV DNA水平呈正相关(r=0. 426,P=0. 043)。
3 讨论
HBV是一种特异性靶向肝细胞的双链 DNA病毒,通过病毒包膜蛋白与硫酸乙酰肝素蛋白多糖结合,附着于宿主细胞表面,在牛磺胆酸钠协同转运多肽的作用下促进病毒进入细胞质[8] ,病毒颗粒从包膜释放核衣壳,核衣壳分解导致病毒基因组进入到细胞核形成松弛环状DNA(relaxed circular DNA, rcDNA),部分rcDNA转化为 cccDNA[9-10] 。HBV cccDNA 兼具病毒转录复制模板和基因储存库的功能[11] 。HBV通过HBV基因组的细胞内再循环和继发感染维持稳定的cccDNA库。因此,通过肝组织中的HBV cccDNA水平可以准确地了解HBV复制是否活跃及其活跃程度,而抑制病毒复制可以防止cccDNA库的更新。
本研究结果显示,与CHB患者相比,HBV-ACLF恢复期患者肝组织HBV cccDNA水平显著降低,而两组间血清及肝组织HBV DNA水平无明显差异。CHB患者入院后均口服抗病毒药物,包括恩替卡韦或替诺福韦等NUC,同时给予护肝、退黄、降酶等内科综合治疗。对于ACLF患者,均卧床休息,维持电解质或酸碱平衡,预防和治疗并发症,在内科综合治疗的基础上,必要时联合人工肝治疗。目前认为,机体的免疫系统清除HBV cccDNA有两种机制。一种是细胞溶解作用,通过肝细胞分裂可导致 cccDNA 丢失。增殖肝细胞对 HBV的再感染具有抵抗力,可能与HBV的功能性受体牛磺胆酸钠共转运受体表达水平降低,在肝细胞膜上的分布减少相关[12]。另一种为非细胞溶解作用,通过细胞毒性T淋巴细胞杀死感染的肝细胞。Lutgehetmann等[13] 研究报道,在肝再生且未使用抗病毒药物的情况下,细胞分裂会引起cccDNA库的强烈不稳定,导致大多数慢性感染的肝细胞中cccDNA被清除。在人嵌合小鼠的肝脏中,即使不涉及溶细胞机制,人肝细胞分裂也会引发大量cccDNA损失[14]。笔者推测,在 ACLF恢复期,免疫介导的肝细胞损伤和代偿性肝细胞增殖均可能导致 cccDNA 清除。肝组织cccDNA较血清及肝组织HBV DNA可更好地反映肝损伤后修复这一病理生理过程。
此外,本研究探讨了恢复期肝组织HBV cccDNA能否作为ACLF疾病严重程度的评估指标,发现HBV cccDNA水平与肝组织炎症及纤维化程度无关。有研究[15]报道,HBeAg状态与 HBV-ACLF严重程度相关。HBeAg阴性HBV-ACLF患者的病情较HBeAg阳性患者更重,可能与部分HBeAg阴性HBV-ACLF患者体内存在HBV前C区变异、T淋巴细胞亚群紊乱等因素相关。本研究并未发现HBeAg阳性组和阴性组的肝组织HBV cccDNA水平有统计学差异。上述结果表明,恢复期肝组织HBV cccDNA不能反映ACLF严重程度。可能的原因是HBV-ACLF患者肝脏的损伤是HBV激发机体免疫反应,损伤肝细胞,而不是HBV复制的直接结果[16] 。此外,本研究检测ACLF患者恢复期肝组织 HBV cccDNA,而不是治疗前 HBVcccDNA。如前所述,恢复期肝组织HBV cccDNA的降低是肝损伤和修复共同导致,因此不能反映肝衰竭严重程度,在CHB患者中亦有相同的结论[17]。
NUC 靶向 HBV 聚合酶的逆转录活性,抑制 HBVDNA的生物合成,从而将病毒血症控制在无法检测的水平,并使ALT水平恢复正常[11]。然而,NUC的众多益处不包括HBV cccDNA的消除。NUC不靶向HBV cccDNA,使其在感染的肝细胞中持续存在。在本研究中,HBV-ACLF恢复期患者肝组织HBV cccDNA的水平与肝组织HBV DNA水平呈正相关,与血清HBV DNA水平无明显相关性。有研究[16]显示,在CHB患者中,肝组织HBV cccDNA水平与肝组织HBV DNA水平呈高度相关性。本研究结果证实,使用NUC抗病毒治疗的HBV-ACLF患者中,当血清HBV DNAlt;5. 0×10 2 IU/mL时,肝组织内仍可维持一定水平的cccDNA,血清HBV DNA的水平并不能完全真实地反映肝组织内HBV复制及其活跃程度,停药后容易复发,导致抗病毒治疗失败[18]。复旦大学袁正宏教授团队[19] 对CHB患者肝组织进行原位cccDNA检测发现,阿德福韦长期治疗虽然可使血清HBV DNA被抑制到检测水平之下,肝内HBV抗原水平和细胞质HBV DNA水平大幅降低,但肝细胞核内仍可检测到一定水平的cccDNA,与本研究结果一致。cccDNA很难通过NUC治疗而被彻底清除,并且只要机体未建立有效的抗HBV免疫应答,肝细胞核内残存的cccDNA在停药后很容易实现回补及恢复病毒复制[20]。
综上所述,HBV-ACLF恢复期患者肝组织HBV cccDNA水平可能与感染肝细胞的大量坏死和增殖相关,其含量与HBV标志物、肝组织炎症及纤维化程度关系不密切,可能与HBV-ACLF处于恢复期有关,肝组织HBV cccDNA的水平与肝组织HBV DNA具有相关性,较血清及肝组织HBV DNA 水平更能反映 HBV 的持续感染与复制。然而,关于HBV cccDNA在ACLF中的临床应用价值还需更大样本量的研究。
伦理学声明: 本研究方案于2023年7月3日经由南昌市第九医院伦理委员会审批,批号:[2023]伦审字(34)号。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 蔡哲凯负责研究设计,数据整理,统计分析,文章撰写;张伟、吴敏负责样本收集,数据整理;刘文丽、钟青梅负责病理诊断,实验操作,资料整理;肖影群负责病理诊断质控及论文审阅;徐龙负责研究设计指导,论文审阅。
参考文献:
[1] MOREAU R, GAO B, PAPP M, et al. Acute-on-chronic liver failure: Adistinct clinical syndrome[J]. J Hepatol, 2021, 75(Suppl 1): S27-S35.DOI: 10.1016/j.jhep.2020.11.047.
[2] Liver Failure and Artificial Liver Group, Chinese Society of InfectiousDiseases, Chinese Medical Association; Severe Liver Disease andArtificial Liver Group, Chinese Society of Hepatology, Chinese Medi⁃cal Association. Guideline for diagnosis and treatment of liver failure(2018)[J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 临床肝胆病杂志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.
[3] SARIN SK, CHOUDHURY A, SHARMA MK, et al. Acute-on-chronicliver failure: Consensus recommendations of the Asian Pacific Asso⁃ciation for the Study of the Liver (APASL): An update[J]. HepatolInt, 2019, 13(4): 353-390. DOI: 10.1007/s12072-019-09946-3.
[4] ZHANG B, DILIHUMAER ZYE, ZHANG SY, et al. Progress on patho⁃genesis and medical treatment of hepatitis B virus-related chronicand acute liver failure[J/CD]. Chin J Liver Dis (Electronic Version),2023, 15(1): 28-33. DOI: 10.3969/j.issn.1674-7380.2023.01.005.张斌, 迪丽胡玛尔·扎依尔, 张诗雨, 等. 乙型肝炎相关慢加急性肝衰竭发病机制及治疗进展[J/CD]. 中国肝脏病杂志(电子版), 2023, 15(1): 28-33. DOI: 10.3969/j.issn.1674-7380.2023.01.005.
[5] GU WY, XU BY, ZHENG X, et al. Acute-on-chronic liver failure inChina: Rationale for developing a patient registry and baseline char⁃acteristics[J]. Am J Epidemiol, 2018, 187(9): 1829-1839. DOI: 10.1093/aje/kwy083.
[6] WURSTHORN K, LUTGEHETMANN M, DANDRI M, et al. Peginter⁃feron alpha-2b plus adefovir induce strong cccDNA decline and HB⁃sAg reduction in patients with chronic hepatitis B[J]. Hepatology,2006, 44(3): 675-684. DOI: 10.1002/hep.21282.
[7] Chinese Society of Hepatology, Chinese Medical Association; Chi⁃nese Society of Infectious Diseases, Chinese Medical Association.Guidelines for the prevention and treatment of chronic hepatitis B
[J]. Infect Dis Inf, 2023, 36(1): 1-17. DOI: 10.3969/j.issn.1007-8134.2023.01.01.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 传染病信息, 2023, 36(1): 1-17. DOI: 10.3969/j.issn.1007-8134.2023.01.01.
[8] VERRIER ER, COLPITTS CC, BACH C, et al. A targeted functionalRNA interference screen uncovers glypican 5 as an entry factor forhepatitis B and D viruses[J]. Hepatology, 2016, 63(1): 35-48. DOI:10.1002/hep.28013.
[9] TSUKUDA S, WATASHI K. Hepatitis B virus biology and life cycle[J].Antiviral Res, 2020, 182: 104925. DOI: 10.1016/j.antiviral.2020.104925.
[10] MACOVEI A, PETRAREANU C, LAZAR C, et al. Regulation of hepatitisB virus infection by Rab5, Rab7, and the endolysosomal compartment
[J]. J Virol, 2013, 87(11): 6415-6427. DOI: 10.1128/JVI.00393-13.
[11] XIA YC, GUO HT. Hepatitis B virus cccDNA: Formation, regulation andtherapeutic potential[J]. Antiviral Res, 2020, 180: 104824. DOI: 10.1016/j.antiviral.2020.104824.
[12] YAN Y, ALLWEISS L, YANG DL, et al. Down-regulation of cell mem⁃brane localized NTCP expression in proliferating hepatocytes pre⁃vents hepatitis B virus infection[J]. Emerg Microbes Infect, 2019, 8(1): 879-894. DOI: 10.1080/22221751.2019.1625728.
[13] LUTGEHETMANN M, VOLZ T, KÖPKE A, et al. In vivo proliferation ofhepadnavirus-infected hepatocytes induces loss of covalently closedcircular DNA in mice[J]. Hepatology, 2010, 52(1): 16-24. DOI: 10.1002/hep.23611.
[14] ALLWEISS L, VOLZ T, GIERSCH K, et al. Proliferation of primary hu⁃man hepatocytes and prevention of hepatitis B virus reinfection effi⁃ciently deplete nuclear cccDNA in vivo[J]. Gut, 2018, 67(3): 542-552. DOI: 10.1136/gutjnl-2016-312162.
[15] WEN B, YUAN J, LI XH, et al. The clinical features in chronic severehepatiti B patients with HBeAg-positive and HBeAg-negative[J].Chin J Prim Med Pharm, 2010, 17(1): 50-52. DOI: 10.3760/cma.j.issn.1008-6706.2010.01.024.文彬, 袁静, 李晓鹤, 等. HBeAg阳性与HBeAg阴性慢性重型乙型肝炎死亡患者的临床特征比较[J]. 中国基层医药, 2010, 17(1): 50-52. DOI: 10.3760/cma.j.issn.1008-6706.2010.01.024.
[16] RAO M, LU W, ZHANG ZQ, et al. The relationship among HBVcccDNA , HBV total DNA in liver tissue and serum HBV DNA andtheir clinic-pathological significances in patients with chronic hepati⁃tis B[J]. Chin Hepatol, 2012, 17(6): 381-384. DOI: 10.14000/j.cnki.issn.1008-1704.2012.06.013.饶敏, 陆伟, 张占卿, 等 . 慢性乙型肝炎患者肝组织 HBV cccDNA、总HBV DNA与血清HBV DNA的相关性及其与临床的关系[J]. 肝脏, 2012,17(6): 381-384. DOI: 10.14000/j.cnki.issn.1008-1704.2012.06.013.
[17] XIE YL, HUANG WL, DU J, et al. The relationship between HBVcccDNA of chronic hepatitis B patients liver tissues andserum HB⁃sAg and liverinjury[J]. China J Mod Med, 2014, 24(22): 25-27.谢元林, 黄维亮, 杜杰, 等. 乙肝患者肝组织cccDNA与血清HBsAg及肝损伤的关系[J]. 中国现代医学杂志, 2014, 24(22): 25-27.
[18] LIU XY, CHEN J, XIAO L, et al. Clinical features of HBV-associatedacute-on-chronic liver failure induced by discontinuation of nucleo⁃side analogues[J]. J Clin Hepatol, 2016, 32(9): 1766-1769. DOI: 10.3969/j.issn.1001-5256.2016.09.028.刘晓燕, 陈婧, 肖珑, 等. 停用核苷和核苷酸类药物诱发HBV相关慢加急性肝衰竭患者的临床特点分析[J]. 临床肝胆病杂志, 2016, 32(9):1766-1769. DOI: 10.3969/j.issn.1001-5256.2016.09.028.
[19] ZHANG X, LU W, ZHENG Y, et al. In situ analysis of intrahepatic viro⁃logical events in chronic hepatitis B virus infection[J]. J Clin Invest,2016, 126(3): 1079-1092. DOI: 10.1172/JCI83339.
[20] CHEN JL, YUAN ZH. Influence of interferon and nucleos (t) ide ana⁃logues on HBV cccDNA and functional cure of chronic hepatitis B
[J]. J Clin Hepatol, 2019, 35(6): 1181-1187. DOI: 10.3969/j.issn.1001-5256.2019.06.002.陈捷亮, 袁正宏. 干扰素和核苷(酸)类似物治疗对HBV cccDNA的影响与慢性乙型肝炎的功能性治愈[J]. 临床肝胆病杂志, 2019, 35(6):1181-1187. DOI: 10.3969/j.issn.1001-5256.2019.06.002.
收稿日期:2024-05-17;录用日期:2024-07-10
本文编辑:葛俊
