肿瘤坏死因子-α诱导连接蛋白表达和分布在脓毒症大鼠心房颤动发生中的作用
2025-02-24夏嘉鼎张坤徐敏李国斌郑欣滑立伟
【摘 要】目的:观察肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)对脓毒症大鼠连接蛋白43(conenxin 43,Cx43)和连接蛋白40(conenxin 40,Cx40)表达和分布调控作用,并探讨其与心房颤动(atrial fibrillation,AF)发生的关系。方法:42只SD大鼠随机分为3组,分别为脓毒症组、给药组、假手术组,每组14只。通过盲肠结扎穿孔术制备脓毒症动物模型,给药组于术前6 h、术后24 h及术后48 h泵入TNF-α螯合剂重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白。3组术后48 h均应用程序刺激诱发房颤,记录各组诱发情况。通过酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清中TNF-α浓度,应用蛋白免疫印迹法检测心房肌组织TNF-α、Cx43、Cx40的蛋白表达水平,应用激光共聚焦显微镜观察TNF-α、Cx43、Cx40的分布情况。结果:假手术组、脓毒症组及给药组AF诱发率分别为7.14%、71.42%和21.40%,AF持续诱发时间分别为(79.21±4.10) s、(348.64±11.89) s和(294.50±37.28) s。通过ELISA检测假手术组、脓毒症组和给药组的血清中TNF-α的浓度分别为74.149 pg/mL、104.497 pg/mL和89.059 pg/mL。通过Western blot检测假手术组、脓毒症组和给药组的TNF-α蛋白表达水平分别为1.731±0.417、3.153±0.576和2.543±0.861,Cx40蛋白表达水平分别为1.207±0.230、0.970±0.170和1.010±0.164,Cx43蛋白表达水平分别为1.579±0.158、1.306±0.462和1.324±0.295。相对于假手术组,脓毒症组AF诱发率升高(F=5.394,P=0.003)且AF持续时间延长(F=335.577,P<0.001),血清TNF-α浓度升高(F=25.733,P<0.001),心房肌组织蛋白TNF-α表达增加(F=17.130,P<0.001),Cx40和Cx43表达降低(F=6.215,P=0.045;F=3.001,P=0.035),激光共聚焦显微镜观察心房肌Cx40及Cx43分布紊乱;相对于脓毒症组,给药组AF诱发率降低(χ2=1.292,P=0.028),且血清TNF-α浓度降低(F=18.192,P=0.004),心房肌组织蛋白TNF-α表达减少(F=28.078,P=0.017),心房肌组织Cx40和Cx43分布紊乱有所减轻。结论:脓毒症大鼠过表达的TNF-α可以诱导心房肌Cx43及Cx40表达异常和分布重构,其在脓毒症诱导AF的发展中可能发挥重要作用。
【关键词】脓毒症;心房颤动;肿瘤坏死因子-α;连接蛋白40;连接蛋白43
【中图分类号】R542.2【文献标志码】A【收稿日期】2024-05-29
基金项目:2022年度承德市科技计划资助项目(编号:202204A074);2021年河北省政府资助临床医学优秀人才培养资助项目。
Role of tumor necrosis factor-α in regulating the expression and distribution of connexin in the development of atrial fibrillation in rats with sepsis
Xia Jiading,Zhang Kun,Xu Min,Li Guobin,Zheng Xin,Hua Liwei
(Department of Critical Care Medicine,Affiliated Hospital of Chengde Medical University)
【Abstract】Objective:To investigate the regulatory effect of tumor necrosis factor-α(TNF-α) on the expression and distribution of connexin 43 (Cx43) and connexin 40(Cx40) in rats with sepsis,as well as its association with the development of atrial fibrillation(AF). Methods:A total of 42 Sprague-Dawley rats were randomly divided into sepsis group,drug group,and sham-operation group,with 14 rats in each group. The method of cecal ligation and puncture was used to establish an animal model of sepsis,and the rats in the drug group were given the pumping of rhTNFR:FC at 6 hours before surgery and at 24 and 48 hours after surgery. Programmed electrical stimulation was imposed on all three groups at 48 hours after surgery. ELISA was used to measure the serum level of TNF-α,Western blotting was used to measure the protein expression levels of TNF-α,Cx43,and Cx40 in atrial muscle tissue,and a laser scanning confocal microscope was used to observe the distribution of TNF-α,Cx43,and Cx40. Results:The induction rate of AF was 7.14% in the sham-operation group,71.42% in the sepsis group,and 21.40% in the drug group,with a duration of AF induction of 79.21±4.10 seconds,348.64±11.89 seconds,and 294.50±37.28 seconds,respectively. ELISA showed that the serum concentration of TNF-α was 74.149 pg/mL in the sham-operation group,104.497 pg/mL in the sepsis group,and 89.059 pg/mL in the drug group,and Western blot showed that in these three groups,the protein expres‐sion levels of TNF-α were 1.731±0.417,3.153±0.576,and 2.543±0.861,respectively,the protein expression levels of Cx40 were 1.207±0.230,0.970±0.170,and 1.010±0.164,respectively,and the protein expression levels of Cx43 were 1.579±0.158,1.306±0.462,and 1.324±0.295,respectively. Compared with the sham-operation group,the sepsis group had significant increases in the in‐duction rate of AF(F=5.394,P=0.003),the duration of AF(F=335.577,P<0.001),the serum concentration of TNF-α(F=25.733,P< 0.001),and the protein expression level of TNF-α in atrial muscle tissue(F=17.130,P<0.001) and significant reductions in the ex‐pression levels of Cx40 and Cx43(F=6.215 and 3.001,P=0.045 and 0.035),with disordered distribution of Cx40 and Cx43 in atrial muscle observed by the laser scanning confocal microscope. Compared with the sepsis group,the drug group had significant reductions in the induction rate of AF(χ2=1.292,P=0.028),the serum concentration of TNF-α(F=18.192,P=0.004),and the protein expression level of TNF-α in atrial muscle tissue(F=28.078,P=0.017),as well as alleviation of the disordered distribution of Cx40 and Cx43 in atrial muscle tissue. Conclusion:Overexpression of TNF-α can induce the abnormal expression and distribution remodeling of Cx43 and Cx40 in atrial muscle of rats with sepsis,and it may play an important role in the development of AF induced by sepsis.
【Key words】sepsis;atrial fibrillation;tumor necrosis factor-α;connexin 40;connexin 43
脓毒症是指宿主对感染的反应失调而致的危及生命的器官功能障碍[1],其所导致的心肌损伤和影响血流动力学的心律失常在重症医学领域被重点关注。在重症监护病房中,部分既往未发生心律失常的脓毒症患者会出现心房颤动(atrial fibrilla‐tion,AF)。脓毒症伴AF患者住院时间延长、病死率增加,是影响危重患者预后的重要因素之一[2]。
脓毒症的重要病理生理特征是系统性炎症反应,表现为循环中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子明显增多,而炎症反应参与AF发生发展过程[3]。关于心房肌细胞间的连接蛋白在AF的研究中受到重视,其中连接蛋白43(conenxin 43,Cx43)和连接蛋白40(conenxin 40,Cx40)的表达及分布异常是心房肌细胞内重要的改变,其与房性心律失常关系密切[4]。有研究证实炎性因子可以直接影响连接蛋白,导致细胞间隙连接蛋白功能障碍[5]。但脓毒症中过表达的TNF-α是否能够影响连接蛋白表达和分布重构从而导致AF的发生,有待进一步研究。本研究通过建立脓毒症动物模型,探讨TNF-α对Cx43和Cx40表达及分布的影响及其在AF发生中的作用,以期明确脓毒症诱导AF发生的潜在机制。
1 材料与方法
1.1 材料与试剂
清洁级SD雄性大鼠,购自北京华阜康公司生物科技股份有限公司,许可证号:SCXK(京)2019-0008,体质量260~ 280 g。相关试剂:TNF-α螯合剂:重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(recombinant human tumor necrosis fac‐tor-α receptor Ⅱ:IgG Fc fusion protein for injection,rhTNFR:Fc),规格(25 mg/支,三生国健药业股份有限公司,上海),大鼠TNF-α 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉伊莱瑞特,E-EL-R2856c),兔多克隆TNF-α抗体(英国Abcam,ab205587),兔多克隆Cx40抗体(英国Abcam,ab183648),兔多克隆Cx43抗体(美国CST,3512),兔多克隆β-actin抗体(英国Abcam,ab8227),山羊抗兔HRP二抗(英国Abcam,ab6721),免疫荧光染色剂DAPI(上海碧云天,C1002)。本研究遵循国家实验动物管理条例及国家实验动物管理实施细则,符合医学伦理学标准并经承德医学院附属医院伦理委员会批准(受理编号:CYFYLL2022089)。
1.2 仪器与设备
酶标仪(美国Multiskan FC),BL-420N生物机能实验系统(成都泰盟科技有限公司),程序电子刺激仪(上海玉研仪器),小动物呼吸机(成都泰盟科技有限公司),激光共聚焦显微镜(日本,Olumpus Fluo View 1000)。
1.3 方法
1.3.1 脓毒症大鼠模型制备及分组 将大鼠按随机数字法随机分为脓毒症组、给药组和假手术组,每组各14只。目前盲肠结扎穿孔动物模型是脓毒症研究的经典模型,因具有血流动力学及炎症反应阶段与人类脓毒症类似的临床表现[6],故脓毒症组及给药组采用盲肠结扎穿孔法建立脓毒症模型,术后立即皮下注射0.9%氯化钠补液(补液量2.0 mL/kg);给药组于术前6 h、术后24 h及术后48 h经尾静脉泵入TNF-α螯合剂rhTNFR:Fc(剂量2.0 mg/kg/h)。假手术组用同样方法分离盲肠,但不结扎穿孔,其余操作同脓毒症组及给药组。
1.3.2 程序电刺激诱发AF 模型制备成功后应用戊巴比妥麻醉,腹腔注射无菌戊巴比妥钠(剂量40 mg/kg,浓度1%),大鼠处于麻醉状态后应用生物信号采集处理系统记录心电图,将食管电极延大鼠食管至左心房后壁。测量起搏阈值后通过程序电刺激起搏大鼠左心房诱发AF,设置的电刺激参数为双阈值,周期20 ms,脉冲宽度5 ms,电流50 Hz,刺激时间30 s,间隔5 min后进行下一次刺激,重复3次,AF诱发成功的标志为大鼠体表心电图P波消失,代替以典型的f波,RR间期不等。如AF诱发至少1次且持续时间>5 s为诱发成功。
1.3.3 ELISA检测炎性因子 程序电刺激后采集大鼠心脏中血液样本,室温下将血液自然凝固10~20 min,2 000~ 3 000 r/min离心20 min后采集上层血清,应用大鼠TNF-αELISA试剂盒,通过酶标仪检测450 nm处的吸光度。以标准品浓度作横坐标,对应光密度值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本TNF-α浓度值。
1.3.4 激光共聚焦显微镜观察心房肌TNF-α、Cx43、Cx40分布 采血后剪取模型心脏,用手术刀片将左心耳完整切下,洗净血液后用滤纸吸干多余水分,固定包埋组织块并切取厚度为10 μm的冰冻切片,保持切片与心房肌纵轴平行。4%多聚甲醛固定30 min,洗涤后应用0.1% Triton X-100覆盖组织30 min,10%血清封闭液封闭非特异性位点1 h,应用TNF-α抗体(1∶300),兔多克隆Cx40抗体(1∶300),兔多克隆Cx43抗体(1∶300)分别孵育3组心房肌组织切片,4 ℃孵育过夜。洗涤后加50~100 μL荧光二抗(1∶500)分别避光孵育3组切片,37 ℃孵育2 h,洗涤封片后应用激光共聚焦显微镜下观察切片,每1张切片去3~6个视野,选择细胞纵行走向区域进行观察。
1.3.5 蛋白免疫印迹法Western blot检测TNF-α、Cx43、Cx40表达 采血后剪取模型心脏,生理盐水冲洗,滤纸吸干心房组织表面水分,取10 mg组织用眼科剪剪碎后放入匀浆器,加入500 μL的蛋白裂解液冰上碾磨匀浆30 min。高速低温离心机(4 ℃,12 000 r/min)离心10 min后提取上清液。行SDS聚丙烯酰胺凝胶电泳电泳,5%脱脂奶粉室温下封闭2 h后弃去封闭液,分别加入兔多克隆TNF-α抗体(1∶1 000),兔多克隆Cx40抗体(1∶1 000),兔多克隆Cx43抗体(1∶1 000)的封闭液,4 ℃孵育过夜。洗膜后加入以1∶5 000稀释的过氧化物酶标记的二抗室温下孵育2 h。以β-actin(1∶10 000)抗体作为内参照。洗膜后采用ECL进行化学发光,于化学发光成像仪下拍照并获取图片,运用Image J软件进行分析。
1.4 统计学方法
数据使用GraphPad Prism 6进行处理及统计分析。计量资料采用均数±标准差(x±s)表示,根据方差齐性检验结果,各组间的比较采用单因素方差分析,计数资料用频数,百分比表示,采用χ2检验,检验水准α=0.05。
2 结 果
2.1 3组大鼠AF诱发率和AF持续时间情况
假手术组、脓毒症组及给药组AF诱发率分别为7.14%、 71.42%和21.40%,AF持续诱发时间分别为(79.21±4.10) s、(348.64±11.89) s和(294.50±37.28) s。相对于假手术组,脓毒症组AF诱发率升高(F=5.394,P=0.003)且AF持续时间延长(F=335.577,P<0.001);相对于脓毒症组,给药组AF诱发率降低(χ2=1.292,P=0.028),AF持续时间虽较脓毒症组缩短,但差异无统计学意义(F=294.500,P=0.066)。见表1。
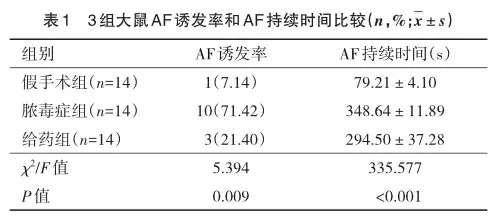
2.2 3组大鼠炎性反应情况
通过ELISA检测3组大鼠血清中TNF-α的浓度见图1,假手术组、脓毒症组和给药组的结果分别为74.149 pg/mL、104.497 pg/mL和89.059 pg/mL。脓毒症组大鼠血清中TNF-α含量较假手术症组明显升高(F=25.733,P<0.001);给药组大鼠经rhTNFR:Fc干预后TNF-α含量较脓毒症组明显降低(F=18.192,P=0.004)。
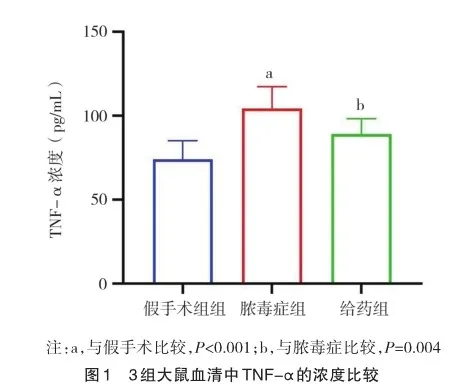
2.3 3组大鼠心房肌组织TNF-α、Cx43、Cx40分布情况
3组大鼠心房肌组织TNF-α免疫荧光染色结果见图2。激光共聚焦显微镜下可见:TNF-α阳性表达呈现绿色荧光,细胞核(DAPI染色)呈现蓝色荧光。与假手术组相比,脓毒症组TNF-α阳性表达相对较多;给药组TNF-α阳性表达较脓毒症组相对减少。
3组大鼠心房肌组织Cx40免疫荧光染色结果见图3,Cx43免疫荧光染色结果见图4。激光共聚焦显微镜下可见:Cx40及Cx43阳性表达呈现绿色荧光,细胞核(DAPI染色)呈现蓝色荧光。假手术组Cx40及Cx43荧光信号主要分布相对均匀,排列较为规律,多数位于心肌细胞长轴垂直的端-端相接处,少数位于与长轴平行的细胞侧-侧相接部位;与假手术组相比,脓毒症组Cx40及Cx43荧光信号端-端分布减少,侧-侧分布相对增多;给药组Cx40及Cx43荧光信号分布仍不均匀,但非均匀程度较脓毒症组有所减轻。
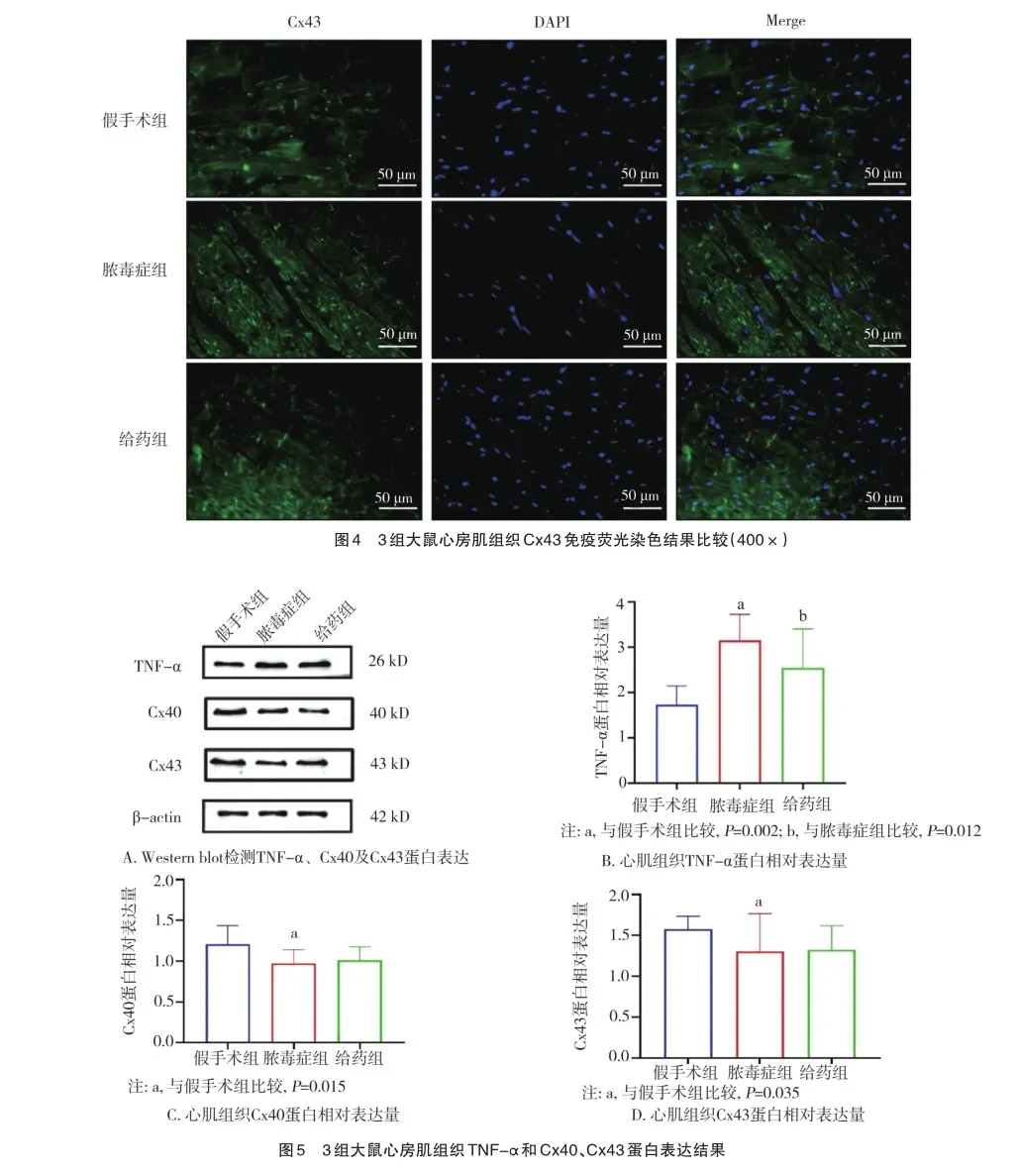
2.4 3组大鼠心房肌组织TNF-α、Cx43、Cx40蛋白表达情况
3组大鼠心房肌组织中TNF-α、Cx40、Cx43蛋白表达水平比较见图5。其中对于TNF-α,各组表达水平分别为假手术组1.731±0.417、脓毒症组3.153±0.576、给药组2.543±0.861,脓毒症组相较于假手术组表达水平明显升高,差异有统计学意义(F=17.130,P<0.001),经过治疗后给药组TNF-α表达水平较给药组明显降低(F=28.078,P=0.017)。对于 Cx40,各组表达水平分别为假手术组1.207±0.230、脓毒症组0.970±0.170、给药组1.010±0.164,脓毒症组较假手术组降低(F=6.215,P=0.045);对于Cx43,各组表达水平分别为假手术组1.579±0.158、脓毒症组1.306±0.462、给药组1.324±0.295,脓毒症组较假手术组降低(F=3.001,P= 0.035)。给药组的Cx40、Cx43的蛋白表达水平较脓毒症组比较差异无统计学意义(F=4.969,P=0.589;F=5.295,P= 0.887)。

3 讨 论
既往未发生心律失常的脓毒症患者发生AF占有相当比例,有研究发现脓毒症患者新发AF的发病率在1.7%~43.9%[7]。但针对脓毒症发病过程中心脏电生理改变的研究相对较少,因此深入研究脓毒症新发AF的发生机制具有重要意义。目前观点认为AF的机制与炎症反应存在关联,作为心房重构的重要上游介质,炎症反应可通过一系列炎性因子作用引起心房机械重构及电重构,从而介导AF的发生和维持[8]。而炎症反应正是脓毒症的主要病理基础之一。在脓毒症启动早期,机体会释放包括TNF-α在内的多种炎性因子。TNF-α由激活的单核-巨噬细胞分泌,参与细胞增殖、分化、凋亡和炎症反应等多个环节,其对心血管组织重构及心肌细胞的增殖具有重要的调控作用[9-10]。相关研究显示,TNF-α可能通过不同机制参与AF发生,包括改变心肌细胞离子通道的表达或功能,发生电重构,延迟动作电位,促进AF的发生和发展[3],本研究也发现,当动物模型出现脓毒症表现后,通过程序电刺激诱发AF发生率较假手术组明显增高,且诱发持续时间延长,大鼠血清TNF-α浓度以及心房肌组织TNF-α的蛋白表达水平明显升高,免疫荧光显示心房肌TNF-α阳性表达增多。而在应用TNF-α受体拮抗剂rhTNFR:Fc结合TNF-α并阻止其与细胞表面受体结合,从而抑制TNF-α生物学效应后,AF诱发率明显下降。由ELISA、Western blot以及免疫荧光等不同检验方式均可以证实脓毒症过程中TNF-α明显升高,且脓毒症大鼠模型AF易感性明显升高,过表达的TNF-α在脓毒症诱导AF启动过程中发挥重要作用。
在AF的心电活动改变中,传导阻滞及折返占重要地位,其与心房肌细胞间缝隙连接蛋白密切相关。连接蛋白在心肌细胞中提供电信号和电流通路,保证动作电位的扩布,因此具有传递电冲动的作用,其中Cx43及Cx40与AF关系最为密切。在正常心肌组织中,Cx43多集中在细胞的端-端连接处,保证电信号冲动沿心肌长轴快速传导,减少了动作电位在细胞间的离散度。而病理条件导致Cx43发生电重构,表现为表达数量减少并出现非均匀化改变,从而改变电传导的同向性,电传导速率降低,即发生传导阻滞;或电信号未能沿心肌长轴纵向传导,而仅是通过横向传导再次返回原来的激动点,即形成折返,从而导致心律失常的发生[11-12]。本研究发现,与脓毒症模型组AF诱发率增高相对应,心房肌Cx43表达水平明显下降,且其分布出现紊乱,由心肌细胞端-端连接部分转移至侧-侧连接,提示脓毒症过程中Cx43数量减少并发生重构,提供了诱导AF的基质基础。
除Cx43外,Cx40也是促进心房细胞间电信号交流与传递的重要电分子基质。本研究还对AF与Cx40表达水平及重构之间的关系进行研究,结果发现AF易感性强的模型组Cx40表达减少。目前国内外不同研究发现AF时Cx40表达量高低不一,但一般认为Cx40表达变化以及分布异常与AF有关[13-14]。从重构角度看,本研究发现高AF诱发率模型组心房肌Cx40荧光信号侧-侧分布相对增多,端-端分布减少,这种异质性分布提示相邻心房肌细胞具有明显不同的阻抗和传导速度,因而产生众多细微传导阻滞区域,并形成微小折返环路,导致AF发生和持续。
在本研究中,脓毒症动物模型TNF-α表达升高,心房肌Cx43及Cx40表达减少且分布紊乱,AF诱发率明显升高,持续时间延长;而当抑制TNF-α炎症反应后,Cx43及Cx40分布非均匀情况改善,AF诱发率较脓毒症组明显降低。提示过表达的TNF-α可以诱导连接蛋白表达异常和分布重构从而发生AF。有研究通过模拟TNF-α在源自人诱导多能干细胞的心肌细胞中分子和功能效应发现TNF-α可以改变了离子通道的表达,并影响Cx43的定位[15]。在心房纤维化过程中,TNF-α通过改变Cx43的表达或分布,导致连接蛋白通道变化并出现房性心律失常[16-18]。本课题组前期研究也显示,TNF-α可以通过诱导心力衰竭大鼠Cx43磷酸化/去磷酸化状态的调控失衡从而诱发心律失常[19]。而脓毒症发生机制也可能与Cx43磷酸化通路异常有关[20],故本研究推测脓毒症过程中过表达的TNF-α可能通过对连接蛋白磷酸化/去磷酸化状态的调控导致连接蛋白表达和重构,从而介导AF的发生和维持。拟在下一步研究中探讨不同浓度的TNF-α作为上游介质通过调控磷酸化/去磷酸化信号通路介导体外细胞连接蛋白表达及分布,从而导致AF的作用机制。
综上所述,脓毒症大鼠过表达的TNF-α可以诱导心房肌Cx43及Cx40表达异常和分布紊乱,从而增加AF诱发率。初步确认TNF-α是在诱导脓毒症AF发生中的可能靶点之一,为脓毒症伴新发心律失常的防治提供理论基础。
参 考 文 献
[1] Fernando SM,Rochwerg B,Seely AJE. Clinical implications of the third international consensus definitions for sepsis and septic shock(Sepsis-3)[J]. J De L’association Med Can,2018,190(36):1058-1059.
[2] Mohamed MW,Riyad MK,Khamis AM,et al. New onset of atrial fi‐brillation\"as an outcome predictor in critically ill patients with sepsis:a systemic review[J]. QJM,2021,114(Suppl 1):S30.
[3] 周姝冶,谢美丽,王智昊. 炎症与心房颤动相关性研究进展[J].国际老年医学杂志,2022,43(6):742-746. Zhou SY,Xie ML,Wang ZH. Research progress on the relationship be‐tween inflammation and atrial fibrillation[J]. Int J Geriatr,2022,43(6):742-746.
[4] 王同霞,陈章荣,吴新华. 缝隙连接蛋白40、43与心房颤动的关系[J]. 国际心血管病杂志,2019,5(4):230-232. Wang TX,Chen ZR,Wu XH. Relationship between gap junction pro‐teins connexin 40,43 and atrial fibrillation[J]. Int J Cardiovasc Dis,2019,5(4):230-232.
[5] Lazzerini PE,Laghi-Pasini F,Acampa M,et al. Systemic inflam‐mation rapidly induces reversible atrial electrical remodeling:the role of interleukin-6-mediated changes in connexin expression[J]. J Am Heart Assoc,2019,8(16):e011006.
[6] 黄鑫,张敏州.盲肠结扎穿孔术—脓毒症模型研究的金标准[J].医学综述,2015,21(3):392-395. Huang X,Zhang MZ. Gold standard for the model research of cecal liga‐tion and puncture-Sepsis [J]. Med Recapitul,2015,21(3): 392-395.
[7] Wetterslev M,Haase N,Hassager C,et al. New-onset atrial fibrilla‐tion in adult critically ill patients:a scoping review[J]. Intensive Care Med,2019,45(7):928-938.
[8] 许润霞,史家欣,吴佳灿,等. 心外膜脂肪组织及炎症因子与房颤的相关性研究[J]. 重庆医科大学学报,2024,49(7):884-889. Xu RX,Shi JX,Wu JC,et al. Association of epicardial adipose tissue and inflammatory factors with atrial fibrillation[J]. Journal of Chongqing Medical University,2024,49(7):884-889.
[9] Hanna A,Frangogiannis NG. Inflammatory cytokines and chemo‐kines as therapeutic targets in heart failure[J]. Cardiovasc Drugs Ther,2020,34(6):849-863.
[10] Pan X,Zhang K,Shen C,et al. Astaxanthin promotes M2 macro‐phages and attenuates cardiac remodeling after myocardial infarction by suppression inflammation in rats[J]. Chin Med J,2020,133(15):1786-1797.
[11] 邓 龙,时向民,林 琨,等. 缝隙连接蛋白43在心房颤动发病及维持中的作用[J]. 中华老年心脑血管病杂志,2015,17(12):1329-1331. Deng L,Shi XM,Lin K,et al. The role of connexin 43 in the pathogen‐ esis and maintenance of atrial fibrillation[J]. Chin J Geriatr Heart Brain Vessel Dis,2015,17(12):1329-1331.
[12] Dai WR,Chao XY,Li SS,et al. Long noncoding RNA HOTAIR functions as a competitive endogenous RNA to regulate Connexin43 re‐modeling in atrial fibrillation by sponging microRNA-613[J]. Cardio‐vasc Ther,2020,2020:5925342.
[13] Parahuleva MS,Kocksk?mper J,Heger J,et al. Structural,proinflammatory and calcium handling remodeling underlies spontaneous onset of paroxysmal atrial fibrillation in JDP2-overexpressing mice[J]. Int J Mol Sci,2020,21(23):9095.
[14] Zhang H,Ruan HM,Rahmutula D,et al. Effect of acute and chronic ethanol on atrial fibrillation vulnerability in rats[J]. Heart Rhythm,2020,17(4):654-660.
[15] Saraf A,Rampoldi A,Chao M,et al. Functional and molecular ef‐fects of TNF-α on human iPSC-derived cardiomyocytes[J]. Stem Cell Res,2021,52:102218.
[16] Reale C,Zotti T,Scudiero I,et al. The NF-κB family of transcrip‐tion factors and its role in thyroid physiology[J]. Vitam Horm,2018,106:195-210.
[17] Yang Y,Lv J,Jiang S,et al. The emerging role of Toll-like recep‐tor 4 in myocardial inflammation[J]. Cell Death Dis,2016,7(5):e2234.
[18] Zhou P,Yang XL,Yang DZ,et al. Integrin-linked kinase activa‐tion prevents ventricular arrhythmias induced by ischemia/reperfusion via inhibition of connexin 43 remodeling[J]. J Cardiovasc Transl Res,2021,14(4):610-618.
[19] 夏嘉鼎,杨 华,刘学刚,等. 肿瘤坏死因子-α诱导连接蛋白43重构在心力衰竭大鼠室性心律失常发生中的作用[J]. 免疫学杂志,2017,33(10):861-866. Xia JD,Yang H,Liu XG,et al. Roles of tumor necrosis factor-α in regu‐lation of Connexin43 and ventricular arrhythmias in rats with heart fail‐ure[J]. Immunol J,2017,33(10):861-866.
[20] 赵希伟,刘 凯,侯林义,等. 连接蛋白43磷酸化及其信号通路在脓毒症发生机制中的作用研究进展[J]. 中华危重病急救医学,2022,34(6):655-660. Zhao XW,Liu K,Hou LY,et al. Research progress on the role of con‐nexin 43 phosphorylation and its signal pathway in the pathogenesis of sepsis[J]. Chin Crit Care Med,2022,34(6):655-660.
(责任编辑:曾 玲)
本文引用格式:
夏嘉鼎,张 坤,徐 敏,等. 肿瘤坏死因子-α诱导连接蛋白表达和分布在脓毒症大鼠心房颤动发生中的作用[J]. 重庆医科大学学报,2025,50(1):58-64.
