电休克对青少年重度抑郁症BDNF和氧化应激因子的影响
2025-02-24王余娜杜宁耿丹丹冉攀徐何雁郭家梅况利
【摘 要】目的:为探究电休克(electroconvulsive therapy,ECT)治疗对重度抑郁症(major depressive disorder,MDD)青少年患者的疗效,进行MDD青少年患者电休克治疗期间氧化应激水平、血清脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和抑郁程度的相关性分析。方法:选择2023年5月至2023年12月在重庆医科大学附属第一医院38例重度抑郁症青少年患者为回顾性分析试验组(MDD组),采用问卷招募20例健康儿童作对照组。电休克治疗前及治疗结束后,采集MDD组17项汉密尔顿抑郁量表(17-items Hamilton depression scale,HAMD-17)、心理弹性量表(connor-davidson resilience scale,CDRISC)等量表评分,并检测超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、BDNF水平。对照组仅采集血样和人口学数据。结果:MDD组治疗前的SOD和BDNF低于对照组(P<0.001),差异具有统计学意义。MDA高于对照组(P<0.001)。经过电休克治疗后,MDD组SOD较治疗前增高(P<0.001)、BDNF较治疗前增高(P<0.001),MDA较治疗前降低(P<0.001),SOD、MDA、BDNF治疗后与治疗前比较差异均有统计学意义。HAMD-17治疗后降低(P<0.001)、PDQ-D治疗后降低(P=0.004)、CFQ量表评分治疗后降低(P=0.001),评分差异有统计学意义;CD-RISC、AAQ-2量表评分治疗前后无统计学意义。相关性分析显示电休克治疗前后的SOD、MDA、BDNF分别和治疗前后HAMD-17评分存在弱相关性。多元逻辑回归分析显示电休克治疗前SOD水平能作为ECT治疗应答的独立影响因素,治疗前MDA、BDNF水平对HAMD-17治疗后评分差异无统计学意义。结论:ECT治疗后,患者血清中SOD和BDNF升高、MDA降低。MDA降低,SOD和BDNF的增加与抑郁改善程度具有弱相关性,推测ECT治疗可改善MDD青少年患者抑郁症状,具体机制与SOD、MDA、BDNF改变有关,但3种指标能否成为预测电休克改善抑郁症状的独立影响因素还需进一步研究。
【关键词】抑郁症;青少年;电休克;氧化应激;血清脑源性神经营养因子
【中图分类号】749.4【文献标志码】A【收稿日期】2024-12-11
基金项目:重庆英才计划名家名师(医学领域)资助项目(编号:CQYC2021020203105)。
Effect of electroconvulsive therapy on brain-derived neurotrophic factor and oxidative stress factors in adolescents with major depressive disorder
Wang Yuna,Du Ning,Geng Dandan,Ran Pan,Xu Heyan,Guo Jiamei,Kuang Li
(Center of Psychiatry,The First Affiliated Hospital of Chongqing Medical University)
【Abstract】Objective:To investigate the effect of electroconvulsive therapy (ECT) on adolescents with major depressive disorder(MDD),as well as the correlation of oxidative stress and brain-derived neurotrophic factor (BDNF) with the degree of depression in adolescents with MDD during ECT. Methods:A total of 38 adolescents with MDD from May to December 2023 were enrolled as retro‐spective analysis group(MDD group),and 20 healthy children were recruited as control group through a questionnaire survey. Before and after ECT,the scores of 17-item Hamilton Depression Rating Scale(HAMD-17) and Connor-Davidson Resilience Scale(CDRISC) were collected from the adolescents in the experimental group,and the serum levels of superoxide dismutase(SOD),malondial‐dehyde(MDA),and BDNF were measured. Only blood samples and demographic data were collected for the control group. Results:Compared with the control group,the MDD group had significantly lower levels of SOD and BDNF(P<0.001) and a significantly higher level of MDA(P<0.001) before treatment. After ECT,the MDD group had significant increases in SOD and BDNF(P<0.001) and a significant reduction in MDA(P<0.001). After treatment,there were significant reductions in the scores of HAMD-17(P<0.001),PDQ-D(P=0.004),and CFQ(P=0.001),while there were no sig‐nificant changes in the scores of CD-RISC and AAQ-2 after treat‐ment. The correlation analysis showed that SOD,MDA,and BDNF were weakly correlated with HAMD-17 score before and after ECT. The multivariate logistic regression analysis showed that SOD level before ECT was an independent influencing factor for treatment response to ECT,while the levels of MDA and BDNF before treatment had no statistical significance on HAMD-17 score after treatment. Conclusion:There are increases in the serum levels of SOD and BDNF and a reduction in the serum level of MDA after ECT. The reduction in MDA and the increases in SOD and BDNF have a weak correlation with the degree of improvement in depression,and it is speculated that ECT can improve depressive symptoms in adolescents with MDD,which is associated with the changes in SOD,MDA,and BDNF. However,further studies are needed to inves‐tigate whether these three indicators can be used as independent influencing factors to predict the improvement in depressive symptoms by ECT.
【Key words】depression;adolescent;electroconvulsive therapy;oxidative stress;brain-derived neurotrophic factor
重度抑郁症(major depressive disorder,MDD)是一种严重的心理健康问题,其主要症状包括抑郁、失去兴趣和认知障碍,全球受其影响的人数超过了3 亿[1-2]。该疾病不仅对患者造成了巨大的身体和心理损害,还因为该病的高发病率和复发率,给社会带来了沉重的经济压力。然而,在当前的临床实践中,一些常用的抗抑郁药物,例如三环类抗抑郁药和5-羟色胺再摄取抑制剂等,往往伴随着一系列的副作用,有时甚至无法达到预期的治疗效果[3]。因此,电休克的治疗方法因其明显的疗效和高度的安全性而受到广泛关注,已经成为治疗重度抑郁症的主要手段之一。
青少年MDD的产生和疾病进展受到多种因素的影响,其中氧化应激是一个高风险的影响因素,但是精神疾病和氧化剂增加之间的因果关系还没有被完全揭示。氧化应激的产生是由于人体内活性氧水平与抗氧化能力之间的细胞氧化还原失衡,导致细胞内活性氧的相对增加。氧自由基进一步破坏了构成细胞组织的多种物质,如脂质、糖类、蛋白质和DNA等,造成了变性、交联和断裂等氧化损伤。氧化应激通过直接或间接性损害细胞膜功能而引起一系列生理生化变化。丙二醛(malondialde‐hyde,MDA)是脂质过氧化的产物,它在很大程度上能够反映细胞自由基的损伤程度。超氧化物歧化酶(superoxide dismutase,SOD)是人体一种重要的抗氧化酶,它能够避免氧自由基对人体的器官和组织造成伤害[4-5]。血清脑源性神经营养因子(brainderived neurotrophic factor,BDNF)在神经元的成熟、突触的生成以及突触的可塑性等关键过程中起到了作用[6]。一些前沿的研究指出,无论是抗抑郁治疗还是电休克治疗,都能提高MDD患者的外周 BDNF水平[6]。
电惊厥疗法(electroconvulsive therapy,ECT)被视为治疗多种精神障碍的有效手段之一,包括但不限于重度抑郁症、双相情感障碍、精神分裂症以及分裂情感障碍[8]。在最近的几年中,电休克治疗方法已经被认为是治疗重度抑郁症的一种既有效又安全的手段。虽然ECT在临床上的治疗效果已经得到了广泛的认可和文献记录,但ECT如何具体减轻抑郁症状的具体作用机制尚未明确。存在证据显示,脑源性神经营养因子BDNF在MDD的病理生理学和/或治疗进展中起着关键作用,并且BDNF在ECT的临床治疗效果中起着至关重要的作用。然而,ECT对BDNF水平的具体影响还存在许多不同的观点和争议。例如,之前众多的临床研究均指出,抑郁症患者的血清和血浆BDNF水平明显下降,并且这一下降与疾病的严重性是负相关的[9-10]。然而,一些研究指出ECT对BDNF的水平并无明显影响[11]。基线血清中的BDNF水平在预测难以治疗的MDD患者的MECT反应上,并未展现出明显的临床应用价值[12]。综上,有必要进一步探究MECT对氧化应激标志物和BDNF的具体影响,以及这些影响因子在血清测定中对于接受电休克治疗患者疗效预测的价值。
本研究旨在探究电休克治疗对重度抑郁青少年患者症状的改善情况和对患者外周SOD、MDA以及BDNF水平的影响,为临床治疗重度抑郁的机制提出进一步见解。
1 资料与方法
1.1 研究对象
本项研究选择了2023年5月至2023年12月,在重庆医科大学附属第一医院被确诊为MDD的青少年患者的临床资料作为回顾性分析的对象,目的是收集这些青少年患者的基本信息,包括但不限于年龄、性别、吸烟和饮酒的历史等。被纳入的标准是:①患者满足DSM-5关于“重度抑郁障碍”的诊断准则;②在儿童抑郁症量表(修正版)(CDRS-S)中得分达到或超过40分,或者在17项汉密尔顿抑郁症量表(HAMD-17)中得分达到或超过17分;③年龄范围在12至17岁之间,性别没有限制,属于中国汉族。健康对照组(HC组)由20例健康的青少年组成,他们都是通过问卷方式进行招募的。当前及过往,对照组未患有包含抑郁症在内的任何形式的精神疾病,并且对照组在年龄、性别及教育背景上与MDD(重性抑郁障碍)组实现了匹配。对于患者及健康对照组的排除条件设置如下:①存在可影响情绪状态的器质性疾病;②患有严重实质性脏器(如心脏)、内分泌系统(如甲状腺功能紊乱)、血液系统或自身免疫性疾病;③正在感染或近期有感染、传染性疾病史;④具有其他重大精神障碍的既往史;⑤酒精或其他精神活性物质的滥用行为;⑥未给予知情同意的个体。本院医学伦理委员会已经批准本研究的研究方案(批准号:IACUC-CQMU-2023-0274)。根据既定的纳入与排除标准,最终招募了38例受试者,包括7例男性和31例女性;同期,还纳入了20例年龄相匹配的健康对照组个体,其中含8例男性和12例女性。
1.2 试验方法
针对所有罹患MDD的青少年,实施了优化后的双侧额颞叶ETC。每位重度抑郁患者共计接受了6~8轮电惊厥治疗。本院采用低强度模式0.25,依据患者年龄设定ETC初始能量,具体算法为:能量百分比=年龄(岁)×50%。治疗时,根据惊厥发作的持续时长调整刺激能量,并参考发作形态的适宜性来决定后续治疗剂量。麻醉方案包括使用琥珀酰胆碱(0.5~1.0 mg/kg)与地普麻(1.5~2.0 mg/kg)。若惊厥发作的形态及持续时间显示出发作质量不佳或不足,精神科医师将在后续的ETC疗程中增强治疗强度,具体调整幅度由医师决定。若发作质量评估为满意,则维持前次治疗强度。ECT疗程的频率与总次数由主治精神科医师根据患者对ECT的应答情况及继续治疗的利弊考量来确定。此外,还制定了个性化的维持性ETC方案以减少复发可能性。ECT期间的辅助药物治疗由主治精神科医师负责开具
在电休克前1 d早上和电休克治疗6~8次后次日清晨分别采集MDD组青少年患者的血液样,2次血液采集的同时对患者进行HAMD-17等量表评估。健康对照组在清晨空腹状态下采集血液样本。用试管抽取青少年患者5 mL血液,血液静置,使其室温下自然凝固20 min,然后用离心机以每分钟3 000转的转速来分离血清,分离的血清在?80 ℃冰箱中保存,分析细胞因子时才取出。检测方法采用酶联免疫吸附试验检测血清中的SOD、MDA、BDNF。
1.3 量表指标
1.3.1 HAMD-17 HAMD 17(汉密尔顿抑郁量表-17项)用以评估MDD青少年患者的抑郁症状严重程度,共有17个条目,量表总评分越高表示患者抑郁症状程度越严重。该量表在临床上常作为判定抑郁症严重程度的金标准。通常HAMD-17降低50%或以上的患者被认为是有应答者,否则为无应答者。
1.3.2 CD-RISC CD-RISC(心理弹性量表)评估心理状态:包括5个方面,能力、坚韧性、接受变化、控制、精神影响,量表总评分为100分,总分值越高代表患者心理弹性越好。
1.3.3 PDQ-D 主观认知缺陷评估采用PDQ-D(认知缺陷问卷-抑郁),主要结局指标为患者的认知功能,包括20个项目,范围从0(从未在过去7 d)到4(经常,每天超过1次)。PDQ-D-20评估了4个认知功能领域,包括回顾记忆、注意/集中、前瞻记忆和计划/组织。得分越高,表明认知症状的程度越高。
1.3.4 CFQ CFQ(认知融合量表)主要用于心理灵活性的测量,强调个体在面对外部环境变化时的适应能力。其中1分代表“明显不符”,7分代表“高度符合”。受试者在这9个条目上的得分总和即为最终得分,分数越高表示患者的认知融合程度越高,心理灵活性水平则越低。
1.3.5 AAQ-2 AAQ-2(接纳和行动问卷),主要用于心理灵活性的测量。该量表由7个项目组成,每个项目都要求个人在7分的李克特量表上对他们对陈述的同意程度进行评分,范围从“从不正确”到“总是正确”。它评估的是1个人的心理灵活性,指的是即使面对不愉快的想法、感觉或经历,也能活在当下,从事与个人价值观一致的活动的能力。
1.4 统计学方法
本研究采用夏皮罗-威尔克检验进行了正态性检验,通过t检验评估正态分布的计量资料2组间差异的显著性,结果以算术平均数±标准差(x±s)表示。非正态分布的计量资料采用非参数检验评估2组间差异显著性,结果以中位数即[Md(P25,P75)]表示,计数资料的表达以频数和百分比展现。采用卡方检验或Fisher检验来评估统计学差异。在检验数据是否服从正态分布后,通过斯皮尔曼相关检验或皮尔逊相关检验来研究数据的相关性。采用多元逻辑回归分析电休克治疗前后抑郁疗效的预测因素。检验水准α=0.05。
2 结果
2.1 人口学及其特征
MDD组与HC组在年龄、BMI、男女性别、吸烟史、饮酒史、家族精神病史和居住地方面差异均无统计学意义,如表1所示。本研究共收集MDD试验组患者38例,其中女性31例电休克占81.60%,试验组年龄15(14,16)岁,BMI20.68(18.76,23.81),吸烟者占7.90%,饮酒者占5.30%,有家族精神病史者占15.80%,城镇居住者占60.50%;对照组20例,其中女性占60.00%,对照组年龄15(14,17)岁,吸烟者占5.00%,饮酒者占25.00%,有家族精神病史者占10.00%,城镇居住者占75.00%。
2.2 MDD青少年治疗前氧化应激因子及BDNF与对照组差异
MDD组治疗前与HC组在SOD、MDA、BDNF水平的差异均有统计学意义。如表2所示,治疗前MDD组的MDA水平高于HC组(P<0.001),而SOD水平低于HC组(P<0.001),BDNF水平也低于HC组(P<0.001)。
2.3 MDD青少年治疗前后氧化应激因子水平及抑郁程度的变化
如图1表示,电休克治疗6~8轮次后,MDD组血清中SOD、BDNF水平均较治疗前升高(P<0.001),而MDA水平较治疗前降低(P<0.001)。如表3所示,MDD组经6~8次电休克治疗后,HAMD-17、认知功能缺陷自评(PDQ-D)、认知融合量表、得分均降低(P均<0.05)。接纳与行动量表(AAQ-2)、CD-RISC量表治疗后较治疗前评分均增高,但其评分增高差异无统计学意义(P>0.05)。
2.4 氧化应激因子水平与治疗前后HAMD-17评分的相关性
如图2A所示,试验组血清SOD含量与HAMD-17量表得分呈负相关(r=-0.400,P<0.001);如图2B所示,试验组HAMD-17量表评分与血清中MDA含量呈中等强度正相关(r=0.545,P<0.001);如图2C所示,试验组血清BDNF含量与HAMD-17量表得分呈负相关(r=-0.348,P=0.003)
2.5 氧化应激因子水平与ECT治疗疗效的逻辑回归分析
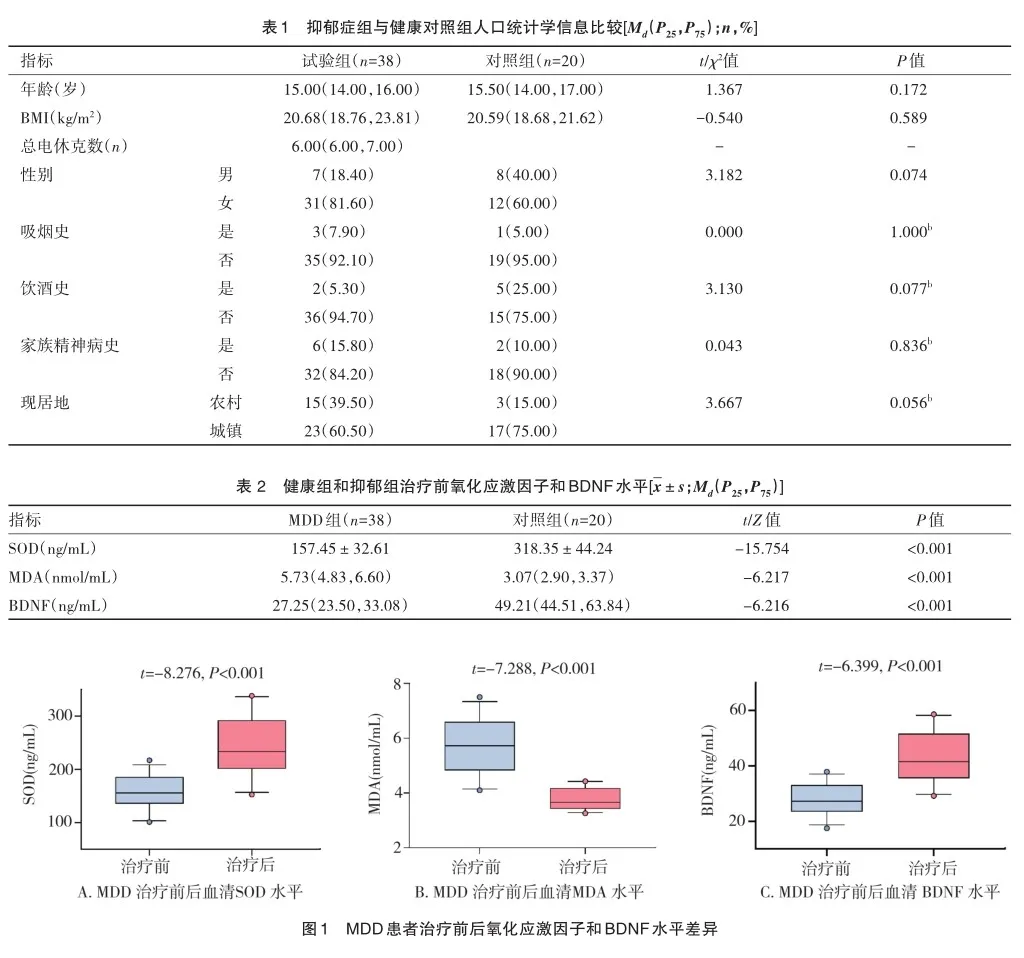
如图3所示,在逻辑回归分析模型中,SOD可作为HAMD-17评分的可预测因素,而MDA、BDNF水平以及年龄、BMI、总电休克次数对HAMD-17评分预测差异无统计学意义。电休克治疗前血清SOD的水平对HAMD-17评分应答具有负向的影响作用,血清SOD越低相对于较高者,HAMD-17应答的可能性前者是后者0.943倍,换言之,电休克治疗前血清SOD越高者HAMD-17应答的可能性越大。OR<1的因素为HAMD-17评分有应答的保护因素,OR>1则为危险因素,通过图3可见,SOD可作为评分有应答的保护因素。
3 讨论
本研究主要通过对比重度抑郁症青少年患者电休克治疗期间引起的血清炎症因子及脑源性神经营养因子水平的变化,来验证其在电休克治疗重度抑郁青少年患者疗效中的作用。
本研究主要通过抽取MDD青少年患者和健康对照组的静脉血,检测血清中氧化应激标志物SOD、MDA和脑源性营养因子。如表1所示,课题组发现MDD青少年女性患者远多于男性,这与最新的研究内容一致,即与男性相比,女性在各个年龄段表现出更高的抑郁率和更严重的抑郁症状。在图1中,本研究发现,经过电休克6~8次治疗后,重度抑郁青少年患者MDA水平较电休克治疗前下降(P< 0.001),SOD、BDNF水平较电休克治疗前增加,并且差异均有统计学意义(P<0.001)。电休克治疗后与治疗前的各量表评分经检验发现,HAMD-17、PDQD、CFQ得分均降低,且差异均有统计学意义(P值均<0.05)。HAMD-17量表评分的降低意味着电休克抗抑郁治疗有效;PDQ-D评分降低可能与之前的研究者结论中,电休克能造成部分患者记忆功能受到损害[14]有关;CFQ降低可能和前期研究中电休克治疗造成部分患者认知功能不良反应[15]的实验结论有关。为了探究抑郁症与氧化应激的关系,既往有研究者在动物实验中发现,与对照组相比,慢性不可预测应激造模成功的小鼠,其前额叶、海马、纹状体的过氧化反应增加;小鼠海马、前额叶等SOD活性则降低。故研究者推测慢性不可预测应激可以诱导氧化损伤增加和SOD活性的降低,这些变化可能在促成应激相关疾病上起重要作用,例如抑郁症[24],本研究结果与该推测结论相符。MDA是脂质过氧化作用的最终产物,有研究通过对抑郁症患者血浆脂质过氧化进行测定,发现与健康对照相比,抑郁症患者的MDA明显上调[16],本研究与该结论一致。关于电休克与氧化应激因子的关系,在动物实验中,有发现与本研究结论一致,如发现单次电休克后大脑氧化反应呈现区域性差异,仅额叶皮层受到氧化损伤,海马、小脑等部分区域则未见脂质过氧化现象[17],在另一项研究中,MDA与之前的值相比,单次和重复ECT后脑样本中氧化脂质损伤指标下降,谷胱甘肽过氧化物酶(GPx)和SOD活性增加。与之相对的发现,如Feier G等[18]在动物实验中表明,单次或八次电休克后,脂质过氧化产物MDA和蛋白质羰基水平升高,表现为蛋白质损伤,SOD和CAT活性在老鼠大脑各区域降低。换句话说,电休克后氧化应激增加,抗氧化酶活性降低[19]。
关于BDNF的研究,如BDNF能否穿过血脑屏障也具有一定争议性。分子和临床前研究已经报道,BDNF在巨核细胞中产生并储存,随后在血小板中产生并储存,不通过脑血屏障[20]。然而,另一项研究指出,BDNF可以慢慢穿过血脑屏障[21],并且外周BDNF和脑脊液BDNF高度一致[22]故有人提出,BDNF的外周水平可能一定程度上能反映中枢神经营养蛋白的活性,该结论给本研究的检验方法(外周血检测)提供一定理论支持。有研究通过低氧应激使小鼠产生抑郁样行为,低氧状态下,小鼠脑的氧化应激增加,脑组织抗氧化能力降低。该研究结果表明,反复低氧应激导致了BDNF免疫阳性细胞在小鼠大脑杏仁核表达的减少,通过治疗使小鼠抑郁和焦虑样行为减少的同时,缺氧应激引起的小鼠脑杏仁核区BDNF免疫阳性细胞表达的降低也得到缓解[23]。结合本实验重度抑郁青少年患者治疗后BDNF水平较治疗前升高,我们合理推测,BDNF的降低在抑郁症的发病机制中起到重要作用。此外,耐药性抑郁症患者在接受ECT后血清BDNF水平显著升高[24],也与本研究结果一致。
本课题组还发现,SOD、BDNF的水平在治疗期间与MDD青少年患者电休克治疗前的HAMD-17评分呈负相关,MDA水平与MDD青少年患者治疗前的HAMD-17评分呈正相关,在ECT 6~8次后SOD、BDNF升高,MDA降低,这表明这3种检测因子水平与MDD青少年患者的抑郁严重程度具有一定关联。换言之,即青少年患者抑郁情况好转,可能与血清中SOD、BDNF水平升高,以及MDA水平下降有关。有研究者在双相情感障碍(躁狂和抑郁发作)中的发现呈现出相反的意见,比如先前的一项研究表明,抗抑郁药和ECT治疗对SOD水平的改变没有明显影响[25]。最近的研究则显示,SOD的降低可能更偏向于是双相情感障碍的一种特性而不是一种状态,并且氧化应激水平与疾病严重程度和ECT治疗疗效有关。同样矛盾的结果也出现在精神分裂症的研究上,ECT对重度抑郁症和双相情感障碍患者血清MDA、NO水平以及黄嘌呤氧化酶和SOD活性的影响,发现ECT后SOD活性降低[25]。
当根据表1进一步进行逻辑回归分析时,本课题组发现,仅SOD可预测HAMD-17评分的变化(P<0.05),而MDA、BDNF水平以及年龄、BMI、总电休克数对HAMD-17评分预测差异无统计学意义。故SOD能作为预测疗效的因子,BDNF和MDA与电休克治疗疗效的相互影响还需进一步研究。
本研究局限性在于,测量重度抑郁青少年患者外周血氧化应激参数水平,应当进一步对患者脑部进行研究,检测MDD青少年患者脑部氧化应激状态,与外周氧化应激状态进行对比。最后,采用酶联免疫吸附法检测氧化应激参数,而不是液相色谱-质谱法,这使得检测结果的特异性和检测灵敏度有降低。后期对电休克治疗重度抑郁青少年在氧化应激方面的疗效和机制进行进一步探究时,可通过扩大样本量和提高检测精度等变量使结果真实性和准确性进一步提高。
参考文献
[1] Otte C,Gold SM,Penninx BW,et al. Major depressive disorder[J]. Nat Rev Dis Primers,2016,2:16065.
[2] Kessler RC,Bromet EJ. The epidemiology of depression across cul‐tures[J]. Annu Rev Public Health,2013,34:119-138.
[3] Li KW,Yan L,Zhang YP,et al. Seahorse treatment improves depression-like behavior in mice exposed to CUMS through reducing in‐flammation/oxidants and restoring neurotransmitter and neurotrophin function[J]. J Ethnopharmacol,2020,250:112487.
[4] Bahnson ES,Koo N,Cantu-Medellin N,et al. Nitric oxide inhibits neointimal hyperplasia following vascular injury via differential,cellspecific modulation of SOD-1 in the arterial wall[J]. Nitric Oxide,2015,44:8-17.
[5] Li LL,Tan J,Miao YY,et al. ROS and autophagy:interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol,2015,35(5):615-621.
[6] Bj?rkholm C,Monteggia LM. BDNF - a key transducer of antide‐pressant effects[J]. Neuropharmacology,2016,102:72-79.
[7] Sengul MC,Kenar AN,Hanci E,et al. Practice of acute and main‐tenance electroconvulsive therapy in the psychiatric clinic of a univer‐sity hospital from Turkey:between 2007 and 2013[J]. Clin Psychophar‐macol Neurosci,2016,14(1):57-63.
[8] Karege F,Perret G,Bondolfi G,et al. Decreased serum brainderived neurotrophic factor levels in major depressed patients[J]. Psy‐chiatry Res,2002,109(2):143-148.
[9] Kim YK,Lee HP,Won SD,et al. Low plasma BDNF is associated with suicidal behavior in major depression[J]. Prog Neuropsychopharma‐col Biol Psychiatry,2007,31(1):78-85.
[10] Polyakova M,Schroeter ML,Elzinga BM,et al. Brain-derived neurotrophic factor and antidepressive effect of electroconvulsive therapy:systematic review and meta-analyses of the preclinical and clinical literature[J]. PLoS One,2015,10(11):e0141564.
[11] Maffioletti E,Gennarelli M,Gainelli G,et al. BDNF genotype and baseline serum levels in relation to electroconvulsive therapy effective‐ness in treatment-resistant depressed patients[J]. J ECT,2019,35(3):189-194.
[12] Sun Y,Zhong YW,Sun WZ,et al. More prevalent and more se‐vere:gender differences of depressive symptoms in Chinese adolescents[J]. Front Public Health,2023,11:1167234.
[13] Wartberg L,Kriston L,Thomasius R. Depressive symptoms in adolescents[J]. Dtsch Arztebl Int,2018,115(33/34):549-555.
[14] Nuninga JO,Claessens TFI,Somers M,et al. Immediate and longterm effects of bilateral electroconvulsive therapy on cognitive function‐ing in patients with a depressive disorder[J]. J Affect Disord,2018,238: 659-665.
[15] Zupan G,Pilipovi? K,Hrelja A,et al. Oxidative stress parameters in different rat brain structures after electroconvulsive shock-induced seizures[J]. Prog Neuropsychopharmacol Biol Psychiatry,2008,32(3):771-777.
[16] Camkurt MA,F?nd?kl? E,?zci F,et al. Evaluation of malondialde‐hyde,superoxide dismutase and catalase activity and their diagnostic value in drug na?ve,first episode,non-smoker major depression patients and healthy controls[J]. Psychiatry Res,2016,238:81-85.
[17] Barichello T,Bonatto F,Feier G,et al. No evidence for oxidative damage in the hippocampus after acute and chronic electroshock in rats[J]. Brain Res,2004,1014(1/2):177-183.
[18] Feier G,Jornada LK,Barichello T,et al. Long lasting effects of electroconvulsive seizures on brain oxidative parameters[J]. Neurochem Res,2006,31(5):665-670.
[19] Pardridge WM,Kang YS,Buciak JL. Transport of human recombi‐nant brain-derived neurotrophic factor (BDNF) through the rat bloodbrain barrier in vivo using vector-mediated peptide drug delivery[J]. Pharm Res,1994,11(5):738-746.
[20] Pan W,Banks WA,Fasold MB,et al. Transport of brain-derived neurotrophic factor across the blood-brain barrier[J]. Neuropharmacol‐ogy,1998,37(12):1553-1561.
[21] Pillai A,Kale A,Joshi S,et al. Decreased BDNF levels in CSF of drug-naive first-episode psychotic subjects:correlation with plasma BDNF and psychopathology[J]. Int J Neuropsychopharmacol,2010,13(4):535-539.
[22] Bocchio-Chiavetto L,Zanardini R,Bortolomasi M,et al. Electro‐convulsive Therapy (ECT) increases serum Brain Derived Neurotrophic Factor (BDNF) in drug resistant depressed patients[J]. Eur Neuropsy‐chopharmacol,2006,16(8):620-624.
[23] Olugbemide AS,Ben-Azu B,Bakre AG,et al. Naringenin im‐proves depressive- and anxiety-like behaviors in mice exposed to re‐peated hypoxic stress through modulation of oxido-inflammatory media‐tors and NF-kB/BDNF expressions[J]. Brain Res Bull,2021,169:214-227.
[24] Selek S,Savas HA,Gergerlioglu HS,et al. The course of nitric ox‐ide and superoxide dismutase during treatment of bipolar depressive epi‐sode[J]. J Affect Disord,2008,107(1/2/3):89-94.
[25] Lv QY,Hu QY,Zhang WZ,et al. Disturbance of oxidative stress parameters in treatment-resistant bipolar disorder and their association with electroconvulsive therapy response[J]. Int J Neuropsychopharma‐col,2020,23(4):207-216.
(责任编辑:周一青)
本文引用格式:
王余娜,杜 宁,耿丹丹,等. 电休克对青少年重度抑郁症BDNF和氧化应激因子的影响[J]. 重庆医科大学学报,2025,50(1):123-129.
