镁铝层状双(氢)氧化物对亚铁氰离子的吸附性能研究
2025-02-19王晓歌吴冰李斌川刘亚芳陈建设孟伟粉韩庆



摘要:研究采用镁铝层状双(氢)氧化物(MgAl-LDH)及其焙烧产物(MgAl-LDO)去除水溶液中的亚铁氰离子([Fe(CN)₆]4)。采用共沉淀法制备了不同CO₃-、Cl-插层浓度的MgAl-LDH,并通过焙烧法制备了不同的MgAl-LDO。探究了LDH及LDO对[Fe(CN)₆]⁴的吸附性能。结果表明:LDH具有较快的吸附速率,可在20 min内实现吸附平衡;LDO具有较高的吸附容量,最高为234.4 mg/g;在pH值为7~12时,吸附剂对[Fe(CN)₆]⁴-均有较好的吸附效果;在含有高浓度SO²及SCN-溶液中,吸附剂能实现[Fe(CN)₆]4-的选择性吸附。对反应机理的分析表明:在LDH的插层阴离子中,只有Cl-能与[Fe(CN)₆]⁴发生离子交换产生吸附效果,并生成Al[FeMg(CN)₆];LDO对[Fe(CN)₆]4的吸附作用源于其“记忆效应”,LDH层间CO³-占比越高,相应LDO的吸附容量越大。
关键词:镁铝层状双(氢)氧化物;插层阴离子;亚铁氰离子;选择性;吸附机理;废水处理中图分类号:TD926.4文章编号:1001-1277(2025)01-0100-08
文献标志码:A doi:10.11792/hj20250116
引言
在氰化提金过程中,由于金矿石中存在大量黄铁矿、磁黄铁矿、砷黄铁矿等伴生矿,氰化废水中通常含有大量铁氰离子1。氰化物具有极强的毒性,含氰废水一旦进入自然水体,便会对动物及水生生物产生负面影响。因此,国标对含氰废水的排放有严格规定。GB 8978—1996 《污水综合排放标准》规定,企业排放废水中总氰化合物质量浓度分别为0.5 mg/L(一级标准、二级标准)和1.0 mg/L(三级标准)。
处理低浓度含氰废水时,深度氧化法和吸附法是常用的方法。许多学者将紫外光与臭氧[21、过氧化氢[3)、过硫酸盐(4)等氧化剂联用,并辅以TiO2(5)、沸石[2)等光催化剂降解铁氰络合物,可将总氰化合物质量浓度降至0.2 mg/L以下。但是,由于紫外灯的发光效率低、能耗高、寿命及光程短等缺陷,使得其难以应用于工业生产中。也有许多学者研究了活性炭、A120,6、黏土矿物[7、活化的赤泥[8、高炉污泥[9、针铁矿[10等吸附剂对铁氰离子的去除性能,但吸附容量均较低。近些年,有学者不断提出新型吸附剂用于铁氰离子的吸附去除。其中,CHEN等[11制备了一种新型季铵盐功能化Zr\"金属有机树脂,成功去除了溶液中的亚铁氰离子([Fe(CN),])。 ZHANG等2制备了一种季铵盐功能化金属有机骨架(MOFs)材料去除[Fe(CN)。],其去除率大于98%。这些新型吸附剂具有较高的吸附容量和较快的吸附速率,但往往制备流程复杂,仍处于实验室研究阶段。
层状双金属氢氧化物(LDHs)具有独特层状结构,组成板层的阳离子可以被其他半径相似的金属离子所取代,层间的阴离子也可以与其他阴离子交换3。因此,LDHs具有灵活可调的空间结构和阴离子交换能力。LDOs是LDHs的焙烧产物,其具有“记忆效应”,在水溶液中可以吸附阴离子而恢复成原有的层状结构415。相比于LDHs,LDOs具有金属溶解少、pH适应范围广、吸附能力强的优点。近些年,随着水处理技术的发展,传统吸附材料成本高、选择性低、再生复杂、循环利用性能低等缺点逐渐凸显出来,而LDHs和LDOs由于其可持续性、低成本,在重金属阴离子的吸附方面具有极大优势6
本文采用共沉淀法制备了不同CI及CO插层浓度的MgAl—LDH,并以亚铁氰化钾为污染物,探究了吸附剂对溶液中[Fe(CN)。]的吸附性能,以及其焙烧产物MgAl—LDO对[Fe(CN)。]的吸附性能;确定了在高浓度SO及SCNˉ溶液中,吸附剂对[Fe(CN)。]的选择性吸附。最后,探明了吸附剂的吸附机理。
1试验部分
1.1试验原料
氯化镁(MgCl₂·6H₂O)、氯化铝(AlCl₃·6H₂O)、碳酸钠(Na₂CO₃)、氢氧化钠(NaOH)、亚铁氰化(K₄[Fe(CN)₆]·3H₂O)、硫酸钠(Na₂SO₄)、硫氰酸钠(NaSCN)等分析纯试剂均采购自国药集团。试验用水均为去离子水。
1.2吸附剂制备
MgAl-LDH制备:称取30.4 g MgCl₂·6H₂O和12.1g AlCl₃·6H₂O溶于200mL去离子水中,为溶液A;称取18.0g NaOH溶于200 mL去离子水中,为溶液B。将溶液A逐滴加入溶液B中,搅拌30 min,在90℃静置8h后离心进行固液分离,并将所得固体用去离子水洗涤至洗涤液呈中性。此后,所得固体在干燥箱中于90℃烘干,研磨,备用。
MgAl-CO3--LDH制备:称取18.0g NaOH与2.6g Na₂CO₃溶于200mL去离子水中,为溶液C。制备过程与MgAl-LDH制备相同,仅将溶液B替换为溶液C。
MgAl-LDO及MgAl-CO³--LDO制备:分别将MgAl-LDH及MgAl-CO³--LDH样品在马弗炉中于400℃焙烧3h。
1.3吸附试验
除特殊说明外,以亚铁氰化钾为原料配制总氰根离子质量浓度为100 mg/L的溶液进行吸附试验,现配现用。吸附试验在恒温水浴振荡器中进行,吸附剂添加量为0.5g/L,反应温度为25℃,以0.1 mol/L稀盐酸溶液和0.1 mol/L氢氧化钠溶液调节溶液pH,pH计监测反应过程中的pH变化。
1.4分析方法
溶液中总氰根离子的测定采用硝酸银滴定法。吸附试验后,溶液采用0.45μm滤膜过滤后取样10mL进行蒸馏操作。接收液以试银灵为指示剂、硝酸银溶液为滴定剂检测溶液中亚铁氰离子。采用D8 Advance X射线衍射仪(Bruker,XRD)分析吸附前后物料的物相;采用Nicolet iS10红外光谱仪(Thermo Fisher)分析吸附前后物料的官能团;采用Escalab 250Xi光电子能谱仪(Thermo Fisher,XPS)分析物料表面元素价态分布。
2结果与讨论
2.1吸附剂的表征
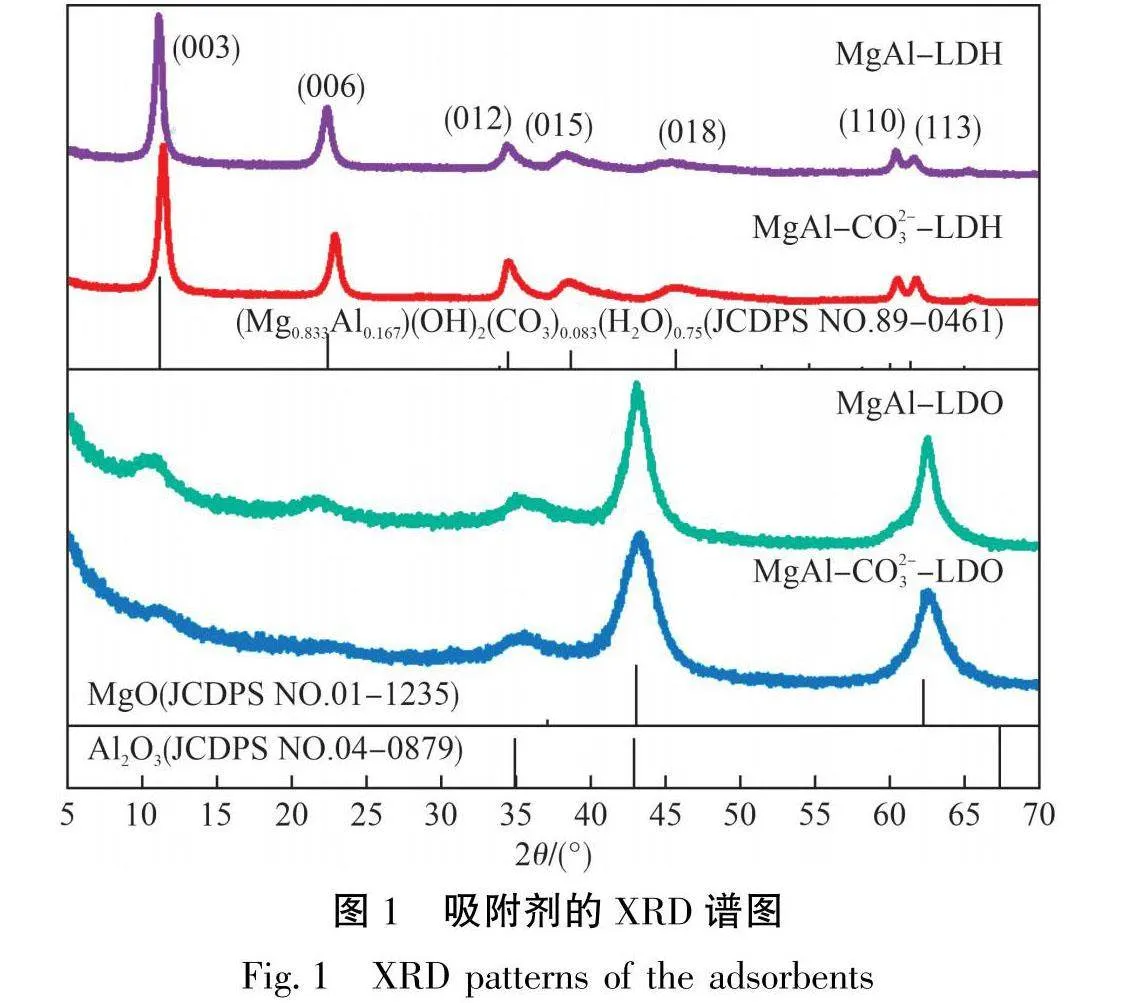
吸附剂的XRD谱图见图1。从图1可以看出:无论在制备时是否添加碳酸钠,反应所制备样品的XRD谱图均与(Mg₀833Alo.67)(OH)₂(CO₃)₀.083(H₂O)a₇5相符合。但是,经过对样体d(003)的计算,可知MgAl-LDH的层间距为0.795 nm,MgAl-CO3--LDH的层间距为0.779 nm,二者均比碳酸盐型LDH的层间距大,表明二者层间均含有Cl-作为插层阴离子,且MgAl-LDH层间的Cl-含量更高[17]。这是因为CO³的插层能力强于Cl-,当初始碱溶液中不含有CO³-时,溶液会吸收空气中的CO₂形成碳酸盐插层的LDH,然而吸收的CO₂浓度有限,层中还有部分Cl-作为插层阴离子。当初始溶液中含有CO3-时,层中插层的Cl-浓度随之减少,层间距也变小。2种LDH经400℃焙烧3h后,主要物相均为MgO和Al₂O₃。此外,焙烧后的样品中还含有原本LDH的特征峰(003)、(006)和(012),且MgAl-LDO更为明显,这是由于插层中的Cl-在焙烧后仍然存在于样品中,保留了部分LDH的结构。
2.2吸附性能
2.2.1吸附容量
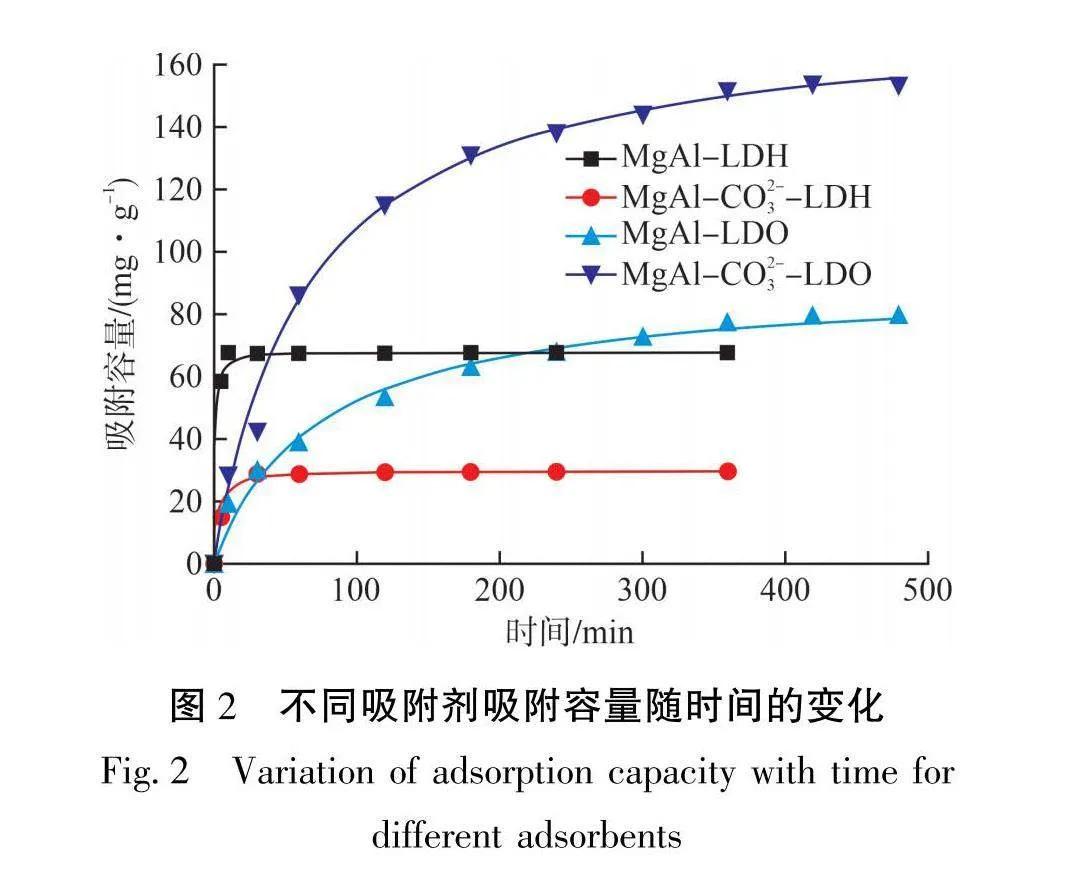
不同条件下制备的吸附剂对亚铁氰离子的吸附效果见图2。从图2可以看出:未焙烧过的LDH对亚铁氰离子的吸附速度较快,可在20 min内达到吸附平衡;而焙烧过的LDO具有较高的吸附容量,但其吸附速率较慢。这与许多文献中的描述类似,LDH作为吸附剂的一大优势就是吸附速度快[18]。而LDO由于焙烧破坏了水滑石原有的层状结构,其因“记忆效应”再吸附污染物并逐渐恢复层状结构的速度相对缓慢[19]。此外,对于2种LDH,制备时溶液中不加入碳酸钠的MgAl-LDH吸附容量较大,为67.4 mg/g;而加入碳酸钠的MgAl-CO₃-LDH吸附容量较小,为28.8 mg/g。焙烧后所得吸附剂的情形相反,MgAl-CO3--LDO的吸附容量最高为154.8 mg/g。这是由于MgAl-CO3--LDH中插层的CO³-比例较高,而CO³-在层间比较稳定,不易于亚铁氰离子交换,因此吸附效果较弱;而正是由于CO3-比例较高,才使得焙烧过的LDO能够吸附大量的亚铁氰离子以恢复原本的层状结构,获得较高的吸附容量。
2.2.2吸附动力学
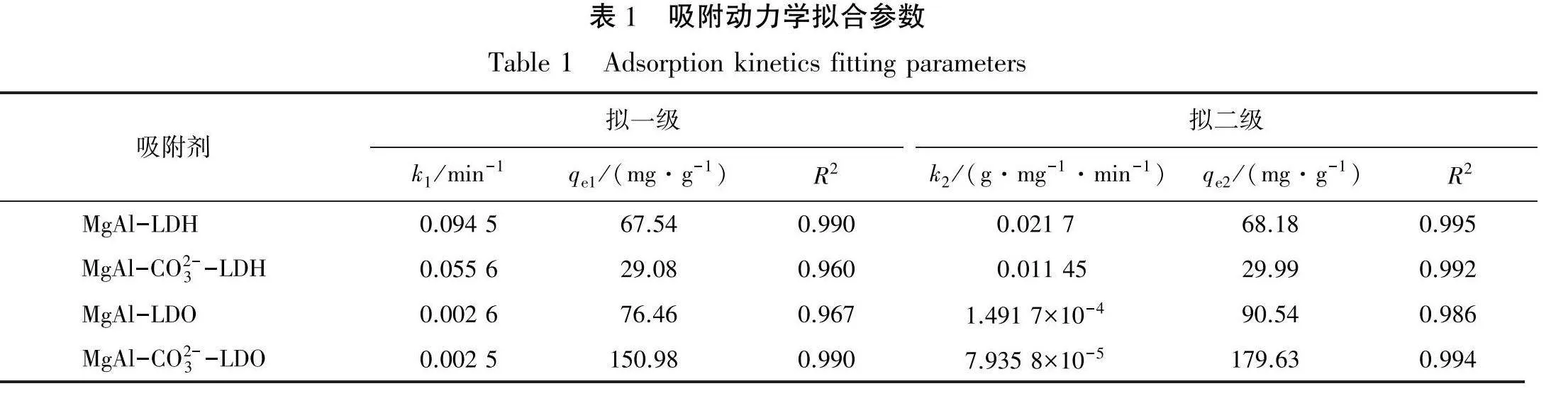
对吸附过程中的数据按式(1)和式(2)分别进行了拟一级和拟二级模型拟合,拟合参数见表1。从表1可以看出:2种模型都能较好地拟合试验数据,但拟二级模型(见图2)更加吻合,这表明化学吸附过程决定了亚铁氰离子的吸附速率[20]。
式中:q,为反应过程中的总氰根离子吸附量(mg/g);qe和q₂为2种模型理论吸附量(mg/g);k₁和k₂分别为2种模型的速率常数(min-¹)和(g/mg/min);t为反应时间(min)。
2.2.3吸附等温线
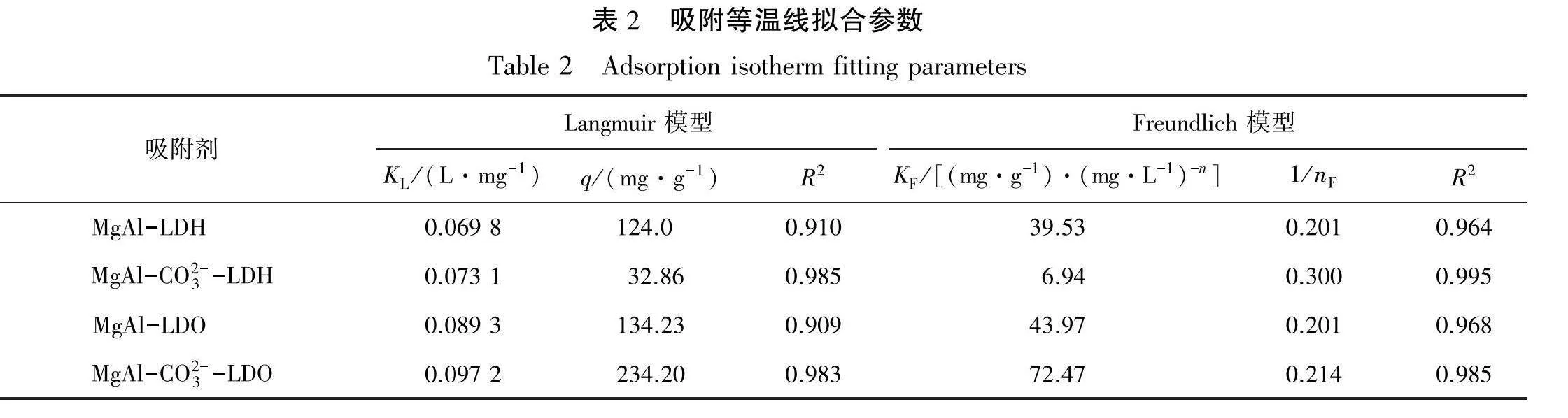
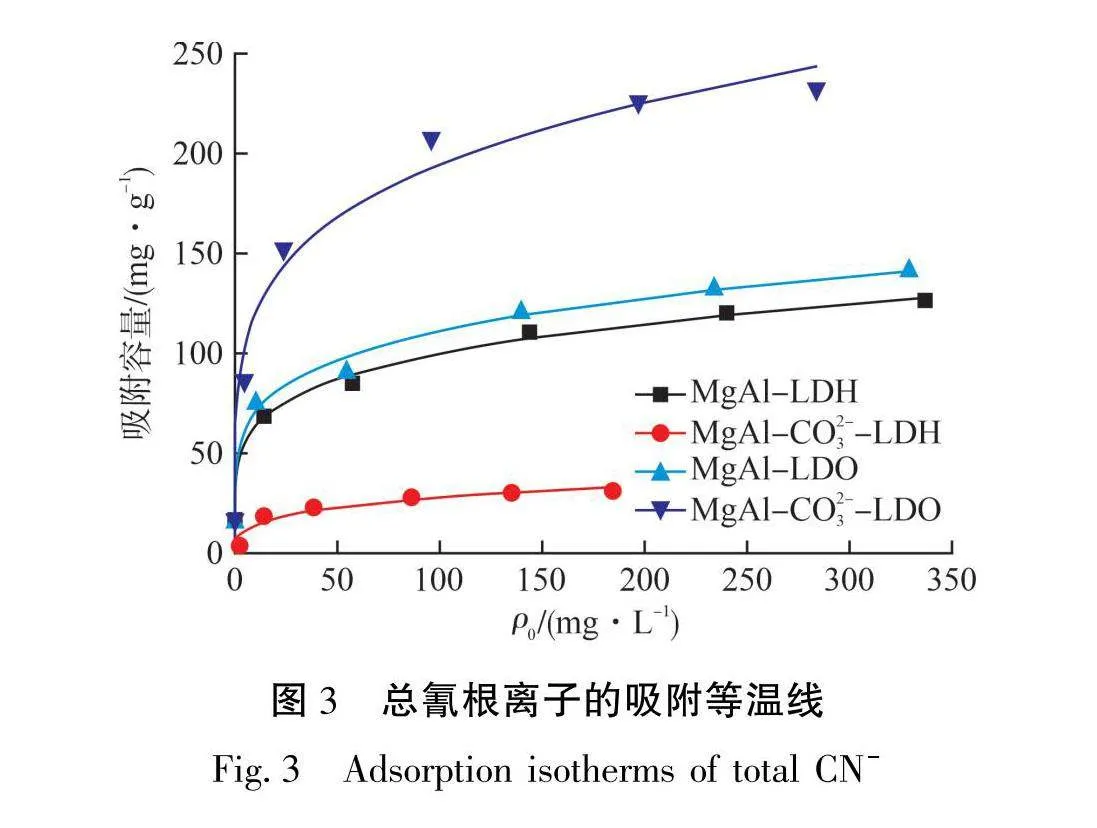
吸附剂对溶液中总氰根离子的吸附等温线见图3,分别对数据进行了Langmuir模型(见式(3))和Freundlich模型(见式(4))拟合,拟合参数见表2。从拟合结果来看,相比于Langmuir模型,Freundlich模型(见图3)拟合更好,且1/np均小于1,表明吸附很容易发生[21]。此外,Freundlich模型预测MgAl-LDH、MgAl-CO3--LDH、MgAl-LDO、MgAl-CO³--LDO4种吸附剂的最大吸附容量分别为124.0 mg/g、32.86 mg/g、134.23 mg/g及234.4 mg/g。
式中:p。为平衡时溶液中总氰根离子质量浓度(mg/L);K₁为Langmuir常数(L/mg);q为理论吸附量(mg/g);po为初始总氰根离子质量浓度(mg/L);Kp和np为Freundlich常数((mg/g)/(mg/L)\")。
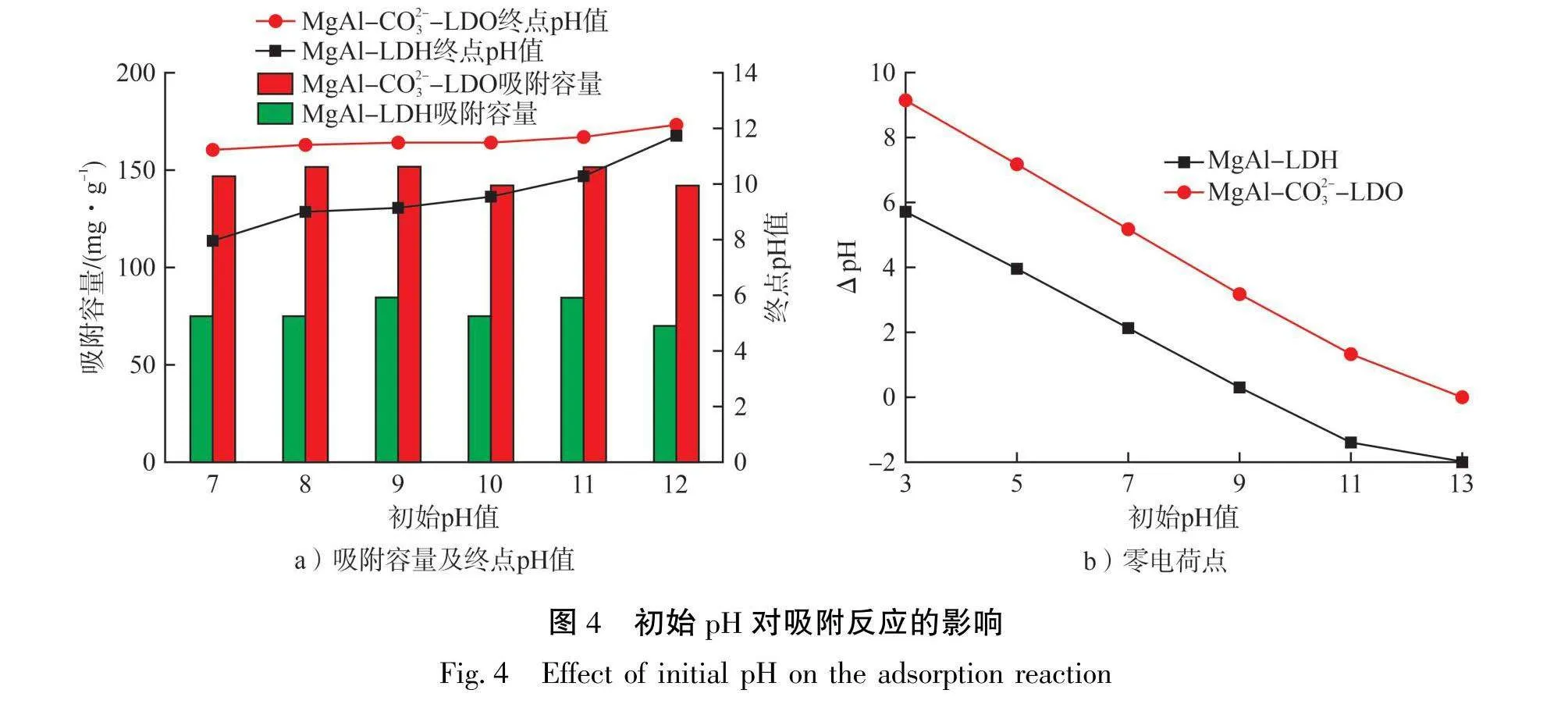
2.2.4初始pH的影响
溶液初始pH对吸附剂的表面电荷有显著影响,可以控制吸附剂与吸附质之间的静电相互作用。初始pH对吸附反应的影响见图4。从图4-a)可以看出:在试验pH范围内,随着溶液初始pH的逐渐升高,2种吸附剂的吸附容量变化不大,只有微小的上下浮动,表明初始pH不影响吸附剂对溶液中亚铁氰离子的吸附过程。反应后溶液的pH均有所上升,MgAl-CO3--LDO吸附后溶液pH值均为12左右。从pH移位法测得的2种吸附剂的零电荷点(见图4-b))可以看出:MgAl-LDH和MgAl-CO₃-LDO的零电荷点(pHpzc)分别为9.40和12.87。对于MgAl-CO³--LDO来说,试验pH均小于其零电荷点,表明其在试验过程中表面均携带正电荷,这有利于亚铁氰离子与吸附剂之间的静电作用;对于MgAl-LDH来说,随着试验pH的升高,其表面先携带正电荷再携带负电荷,亚铁氰离子与吸附剂之间的静电作用从相互吸引逐渐变为相互排斥。然而,2种吸附剂的吸附效果均与初始pH无关,表明吸附机理不是吸附剂和亚铁氰离子间的静电作用。
2.2.5共存离子的影响
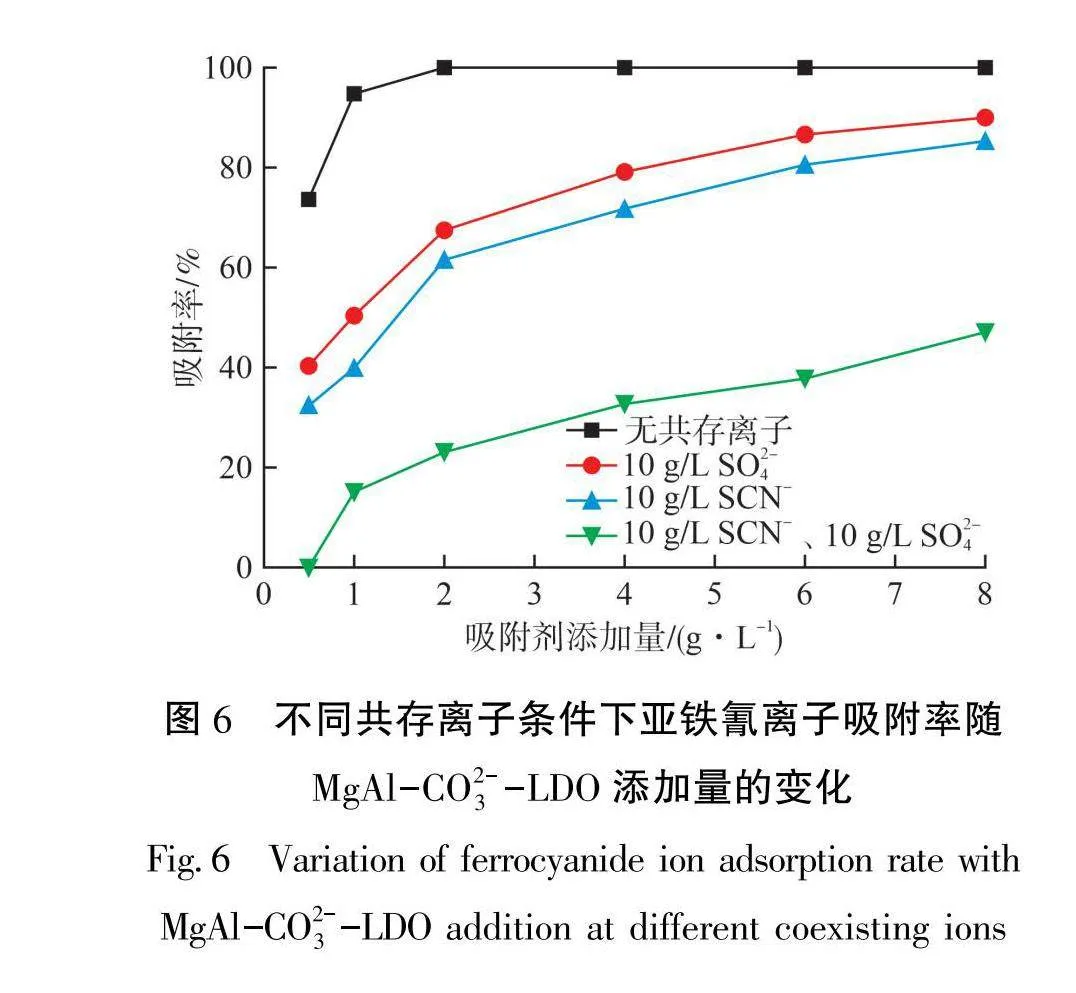
工业含氰废水往往含有较高浓度的SO2及SCN-,还含有部分Cl-,因此检验吸附材料在高无机盐浓度溶液中的吸附性能具有十分重要的现实意义。共存离子质量浓度对吸附容量的影响见图5。从图5可以看出:随着杂质离子质量浓度的增加,2种吸附剂的吸附容量均有所降低,但由于MgAl-CO³-LDO本身具有较好的吸附性能,在SCN-质量浓度为10g/L时,其吸附容量仍然达70 mg/g。Cl-、SO²及SCN-对2种吸附剂吸附性能的影响程度为SCN-gt;SO2-gt;Cl-。其中,SO²-比Cl-更容易插层进入LDH中,这与文献[22]研究结果一致。试验结果还表明,SCN-插层的离子交换常数大于SO²。MgAl-CO³--LDO添加量对亚铁氰离子吸附率的影响见图6。从图6可以看出:当溶液中只有亚铁氰离子,吸附剂添加量为2 g/L时,可实现溶液中亚铁氰离子的完全吸附;当溶液中含有10 g/L SO²-或SCN-,吸附剂添加量为8g/L时,亚铁氰离子吸附率分别为87%及90%;当溶液中同时含有10 g/L SO2-、SCN-,吸附剂添加量为8g/L时,亚铁氰离子吸附率为50%。这表明,在高浓度盐溶液中,MgAl-CO?--LDO仍然能够实现亚铁氰离子的选择性吸附。
2.3吸附机理分析
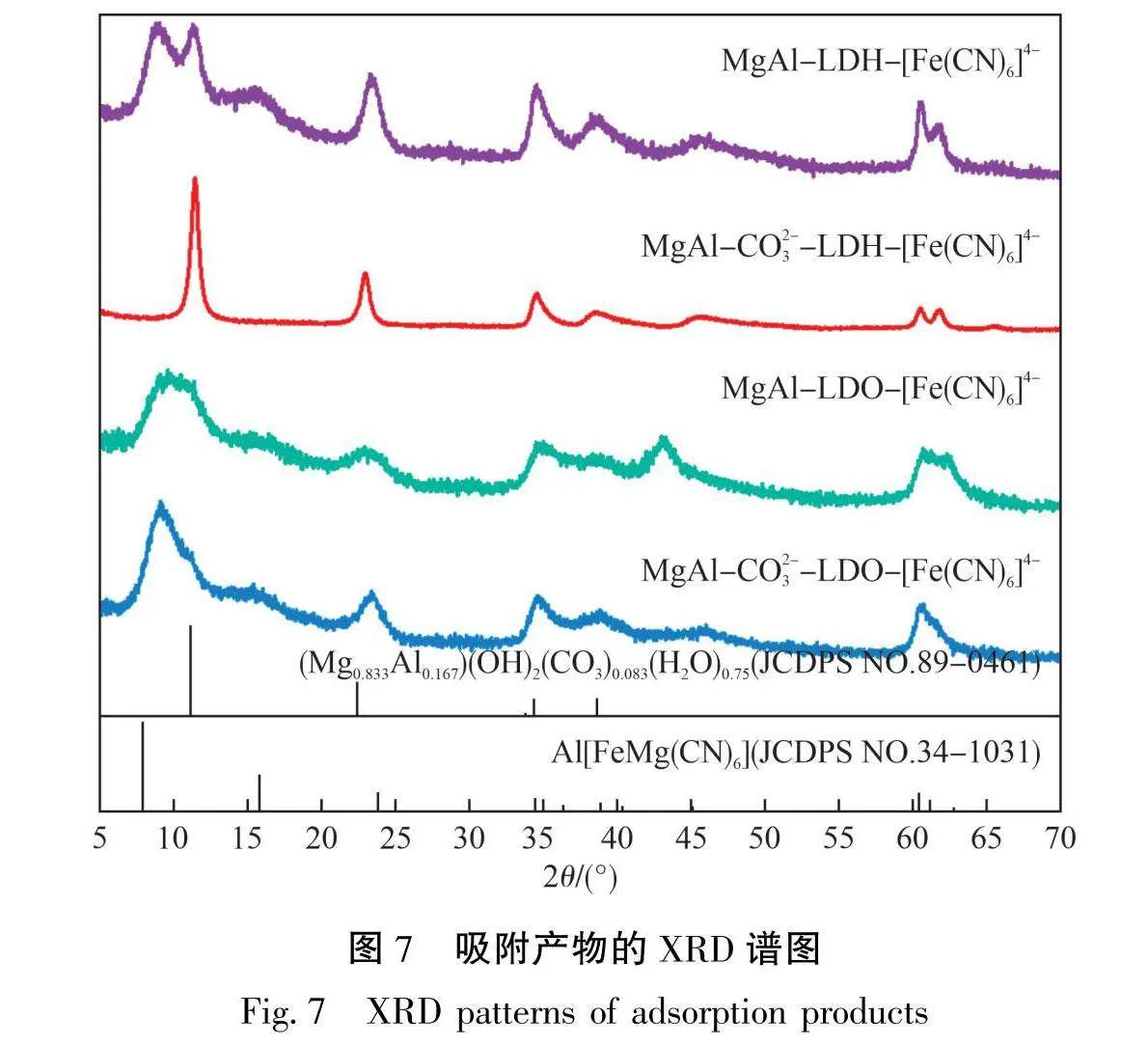
2.3.1 XRD分析
4种吸附剂吸附亚铁氰离子后的XRD谱图见图7。从图7可以看出:MgAl-CO³-LDH-[Fe(CN)₆]⁴的XRD谱图基本不变,维持原有的LDH结构。d(003)由0.779 nm降至0.773 nm,层间距的变化说明[Fe(CN)₆]⁴-进入了MgAl-CO3-LDH层中间,可能是由于[Fe(CN)₆]⁴与MgAl-CO3--LDH中残余的少量Cl-发生了离子交换,这与MgAl-CO³-LDH微弱的吸附效果相吻合[23]。MgAl-LDH在原有11.15°处的LDH特征峰强度有所减弱,在20为7.89°、15.81°处增加了2个属于Al[FeMg(CN)₆]的特征峰。该物质为Mga₇41Alo₂s₉(OH)₂(Fe(CN)₆)₀.067(CO₃)₀00(H₂O)1.05,其结构与LDH类似,d(003)为1.118 nm[24-25]。在23.80°、34.51°、38.91°、60.50°及61.21°处的峰强度有所增加,这是由于这些位置也是Al[FeMg(CN)₆]特征峰的所在处。MgAl-LDO和MgAl-CO3--LDO在吸附[Fe(CN)₆]⁴后,由于“记忆效应”,均从原本的混合镁铝氧化物恢复了LDH的结构,并在11.15°、22.41°及33.78°处出现了LDH的特征峰。同时,在7.89°、15.81°处出现了属于Al[FeMg(CN)₆]的特征峰。Al[FeMg(CN)₆]的生成表明,[Fe(CN)₆]4进入了LDO的层间。
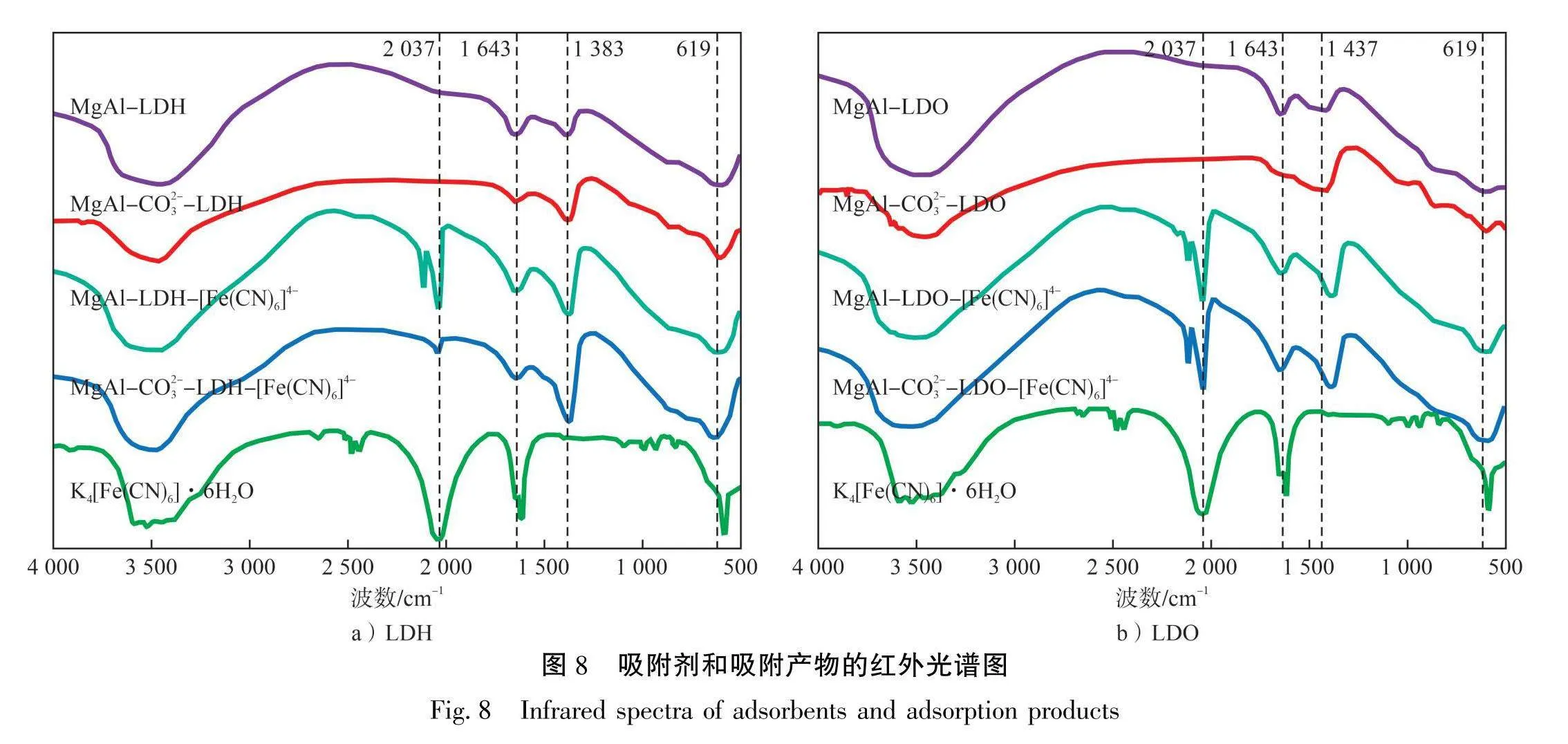
2.3.2红外光谱分析
LDH和LDO吸附前后的红外光谱图见图8。从图8可以看出:在3476 cm⁻¹的宽不对称峰是0—H的伸缩振动峰,属于样品的层间或表面吸附的水分子振动。1643 cm¹的峰为水分子的弯曲振动[26]。500~1000cm⁻¹的峰为金属氧化物中M—0、0—M—0或M—0—M(M为Al、Mg)的晶格振动峰[20]。LDH在1384 cm⁻¹的峰为C=0(或CO³)的特征峰[27]。焙烧后的LDO中CO³-的特征峰由1383cm-¹移至1437 cm⁻¹,吸附[Fe(CN)₆]4后又变为1383 cm⁻¹,这可能是由于经过焙烧后的LDO中含有的CO3减少,重新进入水溶液后,吸附了部分水溶液中溶解的CO₂,使得吸附后的样品中C=0特征峰强度增强。此外,在原有吸收峰的基础上,吸附[Fe(CN)₆]4-后的吸附剂均在2037 cm-¹处增加了新的吸收峰。从K₄[Fe(CN)₆]·3H₂O的红外光谱图上看,该峰是C=N的特征峰。其中,MgAl-CO3-LDH-[Fe(CN)₆]4在此处的峰较弱,表明其对[Fe(CN)₆]⁴也具有吸附作用,与XRD分析中层间距的改变相符合。
2.3.3 XPS分析
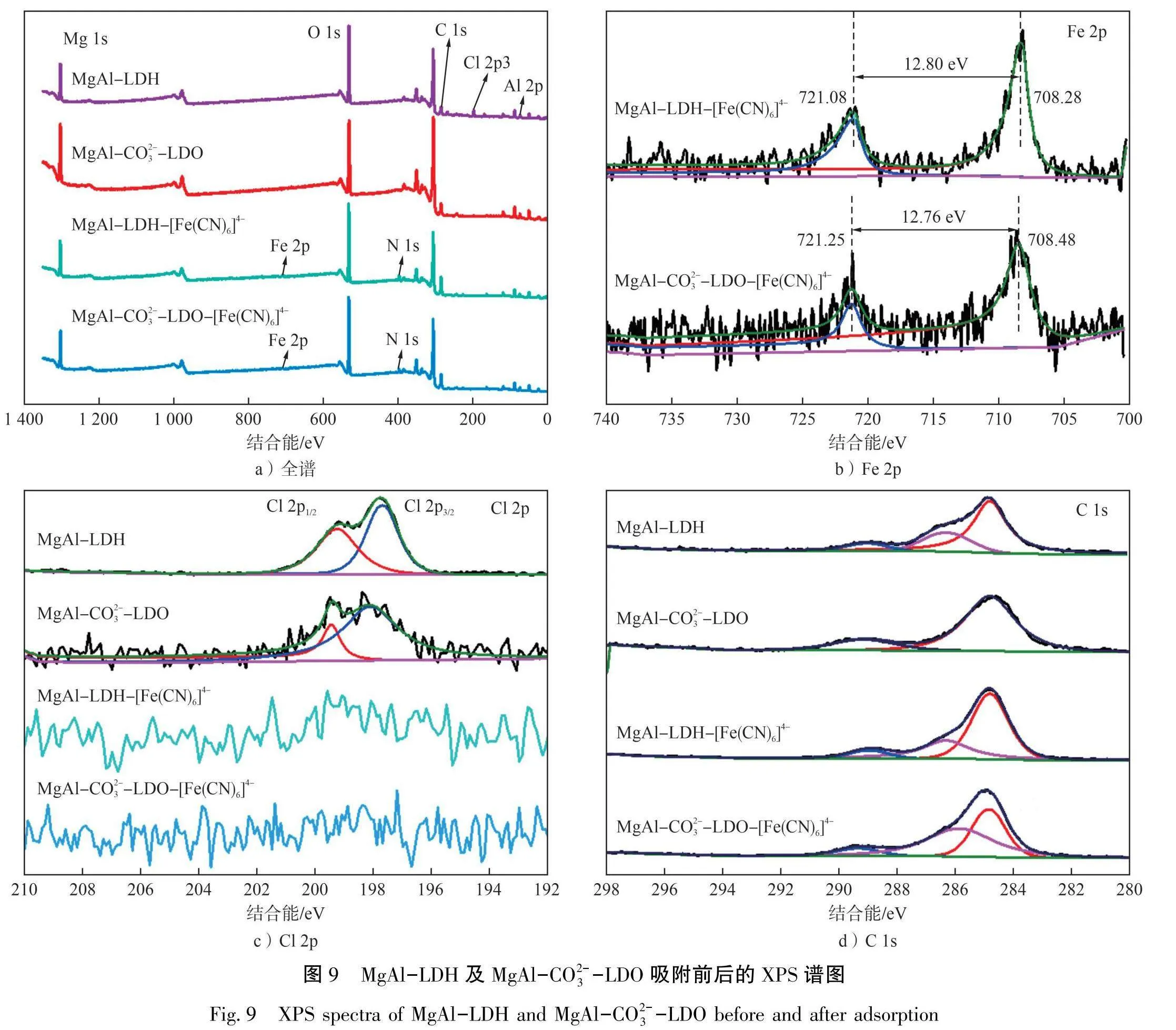
MgAl-LDH及MgAl-CO3--LDO吸附前后的XPS谱图见图9。
从全谱图(见图9-a))可以看出:MgAl-LDH及MgAl-CO³--LDO的表面均含有Mg、Al、C、0及Cl。MgAl-LDH中Cl元素的峰更加明显,这是由于其插层中Cl-含量更高,与XRD层间距分析结果相符。吸附后的谱图增加了Fe及N的吸收峰,表明[Fe(CN)₆]4被成功吸附到吸附剂上。从吸附后样品表面Fe元素的精细谱图(见图9-b))可以看出:Fe 2p,₂和Fe 2p₃2间距分别为12.80 eV和12.76 eV。文献[28]指出,[Fe(CN)₆]³-的Fe 2p轨道间距为12.80 eV,[Fe(CN)₆]的轨道间距为13.50 eV,这表明在吸附剂表面的铁以[Fe(CN)₆]³-形式存在,这是由于[Fe(CN)₆]4-在空气中易被氧化为[Fe(CN)₆]³-。从吸附前后Cl元素的精细谱图(见图9-c))可以看出:吸附前的吸附剂表面均具有Cl元素,且MgAl-LDH中Cl元素的谱形更加清晰,表明其含有的Cl元素更多。吸附后样品表面Cl元素的峰几乎消失,表明在吸附过程中吸附剂中所有的Cl-均与亚铁氰离子进行了交换,即吸附剂以离子交换的方式对亚铁氰离子进行吸附。从吸附前后吸附剂表面C元素的精细谱图(见图9-d))可以看出:286.0 eV左右的峰为CO³的特征峰[17]。MgAl-LDH表面有此峰是制备时溶液中CO₂插入层间导致的,吸附后的吸附剂表面仍有此峰,表明CO³不与[Fe(CN)₆]-发生离子交换。焙烧后的吸附剂MgAl-CO³--LDO表面无此峰,表明焙烧过程中,层间的CO³-已全部以CO₂形式挥发。吸附后的吸附剂表面又检测出CO²-的特征峰,表明溶液中的CO₂又重新插入LDH层间。由此可知,MgAl-LDH对[Fe(CN)₆]⁴-的吸附机理为层间Cl-与[Fe(CN)₆]⁴的相互交换,MgAl-CO--LDO的吸附机理则基于其“记忆效应”。
3结论
本文开展了MgAl-LDH的制备及其焙烧产物LDO对溶液中[Fe(CN)₆]⁴-吸附性能的研究,得出以下结论:
1)研究制备的MgAl-LDH、MgAl-CO³--LDH、MgAl-LDO、MgAl-CO³-LDO 4种吸附剂的最大吸附容量分别为124.0 mg/g、32.86 mg/g、134.23 mg/g及234.4 mg/g。
2)吸附过程的动力学与Freundlich模型较为符合,为化学吸附过程。
3)常见杂质离子对吸附剂吸附性能的影响顺序为SCN⁻gt;SO₄²-gt;Cl-。
4)LDH层间的Cl-可与[Fe(CN)₆]4-发生离子交换生成Al[FeMg(CN)₆],LDO由于“记忆效应”可吸附[Fe(CN)₆]⁴-生成Al[FeMg(CN)₆]。
5)研究重点探究了高盐水溶液中[Fe(CN)₆]4的去除性能,可为含氰废水的处理提供参考。
[参考文献]
[1]ANNING C,WANG JX,CHEN P,et al.Determination and detoxifi-cation of cyanide in gold mine tailings:A review[J].Waste Manage-ment and Research,2019,37(11):1117-1126.
[2]HANELA S,DURANJ,JACOBO S.Removal of iron-cyanide complexes from wastewaters by combined UV-ozone and modified zeolite treatment[J].Jourmal of Environmental Chemical Engineering,2015,3(3):1794-1801.
[3]OZCAN E,GOK Z,YEL E.Photo/photochemical oxidation of cyanide and metal-cyanide complexes:Ultraviolet A versus ultraviolet C[J].Environmental Technology,2012,33(16):1913-1925.
[4]IBARGUEN-LOPEZ H,LOPEZ-BALANTA B,BETANCOURT-BUITRAGO L,et al.Degradation of hexacyanoferrate(Ⅲ)ion by the coupling of the ultraviolet light and the activation of persulfate at basic pH[J].Jourmal of Environmental Chemical Engineering,2021,9(5):106233.
[5]VAN GREKEN R,AGUADO J,LOPFZ-MUNOZ M J,et al.Photocatalytic degradation of iron-cyanocomplexes by TiO₂based catalysts[J].Applied Catalysis B:Environmental,2004,55(3):201-211.
[6]BUSHEYJT,DZOMBAK DA.Ferrocyanide adsorption on aluminum oxides[J].Journal of Colloid and Interface Science,2004,272(1):46-51.
[7]KANG DH,SCHWABAP,JOHNSTON CT,et al.Adsorption of iron cyanide complexes onto clay minerals,manganese oxide,and soil[J].Journal of Environmental Science and Health,Part A,2010,45(11):1391-1396.
[8]DEIHIMIN,IRANNAJAD M,REZAI B.Equilibrium and kinetic studies of ferricyanide adsorption from aqueous solution by activa-ted red mud[J].Journal of Environmental Management,2018,227:277-285.
[9]RENNERTT,MANSFELDT T.Sorption and desorption of iron-cyanide complexes in deposited blast furnace sludge[J].Water Research,2002,36(19):4877-4883.
[10]RENNERT T,MANSFELDT T.Sorption of iron-cyanide complexes on goethite in the presence of sulfate and desorption with phosphate and chloride[J].Journal of Environmental Quality,2002,31(3):745-751.
[11]CHEN MH,LISL,JIN C,et al.Removal of metal-cyanide complexes and recovery of Pt(Ⅱ)and Pd(Ⅱ)from wastewater using an alkali-tolerant metal-organic resin[J].Journal of"Hazardous Materials,2021,406:124315.
[12]ZHANG Q,CHEN MH,ZHONGLJ,et al.Highly effective removal of metal cyanide complexes and recovery of palladium using quater-nary-ammonium-functionalized MOFs[J].Molecules,2018,23(8):2086.
[13]FENG X,LONG R,WANG L,et al.A review on heavy metal ions adsorption from water by layered double hydroxide and its compo-sites[J].Separation and Purification Technology,2022,284:120099
[14]WU H,LIUXZ,WEN J,et al.Rare-earth oxides modified Mg-Al layered double oxides for the enhanced adsorption-photocatalytic activity[J].Colloids and Surfaces A-Physicochemical and Engi-neering Aspects,2021,610:125933.
[15]XIE ZH,HE CS,PEI DN,et al.Efficient degradation of micropol-lutants in CoCaAl-LDO/peracetic acid(PAA)system:An organic radical dominant degradation process[J].Journal of Hazardous Materials,2023,452:131286.
[16]DONGYC,KONGXR,LUOXS,et al.Adsorptive removal of heavy metal anions from water by layered double hydroxide:A review[J].Chemosphere,2022,303:134685.
[17]HUANGPP,CAOCY,WEI F,et al.MgAl layered double hydroxides with chloride and carbonate ions as interlayer anions for removal of arsenic and fluoride ions in water[J].RSC Advances,2015,5(14):10412-10417.
[18]CHEN Y,GEORGI A,ZHANGWY,et al.Mechanistic insights into fast adsorption of perfluoroalkyl substances on carbonate-layered double hydroxides[J].Journal of Hazardous Materials,2021,408:124815.
[19]LIYJ,GAOBY,WU T,et al.Adsorption kinetics for removal of thiocyanate from aqueous solution by calcined hydrotalcite[J].Colloids and Surfaces A-Physicochemical and Engineering Aspects,2008,325(12):38-43.
[20]NGUYEN TH,TRANHN,NGUYENTV,et al.Single-step removal of arsenite ions from water through oxidation-coupled adsorption using Mn/Mg/Fe layered double hydroxide as catalyst and adsor-bent[J].Chemosphere,2022,295:133370.
[21]WANGXY,WULJ,HUANGYC,et al.Efficient removal and selective recovery of phosphorus by calcined La-doped layered double hydroxides[J].Journal of Water Process Engineering,2022,47:102722.
[22]ABDELLAOUI K,PAVLOVICI,BOUHENT M,et al.A comparative study of the amaranth azo dye adsorption/desorption from aqueous solutions by layered double hydroxides[J].Applied Clay Science,2017,143:142-150.
[23]ZHOU YH,LIU Z,BOAX,et al.Simultaneous removal of cationic and anionic heavy metal contaminants from electroplating effluent by hydrotalcite adsorbent with disulfide(S²-)intercalation[J].Journal of Hazardous Materials,2020,382:121111.
[24]MIYATA S,HIROSE T.Adsorption of N₂,O₂,CO₂and H₂on hydro-talcite-like system:Mg²+-Al³+-Fe(CN)₆[J].Clays and Clay Minerals,1978,26(6):441-447.
[25]FROST RL,MUSUMECIA W,BOUZAID J,et al.Intercalation of hydrotalcites with hexacyanoferrate(Ⅱ)and(Ⅲ)-a thermo-Raman spectroscopic study[J].Journal of Solid State Chemistry,2005,178(6):1940-1948.
[26]YANG K,YAN LG,YANGYM,et al.Adsorptive removal of phos-phate by Mg-Al and Zn-Al layered double hydroxides:Kinetics,isotherms and mechanisms[J].Separation and Purification
Technology,2014,124:36-42.
[27]MENG ZL,FAN JX,CUIXY,et al.Removal of perchlorate from aqueous solution using quatermary ammonium modified magnetic Mg/Al-layered double hydroxide[J].Colloids and Surfaces A-Physico-chemical and Engineering Aspects,2022,647:129111.
[28]OKU M.Kinetics of photoreduction of Fe(Ⅲ)in solid solution K₃(Fe,M)(CN)₆(where M is Cr,Co)during XPS measure-ment[J].Joumal of Electron Spectroscopy and Related Phenomena,1994,67(3):401-407.
Study on the adsorption performance of MgAl layered double(hydro)oxides for ferrocyanide ions
Wang Xiaoge¹,Wu Bing²,Li Binchuan¹,Liu Yafang³,Chen Jianshe',Meng Weifen³,Han Qing'
(1.School of Metallurgy,Northeastern University;2.Sanmenxia Polytechnic;3.Sanmenxia Nonferrous Metals Technology Development Center)
Abstract:This study investigates the removal of ferrocyanide ions([Fe(CN)₆]⁴)from aqueous solutions using MgAl layered double(hydro)oxides(MgAl-LDH)and their roasting products(MgAl-LDO).MgAl-LDH with different concentrations of CO³and Cl-intercalates were synthesized by co-precipitation,and various MgAl-LDO were prepared by roasting.The adsorption performance of LDH and LDO for[Fe(CN)₆]⁴was explored.The results show that LDH exhibits a rapid adsorption rate,achieving equilibrium within 20 min.LDO has a higher adsorption capacity,reaching a maximum of 234.4 mg/g.The adsorption is effective at pH values between 7 and 12.The adsorbent also demonstrates selective adsorption of[Fe(CN)₆]⁴in solutions containing high concentrations of SO2and SCN-.Mechanism analysis indicates that in LDH intercalated anions,only Cl-can exchange with[Fe(CN)₆]⁴-,leading to adsorption and forming Al[FeMg(CN)₆].The adsorption of[Fe(CN)₆]⁴by LDO is attributed to its\"memory effect\"with higher CO²content in LDH layers corresponding to greater adsorption capacity of LDO.
Keywords:MgAl layered double(hydro)oxides;intercalated anion;ferrocyanide ion;selectivity;adsorption"echanism;wastewater treatment
