番茄黄化曲叶病毒胁迫下外源NO 对番茄抗氧化物酶基因表达的影响
2025-02-19罗金城朱晓林魏小红王贤王宝强杜雪芬



摘要:为探究番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)胁迫下外源一氧化碳(nitric oxide,NO)对番茄抗氧化物酶基因表达的影响,以易感病番茄品种金鹏1号为试验材料,在对照(CK)、TYLCV(TY)和NO+TYLCV(NO+TY)3种处理下,通过转录组测序、荧光qRT-PCR和生物信息学分析进行研究。结果表明,在番茄基因组中共筛选出55个抗氧化酶相关编码基因,其中存在于不同亚细胞区室中含有外显子数目最多的抗氧化酶基因均显著响应TYLCV胁迫。NO介导的抗氧化酶编码基因数量在不同亚细胞区室的分布表现为叶绿体gt;细胞膜gt;细胞质gt;过氧化物酶体gt;液泡,其中Chl Cu-Zn SOD、Chl MR2、Chl GR、Per MR、Pla CAT1 和PlaCAT7 的表达量显著上调;Chl Fe SOD1、Chl Fe SOD2、Cyt GPX、Cyt APX1、Cyt APX2 L-5、Pla CAT3、Pla CAT8 和Vac CAT 的表达量显著下调。实时荧光qRT-PCR验证发现,Chl GR、Min Mn SOD 和Per CAT2 响应TYLCV表达,Chl Cu-Zn SOD、Pla CAT7、Pla CAT8 和Cyt APX2 L-5 响应TYLCV和NO表达。以上结果为研究NO在提高番茄抗病性机制中的作用提供理论依据。
关键词:番茄;番茄黄花曲叶病;一氧化氮;抗氧化酶基因doi:10.13304/j.nykjdb.2023.0647
中图分类号:S641.2;Q344 文献标志码:A 文章编号:1008‐0864(2025)02‐0125‐11
番茄(Solanum lycopersicum)因富含对平衡膳食和维护人体健康起重要作用的营养物质(胡萝卜素和维生素C等)而被广泛种植[1]。在生产过程中,番茄黄化曲叶病毒(tomato yellow leaf curlvirus, TYLCV)是导致番茄产量和品质下降或死亡的最具破坏性病害之一[2‐3]。目前对于TYLCV的防治主要有提前预防、培育抗性番茄新品种、通过转基因获得抗TYLCV番茄苗,以及应用外源物质来提高番茄的抗病能力[4]。Sun等[5]研究发现,施用丁香酚能刺激番茄植株产生内源一氧化氮(nitric oxide, NO)和水杨酸(salicylic acid, SA),从而提高番茄对TYLCV的抗性。茄属植物和番茄白粉菌之间的相互作用也证实了NO在防御激活中具有积极作用[6]。此外,硝普钠(sodiumnitroprusside,SNP)是一种NO供体,用其处理番茄可增强果实对灰霉病菌的抗性[7],通过激活细胞壁相关的防御反应来保护番茄植物免受立枯丝核菌感染[8]。Sivakumaran等[9]发现,施加外源脱落酸(abscisic acid ABA)会减少NO的合成,导致番茄对灰霉病菌的抗性降低。以上说明,NO对调控植物抗性具有重要作用。
NO和活性氧(reactive oxygen species ROS)是植物受到病原体感染或诱导剂处理下激活抗病反应所必需的信号物质[10]。研究表明,细胞在遭受病原体攻击时会应对ROS 的增多,NO 自由基(NO-·)可与超氧化物自由基(O-2·)反应,产生对植物具有保护作用的过氧亚硝酸盐(ONOO-),以减少ROS 对细胞的损伤[11-12]。NO 通过与H2O2 协同介导超敏细胞死亡的假设也得到验证,转基因拟南芥与对照相比,过表达植株中清除H2O2的类囊体抗坏血酸过氧化物酶活性增加,植物显示出对NO诱导的细胞死亡抗性显著增强[13]。因此,如何控制ROS积累是植物抵御外界不利条件的重要途径,研究NO 调控植物体内超氧化物歧化酶(superoxide dismutase, SOD) 、过氧化氢酶(catalase, CAT)和谷胱甘肽还原酶(glutathionereductase, GR)等抗氧化酶在清除活性氧、保护植物细胞免受破坏中的作用机制显得尤为重要[14]。
目前,有关NO诱导生物胁迫的研究多停留在生理水平,而在分子水平上研究NO诱导TYLCV抗性的研究尚未见报道。因此,本研究利用转录组测序技术、荧光qRT-PCR技术和生物信息学方法,对TYLCV胁迫下外源NO对番茄抗氧化物酶基因表达的影响进行研究,旨在解析NO在调控番茄抗黄化曲叶病中的功能,为进一步探究外源NO 在TYLCV胁迫下的分子机制提供理论参考。
1 材料与方法
1.1 试验材料
以TYLCV易感品种金鹏1号为试验材料,由西安金鹏种苗有限公司选育。用于病毒接种的TYDNA侵染性克隆(农杆菌)引自周雪平教授实验室。
1.2 试验设计
试验共设置3 个处理,分别为:对照处理(CK),接种清水;接种TYLCV 处理(TY);接种NO+TYLCV处理(NO+TY)。其中NO+TY处理喷施 0.15 mmol·L-1的SNP溶液,该溶液中含有0.1%的吐温20,目的是促进植物对SNP的吸收,在病毒接种的前3 d每天喷施SNP溶液1次,接种后,隔10 d再喷施1次,每株30 mL。所有处理于接种20 d后对番茄植株的叶片进行采样并混合剪碎,每份0.3 g,使用液氮快速冷冻,每处理3次重复。然后封装保存于-80 ℃冰箱,送至广州基迪奥生物科技有限公司进行测序。
1.3 试验方法
1.3.1 番茄苗培育 选取健康饱满、大小一致的番茄种子在温水中浸泡30 min后,点播在32孔育苗盘,长至2~3 片真叶时,选取大小一致的幼苗移栽于花盆(直径26 cm、高16 cm的圆形花盆)。生长条件为:室温(25±1) ℃,光照强度约450 μmol·m-2·s-1。
1.3.2 TYLCV-[CN:SH2]载体的农杆菌培养与接种 接种前将含有TYLCV-[CN:SH2]的农杆菌菌液均匀涂于固体LB培养基,置于28 ℃暗培养箱,随后再转接于液体LB 培养基中,于200 r·min-1、28 ℃摇床过夜,固体与液体培养基均含50 mg·L-1的卡那霉素(kanamycin,Kan)和50 mg·L-1的利福平(rifampicin,Rif),菌液的OD600值为0.7时进行注射接种试验。接种病毒前一晚过量浇水,以便TYLCV成功侵入。选取长势一致的番茄植株,采用注射器将菌液缓慢注射进幼苗叶片背部,每株0.2 mL。
1.3.3 总RNA 提取、反转录与荧光qRT-PCR 分析 使用DP441 RNAprep Pure 多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取番茄叶片组织的总RNA;然后利用TaKaRa反转录试剂盒RT reagent Kit[宝日医生物技术(北京)有限公司]合成cDNA。qRT-PCR 在BIO-RADCFX96 实时荧光定量PCR 仪(Bio-Rad,美国)上进行,引物序列详见表1,内参基因为UBI。反应体系10 μL:Taq 酶6 μL,cDNA模板1 μL,正反向引物各1 μL,ddH2O 1 μL。反应程序为: 95 ℃预变性30 s;95 ℃变性5 s、58 ℃退火延伸30 s,40个循环。使用2-ΔΔCT 方法[15] 分析基因的相对表达水量。
1.3.4 生物信息学分析 利用Expasy Prot Param(https://web.expasy.org/protparam/)网站分析筛选出的55个抗氧化物酶编码基因的基本理化性质;利用GSDS 2.0(http://gsds.gao-lab.org/)在线软件分析其基因结构;利用在线工具WoLF PSORT(https://wolfpsort.hgc.jp/)预测抗氧化酶基因序列编码蛋白的亚细胞定位。
1.4 数据处理
将筛选出的抗氧化酶基因的转录组数据FPKM使用SPSS 20.0软件进行分析,采用单因素方差分析(one-way analysis of variance,ANOVA)进行差异显著性分析。利用Graph Pad Prism 9软件绘图。
2 结果与分析
2.1 番茄抗氧化酶编码基因的筛选
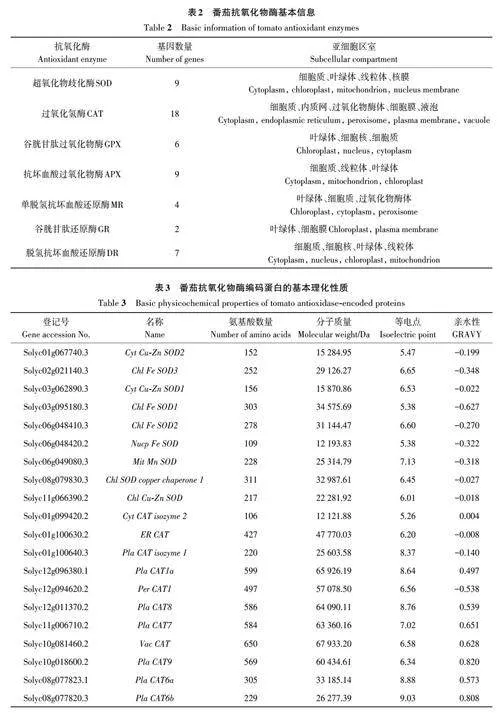
通过cDNA 库基因功能注释筛选,筛选到与抗氧化物酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GPX)、抗坏血酸过氧化物酶(ascorbateperoxidase,APX)、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MR)、和谷胱甘肽还原酶(GR)和脱氢抗坏血酸还原酶(dehydroascorbate reductase,DR)相关的基因家族成员共计55 个(表2),其编码基因数量分别为9、18、6、9、4、2和7个,其中编码基因数量最多的是CAT,最少的是GR。
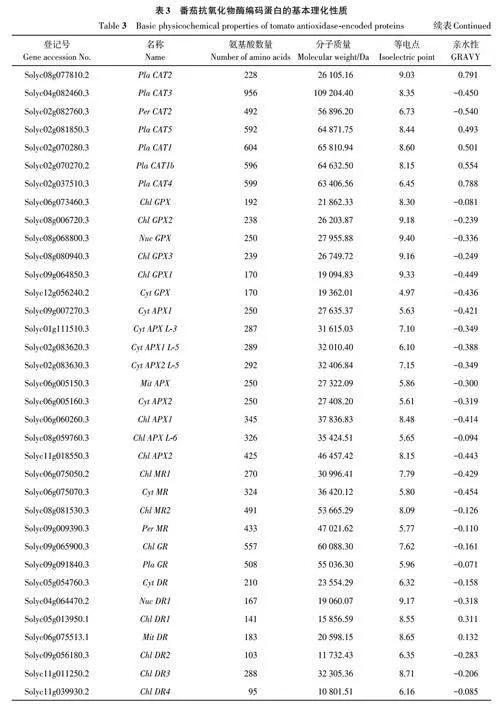
2.2 番茄抗氧化物酶编码蛋白的基本理化性质分析
将转录组数据中筛选出的SOD、CAT、GPX、APX、MR、GR 和DR 基因家族成员分别命名,如表3所示,然后进行理化性质分析,结果表明,抗氧化物酶所含氨基酸数量为95(Chl DR4)~956(Pla CAT3)个;分子量为10 801.51(Chl DR4)~109 204.40(Pla CAT3)Da;等电点为4.97(CytGPX)~9.40(Nuc GPX);蛋白的总平均亲水性(grand average of hydropathicity,GRAVY)为-0.538(Per CAT1)~0.820(Pla CAT9)。
2.3 番茄抗氧化物酶编码基因的基因结构分析
由图1可知,Chl MR2 的外显子数量最多,为17个;Pla CAT8 的外显子数量最少,仅1个。SOD、GPX、APX和DR编码基因的外显子数量均≤3,而CAT 编码基因的外显子数量差异较大,达14个(表4)。
2.4 不同亚细胞区室抗氧化酶编码基因表达量
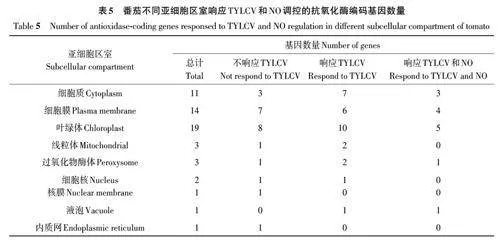
各亚细胞区室中共筛选到29 个基因响应TYLCV调控,14个基因响应NO调控,分别定位于细胞质、细胞膜、叶绿体、线粒体、过氧化物酶体、细胞核、核膜、液泡和内质网(表5)。SOD、GPX、MR、GR 和DR 的编码基因中定位于叶绿体的占比较高,分别为55.6%、66.7%、50.0%、50.0% 和57.1%;CAT 编码基因的表达产物主要存在于细胞膜中,占72.2%。
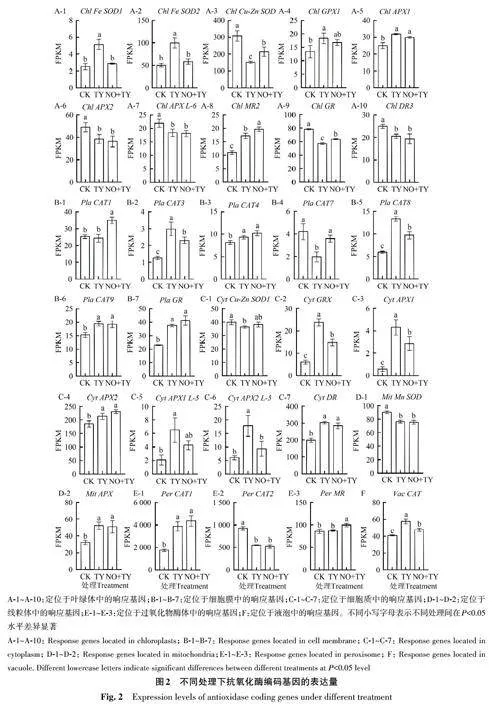
2.4.1 叶绿体 与其他亚细胞区室相比,在叶绿体中筛选到的编码基因数量最多,共计19 个。其中Chl Fe SOD3、Chl SOD copper chaperone 1、ChlGPX2、Chl GPX2、Chl GPX3、Chl MR1、Chl DR1、Chl DR2 和Chl DR4 共9 个基因的表达量未受到TYLCV 的影响。如图2 所示,与CK 相比,接种TYLCV后,Chl Fe SOD1、Chl Fe SOD2、Chl GPX1、Chl APX1 和Chl MR2 表达量显著上调,分别提高2.04、1.98、1.37、1.27 和1.57 倍;Chl Cu-Zn SOD、Chl APX2、Chl APX L-6、Chl GR 和Chl DR3 表达量显著下调,分别降低2.03、1.27、1.19、1.37 和1.21倍;Chls GPX 表达量也有所上升。与TY 处理相比,NO 介导下显著提高了Chl Cu-Zn SOD、ChlMR2 和Chl GR 的表达量,分别提高1.41、1.14 和1.12倍;而Chl Fe SOD1 和Chl Fe SOD2 的表达量均显著下调,分别降低1.79和1.71倍。
2.4.2 细胞膜 亚细胞定位显示共计14个编码基因存在于细胞膜上,其中Pla CAT isozyme 1、PlaCAT1a、Pla CAT6a、Pla CAT6b、Pla CAT2、Pla CAT5和Pla CAT1b 共7 个基因不响应TYLCV 。如图2所示,与CK 相比,接种TYLCV 后,Pla CAT3、PlaCAT4、Pla CAT9、Pla CAT8 和Pla GR 表达量显著上调,分别提高2.36、1.14、1.27、2.24 和1.63 倍;PlaCAT7基因表达量显著下调,降低2.14倍。与TY相比,NO介导使Pla CAT1 和Pla CAT7 的基因表达量显著提高1.43和1.82倍;而Pla CAT3 和Pla CAT8的基因表达量显著降低1.29和1.38倍。
2.4.3 细胞质 在细胞质中表达的基因共计11 个,接种TYLCV 后表达无变化的有3 个(CytCAT isozyme 2、Cyt APX L-3 和Cyt MR)。如图2所示,与CK 相比,接种TYLCV 后,Cyt GPX、Cyt APX1、Cyt APX2、Cyt DR、Cyt APX1 L-5 和Cyt APX2 L-5 表达量显著上调,分别提高3.94、7.39、1.15、1.53、3.15、2.97 倍;Cyt Cu-Zn SOD1 表达量显著降低1.1 倍。与TY 相比,NO 介导下Cyt GPX、Cyt APX1 和Cyt APX2 L-5 的表达量显著降低1.61、1.50和1.91倍。
2.4.4 其他细胞器 在线粒体、过氧化物酶体、细胞核和液泡上分别筛选到3、3、3和1 个抗氧化酶编码基因,其中Mit DR、Nucp Fe SOD 和Nuc DR1不响应TYLCV;Nuc GPX 只响应TYLCV,但相对表达量较低。由图2 可知,与CK 相比,接种TYLCV 后,Mit APX、Per CAT1、Nuc GPX 和VacCAT 表达量显著提高1.62、2.21、2.59和1.41倍;而Mit Mn SOD 和Per CAT2 表达量显著降低1.18 和1.68倍。与TY相比,喷施NO后Per MR 表达量显著上调1.14倍;而Vac CAT 表达量得以恢复。
2.5 荧光实时定量分析
分析Chl Cu-Zn SOD、Chl GR、Pla CAT7、Pla CAT8、Cyt APX2 L-5、Min Mn SOD 和Per CAT2 基因在各处理第30 天的表达量,结果(图3)显示,Chl Cu-Zn SOD 和Pla CAT7 具有相似的表达模式,表现为在接种TYLCV后显著下调,喷施NO显著上调;Pla CAT8 和Cyt APX2 L-5 均表现为接种TYLCV后显著上调、喷施NO 显著下调的表达模式;Chl GR、Min Mn SOD 和Per CAT2 在接种TYLCV后显著下调,喷施NO对他们无显著影响。综上分析,除Chl GR 外,其他基因的表达与转录组数据呈现一致的趋势。
3 讨论
3.1 番茄抗氧化酶编码基因基本性质和结构域分析
番茄是全球具有重要经济地位的蔬菜作物,富含各种微量营养元素和矿物质[16]。抗氧化酶是重要的酶系统,用于将过氧化氢降解为水和氧气,从而降低细胞内过氧化氢水平[17]。研究表明,基因结构的差异对研究其功能差异至关重要[18]。本研究共鉴定出55个番茄抗氧化酶编码基因。基因结构分析表明,各抗氧化酶基因的外显子数量为1~17 个,其中SOD 基因具有相似的外显子数量,而CAT基因的外显子数量存在较大差异,这与Yu等[19]和Zhang等[20]研究结果一致。本研究发现,在同一种抗氧化酶基因家族中,外显子数量最多的基因显著响应番茄黄化曲叶病,如Chl FeSOD1 和Pla CAT4 等均响应TYLCV的表达,说明同一基因家族的基因其外显子数量的差异可能导致其功能上的变化。
3.2 抗氧化酶编码基因受TYLCV 影响导致表达量的变化
植物在感染病菌后会诱导体内ROS的积累,而ROS的积累会诱发膜脂过氧化反应,导致细胞结构被破坏甚至死亡[21]。SOD、POD 和CAT等抗氧化酶能对植物体内的自由基和过氧化物进行有效清除,抵御活性氧对细胞的伤害,保护细胞膜结构及其稳定性[22],从而间接参与抗病反应[23]。
本研究表明,基于转录组数据得到的55 个抗氧化酶编码基因对TYLCV的响应程度存在差异,其中所有的Cu-Zn SOD、50%的GR和50%的DR 显著下调;所有的Fe SOD 和GPX、67% 的CAT、78% 的APX、50% 的MR、50% 的GR 及50%的DR显著上调。此外,同一抗氧化酶基因家族的不同基因对TYLCV 的响应程度也存在差异,如Cyt Cu-Zn SOD2 表达量变化较小;Chl Cu-ZnSOD 表达量发生显著变化。Shang 等[24]也发现,在感染木薯白叶枯病条件下,植株体内SOD、APX和CAT的响应程度存在差异,且同一抗氧化酶基因家族对白枯病的响应程度也不同,这可能是由于其受调控途径的不同所导致。本研究通过转录组和qRT-PCR 发现,Min Mn SOD 在接种TYLCV 后表达量显著降低,而Jiang 等[25]将萝卜中分离到的Mn SOD 基因在花椰菜中过表达提升了其对霜霉病的抗性,由此推测,Min Mn SOD 可能参与番茄抗TYLCV 的重要环节。研究表明,CAT 占过氧化物酶体总蛋白质的10%~25%[26]。本研究发现,Pla CAT7、Pla CAT8 和Per CAT2 均显著响应TYLCV胁迫,这与张志刚[27]研究结果结果一致,推测CAT相关编码基因可能在抗病反应中发挥重要作用。
3.3 NO 对接种TYLCV 的番茄抗氧化酶编码基因表达量的影响
NO 是一种重要的信号分子,在植物种子萌发、生长、发育及逆境胁迫中都发挥着重要的调节作用[28]。在植物中,NO产量会随着各种胁迫环境呈现不同的增加,如干旱、冷胁迫、紫外线暴露等非生物胁迫会导致植物中产生NO,而病原体感染可在植物-病原体的相互作用过程中诱导NO快速爆发[29]。Wang等[30]发现,在接种TYLCV的番茄上喷施NO,其CAT、SOD和APX活性发生不同的变化。Choe等[31]研究表明,过表达G2 基因可获得耐受TYLCV的番茄植株。本研究通过转录组分析和qRT-PCR发现,Chl Cu-Zn SOD 在接种TYLCV后显著下调,而喷施NO可使其表达量得以恢复,表明NO可能通过提高相关基因的表达来增强植物的抗病性。Li等[32]将miR398b靶基因的4个SOD 基因全部突变后发现,CSD1、CSD2 和SODX 转基因植株对稻瘟病的敏感性降低,而突变CCSD 结果相反。本研究还发现,接种TYLCV 显著提高了Cyt GPX、Cyt APX1、Cyt APX2 L-5、Pla CAT3、Pla CAT8、Chl Fe SOD1 和Chl Fe SOD2 的表达量,而施加NO后会显著降低这些基因的表达,说明NO可能对这些基因具有保护作用;另外Chl MR2在接种后TYLCV后表达量显著上调,且喷施NO使其表达量进一步提高,推测NO可进一步诱导该基因,从而增强植株对TYLCV的抗性。
3.4 抗氧化酶编码基因在不同亚细胞区室的表达量分析
叶绿体是光合作用的场所,也是产生活性氧的主要部位之一,于力等[33]发现,接种TYLCV后番茄植株叶片中的叶绿体数量明显减少,且其结构发生变形,说明TYLCV会使番茄叶片的叶绿体产生损伤。张永平等[34]发现,接种番茄黄化曲叶病后,SOD、CAT和POD等抗氧化酶活性会发生显著变化。许培磊等[35]发现,在双红葡萄接种霜霉病菌后的第3天,其叶绿体结构发生不同程度的变化。本研究表明,响应TYLCV和NO的抗氧化物酶编码基因在叶绿体中的数量最多,表明叶绿体可能是抗氧化酶主要的工作场所。这可能是接种TYLCV后,外源NO诱导抗氧化物酶基因的表达量发生变化,导致SOD、CAT和POD等抗氧化酶活性也发生改变,从而调控ROS含量,减轻其对叶绿体的损伤,最终提高植物对生物胁迫的抗性。
参考文献
[1] VAN ECK J, KIRK D D, WALMSLEY A M. Tomato
(Lycopersicum esculentum) [J]. Methods Mol. Biol., 2006, 343(1):
459-473.
[2] 国艳梅,杜永臣,王孝宣,等.番茄黄化卷叶病毒病(TYLCV)的
研究进展[J].中国农业科技导报,2009,11(5):30-35.
GUO Y M, DU Y C, WANG X X, et al .. Research progress in
tomato yellow leaf curl viruses [J]. J. Agric. Sci. Technol.,
2009, 11(5):30-35.
[3] LI T, WANG Y H, HUANG Y, et al .. A novel plant proteindisulfide
isomerase participates in resistance response against
the TYLCV in tomato [J/OL]. Planta, 2020, 252(2):1 [2023-07-
20]. https://doi.org/10.1007/s00425-020-03430-1.
[4] PRASAD A, SHARMA N, HARI-GOWTHEM G, et al .. Tomato
yellow leaf curl virus: impact, challenges, and management [J].
Trends Plant Sci., 2020, 25(9):897-911.
[5] SUN W J, LYU W J, LI L N, et al .. Eugenol confers resistance
to tomato yellow leaf curl virus (TYLCV) by regulating the
expression of SlPer1 in tomato plants [J]. New Biotechnol.,
2016, 33(3):345-389.
[6] PITERKOVÁ J, LUHOVÁ L, MIESLEROVÁ B, et al .. Nitric
oxide and reactive oxygen species regulate the accumulation of
heat shock proteins in tomato leaves in response to heat shock
and pathogen infection [J]. Plant Sci., 2013, 207(1):57-65.
[7] ZHENG Y, HONG H, CHEN L, et al .. LeMAPK1, LeMAPK2,
and LeMAPK3 are associated with nitric oxide-induced defense
response against Botrytis cinerea in the Lycopersicon esculentum
fruit [J]. J. Agric. Food Chem., 2014, 62(6):1390-1396.
[8] NOORBAKHSH Z, TAHERI P. Nitric oxide: a signaling
molecule which activates cell wall-associated defense of tomato
against Rhizoctonia solani [J]. Eur. J. Plant Pathol., 2016, 144
(3):551-568.
[9] SIVAKUMARAN A, AKINYEMI A, MANDON J, et al .. ABA
suppresses botrytis cinerea elicited NO production in tomato to
influence H2O2 generation and increase host susceptibility [J/OL].
Front. Plant Sci., 2016, 7: 709 [2023-07-20]. https://doi. org/
10.3389/fpls.2016.00709.
[10] MAŁOLEPSZA U, RÓZALSKA S. Nitric oxide and hydrogen
peroxide in tomato resistance. nitric oxide modulates hydrogen
peroxide level in o-hydroxyethylorutin-induced resistance to
Botrytis cinerea in tomato [J]. Plant Physiol. Biochem., 2005,
43(6):623-635.
[11] DELLEDONNE M, ZEIER J, MAROCCO A, et al .. Signal
interactions between nitric oxide and reactive oxygen
intermediates in the plant hypersensitive disease resistance
response [J]. Proc. Natl. Acad. Sci. USA, 2001, 98(23):13454-
13459.
[12] ROMERO-PUERTAS M C, LAXA M, MATTÈ A, et al .. Snitrosylation
of peroxiredoxin II E promotes peroxynitrite-
mediated tyrosine nitration [J]. Plant Cell, 2007, 19(12):4120-
4130.
[13] DELLEDONNE M. NO news is good news for plants [J]. Curr.
Opin. Plant Biol., 2005, 8(4):390-396.
[14] 胡炎.东南景天对镉胁迫的响应和镉再转运的生理与分子
机制[D].杭州:浙江大学,2019.
HU Y. Physiological and molecular responses and cadmium
retranslocation in sedum alfredii under cadmium stress [D].
Hangzhou: Zhejiang Uniiversity, 2019.
[15] KENNETH J L, THOMAS D S. Analysis of relative gene
expression data using real-time quantitative PCR and thg 2-ΔΔCT
method [J]. Method, 2001, 25(4): 402-408.
[16] CHOE S, CHOI B, KANG J H, et al .. Tolerance to tomato
yellow leaf curl virus in transgenic tomato overexpressing a
cellulose synthase-like gene [J]. Plant Biotechnol. J., 2021, 19(4):
657-659.
[17] ALI S, HUANG Z, LI H, et al .. Antioxidant enzyme influences
germination, stress tolerance, and virulence of Isaria
fumosorosea [J]. J. Basic Microbiol., 2013, 53(6):489-497.
[18] HAO Q, ZHANG L, YANG Y, et al .. Genome-wide analysis of
the WOX gene family and function exploration of GmWOX18 in
soybean [J/OL]. Plants (Basel), 2019, 8(7): 8070215 [2023-07-
20]. https://doi.org/10.3390/plants8070215.
[19] YU W, KONG G, CHAO J, et al .. Genome-wide identification
of the rubber tree superoxide dismutase (SOD) gene family and
analysis of its expression under abiotic stress [J/OL]. PeerJ,
2022, 10: 14251 [2023-07-20]. https://doi.org/10.7717/peerj.14251.
[20] ZHANG Y, ZHENG L, YUN L, et al .. Catalase (CAT) gene
family in wheat (Triticum aestivum L.): evolution, expression
pattern and function analysis [J/OL]. Int. J. Mol. Sci., 2022, 23
(1):542 [2023-07-20]. https://doi.org/10.3390/ijms23010542.
[21] 刘放.不同番茄材料黄化曲叶病毒病抗性研究[D].兰州:甘
肃农业大学,2020.
LIU F. Study on resistance to yellow leaf curl virus disease in
different tomato materials [D]. Lanzhou: Gansu Agricultural
University, 2020.
[22] 韦弟,韦莉萍,周维,等.香蕉枯萎病菌对不同抗性香蕉品种
根系抗氧化能力的影响[J].南方农业学报,2021,52(7):1851-
1859.
WEI D, WEI L P, ZHOU W, et al .. Effects of Fusarium
oxysporum f. sp. cubense on antioxidant capacity in roots of
different resistant banana varieties [J]. J. Southern Agric.,
2021, 52(7):1851-1859.
[23] 丁玉梅,张杰,谢俊俊,等. 枯萎病菌胁迫下3 种黑籽南瓜
HQRGA2 表达及抗氧化酶活性差异分析[J].植物生理学报,
2019,55(3):349-358.
DING Y M, ZHANG J, XIE J J, et al .. Expression analysis of
HQRGA2 and differences of anti-oxidant enzymes in three
varieties of Cucurbita ficifolia under stress of Fusarium
oxysporum f. sp. Cucumerinum [J]. Plant Physiol. J., 2019, 55(3):
349-358.
[24] SHANG S, TANG Y, DAI J, et al .. Genomic analysis of the
principal members of antioxidant enzymes in simulated
stresses response and postharvest physiological deterioration in
Cassava [J]. Trop. Plant Biol., 2021,14(1):419-428.
[25] JIANG M, MIAO L X, HE C. Overexpression of an oil radish
superoxide dismutase gene in broccoli confers resistance to
downy mildew [J]. Plant Mol. Biol. Rep., 2012,30(1):966-972.
[26] MHAMDI A, NOCTOR G, BAKER A. Plant catalases:
peroxisomal redox guardians [J]. Arch. Biochem. Biophys.,
2012,525(2):181-194.
[27] 张志刚.大白菜抗芜菁花叶病毒(TuMV)遗传规律及过氧化
氢等保护酶与抗病性关系的研究[D].泰安:山东农业大学,
2011.
ZHANG Z G. Studies on Inheritance of TuMV resistance of
Chinese cabbage and the relationship between protective
enzymes and TuMV resistance [D]. Tai’an: Shandong Agricultural
University, 2011.
[28] 赵晓菊,张丽霞,满秀玲.NO对盐胁迫下长春花种子萌发和
幼苗生理代谢的影响[J].植物研究,2018,38(5):669-674,681.
ZHAO X J, ZHANG L X, MAN X L. Effects of exogenous NO
on seed germination and physiological metabolism in
Catharanthus roseus seedling under NaCl stress [J]. Bull. Bot.
Res., 2018, 38(5):669-674,681.
[29] SHI H T, LI R J, CAI W, et al .. In vivo role of nitric oxide in
plant response to abiotic and biotic stress [J]. Plant Signaling
Behav., 2012, 7(3):437-439.
[30] WANG X, WANG B, ZHU X, et al .. Exogenous nitric oxide
alleviates the damage caused by tomato yellow leaf curl virus
in tomato through regulation of peptidase inhibitor genes [J/OL].
Int. J. Mol. Sci., 2022, 23(20):12542 [2023-07-20]. https://doi.
org/10.3390/ijms232012542.
[31] CHOE S, CHOI B, KANG J H, et al .. Tolerance to tomato
yellow leaf curl virus in transgenic tomato overexpressing a
cellulose synthase-like gene [J]. Plant Biotechnol. J., 2021, 19(4):
657-659.
[32] LI Y, CAO X L, ZHU Y, et al .. Osa-miR398b boosts H2O2
production and rice blast disease-resistance via multiple
superoxide dismutases [J]. New Phytol., 2019, 222(3):1507-1522.
[33] 于力,郭世荣,朱为民,等.番茄黄化曲叶病毒对番茄叶片光
合特性和叶绿体超微结构的影响[J].西北植物学报,2011,
31(7):1355-1359.
YU L, GUO S R, ZHU W M, et al .. Effects of tomato yellow leaf
curl virus on photosynthetic characteristics and chloroplast
ultra-structure of the tomato leaves [J]. Acta Bot. Bor-Occid.
Sin., 2011, 31(7):1355-1359.
[34] 张永平,朱为民.TYLCV侵染对番茄叶片解剖结构和保护酶
系统的影响[J].安徽农业科学,2009,37(29):14188-14190.
ZHANG Y P, ZHU W M. The effects of TYLCV infection on
leaf anatomical structure and protective enzyme system of
tomato [J]. J. Anhui Agric. Sci., 2009, 37(29):14188-14190.
[35] 许培磊,杨义明,秦红艳,等.不同品种山葡萄接种霜霉病菌
后叶片的超微结构与抗氧化酶活性变化[J]. 北方园艺,
2018(17):45-54.
XU P L, YANG Y M, QIN H Y, et al .. Changes of
ultrastructure and antioxidant enzyme in leaves of two cultivars
of Vitis amurensis in response to downy mildew [J]. Northern
Hortic., 2018 (17):45-54.
