高良姜素对膝关节炎大鼠软骨细胞自噬和凋亡的影响
2025-02-15杨青黄伟刘清毅周仲瑜



关键词高良姜素;膝关节炎;软骨细胞;自噬;凋亡;AMPK/mTOR/ULK1信号通路
膝关节炎(kneeosteoarthritis,KOA)是临床上常见的一种慢性退行性疾病,以关节疼痛、畸形和功能障碍为特征,其进展缓慢,最终因疼痛和关节运动受损而导致患者活动能力丧失[1]。我国KOA的患病率为25.51%,且随着人口老龄化加剧和平均预期寿命延长,KOA的患病率将进一步上升[2]。目前,KOA患者的治疗以口服非甾体抗炎药为主,严重者需要进行全关节置换术来恢复关节功能;然而,药物只能暂时缓解症状,而手术是一种危险且昂贵的选择,效果有限[3],加之学界对KOA的病因认识有限,因此有必要进一步阐明该病的生理病理,并开发新的治疗手段。
在细胞饥饿状态下,腺苷一磷酸活化的蛋白质激酶(adenosinemonophosphate-activatedproteinkinase,AMPK)可通过抑制哺乳动物雷帕霉素靶蛋白(mammaliantargetofrapamycin,mTOR)来激活UNC-51样激酶1(UNC-51-likekinase1,ULK1),从而触发软骨细胞自噬抑制细胞凋亡,参与调控KOA的疾病进展[4]。高良姜素(galangin,GLA)是一种重要的具有天然活性的类黄酮,具有抗炎、抗菌、抗氧化应激、抗纤维化、抗高血压等生物活性,对类风湿性关节炎、骨关节炎(osteoarthritis,OA)、骨质疏松症等疾病具有较好的疗效[5]。相关研究显示,GLA可通过调控AMPK/mTOR信号通路,促进细胞自噬,抑制细胞凋亡,从而减轻镉诱导的肾毒性[6]。然而,GLA在KOA中的作用机制尚不清楚。基于此,本研究通过探讨GLA调节AMPK/mTOR/ULK1信号通路对KOA大鼠软骨细胞自噬和凋亡的影响,以期为KOA的临床治疗提供参考。
1 材料
1.1 主要仪器
TalosF200XS型透射电子显微镜(transmissionelectronmicroscope,TEM)购自北京欧波同光学技术有限公司;MACSQuant®VYB型流式细胞仪购自德国美天旎生物技术有限公司;LK-YG96型倒置显微镜购自天津徕科光学仪器有限公司;SH-523型凝胶成像系统购自杭州申花科技有限公司。
1.2 主要试剂与仪器
GLA对照品(批号ES-1114S,纯度≥99%)购自上海玉博生物科技有限公司;AMPK抑制剂CompoundC对照品(批号orb1909567,纯度≥98%)购自武汉博欧特生物科技有限公司;苏木素-伊红(HE)染色试剂盒(批号G1120-10)购自北京祥生兴业科技有限公司;基质金属蛋白酶13(matrixmetalloproteinase13,MMP-13)、白细胞介素1β(interleukin-1β,IL-1β)酶联免疫吸附测定(ELISA)试剂盒(批号分别为F16182、F15810)购自上海西唐生物科技有限公司;自噬检测试剂盒(批号A486454)购自上海阿拉丁生化科技股份有限公司;AnnexinⅤ-FITC/PI凋亡检测试剂盒(批号JC-A80300)购自上海机纯实业有限公司;BCA蛋白定量试剂盒、ECL试剂盒(批号分别为KL-X126、KL-X122)购自上海康朗生物科技有限公司;兔源β-肌动蛋白(β-actin)、磷酸化AMPK(phosphorylatedAMPK,p-AMPK)、AMPK、磷酸化mTOR(phosphorylatedmTOR,p-mTOR)、mTOR、磷酸化ULK1(phosphorylatedULK1,p-ULK1)、ULK1抗体和辣根过氧化物酶标记的山羊抗兔二抗(批号分别为ab181095、ab68206、ab271188、ab137133、ab32028、ab133766、ab177472、ab6721)购自英国Abcam公司。
1.3 实验动物
本研究所用动物为雄性SD大鼠,体重250~300g,购于武汉有度生物科技有限公司,动物生产许可证号为SCXK(鄂)2021-0025。所有大鼠均置于温度24℃、湿度55%、12h光/暗循环的环境中自由进食和饮水。本实验经武汉有度生物科技有限公司动物伦理委员会审批(批件号2242930)。
2 方法
2.1 动物造模、分组与给药
将56只大鼠采用0.3%戊巴比妥钠腹腔注射麻醉,于右后肢膝关节腔内侧切口后暴露关节腔,之后横切前交叉韧带,切除内侧半月板,然后将髌骨复位,缝合内侧囊切口,闭合皮肤。6周后,对大鼠进行X射线检查,若显示关节面粗糙变形,边缘有明显骨赘,内侧间隙变窄,软骨下骨的骨密度明显增高,则说明KOA模型构建成功[7]。另选择10只正常饲养的大鼠打开关节腔,但保持半月板完整,作为假手术组(即Sham组)。
将建模成功的大鼠分为模型组(即KOA组),GLA低、中、高剂量组(即L-GLA、M-GLA、H-GLA组,皮下注射100、200、400μg/kg的GLA[8],临用时以二甲基亚砜溶解),GLA+CompoundC组(皮下注射400μg/kg的GLA+0.2mg/kg的AMPK抑制剂CompoundC[9]),每组10只。各给药组皮下注射相应药液,Sham组和KOA组大鼠注射等量的生理盐水,每天1次,连续给药21d。
2.2 大鼠膝关节肿胀程度检测
于给药第7、21天时,采用游标卡尺测量大鼠左右膝关节直径,计算右膝关节肿胀度(即右膝关节直径与左膝关节直径的差值)。
2.3 样品采集
测量完大鼠左右膝关节直径后,各组大鼠以颈椎脱臼法处死,于眼眶采集全血标本,分离血清,保存于-80℃。将右后肢膝关节软骨组织分成两部分:一部分置于10%多聚甲醛中固定,用于病理学观察;另一部分保存于-80℃,备用。
2.4 大鼠血清中MMP-13、IL-1β水平检测
采用ELISA法检测。取“2.3”项下血清样品,按试剂盒说明书方法操作,采用酶标仪于450nm波长处测定吸光度,并绘制MMP-13、IL-1β的标准曲线,然后计算大鼠血清中MMP-13、IL-1β水平。
2.5 大鼠膝关节软骨组织病理学特征观察
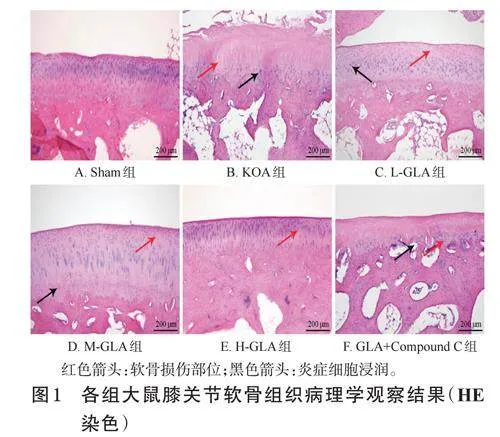
取“2.3”项下固定的膝关节软骨组织适量,用水冲洗30min,在乙二胺四乙酸中室温脱钙4~6周,每周更换脱钙液,然后用水冲洗30min,用不同浓度的乙醇(50%~100%)脱水,再以二甲苯透明,经石蜡包埋后制成5μm切片;切片经苏木素染色10min,再以伊红染色3~5min,然后在显微镜下观察其病理学特征。
2.6 大鼠软骨细胞自噬观察
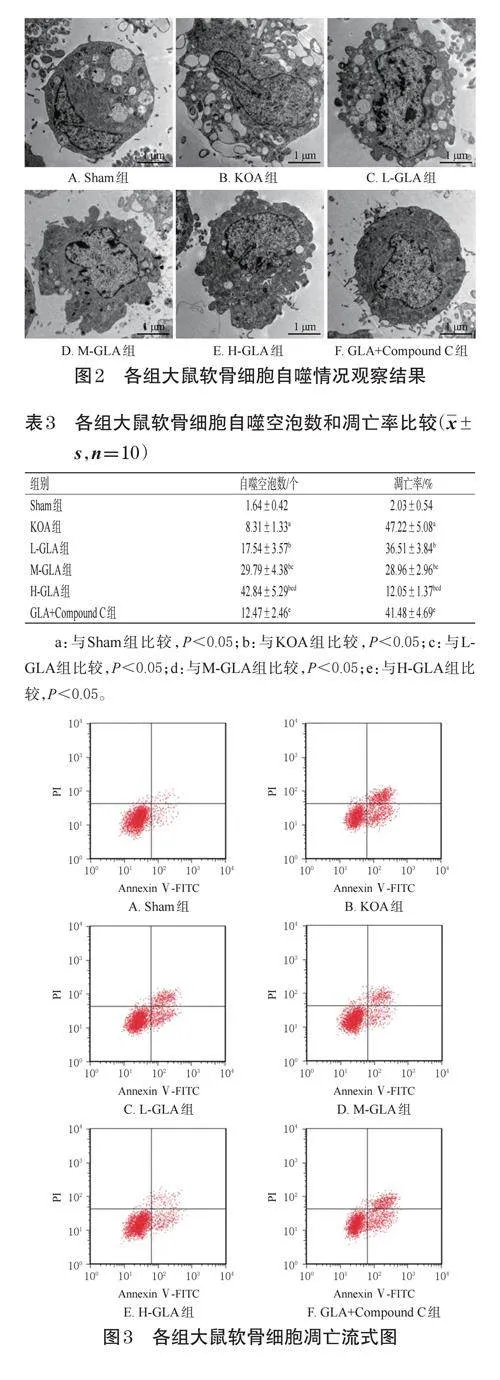
取“2.3”项下冻存的膝关节软骨组织适量,修剪为1mm×1mm×1mm大小,在四氧化锇(1%)中固定3h,经脱水、包埋后,切成70nm厚的薄片,再以柠檬酸铅、醋酸铀进行双重染色,然后采用TEM观察,并统计自噬空泡数。
2.7 大鼠软骨细胞凋亡检测
取“2.3”项下冻存的膝关节软骨组织适量,用0.25%胰蛋白酶消化10min,加入500μL结合缓冲液重悬,再加入5μLAnnexinⅤ-FITC试剂和5μL碘化丙啶(PI),室温下黑暗反应15min,采用流式细胞仪检测软骨细胞凋亡情况,并计算凋亡率(凋亡率=凋亡细胞数/总细胞数×100%)。
2.8 大鼠膝关节软骨组织中AMPK/mTOR/ULK1信号通路相关蛋白表达检测
采用Westernblot法检测。取“2.3”项下冻存的膝关节软骨组织适量,用RIPA裂解液裂解,提取总蛋白,采用BCA试剂盒检测上清液中的蛋白浓度。蛋白经变性处理后,取50μg至10%十二烷基硫酸钠凝胶上,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。将分离的样品转移到PVDF膜上,用含5%脱脂奶粉的TBST在室温下阻断1h,加入β-actin(稀释度为1∶1000)、p-AMPK(稀释度为1∶2000)、AMPK(稀释度为1∶1000)、p-mTOR(稀释度为1∶1000)、mTOR(稀释度为1∶1000)、p-ULK1(稀释度为1∶1000)、ULK1(稀释度为1∶10000)一抗在4℃下孵育过夜;用TBST洗涤10min,加入二抗(稀释度为1∶5000)在室温下孵育1h,使用ECL试剂盒进行显色、成像。使用ImageJ软件进行分析,以β-actin为内参进行归一化,以p-AMPK与AMPK、p-mTOR与mTOR、p-ULK1与ULK1的比值表示AMPK、mTOR、ULK1的磷酸化水平。
2.9 统计学方法
采用SPSS26.0软件对数据进行统计分析。符合正态分布的计量资料以x±s表示,组间比较用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 GLA对KOA大鼠膝关节肿胀程度的影响
GLA处理7、21d后,KOA组大鼠膝关节肿胀程度均显著高于Sham组(P<0.05);L-GLA、M-GLA、H-GLA组大鼠膝关节肿胀程度均显著低于KOA组,且具有剂量依赖性(P<0.05);GLA+CompoundC组大鼠膝关节肿胀程度显著高于H-GLA组(P<0.05)。结果见表1。
3.2 GLA对KOA大鼠血清中MMP-13、IL-1β水平的影响
KOA组大鼠血清中MMP-13、IL-1β水平均显著高于Sham组(P<0.05);L-GLA、M-GLA、H-GLA组大鼠血清中MMP-13、IL-1β水平均显著低于KOA组,且具有剂量依赖性(P<0.05);GLA+CompoundC组大鼠血清中MMP-13、IL-1β水平均显著高于H-GLA组(P<0.05)。结果见表2。
3.3 GLA对KOA大鼠膝关节软骨组织病理学的影响
Sham组大鼠膝关节软骨细胞排列整齐、形态规则,组织结构完整,无炎症细胞浸润;KOA组大鼠膝关节软骨细胞排列紊乱,细胞核固缩,关节软骨层纤维化严重,伴有大量炎症细胞浸润;与KOA组相比,L-GLA、MGLA、H-GLA组大鼠膝关节软骨损伤得到明显改善,炎症细胞浸润减轻,且呈现剂量依赖趋势;与H-GLA组相比,GLA+CompoundC组大鼠膝关节软骨损伤加重,炎症细胞浸润加重。结果见图1。
3.4 GLA对KOA大鼠软骨细胞自噬的影响
KOA组大鼠软骨细胞自噬空泡数显著高于Sham组(P<0.05);L-GLA、M-GLA、H-GLA组大鼠软骨细胞自噬空泡数显著高于KOA组,且具有剂量依赖性(P<0.05);GLA+CompoundC组大鼠软骨细胞自噬空泡数显著低于H-GLA组(P<0.05)。结果见图2、表3。
3.5 GLA对KOA大鼠软骨细胞凋亡的影响
KOA组大鼠软骨细胞凋亡率显著高于Sham组(P<0.05);L-GLA、M-GLA、H-GLA组大鼠软骨细胞凋亡率显著低于KOA组(P<0.05),且具有剂量依赖性(P<0.05);GLA+CompoundC组大鼠软骨细胞凋亡率显著高于H-GLA组(P<0.05)。结果见表3、图3。
3.6 GLA对KOA大鼠膝关节组织中AMPK/mTOR/ULK1信号通路相关蛋白表达的影响
KOA组大鼠膝关节组织中AMPK、ULK1蛋白的磷酸化水平均显著低于Sham组,mTOR蛋白的磷酸化水平显著高于Sham组(P<0.05);L-GLA、M-GLA、H-GLA组大鼠膝关节组织中AMPK、ULK1蛋白的磷酸化水平均显著高于KOA组,mTOR蛋白的磷酸化水平显著低于KOA组(P<0.05),且具有剂量依赖性(P<0.05);GLA+CompoundC组大鼠膝关节组织中AMPK、ULK1蛋白的磷酸化水平均显著低于H-GLA组,mTOR蛋白磷酸化水平显著高于H-GLA组(P<0.05)。结果见图4、表4。
4 讨论
OA是全球致残疾病的主要原因,临床上膝关节是最常见的OA部位[10]。KOA的发病机制复杂,包括机械负荷、炎症、代谢改变、细胞衰老等,这些因素共同导致滑膜关节的结构恶化和功能衰竭,其中炎症反应在KOA的发展中起着至关重要的作用[2]。关节损伤会导致无菌性炎症,而高水平的炎症因子,如MMP-13、IL-1β等,可增强破骨细胞分化,导致软骨细胞凋亡和软骨退变[11]。自噬是一种重要的细胞功能,可通过降解冗余或受损的蛋白质和细胞器来保护细胞免于凋亡。在KOA的进展过程中,软骨细胞的自噬活性存在缺陷,导致细胞凋亡增加,从而加剧KOA的病理进程[12]。因此,探讨KOA软骨细胞自噬和凋亡相关的分子机制,对寻找新的治疗靶点和药物至关重要。本研究构建KOA大鼠模型后发现,大鼠关节肿胀、炎症因子表达升高,软骨细胞自噬空泡数、凋亡率增加,关节软骨细胞排列紊乱,且伴有大量炎症细胞浸润,说明KOA伴随着明显的炎症反应,存在细胞自噬和细胞凋亡,表现出膝关节自噬损伤。
研究发现,提取自中药高良姜根部的GLA可以调控软骨细胞,参与OA的进展[13]。相关研究显示,GLA可通过抑制氧化应激,减弱软骨细胞外基质降解,从而改善OA进展[14]。此外,有研究表明,GLA在体外可抑制IL-1β诱导的炎症反应,在体内可改善软骨退行性变化,可作为治疗OA的潜在新药物[15]。GLA还可在体内抑制类风湿性关节炎的发展,可作为治疗类风湿性关节炎的潜在新药物[16]。本研究结果显示,GLA可促进大鼠软骨细胞自噬,抑制细胞凋亡和炎症反应,减轻软骨细胞的炎症浸润。这提示GLA可能通过抑制炎症反应,促进软骨细胞自噬,抑制细胞凋亡,进而减轻KOA组织损伤。
研究表明,AMPK/mTOR/ULK1信号通路在自噬和凋亡中具有重要作用:AMPK可直接磷酸化mTOR,导致mTOR活性下调;还可通过调节ULK1泛素化,促进细胞自噬,抑制细胞凋亡[17]。Xiao等[18]研究发现,基烯醇可以通过调控AMPK/mTOR/ULK1信号通路,促进急性肺损伤细胞自噬,减轻脂多糖诱导的肺部炎症和白细胞浸润。吴伟欣等[19]研究发现,龟鹿二仙胶可通过调控AMPK/mTOR/ULK1信号通路诱导自噬,减少软骨细胞凋亡,对KOA具有较好的治疗效果。蔡猛等[20]研究发现,牛蒡子苷元可激活AMPK/ULK1信号通路,促进OA细胞自噬,抑制软骨细胞焦亡,减轻关节软骨组织损伤。本研究结果显示,KOA组大鼠膝关节组织中AMPK、ULK1蛋白的磷酸化水平均低于Sham组,mTOR蛋白的磷酸化水平高于Sham组,这提示AMPK/mTOR/ULK1信号通路被抑制,可能是KOA发生的重要原因。经GLA干预后,AMPK、ULK1蛋白的磷酸化水平均高于KOA组,mTOR蛋白的磷酸化水平低于KOA组;进一步以AMPK抑制剂CompoundC干预后发现,其可逆转GLA对AMPK/mTOR/ULK1信号通路的激活作用。这提示,GLA可能通过激活AMPK/mTOR/ULK1信号通路,促进KOA大鼠软骨细胞自噬,抑制细胞凋亡,从而改善KOA组织损伤。
综上所述,GLA可促进KOA大鼠软骨细胞自噬,抑制细胞凋亡,其作用机制可能与激活AMPK/mTOR/ULK1信号通路有关。
