蒲公英总黄酮通过调控肠道菌群对小鼠肥胖的抑制作用机制
2025-02-15郜怡雪郭琳郎林艳吴静王浩阳杨静苗明三李占占




关键词蒲公英总黄酮;肥胖;肠道菌群;脂肪代谢
肥胖是以体重超重为特点,由体内脂肪细胞蓄积过甚引起的慢性疾病,同时伴随脂肪组织慢性炎症反应[1]。随着人们生活水平的提高,以脂质代谢异常为共同特征的相关代谢疾病(包括肥胖、糖尿病、心血管疾病、肝脏疾病、衰老等)发病率逐年升高,预计到2030年,我国成人超重及肥胖患病率将达到65.3%[2]。目前我国用于治疗肥胖的药物仅有奥利司他及胰高血糖素样肽1受体激动剂(利拉鲁肽),但伴随如呕吐、腹泻等副作用[3]。肥胖属中医“肥满”范畴,以腹部肥满、腰围增粗为主要表现,即《内经》所谓的“纵腹垂腴”,以健脾化湿为主要治法,并兼用行气解郁、清泻胃火、活血化瘀等治则[4]。临床实践显示,中医药防治肥胖具有多途径、多环节、多靶点的特点,且具有疗效确切、不良反应少等优势[5]。
蒲公英味苦而甘,入肝胃经,具有清热解毒、利尿、活血的功效。研究表明,其黄酮类成分对代谢综合征具有潜在的治疗作用[6]。有研究报道,肠道微生物尤其是菌群与肥胖之间关系密切,对机体的能量代谢紊乱及修复至关重要[7];菌群若失调,将通过增加肠黏膜通透性、诱导低水平慢性炎症反应等途径诱发肥胖[8]。因此,本研究初步探讨蒲公英总黄酮对小鼠饮食性肥胖的干预作用及其对小鼠肠道菌群的影响,探讨其可能的作用机制,以期为肥胖的治疗提供理论依据。
1 材料
1.1 主要仪器
680型酶标仪购自美国Bio-Rad公司;KDC-160HR型高速冷冻离心机购自科大创新股份有限公司中佳分公司;50TS8型洗板机购自美国BioTek公司;JXFSTPRP-48型研磨仪购自上海净信实业发展有限公司;AL204型电子天平购自瑞士MettlerToledo公司;NanoDropOne型超微量分光光度计、QuantStudioTM6Flex型实时荧光定量聚合酶链式反应(qPCR)仪、Arktik型梯度PCR仪均购自美国ThermoFisherScientific公司;PE300型NextSeq2000测序仪购自美国Illumina公司。
1.2 主要药物与试剂
蒲公英总黄酮(纯度50%)委托南京泽郎生物科技有限公司提取、制备;FastPureCell/TissueTotalRNAIsolationKitV2(批号7E760C3)购自南京诺唯赞生物科技股份有限公司;逆转录试剂盒、SYBRGreenqPCRMasterMix(批号分别为H1201881、H7327110)均购自上海翌圣生物科技股份有限公司;总胆固醇(totalcholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-densitylipoproteincholesterol,LDL-C)、高密度脂蛋白胆固醇(high-densitylipoproteincholesterol,HDL-C)试剂盒(批号分别为20240229、20240115、20240315、20240314)均购自南京建成生物工程研究所;粪便基因组DNA提取试剂盒(批号Y2023)购自天根生化科技(北京)有限公司;甘油醛-3-磷酸脱氢酶(GAPDH)、过氧化物酶体增殖物激活受体γ共激活剂1α(peroxisomeproliferatoractivatedreceptorgammacoactivator1alpha,Ppargc1α)、乙酰辅酶A羧化酶1(acetyl-CoAcarboxylase,ACC1)、细胞色素c氧化酶亚基7A1(cytochromecoxidasesubunit7A1,COX7A1)、COX8B引物由北京睿博兴科生物技术有限公司设计、合成。
1.3 实验动物与饲料
6周龄SPF级雄性C57BL/6J小鼠24只,体重20~22g,购自济南朋悦实验动物繁育有限公司[生产许可证号为SCXK(鲁)20230002],饲养于河南中医药大学动物实验中心(室温20~25℃,相对湿度50%~70%,每12h光照/黑暗循环),自由进食、饮水。高脂饲料(含60%脂肪,批号D12492)购自江苏省协同医药生物工程有限责任公司;普通饲料(批号20230815)购自济南朋悦实验动物繁育有限公司。本研究方案经河南中医药大学实验动物福利伦理委员会审查和批准(伦理号为IACUC-202312030)。
2 方法
2.1 分组、造模与给药
小鼠适应性喂养1周后,随机分为空白组、模型组(生理盐水,0.2mL/只)、蒲公英总黄酮组[400mg/(kg·d),0.2mL/只,根据蒲公英中药材给药剂量结合小鼠体表面积折算],每组8只。除空白组外,其余两组小鼠给予高脂饲料喂养持续造模8周。与此同时,蒲公英总黄酮组小鼠灌胃相应药液,空白组和模型组灌胃生理盐水,每天1次,连续8周。每周监测各组小鼠表观和体重变化,并记录每周前后其食物质量变化,即进食量。若监测到模型组小鼠较空白组小鼠体重平均值增加20%以上,判断为模型构建成功[8]。
2.2 实验取材
末次给药后,留取小鼠粪便,置于冻存管中,于-80℃下冻存,备测;留取小鼠眼球血,置于1.5mL离心管中,于2~8℃下静置2h后,于4℃下以3500r/min离心15min,吸取上层血清,于-40℃下保存,备测;取少量肝脏组织,一部分置于4%多聚甲醛溶液中固定,备测,另一部分于-80℃下冻存,备测;取皮下腹股沟白色脂肪组织(inguinalwhiteadiposetissue,iWAT)、附睾白色脂肪组织(epididymalwhiteadiposetissue,eWAT)、肾周白色脂肪组织(perirenalwhiteadiposetissue,pWAT),称定并记录质量,然后将一部分eWAT置于4%多聚甲醛溶液中固定,其余脂肪组织于-80℃下冻存,备测。
2.3 小鼠脂肪指数的测定
观察各组小鼠iWAT、eWAT、pWAT大小、厚度和颜色,称定质量并按下式计算脂肪指数:脂肪指数=脂肪质量/小鼠体重。
2.4 小鼠血清血脂水平检测
取“2.2”项下小鼠血清样本,根据相应试剂盒说明书操作,使用酶标仪测定各组小鼠血清中TC、TG、LDL-C、HDL-C水平。
2.5 小鼠肝脏和脂肪组织病理形态观察
取“2.2”项下固定的小鼠肝脏组织和eWAT,采用苏木精-伊红(HE)染色,置于显微镜下观察小鼠上述组织的病理形态变化,并拍照。
2.6 小鼠肠道菌群分析
取“2.2”项下各组小鼠粪便样本,使用粪便基因组DNA提取试剂盒从小鼠粪便样本中提取细菌DNA。采用16SrRNA(V3~V4)扩增子测序方法,使用测序仪分析小鼠肠道菌群的丰度及多样性。采用QIIME平台对序列进行生物信息学分析,其中序列同源性高于97%的序列归属于相同的操作性分类单元(operationaltaxonomicunit,OTU),基于Greengenes数据库(http://greengenes.secondgenome.com/)的选择策略选择OTU表。采用Shannon和Sobs指数代表微生物中物种的α多样性,采用线性判别分析(lineardiscriminantanalysis,LDA),以LDA评分绝对值≥3.0作为标准,鉴别发挥潜在作用的关键细菌。基于美吉生物云平台(https://www.majorbio.com/)分析肠道微生物组健康指数(gutmicrobiomehealthindex,GMHI),该值侧重确定患病的可能性,独立于临床诊断,用以评估健康状况。根据未加权的UniFrac距离,采用QIIME平台进行主坐标分析用以展示微生物中物种的β多样性。
2.7 小鼠肝脏脂肪代谢相关基因表达的检测
取“2.2”项下各组小鼠冻存的肝脏组织,称取20mg,提取总RNA。根据逆转录试剂盒说明书将RNA转录为cDNA。以cDNA为模板进行qPCR扩增。反应体系包括:SYBRGreen混合液5μL、cDNA样品1μL、正向引物0.2μL、反向引物0.2μL,加水至10μL。扩增条件如下:95℃预变性2min;95℃变性10s,60℃退火30s,共循环40次。以GAPDH为内参,采用2-ΔΔCt法计算与脂肪合成与分解相关基因[9]的mRNA表达水平。引物序列及产物长度见表1。
2.8 统计学方法
采用SPSS23.0软件对数据进行统计分析,并使用GraphPadPrism9.5软件制图。满足正态分布的计量资料以x±s表示,多组间比较采用方差分析,进一步两两比较使用LSD-t检验。肠道菌群相关分析中,α、β多样性以及菌群健康指数的分析组间比较采用Wilcoxon秩和检验。检验水准α=0.05。
3 结果
3.1 蒲公英总黄酮对小鼠表观变化的影响
在造模第4周时,模型组小鼠体重平均值增加20%以上,说明造模成功。空白组小鼠体态正常,活泼好动。与空白组比较,模型组小鼠体态宽胖,毛发油腻,身体倦怠少动。与模型组比较,蒲公英总黄酮组小鼠体重降低,活动较为灵活,被毛油脂明显减少。
3.2 蒲公英总黄酮对小鼠体重、进食量和脂肪质量的影响
实验期间,小鼠体重由高到低为模型组>蒲公英总黄酮组>空白组,见图1A;体重上涨速率由高到低为模型组>蒲公英总黄酮组>空白组,见图1B。蒲公英总黄酮组小鼠的进食量与模型组比较,差异无统计学意义(P>0.05),见图1C。与模型组比较,蒲公英总黄酮组小鼠iWAT、eWAT的脂肪指数显著降低(P<0.05),见图1D。
3.3 蒲公英总黄酮对小鼠血脂水平的影响
与空白组比较,模型组小鼠血清TC、TG、LDL-C水平均显著升高,HDL-C水平显著降低(P<0.01);与模型组比较,蒲公英总黄酮组小鼠血清TC、TG、LDL-C水平均显著降低,HDL-C水平显著升高(P<0.01)。结果见表2。
3.4 蒲公英总黄酮对小鼠肝脏和脂肪组织病理变化的影响
小鼠肝脏组织病理切片结果显示,空白组小鼠肝细胞未见任何病理改变;与空白组比较,模型组小鼠肝脏可见大量肝细胞脂肪空泡变性;与模型组比较,蒲公英总黄酮组小鼠肝细胞脂肪空泡变性程度明显减轻,仅少量肝细胞存在空泡变性。结果见图2。
小鼠eWAT病理切片结果显示,空白组小鼠附睾脂肪细胞大小均匀,分布密集;与空白组比较,模型组小鼠附睾脂肪细胞数量减少,脂肪细胞直径大小和横截面积增加;蒲公英总黄酮组小鼠附睾脂肪细胞数量仍较空白组少,但脂肪细胞直径较模型组变小。结果见图2。
3.5 蒲公英总黄酮对小鼠肠道菌群的影响
3.5.1 肠道菌群OTUs数与多样性
肠道菌群分析结果显示,3组小鼠粪便样品共有OTUs378个,其中空白组与模型组小鼠共有59个,空白组与蒲公英总黄酮组小鼠共有55个,模型组与蒲公英总黄酮组小鼠共有338个。α多样性分析结果显示,蒲公英总黄酮处理后,蒲公英总黄酮组菌群多样性有上升趋势,Shannon指数与模型组比较差异无统计学意义(P>0.05),Sobs指数则较模型组显著升高(P<0.05),见图3A~3B。β多样性分析结果显示,蒲公英总黄酮组和模型组分为2个较为明显的不同簇,β多样性差异有统计学意义(P<0.05),提示2组小鼠肠道菌群结构有明显差异,见图3C。小鼠健康状况评估结果显示,蒲公英总黄酮组GMHI显著高于模型组(P<0.01),见图3D。
3.5.2 肠道菌群组成与相对丰度
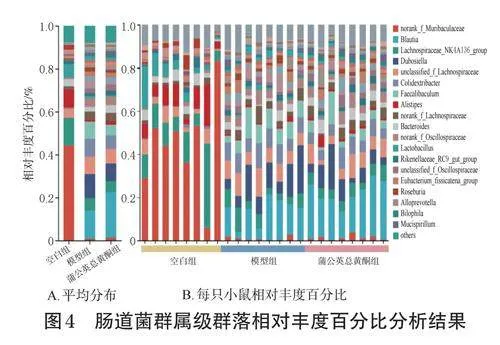
与空白组比较,模型组和蒲公英总黄酮组的Blautia(经黏液真杆菌属)、Dubosiella(杜氏菌属)、Colidextribacter、Faecalibaclum(粪杆菌属)、norank_f_OscillospiraOscillospiraceae的相对丰度升高,norank_f_MuLachnospiraceae_NK4A136_group(毛螺菌科NK4A136组)、Bacteroides(拟杆菌属)、Alistipes(另枝菌属)的相对丰度降低。与模型组比较,蒲公英总黄酮组的经黏液真杆菌属、拟杆菌属、另枝菌属、unclassified_f_Oscillospiraceae及Rikenella(理研菌属)的相对丰度升高,杜氏菌属、Colidextribacter、粪杆菌属、Roseburia(罗氏菌属)及Lactobacillus(乳杆菌属)的相对丰度下降。结果见图4。
3.5.3 肠道差异菌群种属水平
在属水平对模型组和蒲公英总黄酮组进行差异菌群筛选。结果显示,在属水平上,经黏液真杆菌属、norank_f_Ruminococcaceae、Bilophila(嗜胆菌属)、另枝菌属、classified_f_Ruminococcaceae、Parabacteroides(副拟杆菌属)、norank_f_Desulfovibrionaceae、Anaerotruncus(厌氧短杆菌属)的菌群相对丰度显著升高(P<0.05),粪杆菌属、Erysipelatoclostridium(丹毒梭菌属)、GCA-900066575、Tuzzerella(梭菌属)、乳杆菌属、norank_f_norank_o_RF39、achnospiraceae_FCS020_group的菌群相对丰度显著下降(P<0.05),见图5。在种水平上,将是否有培养方法作为筛选标准,Lachnospiraceae_bacterium_28-4(毛螺菌属28-4),Bacteroides_vulgatus(普通拟杆菌)菌群相对丰度显著升高(P<0.05),Faecalibaculum_rodentium(啮齿粪杆菌)、Lactobacillus_murinus(鼠乳杆菌)的相对丰度显著下降(P<0.05),见图6。
3.6 蒲公英总黄酮对小鼠脂肪代谢相关基因的影响
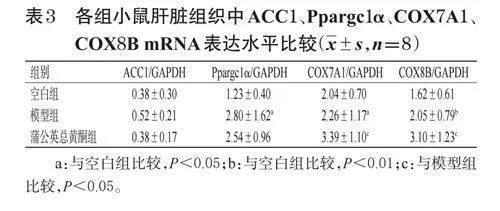
与空白组比较,模型组小鼠肝脏组织中Ppargc1α、COX7A1、COX8BmRNA表达水平显著升高(P<0.05或P<0.01);与模型组比较,蒲公英总黄酮组小鼠肝脏组织中COX7A1、COX8BmRNA表达水平均显著升高(P<0.05)。结果见表3。
4 讨论
4.1 蒲公英总黄酮可降低肥胖小鼠肝脏脂肪量
相关研究表明,植物黄酮类成分在肥胖的治疗中发挥了巨大的作用,如多甲氧基黄酮可能通过调节脂肪因子的水平和干预肠道微生物及其代谢产物等途径,增强胰岛素活性,改善胰岛稳态,调节机体糖脂代谢[10];高粱米糠黄酮可以抑制肥胖小鼠体内脂质蓄积,并显著改善高血糖、胰岛素抵抗及瘦素抵抗[11];大豆异黄酮[12]、青钱柳黄酮[13]、胡柚黄酮[14]等均对肥胖具有良好的治疗作用。肥胖常伴随脂肪在组织中的积累(异位脂肪沉积在肝脏、心脏、骨骼肌等),继而导致高脂血症、糖尿病、心血管疾病等[15]。高脂血症的特征是血清中TC、TG、LDL-C水平升高,HDL-C水平降低[16]。据报道,正常水平范围的LDL-C与HDL-C共同作用,可以调节体内胆固醇含量,降低心血管疾病风险[17]。本研究通过高脂饮食建立肥胖小鼠模型,探讨了蒲公英总黄酮对肥胖小鼠脂质代谢的影响,结果显示,给予蒲公英总黄酮干预可以逆转肥胖小鼠肝细胞脂肪变性,恢复脂肪细胞的健康状态,显著降低小鼠血清TC、TG、LDL-C水平,提高血清HDL-C水平,说明蒲公英总黄酮对血脂水平具有调节作用,能够改善肥胖小鼠的高脂血症。
4.2 蒲公英总黄酮可调控小鼠肠道菌群结构
高脂饮食会导致肠道菌群多样性降低、菌群结构紊乱,伴随有益菌减少及致病菌增加。相关报道表明,肠道菌群在肥胖、胰岛素抵抗等代谢性疾病的发生和发展中起至关重要的作用[18]。本研究结果显示,蒲公英总黄酮能够缓解肥胖小鼠体重增加,降低iWAT和eWAT的脂肪指数,在治疗肥胖中具有潜在价值;蒲公英总黄酮还能够增加肥胖小鼠肠道菌群多样性,提高肠道菌群GMHI;在属水平上,蒲公英总黄酮上调黏液真杆菌属、另枝菌属、瘤胃球菌属、副拟杆菌属,下调粪杆菌属、丹毒梭菌属、梭菌属和乳杆菌属。研究表明,黏液真杆菌属与内脏脂肪呈负相关,而内脏脂肪被认为是发生心血管和代谢疾病风险的肥胖生物标志物[19]。Parker等[20]研究显示,另枝菌属与肝硬化、非酒精性脂肪性肝病或非酒精性脂肪性肝炎等肝性疾病呈负相关;Liao等[21]研究发现,啮齿类杆菌是一种在肥胖大鼠中容易富集的细菌;Luo等[22]研究发现,丹毒梭菌属在经过高脂饲料喂养过的小鼠肠道中显著上升,乳杆菌属中有部分菌株可能会导致体重增加,而其他菌株可能会导致体重减轻。本研究结果显示,蒲公英总黄酮可以调节有关肥胖治疗相关菌属的相对丰度,上调有益菌属,下调有害菌属。在种水平上,蒲公英总黄酮上调的毛螺菌属28-4是肥胖及肥胖抵抗组小鼠的关键菌种,与肥胖呈负相关[23];下调的啮齿粪杆菌是葡萄糖转运体1条件性基因敲除小鼠中的另一种富集微生物,虽然是短链脂肪酸产生者并且能发挥抗癌作用,但微生物的短链脂肪酸可能为宿主提供额外的能量进而促进肥胖[24]。由此可知,蒲公英总黄酮具有调节肥胖肠道菌群向健康状态恢复的功能,这表明在经蒲公英总黄酮调控后的菌群可能存在辅助减缓肥胖的作用。
4.3 蒲公英总黄酮可促进高脂饮食小鼠的脂肪氧化
ACC1是脂肪酸合成过程的关键限速酶,可催化乙酰辅酶A生成丙二酰辅酶A,为脂肪酸的合成提供底物[25]。Ppargc1α基因参与调控线粒体的生成、能量转换以及脂肪细胞的成熟等生理功能,并通过影响这些关键的代谢途径,影响维持机体的能量平衡和细胞功能[26]。本研究发现,肥胖小鼠在经过蒲公英总黄酮处理后,ACC1、Ppargc1αmRNA的表达同模型组比较无明显变化,表明蒲公英总黄酮并不影响丙二酰辅酶A的合成,说明两组小鼠脂肪酸的合成无明显差异。COX是线粒体电子传递链中的重要复合体,线粒体相关基因COX7A1、COX8B在脂肪酸氧化途径中发挥重要作用[27]。本研究中肥胖小鼠在经蒲公英总黄酮处理后,COX7A1、COX8BmRNA的表达明显上调,表明蒲公英总黄酮能促进肥胖小鼠脂肪的氧化,从而降低体重,抑制肥胖。
综上所述,蒲公英总黄酮可改善高脂饮食肥胖小鼠体重及病理损伤,可能通过上调脂肪的COX7A1、COX8BmRNA改善高脂血症;这一作用与其上调肥胖治疗有益菌群、下调有害菌群从而改善肥胖所致微生态紊乱有关。
