活性氧响应型甲氨蝶呤修饰紫杉醇/淫羊藿苷胶束的工艺优化与体外抗肿瘤作用评价
2025-02-15邹乃建孔亮常雷万芃伯姜晓琳袁明殿鹿英强


关键词活性氧响应型胶束;甲氨蝶呤;靶向药物递送;紫杉醇;淫羊藿苷
紫杉醇(paclitaxel,PTX)是一种广泛使用的抗肿瘤药物,主要通过稳定微管、抑制细胞分裂来诱导细胞凋亡;但PTX存在水溶性低、毒性强、多药耐药性突出等缺点,临床应用受限[1]。淫羊藿苷(icariin,ICA)是一种从传统中药淫羊藿中提取的黄酮类化合物,具有显著的抗肿瘤、抗炎和抗氧化活性[2]。研究表明,ICA不仅能抑制肿瘤细胞的增殖和迁移,还能够增强化疗药物的疗效[3]。然而,ICA的临床应用面临着水溶性差和靶向性不足等问题。为了克服这些问题,可考虑将ICA与其他抗肿瘤药物(如PTX)联合使用,并开发合适的药物递送系统,以共同改善ICA和PTX的水溶性、靶向性及生物利用度[4]。
肿瘤细胞代谢异常和快速增殖导致肿瘤微环境中活性氧(reactiveoxygenspecies,ROS)水平较高,因此ROS响应型药物递送系统能够在肿瘤部位选择性释放药物,从而提高疗效并减少对正常组织的损伤[5―6]。ROS响应键——酮缩硫醇键(thioketal,TK)能够在高ROS水平环境下被氧化从而断裂,被广泛用于设计ROS响应型药物递送系统。含有TK的药物载体可以在肿瘤部位选择性地裂解,从而实现药物的靶向递送,减毒增效[7―8]。此外,甲氨蝶呤(methotrexate,MTX)可以通过叶酸受体介导的途径显著增强药物的肿瘤靶向性,从而减少对正常组织的影响[9―10]。
基于上述背景,本研究制备了一种ROS响应型MTX修饰PTX/ICA胶束(MTX-oxi-Ms@PTX/ICA)。该胶束利用疏水核心包载水溶性较差的PTX和ICA;胶束的最外层由聚乙二醇5000(PEG5000)形成水化层,隐藏主动靶向配体MTX,以减少正常细胞对胶束的摄取并减轻不良反应。本研究通过协同实验确定两药的最优配比,采用Box-Behnken设计-响应面法优化制剂工艺,对MTX-oxi-Ms@PTX/ICA进行表征,并考察了其体外靶向性以及体外抗肿瘤作用,旨在为抗肿瘤制剂的研发提供参考。
1 材料
1.1 主要仪器
FA1004型电子天平购自上海越平科学仪器有限公司;RE52CS型旋转蒸发器购自上海亚荣生化仪器厂;KQ3200E型超声波清洗器购自昆山市超声仪器有限公司;JY92-2D型超声波细胞破碎机购自宁波新芝生物科技股份有限公司;2010型高效液相色谱(HPLC)仪(包含紫外检测器)购自日本Shimadzu公司;LITESIZER500型纳米粒度及Zeta电位分析仪购自英国Malvern公司;CKX53型倒置荧光显微镜购自日本Nikon公司;CLARIOstar型全波长荧光扫描酶标仪购自德国BMGLabtech公司;HBS-1096A型酶标仪购自南京德铁生物科技有限公司。
1.2 主要药品与试剂
PTX对照品(批号D1205C,纯度≥98%)、ICA对照品(批号J0703A,纯度≥98%)、香豆素(coumarin,Cou)原料药(批号C104161)、4′,6-双脒基-2-苯基吲哚(DAPI,批号D489987)均购自上海阿拉丁生化科技股份有限公司;聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus®,批号50477909)购自德国BASFSE公司;维生素E琥珀酸酯聚乙二醇1000(TPGS1000,批号MB3962)购自大连美仑生物技术有限公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-甲氨蝶呤(DSPEPEG2000-MTX,批号R-EL-090)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-酮缩硫醇-聚乙二醇5000(DSPEPEG2000-TK-PEG5000,批号R-EL-089)均购自西安瑞禧生物科技有限公司;CCK-8试剂盒(批号CA1210)、DMEM高糖培养基(批号11995)、1640培养基(批号90023)、磷酸盐缓冲液(PBS,批号P903593,pH7.4)均购自北京索莱宝科技有限公司;其余常见溶剂均为色谱级纯度。
1.3 细胞
小鼠肾癌细胞RENCA购自亿奥邦(北京)生物科技研究有限公司。
2 方法与结果
2.1 PTX/ICA协同毒性实验的浓度筛选与分析
为了评估PTX和ICA的协同毒性,将RENCA细胞以1×104个/孔的密度接种到96孔板中,并在细胞贴壁后向细胞孔中加入不同浓度的PTX和ICA溶液。PTX的终浓度分别设置为0、0.31、0.62、1.25、2.50、5.00、10.00、15.00μmol/L,ICA的终浓度分别设置为0、0.62、1.25、2.50、5.00、10.00、15.00、20.00μmol/L。根据上述浓度范围,形成不同的PTX和ICA浓度组合,每个组合设置3个复孔。培养48h后,每孔加入10%CCK-8试剂10μL,继续培养1~4h。采用酶标仪在450nm波长下检测各孔光密度(OD)值。采用在线SynergyFinder软件(https://synergyfinder.fimm.fi)计算药物协同评分(ZIPSynergyscore)。ZIPSynergyscore>0分被认为具有协同作用,>10分被认为具有强协同作用[11]。结果表明,在协同毒性实验中,PTX/ICA组合在抑制RENCA细胞增殖方面表现出了高度的协同效应(ZIPSynergyscore>10分),相较于单独用药,联合应用显著增强了对RENCA细胞的杀伤作用。当PTX浓度在2.5~10μmol/L区间、ICA浓度在5~15μmol/L区间时,表现出最强的协同毒性。
2.2 MTX-oxi-Ms@PTX/ICA胶束的制备
采用薄膜水合法制备胶束。精密称取处方量的DSPE-PEG2000-MTX、DSPE-PEG2000-TK-PEG5000、Soluplus®、TPGS1000、PTX、ICA于圆底烧瓶中,加甲醇溶解,减压除去溶剂,此时圆底烧瓶内壁形成一层均匀的薄膜;向烧瓶中加入PBS,超声振荡使薄膜溶在PBS中;静置,待溶液透明后,用0.22μm聚碳酸酯膜挤压2次,即得MTX-oxi-Ms@PTX/ICA。
采用相同方法制备不加DSPE-PEG2000-TKPEG5000的MTX修饰的PTX/ICA胶束(MTXMs@PTX/ICA)、不加DSPE-PEG2000-MTX和DSPEPEG2000-TK-PEG5000的PTX/ICA胶束(Ms@PTX/ICA)、不加PTX和ICA的空白胶束(Blank-Ms)。
2.3 MTX-oxi-Ms@PTX/ICA工艺优选
2.3.1 色谱条件
参考文献[12―13]设置本研究中HPLC检测条件:色谱柱为AgilentC18柱(250mm×4.6mm,5μm),流速为1.0mL/min,柱温为27℃;PTX以乙腈-甲醇-水(42∶28∶30,V/V/V)为流动相,检测波长为227nm;ICA以乙腈-水(25∶75,V/V)为流动相,检测波长为275nm;进样量为20μL。
2.3.2 包封率测定
参考文献[14]进行包封率测定。取0.5mL胶束溶液至5mL容量瓶中,以甲醇定容,过0.45μm微孔滤膜,收集滤液,得过柱前溶液;取0.5mL胶束溶液至葡聚糖凝胶柱顶部,加入0.5mLPBS洗脱2次,合并洗脱液,以甲醇定容至5mL,过0.45μm微孔滤膜,收集滤液,得过柱后溶液。采用HPLC法测定药物含量,并参照2020年版《中国药典》(四部)相关通则要求进行含量测定方法学考察。考察符合要求后,按“2.3.1”项下色谱条件进样测定,记录过柱前后溶液中PTX和ICA含量,根据下式计算胶束中PTX和ICA的包封率:PTX包封率(%)=胶束中PTX的质量/总PTX的质量×100%,ICA包封率(%)=胶束中ICA的质量/总ICA的质量×100%。
2.3.3 工艺优化
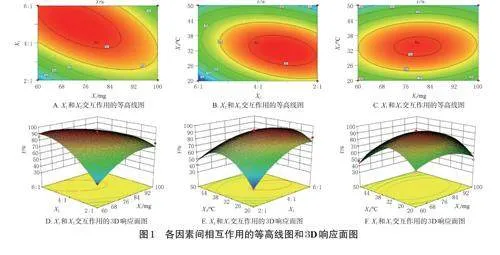
本研究在前期预实验基础上,确定以Soluplus®质量(X1)、Soluplus®与TPGS1000的质量比(X2,mg/mg)、水合温度(X3)为考察因素,以PTX和ICA包封率的综合评分Y[Y(%)=PTX包封率×0.5+ICA包封率×0.5]为响应值,利用Design-Expert8.0.6.1软件进行响应面分析。因素与水平表见表1,实验设计及结果见表2。
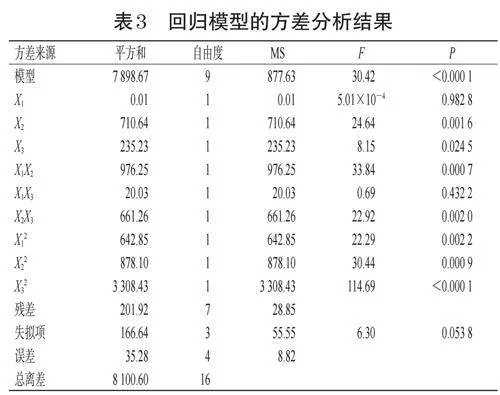
利用Design-Expert8.0.6.1软件,根据表2数据进行多元二次项拟合,得到拟合方程为Y=91.61+0.042X1+9.43X2-5.42X3-15.62X1X2+2.24X1X3-12.86X2X3-12.36X12-14.44X22-28.03X32(R2=0.9751,P<0.05)。方差分析结果(表3)显示,所建模型具有极高的显著性(P<0.01),而失拟项的P>0.05,实验模型相关系数为0.9430。这提示该模型能较好地反映出响应值的变化,可用于筛选MTX-oxi-Ms@PTX/ICA的最优工艺。
由表3可知,因素X1对Y无显著影响(P>0.05),因素X3对Y影响显著(P<0.05),因素X2、X1X2、X2X3、X12、X22、X32对Y有极显著影响(P<0.01)。通过Design-Expert8.0.6.1软件对各因素之间的交互作用进行效应面分析,结果见图1。根据图1结果,再结合胶束制备经验及胶束制备的实际情况,最终确定MTX-oxi-Ms@PTX/ICA的最优工艺如下:X1为80mg,X2为4∶1,X3为35℃,DSPE-PEG2000-TK-PEG5000为2mg,DSPE-PEG2000-MTX为2mg,PTX为1mg,ICA为1.5mg,超声功率为500W,处方量为5mL。
2.3.4 工艺验证
根据最优工艺制备3批MTX-oxi-Ms@PTX/ICA。结果显示,3批MTX-oxi-Ms@PTX/ICA中2个药的总包封率分别为92.36%、92.01%、93.88%,平均为92.75%,与预测值(93.90%)相近,表明所建模型具有良好的预测性,优选的工艺稳定性与重现性良好。
2.4 MTX-oxi-Ms@PTX/ICA的表征
2.4.1 临界胶束浓度
采用芘作为荧光探针进行临界胶束浓度(criticalmicelleconcentration,CMC)测定[15]。将MTX-oxi-Ms@PTX/ICA稀释至不同质量浓度(0.001、0.002、0.005、0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0、5.0mg/mL),然后向每个样品中加入终浓度为6×10-7mol/L的芘,将混合物在室温下避光孵育12h,使芘嵌入胶束的疏水核中。记录激发波长340nm和发射波长300~400nm下的荧光光谱图,并计算CMC。结果,MTX-oxi-Ms@PTX/ICA的CMC为0.0079mg/mL,明显低于血液中胶束的降解浓度(约0.5mg/mL)[16]。
2.4.2 粒径、多分散性指数和Zeta电位
使用纳米粒度及Zeta电位分析仪测定MTX-oxi-Ms@PTX/ICA的粒径、多分散性指数(polydispersityindex,PDI)和Zeta电位。为进一步评估胶束在氧化环境中的响应性,向MTX-oxi-Ms@PTX/ICA溶液中添加0.1mmol/L的H2O2,并在37℃下孵育2h,随后测定胶束的粒径、PDI和Zeta电位。另外,将MTX-oxi-Ms@PTX/ICA储存于4℃环境中,分别于0、10、20、30d时取样,测定其粒径和PDI的变化情况,评价胶束的储藏稳定性。
结果显示,MTX-oxi-Ms@PTX/ICA的粒径为(62.09±1.68)nm;加入H2O2后,粒径收缩至(57.78±2.14)nm。其Zeta电位为(-2.47±0.15)mV,加入H2O2后升高至(-1.60±0.10)mV。其PDI较小(0.046±0.032),表明胶束分布均一;加入H2O2后PDI略增大,但仍低于0.30。
MTX-oxi-Ms@PTX/ICA在10、20和30d时的粒径分别为(62.39±1.00)、(62.68±0.91)和(63.06±0.53)nm,相应的PDI分别为0.071±0.031、0.069±0.034和0.070±0.023。这表明在30d内胶束未发生明显的聚集或沉淀,显示出良好的稳定性。
2.5 胶束的体外释放特点考察
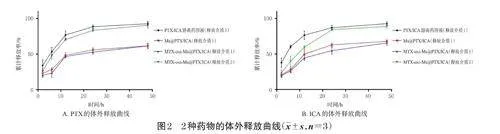
采用透析袋法研究胶束在2种释放介质中的体外释放行为。释放介质1为含5%吐温80的PBS,释放介质2为含5%吐温80和1mmol/LH2O2的PBS。将1mLPTX/ICA游离药溶液(含0.2mgPTX、0.3mgICA的甲醇溶液)和按最优工艺制备的Ms@PTX/ICA、MTX-oxi-Ms@PTX/ICA分别装入分子截留量为8~14kDa的透析袋,浸入20mL释放介质1中,在温度37℃、转速100r/min条件下振荡。同法将MTX-oxi-Ms@PTX/ICA装入透析袋并置于释放介质2中,以评估其在氧化环境中的响应性。分别在4、8、12、24、48h时采集0.5mL释放介质样品(每次取样后补充等体积新鲜介质),每个时间点重复取样3次。利用HPLC法分别测定各样品中PTX、ICA含量,计算各时间点的药物释放率[释放率(%)=释放的药物量/总药量×100%],并绘制体外释放曲线(图2)。
结果显示,PTX/ICA游离药溶液在48h内释放了(92.66±2.87)%的PTX和(92.86±2.50)%的ICA,呈现出初期的突释现象。48h内,MTX-oxi-Ms@PTX/ICA在释放介质1中释放了(61.46±3.91)%的PTX和(65.55±3.40)%的ICA,而在释放介质2中释放了(90.51±4.07)%的PTX和(88.75±2.22)%的ICA,表现出显著的释放增强现象。
2.6 胶束的体外靶向性评价
2.6.1 荧光显微镜观察胶束体外摄取情况
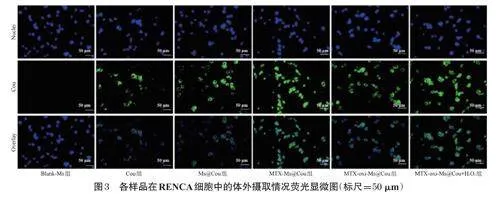
由于PTX和ICA不具有荧光,因此本研究选用具有绿色荧光信号的Cou代替药物,按“2.2”项下方法制备各荧光探针胶束,以此来评价胶束的体外细胞摄取情况。将RENCA细胞按1.6×105个/孔的密度接种于24孔板中,孵育24h。随后,细胞被分为Blank-Ms组、Cou组、Ms@Cou组、MTX-Ms@Cou组、MTX-oxi-Ms@Cou组以及MTX-oxi-Ms@Cou+H2O2组(经0.1mmol/LH2O2诱导氧化应激[16],下同)。各药物组中Cou的终浓度均控制在3μmol/L[15],每组设置3个复孔。加入各胶束后继续孵育2h,加入DAPI室温避光染色15min,利用荧光显微镜观察并拍照。采用ImageJ软件分析荧光强度。使用GraphPadPrism软件进行数据分析,数据以x±s表示,组间比较采用单因素方差分析和Scheffé检验,检验水准α=0.05。结果见图3。
结果显示,Blank-Ms组细胞未观察到绿色荧光信号,其余各组细胞均观察到不同程度的荧光信号。其中,Cou组荧光强度(48192.00±11096.84)最低;Ms@Cou组荧光强度(175941.33±10509.75)较Cou组显著升高(P<0.05);MTX-Ms@Cou组荧光强度(220732.33±23304.96)进一步高于Ms@Cou组(P<0.05);MTX-oxi-Ms@Cou组荧光强度(179027.00±6403.55)则较MTXMs@Cou组显著降低(P<0.05)。此外,MTX-oxi-Ms@Cou+H2O2组荧光强度(221047.33±12576.07)显著高于MTX-oxi-Ms@Cou组(P<0.05),但与MTXMs@Cou组比较差异无统计学意义(P>0.05)。
2.6.2 流式细胞术考察胶束体外摄取情况
细胞分组、培养、给药同“2.6.1”项下。将RENCA细胞在含药培养基中培养1h后,用冷PBS洗涤3次,随后,消化细胞并用0.3mLPBS重悬。通过流式细胞仪测定与细胞结合的Cou的荧光强度。按“2.6.1”项下方法进行统计分析。
结果显示,Blank-Ms组的荧光强度(8.60±1.67)最低,Cou组荧光强度升高至553.00±37.80,而Ms@Cou组进一步升高至635.33±8.50。在MTX修饰后,MTXMs@Cou组的荧光强度达到702.33±12.42,显著高于Ms@Cou组(P<0.05)。MTX-oxi-Ms@Cou组的荧光强度为661.33±12.86。MTX-oxi-Ms@Cou+H2O2组的荧光强度(741.00±25.24)显著高于MTX-oxi-Ms@Cou组(P<0.01),且与MTX-Ms@Cou组相比差异无统计学意义(P>0.05)。流式细胞仪的测定结果与荧光显微镜观察结果一致,进一步验证了MTX-Ms@Cou在RENCA细胞中表现出更好的穿透性,药物更容易在给药部位蓄积。
2.7 胶束对RENCA细胞存活率的影响
采用CCK-8法测定。按2×104个/孔的密度将RENCA细胞接种于96孔板中,培养24h后,根据预实验结果加入不同浓度的Blank-Ms(空白对照)和Ms@PTX/ICA、MTX-Ms@PTX/ICA、MTX-oxi-Ms@PTX/ICA以及MTX-oxi-Ms@Cou+H2O2(总药物终浓度均设置为0.032、0.63、1.25、2.50、5.00、10.00、20.00μmol/L),每个浓度设置5个复孔;并以DMEM培养基为空白对照。加入各胶束,继续培养48h后弃培养液,向各孔中加入含10%CCK-8的培养液100μL,继续孵育2h,于450nm波长处测定样品吸光度(A),计算细胞存活率[细胞存活率(%)=Ax/Ay×100%;式中,Ax为给药孔细胞的A,Ay为空白对照孔细胞的A],并计算各样品对细胞的半数抑制浓度(halfmaximalinhibitoryconcentration,IC50)。结果显示,Ms@PTX/ICA、MTX-Ms@PTX/ICA、MTX-oxi-Ms@PTX/ICA和MTX-oxi-Ms@PTX/ICA+H2O2对细胞的IC50依次为(5.990±0.032)、(3.990±0.036)、(5.170±0.036)、(2.930±0.042)μmol/L。
2.8 胶束对RENCA细胞迁移、侵袭能力的影响
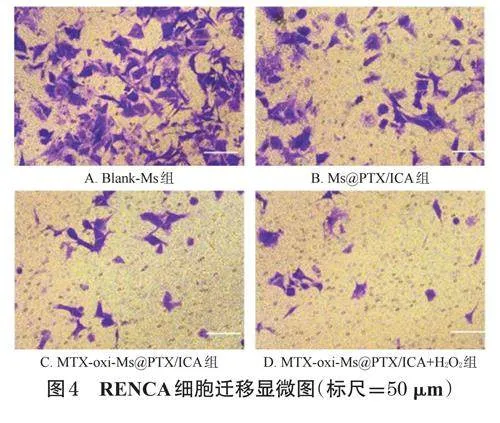
2.8.1 细胞迁移实验
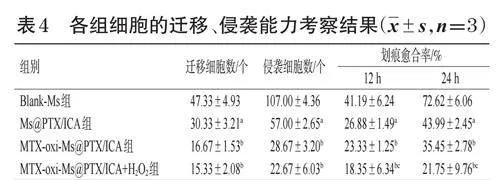
将Transwell小室置于24孔板中,用无血清1640培养基重悬RENCA细胞,以1.5×103个/孔的密度接种于小室上腔室;同时,在下腔室中加入600μL含10%胎牛血清的培养基。实验分为Blank-Ms组(空白对照组)、Ms@PTX/ICA组、MTX-oxi-Ms@PTX/ICA组和MTXoxi-Ms@PTX/ICA+H2O2组(给药组的总药物终浓度均为20.00μmol/L)。将对应胶束加入各组小室的上腔室后,于37℃孵育12h。取出小室,用PBS清洗3次,并用棉签刮除未通过膜的细胞。用4%多聚甲醛固定通过膜迁移的细胞30min,再用0.1%结晶紫溶液在室温下染色20min。用PBS清洗染液,晾干后在显微镜下观察、拍照并计算迁移细胞的平均数量。实验重复3次。按“2.6.1”项下方法进行统计分析。结果见图4、表4。结果显示,与Blank-Ms组相比,Ms@PTX/ICA组迁移细胞数显著减少(P<0.05);与Ms@PTX/ICA组比较,MTXoxi-Ms@PTX/ICA组、MTX-oxi-Ms@PTX/ICA+H2O2组迁移细胞数进一步减少(P<0.05),但MTX-oxi-Ms@PTX/ICA组与MTX-oxi-Ms@PTX/ICA+H2O2组比较差异无统计学意义(P>0.05)。
2.8.2 细胞侵袭实验
将Matrigel基质胶(5μmol/L)在冰上融化,吸取30μL加入到Transwell小室上腔室,在37℃下孵育1h;在下腔室中加入600μL含10%胎牛血清的完全培养基。用无血清培养基将RENCA细胞重悬,并以5×104个/孔的密度接种于小室上腔室。实验分组、给药、培养同“2.8.1”项下。将小室置于37℃、5%CO2的培养箱中孵育24h。用棉签轻轻擦拭上腔室,去除未侵袭的细胞。随后,将小室置于4%多聚甲醛中固定20min,并用PBS清洗2次。用0.1%结晶紫溶液染色15min,再用PBS清洗多余染液。晾干后,在显微镜下观察并计数穿过基质胶到达下腔室的细胞数目。实验重复3次。按“2.6.1”项下方法进行统计分析。结果见表4、图5。结果显示,与Blank-Ms组相比,Ms@PTX/ICA组侵袭细胞数显著减少(P<0.05);与Ms@PTX/ICA组相比,MTX-oxi-Ms@PTX/ICA组、MTX-oxi-Ms@PTX/ICA+H2O2组侵袭细胞数进一步减少(P<0.05),但MTX-oxi-Ms@PTX/ICA组与MTX-oxi-Ms@PTX/ICA+H2O2组比较差异无统计学意义(P>0.05)。
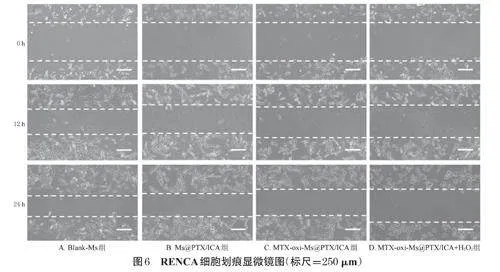
2.8.3 细胞划痕实验
将RENCA细胞以1×105个/孔的密度接种于6孔板中,置于培养箱中孵育24h,使细胞生长形成单层。用划痕器在细胞层中央划出一条直线形成划痕模型,用PBS清洗2次,去除细胞碎片。实验分组、给药、培养同“2.8.1”项下。将细胞置于培养箱中,分别在0、12、24h时用倒置显微镜拍摄划痕区域的图片,记录细胞愈合过程。使用ImageJ软件分析并量化划痕区域的宽度,计算细胞迁移的距离和速度,并计算各组细胞的划痕愈合率[划痕愈合率(%)=(初始划痕宽度-特定时间点划痕宽度)/初始划痕宽度×100%]。按“2.6.1”项下方法进行统计分析,结果见表4、图6。结果显示,与Blank-Ms组比较,Ms@PTX/ICA组细胞在12、24h后的划痕愈合率均显著降低(P<0.05);与Ms@PTX/ICA组比较,MTXoxi-Ms@PTX/ICA组、MTX-oxi-Ms@PTX/ICA+H2O2组细胞在12、24h后的划痕愈合率进一步降低(P<0.05),且MTX-oxi-Ms@PTX/ICA+H2O2组显著低于MTX-oxi-Ms@PTX/ICA组(P<0.05)。
3 讨论
在肿瘤治疗领域,开发高效且具有特异性的药物递送系统一直是研究的热点与挑战。本研究聚焦于提高PTX和ICA在肿瘤防治中的应用效能,通过协同毒性实验探究了2种药物抑制肾癌细胞增殖的协同效果。结果表明,在特定浓度范围内,PTX与ICA的联合使用能够在低于单一药物最大有效浓度的情况下,实现对肿瘤细胞更有效的抑制,这可能源于它们在细胞内作用机制的互补性。这一协同作用的发现不仅为药物剂量的优化提供了科学指导,而且为临床治疗提供了坚实的实验基础。本研究创新性地制备了MTX-oxi-Ms@PTX/ICA胶束,并优化了胶束的最优制备工艺,在最优工艺条件下制备的胶束中PTX和ICA的包封率均超过90%,表明该制剂能够高效地包裹并保护活性药物成分,有助于减少药物在储存和体内循环过程中的泄漏,从而维持药物的稳定性并提高其生物利用度。此外,MTX-oxi-Ms@PTX/ICA的CMC为0.0079mg/mL,表明该胶束具有较强的结构稳定性,能够在体内避免因血液稀释而导致的胶束解聚[16]。在体内血液循环过程中,胶束不可避免地会被血液稀释,而低CMC的胶束能够有效抵抗这种稀释作用,防止胶束解聚,从而确保药物能够稳定存在并精准地靶向递送至肿瘤部位。这一特性对于提高药物在肿瘤组织中的浓度,减少对正常组织的毒副作用具有关键意义。
粒径、PDI以及Zeta电位的测定结果表明,MTXoxi-Ms@PTX/ICA在水溶液中呈现稳定的分散状态。这有利于胶束在体内的循环与分布,使其能够更好地穿越生理屏障,抵达肿瘤组织。此外,本研究所制胶束的粒径大小处于纳米级别,这有助于胶束通过增强的渗透与滞留效应被动靶向肿瘤组织。30d的稳定性测试实验进一步证实了该胶束优异的物理稳定性,这为其长期储存和临床应用提供了可能。值得注意的是,加入H2O2后,ROS敏感键断裂,最外层PEG5000脱落,表现为粒径尺寸收缩。这一现象揭示了胶束的氧化敏感特性。在肿瘤微环境中,由于存在较高水平的ROS,这种氧化敏感特性能够触发胶束结构的变化,进而促进药物的释放。这与肿瘤组织的特殊微环境相契合,肿瘤细胞在快速增殖过程中往往伴随着氧化应激水平的升高,使得胶束能够在肿瘤部位特异性地释放药物,提高治疗效果并减少对正常组织的毒性。
本研究通过透析袋法对MTX-oxi-Ms@PTX/ICA的体外释放行为进行了系统评估。实验设计模拟了2种不同的生理环境:一种是接近生理条件的释放介质1(含5%吐温80的PBS),另一种是模拟肿瘤微环境中氧化应激条件的释放介质2(含5%吐温80和1mmol/LH2O2的PBS)。MTX-oxi-Ms@PTX/ICA在释放介质1中表现出较为缓和的药物释放特性,这可能归因于胶束在模拟生理条件下的稳定性。然而,在释放介质2中,胶束的释放行为显著增强,这种氧化敏感性触发了胶束结构的变化,导致药物的快速释放,从而实现了对肿瘤细胞的高效杀伤。
RENCA细胞存活率实验结果显示,MTX修饰显著增强了胶束的抗肿瘤活性。MTX作为一种靶向配体,能够与肿瘤细胞表面过度表达的叶酸受体特异性结合,从而提高胶束对肿瘤细胞的靶向性,使更多的药物能够进入肿瘤细胞内发挥杀伤作用。此外,MTX-oxi-Ms@PTX/ICA+H2O2对细胞的IC50低于MTX-oxi-Ms@PTX/ICA,这进一步证实了MTX-oxi-Ms@PTX/ICA具有ROS响应能力。在氧化应激条件下,胶束的外层水化层脱落,暴露出的靶向配体增强了肿瘤细胞对胶束的摄取能力,同时也促进了药物的释放,协同增强了抗肿瘤效果。体外摄取实验进一步验证了与非靶向胶束Ms@PTX/ICA相比,MTX修饰的胶束MTX-Ms@PTX/ICA在RENCA细胞中的摄取量显著增加,表明MTX修饰提高了胶束对癌细胞的靶向效果。此外,细胞对MTX-oxi-Ms@Cou+H2O2的摄取效率高于MTX-oxi-Ms@Cou,再次验证了ROS响应特性在增强胶束靶向性和药物释放中的重要性。这一系列结果表明,MTX-oxi-Ms@PTX/ICA通过整合靶向性、氧化敏感性和纳米载体的优势,有望提高肿瘤治疗的精准性和有效性。
细胞迁移和划痕实验结果显示,在高ROS水平下,MTX-oxi-Ms@PTX/ICA抑制RENCA细胞侵袭、迁移的能力变强。这一结果不仅证明了MTX-oxi-Ms@PTX/ICA能够在高ROS环境下实现药物的响应释放,更重要的是揭示了其在抑制肿瘤转移方面的潜力。本研究制备的胶束能够在抑制肿瘤细胞增殖的同时,有效抑制其侵袭、迁移,为肿瘤的综合治疗提供了新的思路。
综上所述,MTX-oxi-Ms@PTX/ICA在提高药物稳定性、增强对RENCA细胞靶向性和抑制肿瘤侵袭、迁移等方面表现出优异的性能,这为肿瘤靶向治疗提供了新的研究思路。本课题组后续将深入研究该胶束在动物模型中的体内靶向性及抗肿瘤作用机制,并进一步评估其在临床应用中的可行性和安全性。
