基因多态性对侵袭性真菌感染患者伏立康唑血药浓度影响的Meta分析
2025-02-11李雅暄李兴德王国徽毛盼盼马雪娇宋沧桑

中图分类号 R969.3;R978.5 文献标志码 A 文章编号 1001-0408(2025)02-0225-07
DOI 10.6039/j.issn.1001-0408.2025.02.16
摘要 目的 评价基因多态性对侵袭性真菌感染患者伏立康唑(VRZ)血药谷浓度(cmin)的影响。方法 检索the Cochrane Library、Embase、PubMed、Web of Science、中国生物医学文献数据库、中国知网、维普网和万方数据,收集基因多态性与VRZ cmin相关的文献,检索时间为建库至2024 年4 月。筛选文献,提取资料,评价文献质量后,使用R 4.3.2 软件进行Meta 分析。结果 共纳入21 篇文献,共计2 454 例患者。Meta 分析结果显示,CYP2C19 IM型、PM型患者的VRZ cmin均显著高于EM型,而IM型显著低于PM型(P<0.01);CYP2C9 rs1057910 AA型患者的VRZ cmin显著高于AC/CC 型,CYP3A5 rs776746 CC型患者的VRZ cmin显著高于TT 型(P<0.01);POR rs10954732 GG型患者的VRZ cmin显著高于GA型和AA型,POR rs1057868 CT型患者的VRZ cmin显著低于TT型(P<0.01);ABCB1 rs1045642 CC型患者的VRZ cmin显著高于TT型(P<0.05);NR1I2 rs2472677 CT型患者的VRZ cmin显著高于TT型,NR1I2 rs7643645 AA型患者的VRZ cmin显著高于AG型(P<0.05);ABCC2 rs717620 CC型患者的VRZ cmin均显著低于CT型和TT 型,且CT 型显著低于TT 型(P<0.01)。结论 CYP2C19、CYP2C9 rs1057910、CYP3A5 rs776746、POR rs10954732、ABCB1rs1045642、NR1I2 rs7643645 突变等位基因均可导致VRZ血药浓度降低,ABCC2 rs717620 突变等位基因则可导致VRZ血药浓度升高。
关键词 伏立康唑;侵袭性真菌感染;基因多态性;血药浓度;Meta分析
伏立康唑(voriconazole,VRZ)是一种三唑类抗真菌药物,主要用于治疗侵袭性真菌感染(invasive fungalinfection,IFI)[1]。研究指出,血液系统恶性肿瘤、实体器官移植、病毒诱导的急性呼吸窘迫综合征等所导致的严重免疫抑制患者是IFI 的高危人群[2]。VRZ具有明显的个体间和个体内药代动力学差异,故其剂量调整困难[3]。《伏立康唑个体化用药指南》建议,临床可通过测量血浆谷浓度(cmin)来进行治疗药物监测(therapeutic drugmonitoring,TDM),并明确了VRZ防治真菌感染的目标血药浓度范围(1~5.5 mg/L)和治疗严重、复杂感染的最佳血药浓度范围(2~5.5 mg/L)[4]。
VRZ药代动力学的高度可变性与饮食(影响吸收)、肝功能、遗传变异、药物相互作用、炎症等密切相关[5]。CYP2C19 基因具有高度多态性,其中CYP2C19*1 是编码酶介导代谢的功能等位基因;CYP2C19*2 或*3 等位基因与编码酶的功能丧失相关,其中间代谢型(intermediatemetabolizer,IM)或代谢不良型(poor metabolizer,PM)可导致VRZ暴露量增加[6]。除CYP2C19 外,其他基因多态性亦可影响VRZ 的暴露量。例如,细胞色素P450(cytochrome P450,CYP)2C19 酶可将VRZ 代谢为伏立康唑N-氧化物,CYP3A4 酶、黄素单加氧酶(flavincontainingmonooxygenases,FMO)也与VRZ 的代谢有关[7]。CYP2C9 酶是CYP 第二亚家族的重要成员,有16% 的VRZ 由其代谢[8]。CYP3A5 酶主要在肝脏、小肠和肾脏表达,其编码基因的单核苷酸多态性可显著影响该酶活性,其中CYP3A5 基因rs776746 位点突变可使CYP3A5 酶活性显著下降甚至丧失[9]。多药耐药蛋白1(multidrug resistance protein 1,MDR1;又称ABCB1)和多药耐药相关蛋白2(multidrug resistance-associated protein2,MRP2;又称ABCC2)均属于ABC转运蛋白,作为药物排出转运体,二者可依赖腺苷三磷酸提供的能量将外源性治疗药物排出,从而导致药物浓度降低[10]。孕烷X受体(pregnane X receptor,PXR)是人体最重要的药物代谢酶,其编码基因为NR1I2[11]。CYP氧化还原酶(CYPoxidoreductase,POR)是肝微粒体CYP 家族唯一的电子供体,只有让CYP酶接受其提供的电子才能参与体内药物代谢[12]。但现有研究结果表明,上述基因多态性对VRZ 血药浓度影响的结果并不一致[13―17]。在临床实践中,VRZ的cmin与疗效、毒性有关,且VRZ的治疗窗相对较窄,若cmin未达到目标治疗范围,可能会降低患者的疗效或导致不良反应的发生。临床通常在患者接受VRZ治疗后4~7 d 进行TDM(使用负荷剂量者,第3 天即可达到稳态),TDM 24~48 h 后进行剂量调整,使得剂量优化滞后[18]。基于此,本研究采用Meta 分析的方法评价了基因多态性对VRZ血药浓度的影响,旨在为VRZ的临床合理应用提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入的文献类型包括:多中心临床研究,含前瞻性和回顾性研究;语种包括中文和英文。
1.1.2 研究对象
本研究的患者均接受VRZ进行IFI 预防或治疗,年龄、种族和性别均不限。
1.1.3 暴露因素
所有患者均接受相关基因检测,并根据基因型结果进行分型:(1)按CYP2C19*1 或*2 或*3 等位基因检测结果分为正常代谢型(extensive metabolizer,EM)、IM 和PM;(2)按CYP2C9 基因rs1057910 位点检测结果分为AA型、AC型和CC型;(3)按CYP3A4 基因rs4646437 位点检测结果分为CC型、CT型和TT型;(4)按CYP3A5 基因rs776746 位点检测结果分为CC 型、CT 型和TT 型;(5)按ABCB1 基因rs1045642 位点检测结果分为CC型、CT型和TT 型;(6)按FMO3 基因rs2266782 位点检测结果分为GG型、GA型和AA型,按FMO3 基因rs2266780位点检测结果分为AA型、AG型和GG型;(7)按POR基因rs10954732 位点检测结果分为GG 型、GA 型和AA型,按POR基因rs1057868 位点检测结果分为CC型、CT型和TT型;(8)按NR1I2 基因rs2472677 位点检测结果分为CC型、CT型和TT型,按NR1I2 基因rs7643645 位点检测结果分为AA 型、AG 型和GG 型,按NR1I2 基因rs3814057 位点检测结果分为AA型、AC型和CC型;(9)按ABCC2 基因rs717620 位点检测结果分为CC型、CT型和TT 型,按ABCC2 基因rs2273697 位点检测结果分为GG型、GA型和AA型。基因检测方法不限。
1.1.4 结局指标
本研究的结局指标为VRZ的cmin。
1.1.5 排除标准
本研究的排除标准为:(1)重复发表的文献;(2)纳入其他基因以及缺少对应结局指标的文献;(3)不能获取全文的文献。
1.2 文献检索策略
检索the Cochrane Library、Embase、PubMed、Webof Science、中国生物医学文献数据库、中国知网、维普网和万方数据。中文检索词为“伏立康唑”“基因多态性”,英文检索词为“voriconazole”“polymorphism”,检索时限均为各数据库建库至2024 年4 月。采用主题词与自由词相结合的方式进行检索。同时,手工搜索相关研究,对于文献里未提供的数据,通过电子邮件与作者取得联系后获取。
1.3 文献筛选与资料提取
由2 名研究者独立筛选文献,并交叉核对,产生分歧时通过协商或咨询第3 位研究者解决。提取资料包括:第一作者、发表时间、样本量和结局指标等。
1.4 文献质量评价
采用遗传关联研究报告(Strengthening the Reportingof Genetic Association Studies,STREGA)评价纳入研究的质量,评价内容包括:(1)明确的目标和假设陈述;(2)研究参与者;(3)明确定义所有变量;(4)明确结果的定义;(5)可信的基因检测方法;(6)统计方法的可重复性;(7)对Hardy-Weinberg 平衡的评估;(8)充分描述人口统计数据;(9)明确报告脱落原因;(10)结果数据的陈述[19]。每个项目评为“+”或“-”,“+”表示描述清楚(记1 分),“-”表示未描述(记0 分);总分为10 分,≥6分为质量可靠[20]。
1.5 统计学方法
采用R 4.3.2 软件进行Meta 分析。计量资料以标准化均数差(standardized mean difference,SMD)及其95%置信区间(confidence interval,CI)表示,采用χ 2检验和I 2检验分析各研究间的异质性,若各研究间无统计学异质性(P>0.10 或I 2<50%),采用固定效应模型分析;反之,则采用随机效应模型分析。当存在较大统计学异质性时,应分析异质性产生的原因,必要时需进行亚组分析。采用R 4.3.2 软件的“metainf ”命令进行敏感性分析;采用Egger’s 法进行发表偏倚分析。检验水准α=0.05。
2 结果
2.1 文献筛选流程与纳入文献基本信息
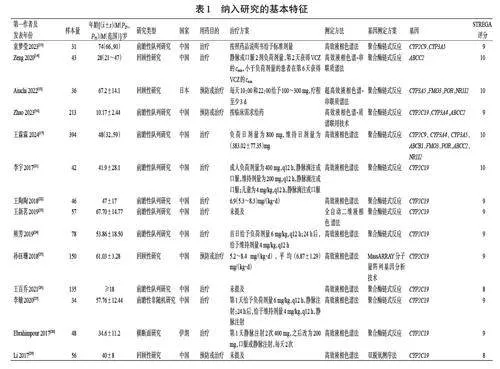
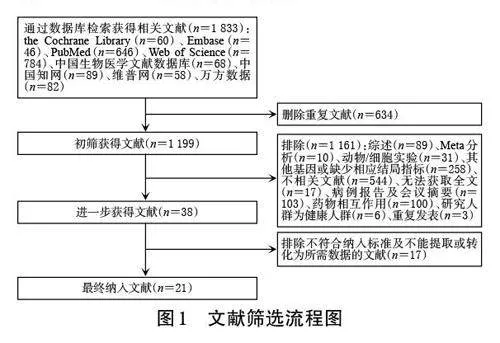
初检得到相关文献1 833 篇,经阅读标题、摘要及全文后,最终纳入21 篇文献[13―17,21―36],共计2 454 例患者,其中8 项研究报道的基因型频率符合Hardy-Weinberg 平衡[14―17,21,23,34―35]。结果见图1、表1。
2.2 纳入文献的质量评价结果
21 篇文献的STREGA 评分均不低于8 分,质量可靠。结果见表1。
2.3 Meta分析结果
2.3.1 CYP基因多态性与VRZ cmin的相关性
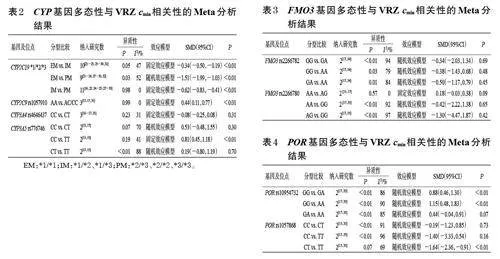
(1)CYP2C19 基因多态性:CYP2C19 IM型、PM型患者的VRZ cmin均显著高于EM型,CYP2C19 IM型患者的VRZ cmin显著低于PM型(P<0.01)。结果见表2。
(2)其他CYP基因多态性:CYP2C9 rs1057910 AA型患者的VRZ cmin显著高于AC/CC型(P<0.01);CYP3A4rs4646437 CC型患者的VRZ cmin与CT型比较,差异无统计学意义(P=0.31);CYP3A5 rs776746 CC型患者的VRZ cmin显著高于TT型(P<0.01),而CC型与CT型、CT型与TT型比较,差异均无统计学意义(P>0.05)。结果见表2。
2.3.2 FMO3基因多态性与VRZ cmin的相关性
FMO3 rs2266782、rs2266780 3 种分型患者之间的VRZ cmin 比较,差异均无统计学意义(P>0.05)。结果见表3。
2.3.3 POR基因多态性与VRZ cmin的相关性
POR rs10954732 GG 型患者的VRZ cmin 显著高于GA型和AA型(P<0.01);POR rs1057868 CT 型患者的VRZ cmin显著低于TT型(P<0.01)。结果见表4。
2.3.4 其他基因多态性与VRZ cmin的相关性
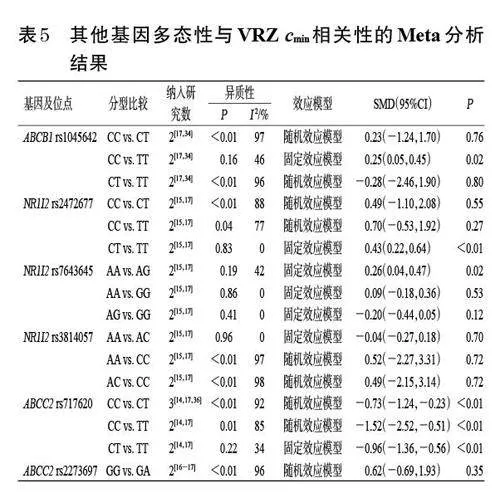
ABCB1 rs1045642 CC 型患者的VRZ cmin 显著高于TT型(P<0.05);NR1I2 rs2472677 CT型患者的VRZ cmin显著高于TT型;NR1I2 rs7643645 AA型患者的VRZ cmin显著高于AG型(P<0.05);NR1I2 rs3814057 3 种分型患者的VRZ cmin 比较,差异均无统计学意义(P>0.05);ABCC2 rs717620 CC 型患者的VRZ cmin 均显著低于CT型和TT 型,且CT 型显著低于TT 型(P<0.01);ABCC2rs2273697 2 种分型患者的VRZ cmin比较,差异无统计学意义(P>0.05)。结果见表5。
2.4 敏感性分析
对纳入3 项及以上研究的指标进行敏感性分析,逐一剔各项研究后,合并效应量的结果均未发生明显变化,表明本研究所得结果较稳健。
2.5 发表偏倚分析
以CYP2C19 基因多态性为指标,采用Egger’s 检验进行发表偏倚分析。结果显示,Egger’s 检验的P值大于0.05,表明本研究存在发表偏倚的可能性较小。
3 讨论
本研究结果显示,CYP2C19 基因多态性与VRZ cmin显著相关,与Zhang 等[37] 的研究结果一致;CYP2C9rs1057910、CYP3A5 rs776746、POR rs10954732、PORrs1057868、ABCB1 rs1045642、NR1I2 rs2472677、NR1I2rs7643645、ABCC2 rs717620 均与VRZ cmin 相关(P<0.05)。同时,CYP2C9 rs1057910(AC/CC 型)、CYP3A5rs776746(TT 型)、POR rs10954732(GA 型和AA 型)、ABCB1 rs1045642(TT 型)、NR1I2 rs7643645(AG 型)突变等位基因均可导致VRZ 血药浓度降低,而ABCC2rs717620 突变等位基因(CT 和TT 型)可导致VRZ 血药浓度升高。这提示上述基因多态性对VRZ血药浓度有显著影响。
VRZ治疗窗较窄,其血药浓度与疗效和毒性具有相关性,易因药物剂量不适宜而达不到治疗目标或者发生不良反应。CYP2C9、CYP3A5、NR1I2 基因主要通过影响VRZ 的代谢酶活性来调节VRZ 血药浓度;ABCB1、ABCC2 基因可通过影响药物外排而造成VRZ血药浓度降低或引发耐药;POR基因可通过诱导氨基酸取代来改变POR酶的自身活性,从而影响CYP酶对VRZ的代谢,进而影响疗效[12]。既往在恶性血液病患者中开展的研究结果显示,POR rs10954732 对VRZ cmin 有影响,而POR rs2228104 对VRZ cmin无影响[35]。本研究结果显示,POR rs10954732 对VRZ 的影响结果与以上研究一致。ABCC2 也称为MRP2,是MRP亚家族成员之一,可参与多药耐药,主要负责药物的主动外排[38]。ABCC2 基因的多态性可影响MRP2 对VRZ的外排功能,导致使用相同剂量VRZ 的不同个体间存在较大的血药浓度差异[38]。有学者在意大利侵袭性真菌感染儿童患者中发现,携带ABCC2 rs717620 突变基因对VRZ 浓度有显著影响,其VRZ中位cmin高于野生纯合子基因型[36]。本研究结果也同样显示,ABCC2 rs717620 突变对VRZ 浓度有显著影响。此外,在本研究中,对于POR rs10954732 和ABCC2rs717620,无论是纯合突变还是杂合突变均能造成患者VRZ cmin的差异。
综上所述,CYP2C19、CYP2C9 rs1057910、CYP3A5rs776746、POR rs10954732、ABCB1 rs1045642、NR1I2rs7643645 突变等位基因均可导致VRZ血药浓度降低,ABCC2 rs717620 突变等位基因则可导致VRZ血药浓度升高。本研究的局限性如下:(1)由于样本来源地区、种族、性别各有不同,使得研究间存在异质性,可能导致结论发生偏倚;(2)部分结局指标采用中位数表示,应用计算公式间接获取的均数及标准差可能存在误差;(3)除CYP2C19 外,有关其他基因的研究纳入较少;(4)由于纳入研究结局指标均为数值变量,无法按传统基因模型进行分组比较,可能导致结论出现偏倚。因此,本文所得结论仍需大规模、高质量的临床研究进一步证实。
参考文献
[ 1 ] PATTERSON T F,THOMPSON G R 3rd,DENNING D
W,et al. Practice guidelines for the diagnosis and management
of aspergillosis:2016 update by the Infectious
Diseases Society of America[J]. Clin Infect Dis,2016,63
(4):e1-e60.
[ 2 ] DENNING D W,RIBAUD P,MILPIED N,et al. Efficacy
and safety of voriconazole in the treatment of acute invasive
aspergillosis[J]. Clin Infect Dis,2002,34(5):
563-571.
[ 3 ] SCHULZ J,KLUWE F,MIKUS G,et al. Novel insights
into the complex pharmacokinetics of voriconazole:a
review of its metabolism[J]. Drug Metab Rev,2019,51
(3):247-265.
[ 4 ] CHEN K,ZHANG X L,KE X Y,et al. Individualized
medication of voriconazole:a practice guideline of the
division of therapeutic drug monitoring,Chinese Pharmacological
Society[J]. Ther Drug Monit,2018,40(6):663-674.
[ 5 ] 任佳秀,倪受东,李萌,等. 伏立康唑的治疗药物浓度监
测影响因素的研究进展[J]. 现代药物与临床,2021,36
(7):1545-1548.
REN J X,NI S D,LI M,et al. Research progress on influen-
cing factors of voriconazole therapeutic drug concentration
monitoring[J]. Drugs Clin,2021,36(7):1545-1548.
[ 6 ] ZHONG X F,TONG X L,JU Y,et al. Interpersonal factors
in the pharmacokinetics and pharmacodynamics of
voriconazole:are CYP2C19 genotypes enough for us to
make a clinical decision? [J]. Curr Drug Metab,2018,19
(14):1152-1158.
[ 7 ] GARCÍA I G,CARCAS A J,BOROBIA A M. Strategy to
effectively and efficiently implement voriconazole pharmacogenetics
in clinical practice[J]. Pharmacogenomics,
2020,21(10):647-649.
[ 8 ] DOLTON M J,MIKUS G,WEISS J,et al. Understanding
variability with voriconazole using a population pharmacokinetic
approach:implications for optimal dosing[J]. J
Antimicrob Chemother,2014,69(6):1633-1641.
[ 9 ] 桂明珠. 伏立康唑治疗儿童侵袭性真菌感染的血药浓度
意义与潜在影响因素研究[D]. 上海:上海交通大学,
2020.
GUI M Z. Study on the significance and potential influencing
factors of plasma concentration of voriconazole
in the treatment of invasive fungal infections in children
[D]. Shanghai:Shanghai Jiao Tong University,2020.
[10] DERMAUW W,VAN LEEUWEN T. The ABC gene family
in arthropods:comparative genomics and role in insecticide
transport and resistance[J]. Insect Biochem Mol Biol,
2014,45:89-110.
[11] LYNCH C,SAKAMURU S,HUANG R L,et al. Characterization
of human pregnane Ⅹ receptor activators identified
from a screening of the Tox21 compound library[J].
Biochem Pharmacol,2021,184:114368.
[12] SHIRASAKA Y,CHAUDHRY A S,MCDONALD M,et
al. Interindividual variability of CYP2C19-catalyzed drug
metabolism due to differences in gene diplotypes and cytochrome
P450 oxidoreductase content[J]. Pharmacogenomics
J,2016,16(4):375-387.
[13] 袁梦莹,潘婷,何霞,等. 老年共病患者使用伏立康唑时
药物基因型与血药浓度的相关性分析[J]. 中国临床药理
学杂志,2023,39(8):1090-1094.
YUAN M Y,PAN T,HE X,et al. Analysis of the correlation
between drug genotype and blood concentration in
elderly patients with comorbidities using voriconazole[J].
Chin J Clin Pharmacol,2023,39(8):1090-1094.
[14] ZENG G T,SHI L H,LI H L,et al. Effect of cyclosporine
a and polymorphisms in CYP2C19 and ABCC2 on the
concentration of voriconazole in patients undergoing allogeneic
hematopoietic stem cell transplantation[J]. Xenobiotica,
2020,50(5):614-619.
[15] AIUCHI N,NAKAGAWA J,SAKURABA H,et al. Impact
of polymorphisms of pharmacokinetics-related genes
and the inflammatory response on the metabolism of voriconazole[
J]. Pharmacol Res Perspect,2022,10(2):
e00935.
[16] ZHAO T,SHEN H,ZHANG H L,et al. Association of
CYP2C19,CYP3A4 and ABCC2 polymorphisms and
voriconazole plasma concentrations in Uygur pediatric patients[
J]. Pharmacogenomics,2023,24(3):141-151.
[17] 王霖霖. 药物基因组学与肾功能对伏立康唑稳态谷浓度
的影响研究[D]. 长沙:中南大学,2024.
WANG L L. Research on impact of pharmacogenetic and
renal function on the steady-state concentration of voriconazole[
D]. Changsha:Central South University,2024.
[18] SHEN K L,GU Y,WANG Y,et al. Therapeutic drug
monitoring and safety evaluation of voriconazole in the
treatment of pulmonary fungal diseases[J]. Ther Adv Drug
Saf,2022,13:20420986221127503.
[19] LITTLE J,HIGGINS J P,IOANNIDIS J P,et al. Strengthening
the reporting of genetic association studies
(STREGA):an extension of the STROBE Statement[J].
Hum Genet,2009,125(2):131-151.
[20] 刘鸣. 系统评价、Meta 分析设计与实施方法[M]. 北京:
人民卫生出版社,2011:72.
LIU M. Design and implementation of systematic evaluation,
meta-analysis [M]. Beijing:People’s Medical
Medical Publishing House,2011:72.
[21] 李宇. 基于CYP2C19 基因多态性检测与血药浓度监测
的伏立康唑临床个体化用药研究[D]. 合肥:安徽中医药
大学,2017.
LI Y. Clinical individualized use of voriconazole based on
CYP2C19 gene polymorphism detection and blood concentration
monitoring[D]. Hefei:Anhui University of
Chinese Medicine,2017.
[22] 王陶陶,胡萨萨,尤海生,等. 恶性血液病患者中伏立康
唑血药浓度监测及其影响因素的探讨[J]. 中国医院药学
杂志,2018,38(7):693-696,707.
WANG T T,HU S S,YOU H S,et al. Monitoring voriconazole
concentrations and identifying the influence factors
in patients with hematological malignancy[J]. Chin J
Hosp Pharm,2018,38(7):693-696,707.
[23] 王新茗. 伏立康唑血药浓度监测方法的建立与
CYP2C19 基因多态性检测的临床应用[D]. 成都:成都医
学院,2019.
WANG X M. Establishment of a method for monitoring
the plasma concentration of voriconazole and clinical
application of CYP2C19 gene polymorphism detection[D].
Chengdu:Chengdu Medical College,2019.
[24] 熊芳,郭虎,陈茂林,等. CYP2C19 基因多态性对侵袭性
真菌感染患者伏立康唑游离型药物浓度的影响[J]. 药物
分析杂志,2019,39(2):291-295.
XIONG F,GUO H,CHEN M L,et al. Influence of
CYP2C19 gene polymorphism on unbound plasma concentrations
of voriconazole in patients with invasive fungal
infections[J]. Chin J Pharm Anal,2019,39(2):
291-295.
[25] 孙钰珊. 采用伏立康唑抗真菌治疗的肝硬化患者血清伏
立康唑谷浓度分布特征及影响因素[J/OL]. 中国肝脏病
杂志(电子版),2018,10(3):86-89[2024-04-30]. https://
kns. cnki. net/kcms2/article/abstract? v=ifIT5_n5_GekUb6-
mXAZGxFUMlT-49Csk9QTZzh8JawoVwNh7mgf2hsCi-
0TM9TNetBf69U7-emyKgPwnMwLQQBraELaYsqOoE9eknP-
QOFIpjUzx_RYtvvI3lIldYJIi4ISRNhVwbHCrZoK1a-
FpwX2-BR_Xkc0mJUowB-xVxt7_foSmN_yfzZ8DvL21_
oDiAamp;uniplatform=NZKPTamp;language=CHS. DOI:10.
3969/j.issn.1674-7380.2018.03.016.
SUN Y S. Distribution characteristics and influencing factors
of valley concentration of serum voriconazole in liver
cirrhosis patients who underwent antifungal therapy with
voriconazole[J/OL]. Chin J Liver Dis Electron Version,
2018,10(3):86-89[2024-04-30]. https://kns. cnki. net/
kcms2/article/abstract?v=ifIT5_n5_GekUb6mXAZGxFUMlT-
49Csk9QTZzh8JawoVwNh7mgf2hsCi0TM9TNetBf69U7-
emyKgPwnMwLQQBraELaYsqOoE9e-knP-QOFIpjUzx_
RYtvvI3lIldYJIi4ISRNhVwbHCrZoK1aFpwX2-BR_Xkc0mJUowB-
xVxt7_foSmN_yfzZ8DvL21_oDiAamp;uniplatform=
NZKPTamp;language=CHS. DOI:10.3969/j.issn.1674-
7380.2018.03.016.
[26] 王百乔,赵震宇,韩敏,等. 伏立康唑治疗侵袭性真菌感
染致肝损伤影响因素及CYP2C19 基因多态性[J]. 中华
医院感染学杂志,2021,31(13):1957-1962.
WANG B Q,ZHAO Z Y,HAN M,et al. Influencing factors
for invasive fungal infection-induced liver injury in
patients treated with voriconazole and CYP2C19 gene
polymorphisms[J]. Chin J Nosocomiology,2021,31(13):
1957-1962.
[27] 李敏,周丽娟,张华,等. CYP2C19 基因多态性对侵袭性
真菌感染患者伏立康唑用药的指导意义探讨[J]. 中国医
院药学杂志,2020,40(2):156-160,207.
LI M,ZHOU L J,ZHANG H,et al. The significance of
CYP2C19 gene polymorphism in guiding voriconazole
administration in patients with invasive fungal infection
[J]. Chin J Hosp Pharm,2020,40(2):156-160,207.
[28] EBRAHIMPOUR S,NAMAZI S,MOHAMMADI M,et
al. Impact of CYP2C19 polymorphisms on serum concentration
of voriconazole in Iranian hematological patients
[J]. J Res Pharm Pract,2017,6(3):151-157.
[29] LI Z W,PENG F H,YAN M,et al. Impact of CYP2C19
genotype and liver function on voriconazole pharmacokinetics
in renal transplant recipients[J]. Ther Drug Monit,
2017,39(4):422-428.
[30] CHEN X M,XIAO Y H,LI H P,et al. Therapeutic drug
monitoring and CYP2C19 genotyping guide the application
of voriconazole in children[J]. Transl Pediatr,2022,
11(8):1311-1322.
[31] FAN X H,ZHANG H,WEN Z P,et al. Effects of
CYP2C19,CYP2C9 and CYP3A4 gene polymorphisms
on plasma voriconazole levels in Chinese pediatric patients
[J]. Pharmacogenet Genomics,2022,32(4):152-158.
[32] WANG T T,ZHU H F,SUN J Y,et al. Efficacy and safety
of voriconazole and CYP2C19 polymorphism for optimised
dosage regimens in patients with invasive fungal infections[
J]. Int J Antimicrob Agents,2014,44(5):436-442.
[33] 赵婷,沈皓,张惠兰,等. 新疆维吾尔族异基因造血干细
胞移植高危患儿的伏立康唑血浆谷浓度的分布特征及
对疗效和不良反应的影响[J]. 中国医院药学杂志,2022,
42(23):2505-2510,2544.
ZHAO T,SHEN H,ZHANG H L,et al. Distribution characteristics
of voriconazole plasma trough concentration in
Xinjiang Uygur children at high risk of allogeneic hematopoietic
stem cell transplantation and its effect on efficacy
and adverse reactions of voriconazole[J]. Chin J Hosp
Pharm,2022,42(23):2505-2510,2544.
[34] CHUWONGWATTANA S,JANTARAROUNGTONG T,
PROMMAS S,et al. Impact of CYP2C19,CYP3A4,
ABCB1,and FMO3 genotypes on plasma voriconazole in
Thai patients with invasive fungal infections[J]. Pharmacol
Res Perspect,2020,8(6):e00665.
[35] ZENG G T,WANG L L,SHI L H,et al. Variability of
voriconazole concentrations in patients with hematopoietic
stem cell transplantation and hematological malignancies:
influence of loading dose,procalcitonin,and
pregnane X receptor polymorphisms[J]. Eur J Clin Pharmacol,
2020,76(4):515-523.
[36] ALLEGRA S,FATIGUSO G,FRANCIA S,et al. Pharmacogenetic
of voriconazole antifungal agent in pediatric patients[
J]. Pharmacogenomics,2018,19(11):913-925.
[37] ZHANG Y,HOU K L,LIU F,et al. The influence of
CYP2C19 polymorphisms on voriconazole trough concentrations:
systematic review and meta-analysis[J]. Mycoses,
2021,64(8):860-873.
[38] GUYOT C,HOFSTETTER L,STIEGER B. Differential
effects of membrane cholesterol content on the transport
activity of multidrug resistance-associated protein 2
(ABCC2)and of the bile salt export pump(ABCB11)[J].
Mol Pharmacol,2014,85(6):909-920.
(收稿日期:2024-07-31 修回日期:2024-11-30)
(编辑:陈 宏)
