氯吡格雷对大鼠体内环泊酚药动学和药效学的影响
2025-02-11路明尹晓玉李文利李珊李相晨张志清

中图分类号 R969.2 文献标志码 A 文章编号 1001-0408(2025)02-0179-06
DOI 10.6039/j.issn.1001-0408.2025.02.08
摘要 目的 考察氯吡格雷对大鼠体内环泊酚药动学和药效学的影响。方法 18 只雄性SD大鼠随机分为对照组、氯吡格雷正常剂量组和氯吡格雷高剂量组,每组6 只。氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠分别灌胃7.5、15 mg/kg 的氯吡格雷,对照组大鼠灌胃同体积的0.5% 羧甲基纤维素钠溶液,每天1 次,连续给药14 d 后于大鼠尾静脉注射环泊酚2.4 mg/kg。在结束注射后2、4、8、12、16、20、30、45、60 min 时于眼内眦取血,统计各组大鼠的翻正反射消失(LORR)持续时间。大鼠血浆经乙腈沉淀蛋白后,以氘代环泊酚为内标,以Symmetry C18为色谱柱,以乙腈-含5 mmol/L乙酸铵的0.01% 氨水溶液(梯度洗脱)为流动相,采用液相色谱-串联质谱法检测血浆中环泊酚的质量浓度,采用DAS 2.0 软件计算各组大鼠的药动学参数。结果 与对照组比较,氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠体内环泊酚的药时曲线下面积和平均驻留时间均显著增加或延长,血浆清除率均显著降低,LORR持续时间分别延长了19.5% 和23.9%,差异均有统计学意义(P<0.05)。氯吡格雷两个剂量组大鼠体内环泊酚药动学参数和LORR 持续时间比较差异均无统计学意义(P>0.05)。结论 氯吡格雷可抑制环泊酚的体内代谢,并延长大鼠的LORR 持续时间。
关键词 氯吡格雷;环泊酚;药物-药物相互作用;药动学;药效学
药物-药物相互作用(drug-drug interactions,DDIs)是指同时或连续服用两种或两种以上药物时,其中一种药物的体内行为或活性可能因其他药物的影响而发生改变[1]。DDIs 严重威胁患者健康,是临床合理用药和新药上市后药物警戒的重要问题之一[2]。细胞色素P450(cytochrome P450,CYP)酶受到抑制是导致DDIs 的常见机制,通常分为可逆(竞争性或非竞争性结合)和不可逆(自杀性或机理性灭活)两类[3]。其中,机理性灭活后的CYP酶活性无法恢复,必须重新合成,因此机理性酶灭活剂比可逆性酶抑制剂更容易导致明显且严重的DDIs[4]。氯吡格雷在2004 年被证实为潜在的CYP2B6酶机理性灭活剂,提示该药可能与该酶底物发生DDIs,从而影响临床用药安全[5]。
环泊酚是我国自主研发的新型短效静脉麻醉药,现已被批准用于非气管插管手术/操作的镇静和麻醉、全身麻醉的诱导和维持以及重症监护机械通气时的镇静[6]。研究表明,环泊酚在体内主要经Ⅰ相和Ⅱ相代谢,其中Ⅰ相代谢主要经CYP2B6 酶氧化生成单氧化葡萄糖醛酸结合物,而Ⅱ相代谢主要经尿苷二磷酸葡萄糖醛酸转移酶1A9(uridine diphosphate glucuronyl transferase1A9,UGT1A9)作用生成葡萄糖醛酸结合物[7]。随着环泊酚临床应用的日益广泛,其与其他药物相互联用的情况也逐渐增多。长期服用氯吡格雷的患者在进行纤维支气管镜、胃镜和结肠镜诊疗以及接受机械通气期间,可能需要同时应用环泊酚进行镇静或麻醉。《抗血栓药物围手术期管理多学科专家共识》建议,对于缺血性脑卒中/短暂性脑缺血发作等存在血栓高风险、出血低风险的患者,应在围手术期坚持应用氯吡格雷[8];此外,国外多项研究证实了接受胃肠道手术、尿道/前列腺电切术以及髋膝关节置换术等手术的患者在围手术期继续应用氯吡格雷的安全性[9―11]。鉴于这些研究成果,本课题组认为环泊酚和氯吡格雷在接受紧急或择期手术的患者中存在联合使用的可能。当前证据显示,CYP2B6 酶的强诱导剂/弱抑制剂以及UGT1A9 酶的强诱导剂/抑制剂均不会对环泊酚在人体内的代谢产生具有临床意义的影响[12]。然而,目前尚不清楚CYP2B6 酶灭活剂是否会影响环泊酚的代谢。为此,本研究采用液相色谱-串联质谱(LC-MS/MS)法检测血浆中环泊酚的质量浓度,拟通过考察氯吡格雷对大鼠体内环泊酚药动学和药效学的影响来探讨两药的相互作用,以期为CYP2B6 酶灭活剂与环泊酚的临床合理联用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有LC-20AD型高效液相色谱仪(日本Shimadzu 公司)、API 4000+型三重四极杆质谱仪(美国AB Sciex 公司)、XW-80A型涡旋混合仪(上海医大仪器有限公司)、CPA225D型电子分析天平(德国Sartorius公司)等。
1.2 主要药品与试剂
环泊酚对照品(批号11220202,纯度99.9%)、氘代环泊酚对照品(内标,批号cc-HSK23287-202005006-001,纯度99.8%)均由海思科制药(眉山)有限公司提供;环泊酚注射液(批号20220207,规格20 mL∶50 mg)购自辽宁海思科制药有限公司;硫酸氢氯吡格雷片[批号DHG0555,规格75 mg(按C16H16ClNO2S 计)]购自赛诺菲(杭州)制药有限公司;羧甲基纤维素钠(CMC-Na,批号20181019)购自国药集团化学制药有限公司;乙酸铵、乙腈为色谱纯,氨水等其余试剂均为分析纯,水为蒸馏水。
1.3 实验动物
SPF 级健康雄性SD 大鼠18 只,体重(200±20)g,7周龄,购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2019-0008。所有动物均饲养于温度(22±2)℃、相对湿度为(55±10)%、12 h 光照/12 h 黑暗的实验室内,自由摄食、饮水。动物操作和实验方案均符合河北医科大学第二医院实验动物管理要求,并经该院科研伦理委员会批准(审查决议编号2023-AE285)。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件
以Symmetry C18(4.6 mm × 150 mm,3.5 μm)为色谱柱;以含5 mmol/L 乙酸铵的0.01% 氨水为流动相A、乙腈为流动相B 进行梯度洗脱(0~1.0 min,75%B→99%B;1.0~5.5 min,99%B;5.5~6.5 min,99%B→75%B);流速为0.70 mL/min;柱温为40 ℃;自动进样器温度为4 ℃;进样量为10 μL。
2.1.2 质谱条件
采用电喷雾离子源,以多反应监测模式进行负离子扫描;碰撞气压力为9 psi;气帘气压力为30 psi;离子源喷射电压为-4 500 V,离子源温度为500 ℃;雾化气压力为50 psi;辅助气压力为60 psi;环泊酚和内标的碰撞电压分别为-28、-30 V,去簇电压分别为-85、-83V,用于定量分析的离子对分别为m/z 203.2→175.1、m/z209.3→181.3。
2.2 对照品溶液和内标溶液的配制
分别精密称定环泊酚和内标对照品适量,加乙腈溶解、定容,得到质量浓度均为2 mg/mL 的环泊酚储备液和内标储备液,于-40 ℃下保存,备用。精密吸取环泊酚储备液适量,用50% 乙腈依次稀释成质量浓度分别为40 000、20 000、10 000、5 000、2 500、1 200、600、300ng/mL 的系列环泊酚对照品溶液和32 000、5 000、600、300 ng/mL 的高、中、低、定量下限质量浓度环泊酚质控工作液;另精密吸取内标储备液适量,用50% 乙腈稀释成质量浓度为5 000 ng/mL的内标溶液。
2.3 样品处理
将冷冻的血浆样品自然解冻,取100 μL,加入内标溶液5 μL,涡旋1 min 混匀,加入乙腈300 μL,涡旋2 min混匀,以10 900 r/min 离心15 min,取上清液,应用LCMS/MS法进样分析。
2.4 方法学考察
2.4.1 专属性试验
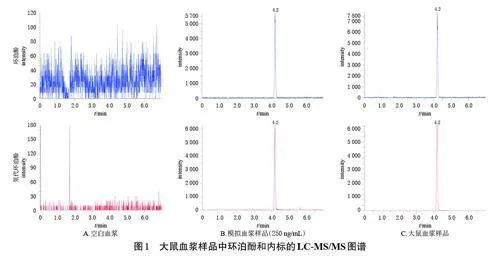
取大鼠空白血浆(不加内标)、250 ng/mL 的环泊酚模拟血浆样品(配制方法见“2.4.2”项)、给予环泊酚12min 后的大鼠血浆样品,分别按“2.3”项下方法处理后,按“2.1”项下条件进样分析,考察方法的专属性。色谱图如图1 所示,血浆中的内源性物质对环泊酚和内标的检测均无干扰,符合2020 年版《中国药典》(四部)的相关要求[13]。
2.4.2 线性关系考察
取系列环泊酚对照品溶液5 μL,加入大鼠空白血浆95 μL,涡旋1 min后,配制成质量浓度分别为15、30、60、125、250、500、1 000、2 000 ng/mL 的环泊酚模拟血浆样品,按“2.3”项下方法处理并按“2.1”项下条件进样测定,记录峰面积。以环泊酚质量浓度(x)为横坐标、环泊酚与内标峰面积的比值(y)为纵坐标,采用加权最小二乘法(权重为1/x2)进行线性回归。结果显示,环泊酚的线性回归方程为y=1.907×10-3x+5.050×10-4(R 2=0.999 2),用于检测的线性范围为15~2 000 ng/mL,定量下限为15 ng/mL。
2.4.3 精密度与准确度试验
取定量下限、低、中、高质量浓度的环泊酚质控工作液5 μL,加入大鼠空白血浆95 μL,涡旋1 min 后,配制成质量浓度分别为15、30、250、1 600 ng/mL 的质控血浆样品溶液,每质量浓度平行5 份,于同一天内按“2.3”项下方法处理并按“2.1”项下条件进样测定,记录峰面积,计算批内精密度和准确度;连续3 d 按“2.3”项下方法处理并按“2.1”项下条件进样测定,计算批间精密度和准确度。精密度和准确度分别用相对标准偏差(relative standard"deviation,RSD)和相对误差(relative error,RE)表示。结果(表1)显示,环泊酚的批内及批间精密度试验的RSD 均小于8%,RE 均不超过±6%,符合2020 年版《中国药典》(四部)的相关要求[13]。
2.4.4 提取回收率和基质效应考察
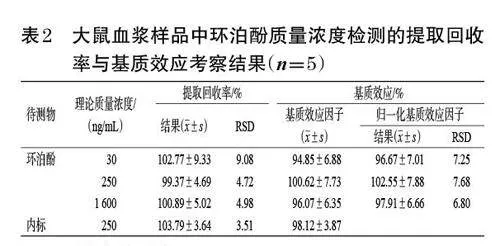
按照“2.4.3”项下方法制备低、中、高质量浓度的质控血浆样品溶液,每质量浓度平行5 份,按“2.3”项下方法处理并按“2.1”项下条件进样测定,记录待测物峰面积(A);取不同来源的空白血浆,按“2.3”项下方法处理,得到空白基质溶液,加入相应质量浓度的环泊酚质控工作液和内标溶液,制得与上述质控血浆样品溶液质量浓度相同的样品溶液,按“2.1”项下条件进样测定,记录待测物峰面积(B);取低、中、高质量浓度的环泊酚质控工作液,加50% 乙腈,制得与上述质控血浆样品溶液质量浓度相同的样品溶液,按“2.1”项下条件进样测定,记录待测物峰面积(C)。按下式计算提取回收率和基质效应因子,提取回收率=A/B×100%,基质效应因子=B/C×100%;以环泊酚的基质效应因子除以内标的基质效应因子计算归一化基质效应因子。结果(表2)显示,环泊酚的平均提取回收率为99.37%~102.77%,RSD不超过10%(n=5);内标的平均提取回收率为103.79%,RSD为3.51%(n=5);环泊酚的平均归一化基质效应因子为96.67%~102.55%,RSD均小于8%(n=5)。
2.4.5 稳定性试验
按照“2.4.3”项下方法制备低、中、高质量浓度的质控血浆样品溶液,每质量浓度平行5 份,共4 组。取1 组质控血浆样品溶液,按“2.3”项下方法处理后于自动进样器(4 ℃)内放置24 h,再按“2.1”项下条件进样测定,考察样品在进样器中静置的稳定性;另外3 组质控血浆样品溶液分别于室温(25 ℃)下放置8 h、-40 ℃储存30 d、冻融(-40 ℃~室温)循环3 次后按“2.3”项下方法处理并按“2.1”项下条件进样测定,考察样品的短期稳定性、长期稳定性和冻融稳定性。结果显示,在上述条件下3个质量浓度的质控血浆样品溶液中,环泊酚峰面积的RSD 均小于9%(n=5),符合2020 年版《中国药典》(四部)的相关要求[13]。
2.5 大鼠体内环泊酚药动学和药效学研究
2.5.1 药动学研究
将18 只健康雄性SD大鼠,随机分为对照组、氯吡格雷正常剂量组、氯吡格雷高剂量组,每组6 只。给药方案如下:对照组大鼠每天灌胃0.5%CMC-Na 溶液(每200 g体重予1 mL);氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠分别每天灌胃氯吡格雷7.5、15 mg/kg(以0.5%CMC-Na溶液为溶剂,每200 g 体重予1 mL;剂量分别参考硫酸氢氯吡格雷片药品说明书的推荐及维持剂量经换算而得);每天1 次,连续14 d。于末次给药12 h后,经大鼠尾静脉注射环泊酚注射液2.4 mg/kg(剂量参考环泊酚注射液药品说明书的推荐剂量经换算而得),并在注射后2、4、8、12、16、20、30、45、60 min 于眼内眦取血约300 μL,分别置于肝素化离心管中,以10 900 r/min离心10 min,取上层血浆于-40 ℃冻存,备用。取大鼠血浆样品,按“2.3”项下方法处理并按“2.1”项下条件进样测定,记录峰面积,以内标法计算血浆中环泊酚的质量浓度。采用GraphPad Prism 8.0.2 软件绘制药时曲线,应用DAS 2.0 软件的非房室模型对各组大鼠体内环泊酚的药动学参数进行分析。采用SPSS 27 软件对药时曲线下面积(area under the drug concentration time curve,AUC)、平均驻留时间(mean residence time,MRT)、消除半衰期(elimination half-life,t1/2)、血浆清除率(plasmaclearance,CL)、表观分布容积(apparent volume of distribution,Vd)、峰浓度(peak concentration,cmax)等进行统计分析(MRT、t1/2、CL、Vd采用单因素方差分析进行多组间比较,并使用LSD-t 检验进行多重比较;AUC和cmax经对数转换后再按上述方法进行比较),检验水准α=0.05。
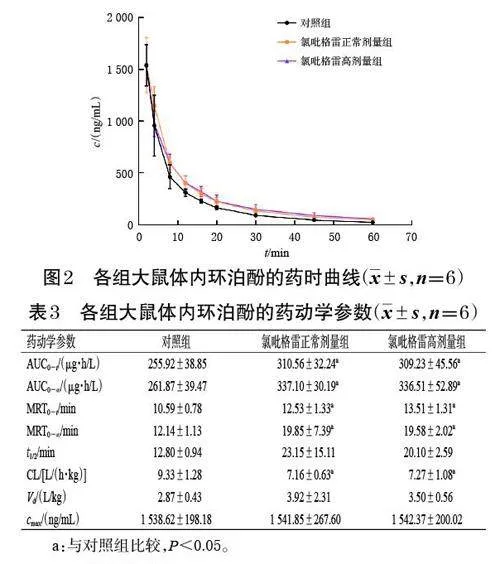
环泊酚的药时曲线如图2 所示,3 组大鼠体内环泊酚的血药浓度均随时间延长而迅速下降,其中对照组的下降趋势最明显。各组大鼠体内环泊酚的药动学参数如表3 所示,与对照组比较,氯吡格雷正常剂量组大鼠体内环泊酚的平均AUC0-t、AUC0-∞ 分别升高了21.4%、28.7%,平均MRT0-t、MRT0-∞分别延长了18.3%、63.5%,平均CL 降低了23.3%,差异均具有统计学意义(P<0.05);氯吡格雷高剂量组大鼠体内环泊酚的平均AUC0-t、AUC0-∞分别升高了20.8%、28.5%,平均MRT0-t、MRT0-∞ 分别延长了27.6%、61.3%,平均CL 降低了22.1%,差异均具有统计学意义(P<0.05)。然而,氯吡格雷高剂量组大鼠体内环泊酚各药动学参数与氯吡格雷正常剂量组比较,差异均无统计学意义(P>0.05)。
2.5.2 药效学研究
将“2.5.1”项下尾静脉注射环泊酚注射液后的各组大鼠迅速放置于平整柔软的保温垫上,从其处于仰卧位并失去翻正反射时开始计时,至其能够成功翻转至俯卧位时结束计时,统计每只大鼠的翻正反射消失(loss ofrighting reflex,LORR)持续时间[14]。采用SPSS 27 软件对LORR持续时间进行单因素方差分析,并使用LSD-t检验进行多重比较,检验水准α=0.05。3 组大鼠经尾静脉注射环泊酚注射液后,均迅速失去翻正反射;对照组大鼠的LORR 持续时间为(674.5±65.0)s,而氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠的LORR 持续时间分别为(806.0±105.8)s、(835.7±124.4)s,均显著长于对照组(P<0.05),但后两组之间比较差异无统计学意义(P>0.05)。
3 讨论
环泊酚是一种基于丙泊酚结构改造而成的新型短效静脉麻醉药[15]。既往研究采用液质联用法测定丙泊酚的血药浓度,所用流动相为甲酸溶液-甲醇[16],本研究改用洗脱能力更强的乙腈作为有机相,可以使待测物色谱峰峰宽相对更窄、峰形更好。此外,鉴于环泊酚为弱酸性化合物,故本研究应用负离子扫描模式,并以0.01%氨水作为水相以提供弱碱性环境(pH≈8.1),从而增强待测物的离子化程度。经进一步优化发现,在水相中加入乙酸铵可以提供充足的铵根离子,改善色谱峰拖尾并使响应值升高50% 左右,还可以避免因加入过量的碱而影响色谱柱的寿命。本研究选用氘代环泊酚作为环泊酚的内标,该成分拥有与待测物基本相同的理化性质、色谱行为和响应特征,有利于待测物的准确定量[17]。
本研究中,氯吡格雷(7.5 mg/kg,灌胃,每天1 次)和环泊酚(2.4 mg/kg,静脉注射)在大鼠体内的给药方式和剂量均根据药品说明书的推荐剂量(氯吡格雷口服75mg,每天1 次;环泊酚单次注射0.4 mg/kg)换算确定[18―19]。此外,双倍维持剂量(150 mg/d)的氯吡格雷在临床实践中具有重要价值——《抗血小板治疗中国专家共识》推荐,对于无出血高危险、接受经皮冠状动脉介入治疗的急性冠脉综合征患者,在使用氯吡格雷负荷剂量600 mg 后,可降低至150 mg/d,持续6 d 后再以75 mg/d维持[20]。国内外研究证实,氯吡格雷双倍维持剂量方案是CYP2C19 酶功能异常患者抗血小板治疗的有效策略[21―22]。因此,本研究设定氯吡格雷高剂量组大鼠的氯吡格雷给药剂量为正常剂量组的2 倍。考虑到氯吡格雷用药的长期性,本研究采用连续给药14 d 的方式,以保证药物的充分干预。
Nishiya 等[23]曾选用CYP2B6 酶探针药物安非他酮作为代谢底物,在体外孵育实验中证实了氯吡格雷能高度抑制重组人CYP2B6 酶的活性。本研究选用SD大鼠为对象,初步探讨了氯吡格雷对环泊酚体内代谢的影响。药动学研究结果表明,环泊酚起效迅速,体内无蓄积,麻醉恢复快。其中,对照组大鼠的药时曲线下降趋势最明显,且随着时间的延长,该曲线与氯吡格雷正常剂量组、氯吡格雷高剂量组大鼠的药时曲线逐渐分离。氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠的AUC、MRT、CL均较对照组显著改变,表明连续给予氯吡格雷14 d 后,环泊酚在大鼠体内的清除速率下降,药物暴露量增加,其在体内的驻留时间较对照组显著延长。由此可见,氯吡格雷对环泊酚在大鼠体内的代谢具有一定的抑制作用。此外,与对照组比较,氯吡格雷正常剂量组和氯吡格雷高剂量组大鼠的平均LORR 持续时间分别延长了19.5% 和23.9%,说明氯吡格雷可以延长环泊酚对大鼠的麻醉作用时间。值得注意的是,氯吡格雷两个剂量组大鼠的药动学和药效学结果比较差异均无统计学意义,表明正常剂量的氯吡格雷即可对环泊酚在大鼠体内的代谢产生充分的抑制效果。
本研究结果表明,氯吡格雷可以抑制大鼠体内环泊酚的代谢,延长大鼠的LORR 持续时间,为环泊酚相关DDIs 研究以及临床联合用药的安全性和有效性提供了理论参考。然而,本实验缺乏对大鼠血压、心率以及呼吸频率等多个生理指标的考察,难以评价氯吡格雷抑制环泊酚代谢后对大鼠麻醉安全性和术后并发症的影响。此外,由于大鼠和人之间存在种属差异,临床患者不同的疾病状态以及个体差异都会影响药物在体内的代谢过程,故有必要进一步对环泊酚相关DDIs予以验证。
参考文献
[ 1 ] NYAMABO A K,YU H,LIU Z,et al. Drug-drug interaction
prediction with learnable size-adaptive molecular substructures[
J]. Brief Bioinform,2022,23(1):bbab441.
[ 2 ] WU H,XING Y,GE W H,et al. Drug-drug interaction extraction
via hybrid neural networks on biomedical literature[
J]. J Biomed Inform,2020,106:103432.
[ 3 ] KALGUTKAR A S,OBACH R S,MAURER T S. Mechanism-
based inactivation of cytochrome P450 enzymes:
chemical mechanisms,structure-activity relationships and
relationship to clinical drug-drug interactions and idiosyncratic
adverse drug reactions[J]. Curr Drug Metab,2007,8
(5):407-447.
[ 4 ] MIRZAEI M S,IVANOV M V,TAHERPOUR A A,et al.
Mechanism-based inactivation of cytochrome P450 enzymes:
computational insights[J]. Chem Res Toxicol,
2021,34(4):959-987.
[ 5 ] RICHTER T,MÜRDTER T E,HEINKELE G,et al. Potent
mechanism-based inhibition of human CYP2B6 by
clopidogrel and ticlopidine[J]. J Pharmacol Exp Ther,
2004,308(1):189-197.
[ 6 ] LU M,LIU J,WU X K,et al. Ciprofol:a novel alternative
to propofol in clinical intravenous anesthesia[J]. Biomed
Res Int,2023,2023:7443226.
[ 7 ] LIAO J,LI M T,HUANG C L,et al. Pharmacodynamics
and pharmacokinetics of HSK3486,a novel 2,6-disubstituted
phenol derivative as a general anesthetic[J]. Front
Pharmacol,2022,13:830791.
[ 8 ] 中国心胸血管麻醉学会非心脏麻醉分会,中国医师协会
心血管内科医师分会,中国心血管健康联盟. 抗血栓药
物围手术期管理多学科专家共识[J]. 中华医学杂志,
2020,100(39):3058-3074.
The Non-Cardiac Anesthesia Branch of the Chinese Society
of Cardiothoracic Anesthesia,the Cardiovascular Physician
Branch of Chinese Medical Doctor Association,
Chinese Cardiovascular Health Alliance. Multidisciplinary
expert consensus on perioperative management of antithrombotic
drugs[J]. Natl Med J China,2020,100(39):
3058-3074.
[ 9 ] JUPITER D C,FANG X,ADHIKARI D,et al. Safety of
continued clopidogrel use in the preoperative course of
gastrointestinal surgery:a retrospective cohort study[J].
Ann Surg,2017,265(2):370-378.
[10] ABDULHAMID A K,KHALAF R J. Safety of not withholding
clopidogrel therapy during the immediate several
days pre- and post-trans-urethral resection of prostate
(TURP) :a retrospective cohort study[J]. Int Urol
Nephrol,2022,54(5):985-992.
[11] MAXFIELD D G,BERNASEK T L,ENGEL C C,et al.
Is it safe to continue clopidogrel in elective hip and knee
arthroplasty?[J]. J Arthroplasty,2022,37(9):1726-1730.
[12] YANG D D,HU Y,RUAN Z R,et al. Drug-drug interaction
of ciprofol injectable emulsion with mefenamic acid
capsules in healthy subjects[J]. Br J Clin Pharmacol,
2023,89(10):3165-3174.
[13] 国家药典委员会. 中华人民共和国药典:四部[M]. 2020
年版. 北京:中国医药科技出版社,2020:466-472.
National Pharmacopoeia Commission. Pharmacopoeia of
the People’s Republic of China:part Ⅳ[M]. 2020 edition.
Beijing:China Medical Science and Technology Press,
2020:466-472.
[14] TAI S K,MA J Y,LEUNG L S. Medial septal cholinergic
neurons modulate isoflurane anesthesia[J]. Anesthesiology,
2014,120(2):392-402.
[15] QIN L L,REN L,WAN S L,et al. Design,synthesis,and
evaluation of novel 2,6-disubstituted phenol derivatives
as general anesthetics[J]. J Med Chem,2017,60(9):3606-
3617.
[16] LEE K M,HAN S M,LEE S,et al. Fluoride-assisted liquid
chromatography-tandem mass spectrometry method
for simultaneous analysis of propofol and its metabolites
without derivatization in urine[J]. J Chromatogr A,2021,
1652:462360.
[17] LOH G O K,WONG E Y L,GOH C Z,et al. Simultaneous
determination of tramadol and paracetamol in
human plasma using LC-MS/MS and application in
bioequivalence study of fixed-dose combination[J]. Ann
Med,2023,55(2):2270502.
[18] 徐叔云. 药理实验方法学[M]. 3 版. 北京:人民卫生出版
社,2002:202-204.
XU S Y. Pharmacological experimental methodology[M].
3rd edition. Beijing:People’s Health Publishing House,
2002:202-204.
[19] 黄继汉,黄晓晖,陈志扬,等. 药理试验中动物间和动物
与人体间的等效剂量换算[J]. 中国临床药理学与治疗
学,2004,9(9):1069-1072.
HUANG J H,HUANG X H,CHEN Z Y,et al. Dose conversion
among different animals and healthy volunteers in
pharmacological study[J]. Chin J Clin Pharmacol Ther,
2004,9(9):1069-1072.
[20] 中华医学会心血管病学分会,中华心血管病杂志编辑委
员会. 抗血小板治疗中国专家共识[J]. 中华心血管病杂
志,2013,41(3):183-194.
Cardiovascular Disease Branch of Chinese Medical Association,
Editorial Committee of Chinese Journal of Cardiovascular
Disease. Expert consensus on antiplatelet
therapy in China[J]. Chin J Cardiol,2013,41(3):183-194.
[21] 方素君,蔡金星,邹奇锋,等. CYP2C19 基因中间代谢型
ACS患者双倍剂量氯吡格雷和标准剂量替格瑞洛疗效
与安全性评价[J]. 中国医院药学杂志,2021,41(14):
1461-1465,1469.
FANG S J,CAI J X,ZOU Q F,et al. Efficacy and safety
of double-dose clopidogrel versus standard-dose ticagrelor
in acute coronary syndrome patients with CYP2C19 intermediate
metabolized genotype[J]. Chin J Hosp Pharm,
2021,41(14):1461-1465,1469.
[22] GALLI M,OCCHIPINTI G,BENENATI S,et al. Comparative
effects of different antiplatelet strategies in carriers
of CYP2C19 loss-of-function alleles:a network metaanalysis[
J]. Eur Heart J Cardiovasc Pharmacother,2024,
10(6):526-536.
[23] NISHIYA Y,HAGIHARA K,ITO T,et al. Mechanismbased
inhibition of human cytochrome P450 2B6 by
ticlopidine,clopidogrel,and the thiolactone metabolite of
prasugrel[J]. Drug Metab Dispos,2009,37(3):589-593.
(收稿日期:2024-07-30 修回日期:2024-12-23)
(编辑:李 劲)
