高温胁迫下金钗石斛花的生理及转录组响应分析
2025-02-09蒙红霞李佳蔚龚建英王华新




摘""要:金钗石斛具有较高的观赏价值,是春石斛杂交品种群的重要亲本之一,为探索金钗石斛花响应高温胁迫的生理和分子机制,本研究结合水势、细胞膜通透性监测、乙烯相关化合物含量测定,以及转录组学分析,以36"℃高温胁迫5、10、24"h为处理组,常温培养为对照组,研究36"℃下金钗石斛花的生理特性,分析其对高温的响应转录组特征。结果表明:36"℃高温胁迫在24"h内对金钗石斛花水分状况和细胞膜通透性几乎没有影响,3个高温处理组的金钗石斛花乙烯前体(ACC)含量与对照组(Dno-CK)相比均显著增加;高温处理5"h与常温对照组(Dno-CK"vs"Dno-5h)、高温处理10"h与常温对照组(Dno-CK"vs"Dno-10h)、高温处理24"h与常温对照组(Dno-CK"vs"Dno-24h)3个比较组的差异基因分别为25"204、25"528、26"878个,上调表达与下调表达的基因量约为1∶1,随着高温胁迫时间的延长,金钗石斛花的差异表达的基因总数逐渐上升。KEGG富集分析结果表明,3个比较组差异基因均富集到单萜生物合成通路,说明高温促进金钗石斛花挥发性萜类化合物的合成。GO功能富集分析结果表明,金钗石斛花受高温胁迫大部分差异基因富集到遗传信息处理途径、代谢途径相关的通路,在核苷酸切除修复、淀粉和蔗糖代谢、内质网中的蛋白质加工3条通路中差异基因数量最多,说明高温激发金钗石斛花提高各类代谢活动响应热胁迫。对差异表达基因中热激蛋白基因(HSP)筛选发现,金钗石斛花的HSP基因大量上调表达响应高温胁迫,金钗石斛花在24"h内响应高温胁迫的HSP基因主要是HSP20基因,其次是HSP90基因。金钗石斛花的热响应基因的进一步研究可针对HSP20基因和HSP90基因。本研究结果可为石斛耐热育种研究提供参考,为耐高温春石斛品系的培育提供理论支持。
关键词:金钗石斛;高温胁迫;生理特性;转录组分析;热激蛋白中图分类号:S567.239""""""文献标志码:A
Physiological"and"Transcriptome"Response"Analysis"of"Dendrobium"nobile"Flowers"under"High"Temperature"Stress
MENG"Hongxia1,2,"LI"Jiawei1,2*,"GONG"Jianying3,"WANG"Huaxin3
1."College"of"Forestry,"Guangxi"University"/"Guangxi"Key"Laboratory"of"Forest"Ecology"and"Conservation,"Nanning,"Guangxi""530004,"China;"2."State"Key"Laboratory"for"Conservation"and"Utilization"of"Subtropical"Agro-bioresources,"College"of"Forestry,"Guangxi"University,"Nanning,"Guangxi"530004,"China;"3."Guangxi"Forestry"Research"Institute,"Nanning,"Guangxi"530002,"China
Abstract:"Dendrobium"nobile"has"a"high"ornamental"value"and"is"one"of"the"important"parental"plants"in"the"hybridization"group"of"Dendrobium."To"explore"the"physiological"and"molecular"mechanisms"of"D."nobile"flowers"in"response"to"high-temperature"stress,"this"study"combined"water"potential,"cell"membrane"permeability"monitoring,"ethylene-related"compound"content"determination,"and"transcriptome"analysis."Treatment"groups"were"subjected"to"36"℃"high-tempe rat ure"stress"for"5"h,"10"h"and"24"h,"with"a"normal"temperature"culture"as"the"control."The"physiological"characteristics"of""D."nobile"flowers"under"36"℃"and"the"transcriptome"response"to"high"temperature"were"studied."The"results"shoed"that"36"℃"high-temperature"stress"had"almost"no"effect"on"the"water"status"and"cell"membrane"permeability"of"D."nobile"flowers"within"24h."The"content"of"ethylene"precursor"(ACC)"in"the"flowers"significantly"increased"in"all"three"high-temperature"treatment"groups"compared"to"the"control"(Dno-CK)."The"number"of"differentially"expressed"genes"between"the"5"h"high-temperature"treatment"and"the"control"group"(Dno-CK"vs"Dno-5h),"the"10"h"high-temperature"treatment"and"the"control"(Dno-CK"vs"Dno-10h),"and"the"24"h"high-temperature"treatment"and"the"control"(Dno-CK"vs"Dno-24h)"was"25"204,"25"528"and"26"878,"respectively,"with"the"number"of"genes"up-and"downregulated"was"approximately"1∶1."As"the"duration"of"high-temperature"stress"increased,"the"total"number"of"differentially"expressed"genes"in"D."nobile"flowers"gradually"rose."KEGG"enrichment"analysis"showed"that"the"differential"genes"of"the"three"comparison"groups"were"enriched"tonbsp;the"monoterpene"biosynthesis"pathway,"indicating"that"high"temperature"promoted"the"synthesis"of"volatile"terpenoids"in"D."nobile."Functional"enrichment"analysis"indicated"that"most"of"the"differentially"ex-pressed"genes"in"response"to"high-temperature"stress"were"enriched"in"pathways"related"to"genetic"information"processing"and"metabolic"pathways,"with"the"highest"number"of"differential"genes"in"the"nucleotide"excision"repair,"starch"and"sucrose"metabolism,"and"protein"processing"in"the"endoplasmic"reticulum"pathways."This"suggests"that"high"temperature"stimulates"D."nobile"flowers"to"enhance"various"metabolic"activities"in"response"to"heat"stress."Screening"of"differentially"expressed"genes"revealed"that"heat"shock"protein"(HSP)"genes"in"D."nobile"flowers"were"significantly"up-regulated"in"response"to"high-temperature"stress."The"HSP"genes"responding"to"high-temperature"stress"within"24"h"in"D."nobile"flowers"were"primarily"the"HSP20"genes,"followed"by"the"HSP90"genes."Further"research"on"the"heat"re-sponse"genes"of"D."nobile"flowers"can"focus"on"the"HSP20"and"HSP90"genes."This"study"on"the"physiological"and"transcriptome"response"of"""""D."nobile"flowers"to"high-temperature"stress"would"provide"a"reference"for"heat-tolerant"breeding"research"and"theoretical"support"for"the"cultivation"of"heat-resistant"D."varieties.
Keywords:"Dendrobium"nobile;"high"temperature"stress;"physiological"property;"transcriptome"analysis;"heat"shock"protein
DOI:"10.3969/j.issn.1000-2561.2025.02.003
兰科石斛属(Dendrobium)园艺种是盆花与切花中的名贵类群,可分为春石斛和秋石斛两类杂交品种群。春石斛是以原产于东亚低纬度高海拔地区的落叶种类为亲本,主要亲本包括原产于中国的金钗石斛(D."nobile)。金钗石斛性喜温暖湿润,生于山地林中树干上或山谷岩石上,目前在中国广西、湖北、贵州、云南、西藏等地区均有分布[1]。花香可以增强观赏植物的美学特性,在植物的繁殖过程中起着重要作用,金钗石斛花香轻清,具有较高观赏价值的同时还可以用于镇静解郁、抗炎等[2]。金钗石斛生境的特殊性导致其生长发育容易受到各种环境因子的影响,高温便是其中之一。目前针对植物高温胁迫的研究主要集中在植物营养器官的形态、生理生化特性、光合作用与呼吸作用、分子调节机制等方面[3],对于花器官的直接关注较少。
植物水分生理状态可以通过植物器官的水势直接反映,植物在面临胁迫时水势变化较为敏感,大部分植物通过降低水势应对胁迫,如景天植物在低盐与高盐胁迫下叶片水势均呈下降趋势[4],新疆大叶苜蓿在轻度与重度水分胁迫下叶片水势均呈下降趋势[5]。也有部分植物如猪毛菜采用升高叶水势的方式适应胁迫环境[6]。高温胁迫会导致细胞膜受损,内稳态失衡,电导率可以在一定程度上反映其受损程度。一般情况下,耐热性强的植株细胞膜稳定性高于耐热性差的植株,植物遭受温度胁迫的程度与电导率大小呈正比关系[7-8]。气态植物激素乙烯参与植物对胁迫环境的响应,如40"℃高温胁迫下黑油冬白菜在48"h内乙烯含量呈直线上升状态[9]。乙烯的合成主要由2种特定的酶促过程完成,ACC合酶(ACS)将底物转化为ACC后,氧化酶(ACO)将ACC转化为乙烯,研究表明,ACC(乙烯前体)预处理可以提高拟南芥在40"℃下的存活率,减少氧化损伤,并诱导其耐热性[10-11]。
高温胁迫启动各种代谢途径,目前已有大量与响应高温胁迫高度相关的途径被鉴别,如谷胱甘肽代谢途径(glutathione"metabolism"pathways)、光合作用-天线蛋白代谢通路(photosyn thetic-an t enna"protein"metabolism"pathway)、叶绿素代谢通路(the"chlorophyll"metabolism"pathway)、碳代谢途径(carbon"metabolic"pathways)、单萜类生物合成(monoterpene"class"biosynthesis)等[12-15]。处于高温胁迫的植物通过各种热响应基因的表达适应胁迫环境,近年研究发现,热激蛋白(heat"shock"proteins,"HSP)在植物遭受高温胁迫过程中大量表达,如火龙果在40"℃高温胁迫下处理5"h后HSP21基因开始大量上调表达[16]。月季RcHSP18.1基因常温下不表达,受到46"℃高温胁迫2.5"h内大量表达[17]。三棱虾脊兰在高温胁迫后的差异基因中鉴定到XTH、HSP等基因家族,且胁迫后HSP20、HSP40和HSP70基因全部上调表达[18]。在42"℃高温胁迫处理6"h内,黄瓜HSP20、HSP70和HSP90基因也全部上调表达[19]。高温胁迫会导致生物体中的蛋白质变性,HSP作为分子伴侣,协助蛋白质复性、稳定、细胞内转运和降解,防止受损蛋白质的积累,维持细胞内环境的稳定性[20-21]。
前人针对石斛高温胁迫分子机制的相关研究表明,翅萼石斛花在40"℃高温胁迫3"h后有82个HSP基因明显上调表达[22];铁皮石斛经历35"℃高温胁迫后,与跨膜转运功能相关的基因均下调表达,推测高温胁迫会降低石斛的质膜转运能力[23];40"℃高温胁迫1"h后,鼓槌石斛花中表达量最高的10个基因均为HSP基因[24]。目前有关金钗石斛高温胁迫转录组响应分析的相关研究较少,基于前人对石斛属植物高温胁迫的研究,本研究以金钗石斛作为试验材料,常温下的植株作为对照组,利用人工气候箱进行36"℃高温处理5、10、24"h,利用RNA-seq技术对处理后的金钗石斛花被进行转录组测序,利用液相色谱串联质谱(LC-MS/MS)法测定花被乙烯类激素含量,同时测定水势、电导率参数。通过解读金钗石斛高温胁迫生理响应及转录组响应,以期为金钗石斛的耐高温品种选育提供科学依据。
1""材料与方法
1.1""材料
供试材料为金钗石斛(图1),采自广西壮族自治区林业科学研究院,于花期(2024年4月)选取长势一致且健康的12株石斛进行试验。高温处理:在花朵完全展开时将植株放入人工气候箱,设置36"℃高温5"h(Dno-5h)、10"h(Dno-10h)、24"h(Dno-24h)3组处理,光照12"h/d。常温培养(24~26"℃)的金钗石斛植株作为对照(Dno-CK),每个处理3株金钗石斛。各处理结束后采集花朵的花瓣放入50"mL离心管中,液氮速冻6~8"min,于‒80"℃冰箱中保存,用于后续转录组测序及乙烯类激素含量测定。
1.2""方法
1.2.1""花朵水势及电导率测定""对照组(Dno-"CK)采集常温下的花朵,高温处理组(Dno-5h、Dno-10h、Dno-24h)在处理结束后将植株拿出人工气候箱后,迅速采集测定。花朵水势采用压力势水势仪(PMS,"Corvallis,Oregon,USA)测定,花朵电导率采用电导率仪(DDSJ-319L型)测定,每个处理在3株金钗石斛上各自采集1朵花朵测定。
1.2.2""乙烯类激素含量测定""采用液相色谱串联质谱法(LC-MS/MS)测定,研磨Dno-CK、Dno-5h、Dno-10h、Dno-24h四个处理的样品后加入内标混合溶液、提取剂,离心后80%甲醇溶液复溶,过滤,置于样瓶里。设置液相条件和质谱条件提取代谢物采集质谱数据,采用Analyst"1.6.3软件和MultiQuant"3.0.3软件处理质谱数据,绘制激素的标准曲线并计算其含量。
1.2.3""转录组测序""(1)RNA提取、cDNA文库构建及测序。采用乙醇沉淀法和CTAB-"PBIOZOL提取试验样本总RNA,使用Qubit荧光定量仪和Qsep400高通量生物片段分析仪对总RNA进行鉴定和定量。cDNA文库构建步骤主要包括:富集mRNA,以小片段mRNA为模板反转录生成第一链cDNA并合成第二链cDNA,对双链cDNA进行测序接头连接后获取250~350"bp的插入片段的文库,经PCR扩增后构建完成文库。库检合格后进行Illumina测序。
(2)转录组数据处理。使用fastp对原始数据进行过滤得到clean"reads,转录本组装使用Trinity软件完成,聚类去冗余由Corset软件完成。利用DIAMOND软件在KEGG、NR、Swiss-Prot、GO、COG/KOG、Trembl数据库中对去冗余后的转录本序列进行注释分析。
(3)差异表达基因分析。使用RSEM软件计算转录本的FPKM值,以此定量基因表达水平。使用DESeq"2分析Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三组之间的差异表达基因(DEGs),差异基因的筛选条件为|log2"(Fold"Change)|≥1,且FDRlt;0.05。基于超几何检验进行富集分析,KEGG富集分析以Pathway为单位进行超几何分布检验,GO富集分析则基于GO-term进行。
1.2.4""挥发性成分分析""采用HS-SPME-GC-MS进行挥发性成分分析。选择3株生长良好的金钗石斛于盛花期采集花朵,每株采集2朵花,保存于‒80"℃冰箱中。样品进行液氮研磨,每个样本称取约500"mg于顶空瓶中,加入饱和NaCl溶液和20"μL内标溶液,设置HS-SPME萃取条件、色谱条件和质谱条件,进行样本萃取及GC-MS分析。通过MassHunter软件处理质谱分析后的原始数据,对样本的代谢物进行质谱定性定量分析,根据离子流峰面积归一化法计算各组分在总挥发物中的相对含量。
1.3""数据处理
使用Excel"2016软件处理数据,使用SPSS"26.0软件评估差异的显著性,使用Origin"2021软
件制图。
2""结果与分析
2.1""高温胁迫下金钗石斛花朵生理响应
在电导率方面,3个高温组处理的花朵电导率与对照组基本一致,保持在4.29~4.95"μs/cm,无显著性差异(图2A),说明36"℃高温胁迫在24"h内对金钗石斛花朵细胞膜几乎无影响。在水势方面,3个高温组处理的花水势基本一致,保持在‒1.36~‒1.34"MPa,与对照组相比略有降低但无显著性差异(图2B),说明36"℃高温胁迫在24"h内对金钗石斛花朵水势的影响不大。乙烯前体(ACC)含量,与Dno-CK相比,Dno-5h增加了76.9%,差异显著;Dno-10h增加了17.9%,差异显著;Dno-24h增加了92.9%,差异显著。金钗石斛在36"℃高温胁迫24"h时ACC变化量达到最高,增长量最低点则在胁迫10"h时(图2C)。
2.2""测序数据质量评估
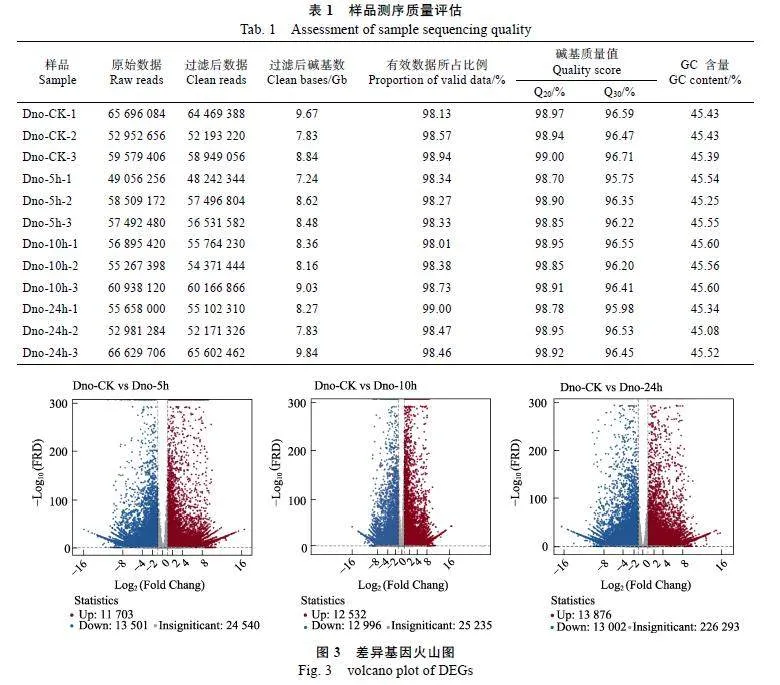
本研究对4个处理结束后的金钗石斛花朵进行转录组测序,得到12组金钗石斛花朵的原始数据和质控数据(表1)。其中,过滤后获得的clean"reads量共102.17"Gb,占原始数据(raw"reads)的98.01%以上。12组金钗石斛花朵的GC含量均大于45%,Q30碱基百分比保持在95%以上,Q20碱基百分比则保持在98%以上。表明本试验的转录组测序质量较好,能满足基因功能注释和分析要求。
2.3""差异表达基因筛选和分析
3个高温处理组与对照组Dno-CK差异表达基因的筛选结果显示(图3),金钗石斛经过5"h的36"℃高温胁迫后共差异表达25"204个基因,包括11"703个上调表达基因和13"501个下调表达基因;经过10"h的36"℃高温胁迫后共差异表达25"528个基因,表达上调和下调的差异基因分别为12"532个和12"996个;在24"h的36"℃高温胁迫后,金钗石斛差异表达的基因总数有26"878个,包括13"876个上调表达基因和13"002个下调表达基因。随着高温胁迫时间的延长,金钗石斛差异表达的基因总数逐渐上升。与5"h相比,10"h高温胁迫多了324个差异表达基因,而经过24"h高温胁迫的金钗石斛比Dno-5h、Dno-10h分别多了1674个、1350个差异表达基因。说明金钗石斛遭受高温胁迫5"h后差异基因数量有较大程度上升,且在热处理24"h的差异基因数量保持持续增长的状态。
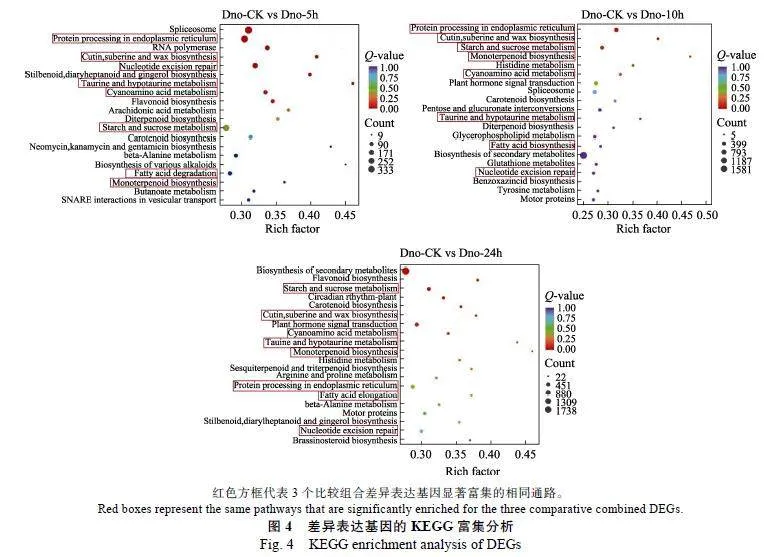
2.4""差异表达基因KEGG分析
对高温处理组与对照组的差异表达基因进行KEGG信号通路富集分析(图4),结果表明,Dno-"CK"vs"Dno-5h组富集最显著的20条通路中差异基因数量排名前5的通路主要包括剪接体(ko03040)、内质网中的蛋白质加工(ko04141)、RNA聚合酶(ko03020)、核苷酸切除修复(ko03420)、淀粉和蔗糖代谢(ko00500);Dno-CK"vs"Dno-10h组富集的通路主要包括内质网中的蛋白质加工(ko04141)、淀粉和蔗糖代谢(ko00500)、植物激素信号转导(ko04075)、剪接体(ko03040)、次生代谢物的生物合成(ko01110);Dno-CK"vs"Dno-24h组富集的通路主要包括次生代谢物的生物合成(ko01110)、淀粉和蔗糖代谢(ko00500)、植物激素信号转导(ko04075)、内质网中的蛋白质加工(ko04141)、核苷酸切除修复(ko03420)。
此外,Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-"10h、Dno-CK"vs"Dno-24h三组中差异表达基因显著富集的相同通路有8个,分别是归属于遗传信息处理过程的内质网中的蛋白质加工(ko04141)、核苷酸切除修复(ko03420)通路;归属于代谢过程的角质、木栓质和蜡生物合成(ko00073)、牛磺酸和低牛磺酸的代谢(ko00430)、氰氨基酸代红色方框代表3个比较组合差异表达基因显著富集的相同通路。
谢(ko00460)、淀粉和蔗糖代谢(ko00500)、脂肪酸降解(ko00071)、单萜生物合成(ko00902)通路。说明金钗石斛在经高温胁迫5~24"h的过程中,遗传信息处理途径和代谢途径发生了较大变化,其中内质网中的蛋白质加工(ko04141)、核苷酸切除修复(ko03420)、淀粉和蔗糖代谢(ko00500)3条通路富集程度较显著,且差异基因数量较多,说明这3条信号通路可能在金钗石斛响应高温胁迫上具有重要作用。
2.5""差异表达基因GO富集分析
对高温处理组与对照组的差异表达基因进行GO富集分析(图5)发现,Dno-CK"vs"Dno-5h组的差异表达基因GO富集有14"696个基因,Dno-CK"vs"Dno-10h组有14"865个基因,Dno-CK"vs"Dno-24h组有15"654个基因。分别取3组富集最显著的9个GO"term进行分析,结果表明,Dno-CK"vs"Dno-5h组的差异表达基因主要富集于2-羟戊二酸依赖性双加氧酶活性、伴侣蛋白结合、绿叶挥发性物质生物合成过程、sm样蛋白家族复合物、二十碳烷酸代谢过程、解剖结构形态发生的调控、剪接体snRNP复合物、细胞对热的响应和生长素稳态。Dno-CK"vs"Dno-10h组的差异表达基因主要富集于果胶分解代谢过程、酶抑制剂活性、伴侣蛋白结合、绿叶挥发性物质生物合成过程、二十碳烷酸代谢过程、天冬氨酸酯酶活性、L-甲硫氨酸从甲基硫代腺苷的回收、氨基酸回收和L-甲硫氨酸回收。Dno-CK"vs"Dno-24h组的差异表达基因主要富集于氧化还原酶活性、绿叶挥发性物质生物合成过程、黄酮类生物合成过程、外肽酶活性、丝氨酸型外肽酶活性、丝氨酸型羧基肽酶活性、羧肽酶活性、二十碳烷酸代谢过程和脂氧酶途径。此外,Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三组中差异表达基因显著富集的相同通路为绿叶挥发性物质生物合成过程和二十碳烷酸代谢过程。
2.6""热激蛋白基因分析
热激蛋白(heat"shock"proteins,"HSP)是在高温下合成的重要蛋白质,已被证明参与对环境压力的各种反应并调节许多发育过程。在高温处理组与对照组的差异表达基因功能注释列表中筛选红色方框代表3个比较组合差异表达基因显著富集的相同通路。
热激蛋白表达相关基因,结果表明(附表1),Dno-CK"vs"Dno-5h组差异表达基因中有71个上调表达的热激蛋白基因(48个HSP20基因,23个HSP90基因)和8个下调表达的热激蛋白基因(4个HSP20基因,4个HSP90基因);Dno-CK"vs"Dno-10h组差异表达基因中有78个上调表达的热激蛋白基因(49个HSP20基因,1个HSP70基因,28个HSP90基因)和9个下调表达的热激蛋白基因(7个HSP20基因,2个HSP90基因);Dno-CK"vs"Dno-24h组差异表达基因中有69个上调表达的热激蛋白基因(41个HSP20基因,28个HSP90基因)和6个下调表达的热激蛋白基因(5个HSP20基因,1个HSP90基因)。说明金钗石斛热激蛋白基因大量上调表达响应高温胁迫且表达的热激蛋白基因以HSP20为主。
对Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三组中共同上调表达的49个热激蛋白基因进行分析,结果如图6所示。有28个基因在5~24"h的高温胁迫处理下表达量呈下降趋势(图6A);有12个基因在5~10"h的表达量呈上升趋势,10~24"h的表达量呈下降趋势,10"h的表达量最高(图6B),而余下9个基因趋势与其相反,在10"h的表达量最低(图6C)。这49个热激蛋白基因由33个HSP20基因和16个HSP90基因组成。此外,Cluster-61924.7(HSP90基因)的表达量在3个高温胁迫处理中明显高于其余48个基因,在Dno-CK"vs"Dno-5h组中的表达量为其余基因的1.17~8.63倍,在Dno-CK"vs"Dno-10h组中的表达量为1.82~15.28倍,在Dno-CK"vs"Dno-24h组中的表达量为1.81~14.19倍。推测金钗石斛的Cluster-61924.7在响应高温胁迫过程中发挥重要作用。
2.7""金钗石斛花朵挥发性成分分析
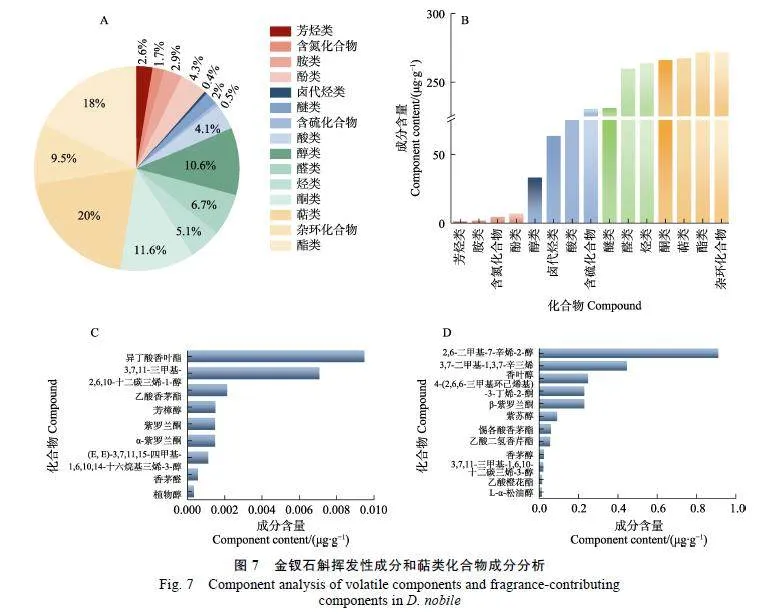
对金钗石斛盛花期的花朵挥发性成分进行鉴定,共检测出1480种挥发性物质,其中,萜类化合物的种类最多(296种),占总量的20%,其次为酯类(266种),占总量的18%,其余主要成分包括酮类、醇类、杂环化合物、醛类等(图7A)。挥发性成分相对含量较高的化合物为杂环化合物、脂类、萜类、酮类,分别达到271.74、271.67、267.39、266.06"μg/g(图7B)。对金钗石斛花中的挥发性萜类化合物进行分析,共有21种成分对花香具有贡献(图7C、图7D),其中2,6-二甲基-7-辛烯-2-醇和3,7-二甲基-1,3,7-辛三烯的贡献最大,"其相对含量分别为0.91、0.45"μg/g。
3""讨论
短期高温胁迫会对植物基因表达、生理活动、植株形态等造成一定的影响,为了生存和适应高温的逆境,植物在进化过程中发展出了复杂的自我防御机制。一般情况下,植物组织通过升高或降低水势响应胁迫环境,其水势与吸水能力成反比关系,金钗石斛在面临干旱胁迫时,叶片通过升高水势延迟脱水来应对干旱环境[25]。本研究发现高温处理下的花朵水势与常温对照组相比略有降低但无显著性差异,说明36"℃高温胁迫在24"h内对金钗石斛花朵水分状况影响不高。同一高温胁迫下不同种金线莲叶片电导率趋势不同,福建金线莲于胁迫的第2天电导率显著下降,第6天显著上升,而台湾金线莲叶片在高温胁迫6"d的电导率与对照组相比无显著性差异,这与大部分研究高温胁迫与电导率关系的结果不完全一致[26]。本研究中4个处理下的金钗石斛花朵电导率均无显著性差异,与台湾金线莲叶片电导率的变化情况相似,说明金钗石斛对36"℃高温胁迫具有较强的适应能力,此温度处理对其细胞膜通透性几乎没有影响。赵晖等[27]研究表明在高温胁迫下杜鹃花叶片乙烯释放速率增高且乙烯合成相关酶活性升高,本研究中3个高温处理组的金钗石斛花乙烯前体(ACC)含量与对照组Dno-CK相比均显著增加,这与赵晖等的研究结果相似。
本研究利用转录组测序筛选出Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三个比较组的差异基因分别为25"204、25"528、26"878个,上调表达与下调表达的基因量约为1∶1,这些基因可以作为后续研究与金钗石斛响应高温胁迫密切相关基因的候选基因。随着高温胁迫时间的延长,金钗石斛差异表达的基因总数逐渐上升。这与程秋如等[28]低温胁迫处理油棕的研究结果一致,说明植物通过激活大量基因表达响应温度胁迫。本研究前期对常温状态下金钗石斛进行挥发性成分分析发现,萜类化合物的种类及相对含量均较高,赋花香的主要成分为2,6-二甲基-7-辛烯-2-醇、3,7-二甲基-1,3,7-辛三烯。对差异基因进行KEGG功能富集分析发现,Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三个比较组差异基因均富集到单萜生物合成通路,说明高温促进金钗石斛花挥发性萜类化合物的合成。对差异基因进行GO功能富集分析发现,金钗石斛受高温胁迫大部分差异基因富集到遗传信息处理途径、代谢途径相关的通路,在核苷酸切除修复、淀粉和蔗糖代谢、内质网中的蛋白质加工3条通路中差异基因数量最多。说明高温激发金钗石斛提高各类代谢活动响应热胁迫,这与菜心、茶树等植物受高温胁迫后差异基因富集结果一致[29-30]。
热激蛋白是植物在温度胁迫下产生的一类保护性蛋白质,高度保守并存在于几乎所有生物体中,参与许多生长发育过程并对逆境胁迫做出反应[31]。对差异表达基因中HSP基因的筛选发现,金钗石斛热激蛋白基因大量上调表达,响应高温胁迫,Dno-CK"vs"Dno-5h、Dno-CK"vs"Dno-10h、Dno-CK"vs"Dno-24h三组中共同上调表达的49个热激蛋白基因由33个HSP20基因和16个HSP90基因组成。这说明金钗石斛在24"h内响应高温胁迫的HSP基因主要是HSP20基因,其次是HSP90基因。研究表明,HSP20是植物中最大的HSP家族,HSP20蛋白是许多高等植物中高温胁迫诱导的最丰富的蛋白质,HSP20基因在植物的非生物胁迫中起着关键作用[32];HSP90基因与植物胁迫信号转导、受体折叠、转录因子和激酶以及辅助细胞在胁迫下的存活有关[33-35]。共同上调表达的HSP基因大部分在5"h的表达量最高,5~24"h的表达量呈下降趋势。这与朱白婢等[36]研究高温处理后冬瓜耐热基因在0~4"h的表达模式相同,热响应基因在高温胁迫短时间内迅速表达,植物适应高温后开始逐渐下降。金钗石斛热响应基因的进一步研究可针对HSP20基因和HSP90基因进行,本研究对金钗石斛高温胁迫转录组响应的分析可为石斛耐热育种研究提供参考。
参考文献
[1]"明兴加,"李博然,"赵纪峰,"张植玮,"袁良琛,"王刚,"罗毅波."金钗、金钗石斛的名实考证[J]."中国中药杂志,"2016,"41(10):"1956-1964.MING"X"J,"LI"B"R,"ZHAO"J"F,"ZHANG"Z"W,"YUAN"L"C,"WANG"G,"LUO"Y"B."Investigation"of"original"materials"under"traditonal"Chinese"medicine"names"of"“Jinchai”"and"“Jinchai"Shihu”[J]."China"Journal"of"Chinese"Materia"Medica,"2016,"41(10):"1956-1964."(in"Chinese)
[2]"颜沛沛,"叶炜,"江金兰,"王培育."金钗石斛花香气日变化规律[J]."亚热带农业研究,"2021,"17(3):"179-183.YAN"P"P,"YE"W,"JIANG"J"L,"WANG"P"Y."Diurnal"variation"of"floral"scents"emitted"from"Dendrobium"nobile"Lindl."[J]."Subtropical"Agriculture"Research,"2021,"17(3):"179-183."(in"Chinese)
[3]"江珊,"吴龙英,"赵宝生,"黄佳惠,"蒋宇喆,"焦元,"黄进."植物耐受高温胁迫的分子机制研究进展[J]."中国农学通报,"2024,"40(9):"132-138.JIANG"S,"WU"Lnbsp;Y,"ZHAO"B"S,"HUANG"J"H,"JIANG"Y"J,"JIAO"Y,"HUANG"J."Molecular"mechanism"of"heat"stress"tolerance"in"plants:"a"review[J]."Chinese"Agricultural"Science"Bulletin,"2024,"40(9):"132-138."(in"Chinese)
[4]"张国军."盐胁迫对4种景天幼苗水势、荧光效率、丙二醛的影响[J]."农业科技与装备,"2012(7):"3-6.ZHANG"G"J."Effect"of"salt"stress"on"the"water"potential,"fluorescence"efficiency,"malonaldehyde"of"four"stonecrop"seedlings[J]."Agricultural"Science"amp;"Technology"and"Equipment,"2012(7):"3-6."(in"Chinese)
[5]"南思睿,"罗永忠,"于思敏,"仝慧鑫,"何钰."水分胁迫对紫花苜蓿叶片水势及生物量分配的影响[J]."草原与草坪,"2022,"42(6):"63-70.NAN"S"R,"LUO"Y"Z,"YU"S"M,"TONG"H"X,"HE"Y."Effects"of"water"stress"on"leaf"water"potential"and"biomass"allocation"of"Medicago"sativa[J]."Grassland"and"Turf,"2022,"42(6):"63-70."(in"Chinese)
[6]"付晓玥,"闫建成,"梁存柱,"贾成朕,"史斌,"张景慧,"齐小军."干旱与半干旱区一年生植物水势对模拟降水变化的响应[J]."内蒙古大学学报(自然科学版),"2012,"43(2):"160-167.FU"X"Y,"YAN"J"C,"LIANG"C"Z,"JIA"C"Z,"SHI"B,"ZHANG"J"H,"QI"X"J."Water"potentials"of"annual"plants"responseto"simulated"rainfall"in"aridand"semiarid"regions[J]."Journal"of"Inner"Mongolia"University"(Natural"Science"Edition),"2012,"43(2):"160-167."(in"Chinese)
[7]"胡娜,"孙玉红,"张国新,"陈思."6个品种樱花在北京地区的适应性研究[J]."亚热带植物科学,"2021,"50(1):"33-38.HU"N,"SUN"Y"H,"ZHANG"G"X,"CHEN"S."Adaptability"of"six"cultivars"of"cerasus"in"Beijing[J]."Subtropical"Plant"Science,"2021,"50(1):"33-38."(in"Chinese)
[8]"王宏辉,"顾俊杰,"房伟民,"陈发棣,"张栋梁."不同品种红掌叶片细胞膜稳定性和渗透调节物质对高温胁迫的响应[J]."上海农业学报,"2020,"36(6):"24-27.WANG"H"H,"GU"J"J,"FANG"W"M,"CHEN"F"D,"ZHANG"D"L."Response"of"cell"membrane"stability"and"osmotic"adjustment"substances"in"leaves"of"different"cultivars"of"Anthurium"andraeanum"under"high"temperature"stress[J]."Acta"Agriculturae"Shanghai,"2020,"36(6):"24-27."(in"Chinese)
[9]"高璐,"李晓锋,"奚丹丹,"朱玉英,"朱红芳."不同温度条件下淹水胁迫对不结球白菜植物激素的影响[J]."上海农业学报,"2022,"38(1):"33-40.GAO"L,"LI"X"F,"XI"D"D,"ZHU"Y"Y,"ZHU"H"F."Effects"of"waterlogging"stress"on"plant"hormones"in"non-heading"Chinese"cabbage"under"different"temperature"conditions[J]."Acta"Agriculturae"Shanghai,"2022,"38(1):"33-40."(in"Chinese)
[10]"BOLLER"T,"HERNER"R"C,"KENDE"H."Assay"for"and"enzymatic"formation"of"an"ethylenenbsp;precursor,"1-aminocyclo pro p ane-1-carboxylic"acid[J]."Planta,"1979,"145:"293-303.
[11]"LARKINDALE"J,"KNIGHT"M"R."Protection"against"heat"stress-induced"oxidative"damage"in"Arabidopsis"involves"calcium,"abscisic"acid,"ethylene,"and"salicylic"acid[J]."Plant"Physiol,"2002,"128:"682-695.
[12]"朱丹,"秦亚东,"李林华,"高焕."高温胁迫诱导薄荷差异表达基因的分析[J]."安徽科技学院学报,"2022,"36(6):"54-62.ZHU"D,"QIN"Y"D,"LI"L"H,"GAO"H."Analysis"of"differentially"expressed"genesin"Mentha"haplocalyx"Briq."inducedby"high"temperature"stress[J]."Journal"of"Anhui"Science"and"Technology"University,"2022,"36(6):"54-62."(in"Chinese)
[13]"周娜,"郑阳,"陆景伟,"胡燕,"陶伟林,"雷开荣,"潘晓雪."高温胁迫下萝卜苗期的转录组分析[J]."南方农业学报,2022,"53(3):"665-675.ZHOU"N,"ZHENG"Y,"LU"J"W,"HU"Y,"TAO"W"L,"LEI"K"R,"PAN"X"X."Transcriptome"analysis"of"Raphanus"sativus"seedlings"in"response"to"high"temperature"stress[J]."Journal"of"Southern"Agriculture,"2022,"53(3):"665-675."(in"Chinese)
[14]"郝力慧,"董彬,"朱绍华,"马进."牡丹响应高温胁迫的转录组分析及PsHSP基因表达[J]."浙江农林大学学报,"2021,"38(4):"802-811.HAO"L"H,"DONG"B,"ZHU"S"H,"MA"J."Transcriptome"analysis"and"PsHSP"gene"expression"of"Paeonia"suffruticosa"in"response"to"high"temperature"stress[J]."Journal"of"Zhejiang"A"amp;"F"University,"2021,"38(4):"802-811."(in"Chinese)
[15]"宋姣敏,"徐小萍,"陈裕坤,"陈桂信,"赖钟雄."热胁迫下水仙花叶片的转录组分析[J]."热带作物学报,2019,"40(10):"1991-2000.SONG"J"M,"XU"X"P,"CHEN"Y"K,"CHEN"G"X,"LAI"Z"X."An a l yses"of"leaf"transcriptome"under"heat"stress"in"narcissus[J]."Chinese"Journal"of"Tropical"Crops,"2019,"40(10):"1991-2000."(in"Chinese)
[16]"李俊成,"党芸芝,"孙清明."高温胁迫下火龙果转录组及热激蛋白响应分析[J]."浙江农业学报,"2024,"36(5):"1067-"1075.LI"J"C,"DANG"Y"Z,"SUN"Q"M."Transcriptome"analysis"and"HSP"response"of"pitaya"(Selenicereus"spp.)"under"heat"stress[J]."Acta"Agriculturae"Zhejiangensis,"2024,"36(5):"1067-1075."(in"Chinese)
[17]"杨碧楠,"李博文,"杨振宇,"徐奕芃,"阎韵清,"娄玉霞,"奉树成,"明凤."月季‘安吉拉’热胁迫反应机制及功能基因的挖掘[J]."园艺学报,"2024,"51(6):"1284-1296.YANG"B"N,"LI"B"W,"YANG"Z"N,"XU"Y"P,"YAN"Y"Q,"LOU"Y"X,"FENG"S"C,"MING"F."The"mechanism"of"heat"stress"response"and"the"exploration"of"functional"genes"in"Rosa"chinensis"'Angela'[J]."Acta"Horticulturae"Sinica,"2024,"51(6):"1284-1296."(in"Chinese)
[18]"陈伦妍,"朱雅婷,"陆艾鲜,"吴悠,"冀宏宇,"陈志清,"吴沙沙,"翟俊文."2种虾脊兰属(Calanthe"R."Br.)植物热胁迫相关基因表达模式分析[J]."植物遗传资源学报,"2023,"24(5):"1413-1425.CHEN"L"Y,"ZHU"Y"T,"LU"A"X,"WU"Y,"JI"H"Y,"CHEN"Z"Q,"WU"S"S,"ZHAI"J"W."The"analysis"of"expression"patterns"of"heat"stress-related"genes"in"two"species"of"Calanthe"R."Br.[J]."Journal"of"Plant"Genetic"Resources,"2023,"24(5):"1413-1425."(in"Chinese)
[19]"陈雪倩,"韩静,"任仲海."黄瓜响应高温胁迫转录组分析[J]."分子植物育种,"2021,"19(12):"3905-3914.CHEN"X"Q,"HAN"J,"REN"Z"H."Transcriptome"analysis"of"cucumber"in"response"to"high"temperature"stress[J]."Molecular"Plant"Breeding,"2021,"19(12):"3905-3914."(in"Chinese)
[20]"SONG"N"H,"AHN"Y"J."DcHsp17."7,"a"small"heat"shock"protein"in"carrot,"is"tissue-specifically"expressed"under"salt"stress"and"confers"tolerance"to"salinity[J]."New"Biotechnol,"2011,"28:"698-704.
[21]"QIN"F,"YU"B,"LI"W."Heat"shock"protein"101"(HSP101)"promotes"flowering"under"nonstress"conditions[J]."Plant"Physiol,"2021,"186:"407-419".
[22]"陈宏宇,"于莹."翅萼石斛花在温度胁迫下的转录组分析[J]."安徽农学通报,"2023,"29(15):"37-42.CHEN"H"Y,"YU"Y."Transcriptome"analysis"of"Dendrobium"cariniferum"under"temperature"stress[J]."Anhui"Agricultural"Science"Bulletin,"2023,"29(15):"37-"42."(in"Chinese)
[23]"徐载萍,"王孟颖,"孙福英,"赵雯,"杨莘锴,"万林春,"曾黎明."高温胁迫下铁皮石斛的转录组分析[J]."中国中药杂志,"2024,"49(20):"5433-5440.XU"Z"P,"WANG"M"Y,"SUN"F"Y,"ZHAO"W,"YANG"X"K,"WAN"L"C,"ZENG"L"M."Transcriptome"analysis"of"Dendr obi um"officinale"exposed"to"high"temperature"stress[J]."China"Journal"of"Chinese"Materia"Medica,"2024,"49(20):"5433-"5440."(in"Chinese)
[24]"陈宏宇,"于莹,"李菲."基于转录组鉴定鼓槌石斛花温度胁迫响应基因[J]."高师理科学刊,"2023,"43(11):"44-49.CHEN"H"Y,"YU"Y,"LI"F."Identifying"genes"responsive"to"temperature"stress"in"Dendrobium"chrysotoxum"flower"based"on"transcriptome"analysis[J]."Journal"of"Science"of"Teachers'"College"and"University,"2023,"43(11):"44-49."(in"Chinese)
[25]"吕朝燕,"高智席,"严羽,"王利霞,"魏英,"叶丽,"卢珊珊,"张琴."干旱-复水对两种石斛属植物叶水势的影响[J]."广西植物,"2021,"41(2):"177-182.LYU"C"Y,"GAO"Z"X,"YAN"Y,"WANG"L"X,"WEI"Y,"YE"L,"LU"S"S,"ZHANG"Q."Effects"of"drought-rewatering"on"leaf"water"potential"of"two"Dendrobium"plants[J]."Guihaia,"2021,"41(2):"177-182."(in"Chinese)
[26]"林晓红,"施木田,"林三睦."高温胁迫对金线莲叶绿素荧光参数及SOD活性与电导率的影响[J]."热带作物学报,"2014,"35(6):"1137-1142.LIN"X"H,"SHI"M"T,"LIN"S"M."Effects"of"high-temperature"stress"on"chlorophyll"fluorescence"parameters,"SOD"activity"and"electrolyte"leakage"of"Anoectochilus"roxburghii"(Wall.)"Lindl."and"Anoectochilus"formosanus"Hayata[J]."Chinese"Jour n al"of"Tropical"Crops,"2014,"35(6):"1137-1142."(in"Chinese)
[27]"赵晖,"耿兴敏,"王露露,"许世达."乙烯在杜鹃花耐热机制中的作用研究[J]."园艺学报,"2022,"49(3):"561-570.ZHAO"H,"GENG"X"M,"WANG"L"L,"XU"S"D."Research"on"the"effect"of"ethylene"in"heat"resistance"mechanism"of"Rhododendron[J]."Acta"Horticulturae"Sinica,"2022,"49(3):"561-570."(in"Chinese)
[28]"程秋如,"刘加能,"刘子凡,"潘登浪,"曾宪海,"曾精."油棕响应低温胁迫的转录组分析[J/OL]."分子植物育种,"(2024-"06-25)[2024-08-27]."http://kns.cnki.net/kcms/d etail/46.1068."S.20240624.1745.008.html.CHENG"Q"R,"LIU"J"N,"LIU"Z"F,"PAN"D"L,"ZENG"X"H,"ZENG"J."Transcriptome"analysis"of"oil"palm"in"response"to"low"temperature"stress[J]."Molecular"Plant"Breeding,"(2024-06-25)[2024-08-27]."http://kns.cnki.net/kcms/detail/46."1068.S.20240624.1745.008.html."(in"Chinese)
[29]"江定,"李光光,"袁凡崇,"雷世康,"张华,"戴修纯,"郑岩松."菜心响应高温胁迫的转录组分析与基因挖掘[J]."南方农业学报,"2024,"55(3):"766-783.JIANG"D,"LI"G"G,"YUAN"F"C,"LEI"S"K,"ZHANG"H,"DAI"X"C,"ZHENG"Y"S."Transcriptome"analysis"and"gene"mining"of"flowering"Chinese"cabbage"in"response"to"high"temperature"stress[J]."Journal"of"Southern"Agriculture,"2024,"55(3):"766-"783."(in"Chinese)
[30]"翟秀明,"唐敏,"李解,"陈世春,"胡方洁,"侯渝嘉."基于RNA-Seq技术的茶树响应高温胁迫转录组差异性分析[J]."分子植物育种,"2020,"18(17):"5629-5637.ZHAI"X"M,"TANG"M,"LI"J,"CHEN"S"C,"HU"F"J,"HOU"Y"J."Difference"analysis"of"heat"stress-responsive"transcriptome"of"Camellia"sinensis"based"on"RNA-Seq"technology[J]."Molecular"Plant"Breeding,"2020,"18(17):"5629-5637."(in"Chinese)
[31]"FEDER"M"E."Organismal,"ecological,"and"evolutionary"aspects"of"heat-shock"proteins"and"the"stress"response:"established"conclusions"and"unresolved"issues[J]."American"Zoologist,"1999,"39:"857-864.nbsp;(in"Chinese)
[32]"OUYANG"Y,"CHEN"J,"XIE"W,"WANG"L,"ZHANG"Q."Comp rehensive"sequence"and"expression"profile"analysis"of"Hsp20"gene"family"in"rice[J]."Plant"Molecular"Biology,"2009,"70(3):"341-57.
[33]"HAN"Y,"CHEN"Y,"YIN"S,"ZHANG"M,"WANG"W."Over-ex pre ssion"of"TaEXPB23,"a"wheat"expansin"gene,"improves"oxidative"stress"tolerance"in"transgenic"tobacco"plants[J]."Plant"Physiol,"2015,"173:"62-71.
[34]"CHA"J,"AHN"G,"KIM"J"Y,"KANG"S"B,"KIM"M"R,"SU'UDI"M,"KIM"W"Y,"SON"D."Structural"and"functional"differences"of"cytosolic"90-kDa"heat-shock"proteins"(Hsp90s)"in"Arabidopsis"thaliana[J]."Plant"Physiology"and"Biochemistry,"2013,"70:"368-373.
[35]"JACKSON"S"E,"QUEITSCH"C,"TOFT"D."Hsp90:"from"structure"to"phenotype[J]."Nature"Structural"amp;"Molecular"Biology,"2004,"11(12):"1152-1155.
[36]"朱白婢,"王静,"张文,"胡艳平,"李雪峤."冬瓜响应高温胁迫的转录组测序及分析[J/OL]."分子植物育种,"(2024-04-"30)[2024-08-27]."http://kns.cnki.net/kcms/detail/46.1068.S."20 240430.0955.004.html.ZHU"B"B,"WANG"J,"ZHANG"W,"HU"Y"P,"LI"X"Q."Tran sc ri pt ome"sequencing"and"analysis"of"wax"gourd"in"resp on se"to"high"temperature"stress[J]."Molecular"Plant"Breeding,"(2024-"04-30)[2024-08-27]."http://kns.cnki.net/kcms/detail/46.1068."S.20240430.0955.004.html."(in"Chinese)
