肿瘤标志物质控品制备冻干工艺研究及质量评价
2025-01-31张豪飞罗利红杨建乐申志发
关键词:冷冻干燥;质控品;肿瘤标志物;均匀性;稳定性;质量评价
中图分类号:R73文献标志码:ADOI编码:10.3969/j.issn.1674-4977.2025.01.063
0引言
肿瘤是全球疾病致死的重要元凶之一。根据国际癌症研究机构于2024年2月在《临床医师癌症杂志》发表的《2022全球癌症统计报告:全球185个国家36种癌症发病率和死亡率估计》,2022年全球新发癌症病例1997.6万例,死亡病例974.4万例[1]。
肿瘤标志物是在恶性肿瘤的发生和增殖过程中,由肿瘤细胞本身所产生的或是由机体对肿瘤细胞反应而异常产生和(或)升高的,反映肿瘤存在和生长的一类物质,包括蛋白质、激素、酶(同工酶)、多胺及癌基因产物等,存在于患者的血液、体液、细胞或组织中,可用生物化学、免疫学及分子生物学等方法进行测定,对肿瘤的辅助诊断、鉴别诊断、疗效观察、复发监测以及预后评估具有一定的价值[2]。在医疗机构诊疗活动中,肿瘤标志物的实验室检测质量水平,直接影响临床诊断、疗效评估和预后判断,因此肿瘤标志物检测的室内质控尤为重要[3]。
当前,国内肿瘤质控品大部分是以试剂配套为主,多数按类别常规项目组合或单一项目浓度设计,复合程度相对不高,临床新开展的标志物项目涵盖不全。因此,针对多项目复合特殊肿瘤质控品的研究不仅有利于提高临床实验室工作效率、有助于实验室质量能力水平提高,也有广阔的应用前景。
1材料与方法
1.1材料
1.1.1来源
已配制好的液态肿瘤质控品(以下简称:质控样品)半成品,由郑州标源生物科技有限公司提供。
1.1.2主要试剂
本研究用到的PGI、PGII、proGRP、CA724、CA242、SCCA、HE4、CY211、NSE检测试剂盒均由郑州安图生物工程股份有限公司提供。
1.1.3主要仪器设备
冻干机(上海东富龙);全自动化学发光测定仪(郑州安图生物);卡尔费休水分测定仪(江苏维科特)。
1.2方法
1.2.1冷冻干燥
1.2.1.1预冻
将质控样品半开瓶塞放入冻干机内,放置好温度探头,设置冻干机搁板温度为-45℃,使其在1 h内从室温降至-40℃以下,维持180 min。留取若干瓶质控样品存放于-70℃作为冻干前的对照样品。
1.2.1.2干燥
冷冻干燥阶段包括升华干燥和解析干燥2个阶段。升华干燥阶段,冷阱温度降至-60℃后,在-60℃左右波动。搁板温度从-45℃以下升至-5℃并维持27 h。真空度一直保持在15 Pa。解析干燥阶段,搁板温度从-5℃升至10℃并维持0.5 h,而后在1 h内升至约30℃并维持7 h。升温期间真空度保持在15 Pa,保持极限真空直至冻干结束,获得冻干曲线。
1.2.2质量检测
1.2.2.1外观检测
取冻干后的质控样品,采用目测法观察样品的成形外观是否良好。
1.2.2.2水分含量测定
使用电子天平称取适量质控冻干制剂样品。利用库仑法原理,采用卡尔费休水分测定仪检测质控冻干制剂的水分含量。
1.2.2.3含量测定
取冻干前后的不同浓度质控样品各3瓶,每瓶重复测试2次,分别检测冻干前后样品中标志物的含量。计算t值,判断冻干前后量值是否有显著变化。
1.2.2.4均匀性评价
随机抽取不同浓度质控样品各10瓶,每个重复测试2次,利用单因子方差分析法对检验结果进行统计,计算F值,若F值小于F临界值(α=0.05),表明样品是均匀的,样品间和样品内差异无统计学意义(P>0.05)[4-9]。
1.2.2.5稳定性评价
取制备好的不同浓度质控样品各3瓶,每瓶重复测试2次,以此作为各项目初始均值。分别在第1、3、6、12、18、24月随机抽取不同浓度质控样品各3瓶,参照以上同样的方法进行测定,再分别取各项目均值与其初始均值比较,若计算得到的t值小于t0.05(10),表明样品之间差异稳定。
2结果
2.1冻干曲线
运行本研究设定的冷冻干燥程序后,得到质控样品冻干曲线,如图1所示。
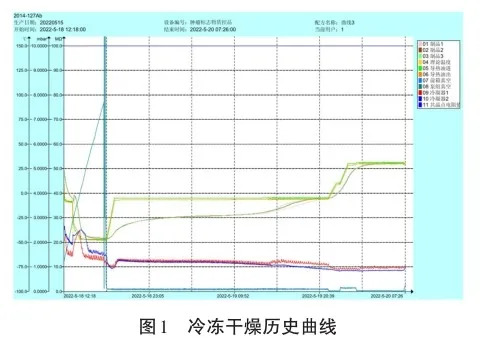
2.2外观检测
外观均呈淡黄、均匀、疏松体。
2.3水分含量
随机取3份质控样品,检测其水分含量为1.202%±0.181%,冻干效果良好。
2.4标志物含量
对冻干前后质控样品的肿瘤标志物含量进行检测。结果显示,冻干质控样品中肿瘤标志物的含量与冻干前的质控样品t值均小于t0.05(10)=2.23,无明显差异。
2.5均匀性评价
分别随机抽取三个水平质控样品各10瓶,用单因子方差分析法进行统计,计算均值、F值和P值。检测结果显示F值均小于F0.05(9,10)=3.02,P>0.05,质控样品中的肿瘤标志物差异含量样品内和样品间无显著性差异。
2.6稳定性评价
在全自动化学发光分析仪上分别测定初始、第1、3、6、12、18、24月的质控样品,检测结果显示各项目t值均小于t0.05(10)=2.23,结果差异不显著,质控样品是稳定的。
3讨论
质控样品的项目复合度、均匀性和稳定性是临床室内质量控制应用关注的重点,本研究从项目复合度上考虑,涵盖了PGI、PGII、proGRP、CA724、CA242、SCCA、HE4、CY211、NSE这9个特殊的肿瘤标志物,与陈文虎等[10]研究的多项目复合肿瘤标志物相比,添加了除常规肿瘤标志物外的新兴肿瘤标志物;从稳定性上考虑,冷冻干燥可实现不稳定标志物的长期保存,便于临床实验室使用。孙珍珠等[11]做过血浆冻干制剂的制备研究,认为冷冻干燥是一个复杂的过程,包括预冻阶段、升华干燥阶段、解析干燥阶段,每个阶段的温度、时间、真空度等因素均可能会对质控样品冻干后的水分含量、标志物含量和稳定性等造成影响。本研究中质控样品复合度高包含标志物数量多,单支装量大厚度高,不利于冷冻干燥;同时质控样品中蛋白浓度高,导致冻干时间长。因此,优化冻干工艺是成功制备冻干质控样品的关键,本研究所建立的质控样品冷冻干燥工艺可制备高质量复合肿瘤标志物质控品,冻干工艺简单、快速、效果好,为其他同类质控品的研究开发奠定良好基础。
本研究建立的冷冻干燥制备工艺制备的质控样品冻干制剂外观呈淡黄、均匀、疏松体;检测其水分含量为(1.202±0.181)%,符合制定的质量标准要求(含水量≤2%)。质控样品冻干制剂中标志物含量在冻干前后无显著差异。利用单因子方差分析法来检验质控样品的均匀性,结果显示在α=0.05显著性水平时,质控样品中所含的肿瘤标志物是均匀的。利用独立样本t检验进行比较结果显示在α=0.05显著性水平时,质控样品稳定性结果差异无统计学意义(P>0.05),稳定性良好且能够满足临床实验室的使用需求。
该制备方法需从以下两个方面进一步完善:
1)冻干时间仍有提升空间,在后续研究中需继续优化冻干程序,以进一步提高冷冻干燥效率。
2)本研究中是按3.0 mL的装量设定冻干程序,在实际应用中可能会有其他规格的需求,后续研究中仍需继续摸索不同装量规格下质控样品的冷冻干燥工艺。
参考文献
[1]姚一菲,孙可欣,郑荣寿.《2022全球癌症统计报告》解读:中国与全球对比[J].中国普外基础与临床杂志,2024,31(70):69-780.
[2]常用血清肿瘤标志物检测的临床应用和质量管理:WS/ T 459—2018[S].
[3]石建新,蒋英,段桂开,等.冷冻分离技术在肿瘤标志物质控品研制中的应用[J].检验医学与临床,2020,17(9):1186-1188.
[4]能力验证样品均匀性和稳定性评价指南:CNAS—GL03:2006[S].
[5]张辉,郭瑛.自制肿瘤标志物室内质控血清的应用评价[J].中国实验诊断学,2016,20(12):2027-2029.
[6]临床检验定量测定室内质量控制:WS/T 641—2018[S].
[7]利用实验室间比对进行能力验证的统计方法:GB/T 28043—2019[S].
[8]标准样品工作导则第3部分:标准样品定值和均匀性与稳定性评估:GB/T 15000.3—2023[S].
[9]体外诊断试剂用质控物通用技术要求:YY/T 1652—2019[S].
[10]陈文虎,张剑英,张毅敏,等.多项目复合肿瘤标志物冻干质控品的制备[J].肿瘤学杂志,2009,15(6):559-561.
[11]孙珍珠,贾俊婷,王强,等.血浆冻干制剂的制备与质量评价[J].军事医学,2023,47(10):754-760.
作者简介
张豪飞,男,1985年出生,学士,研究方向为医学实验室质量控制。
(编辑:于淼,收稿日期:2024-05-25)
