从“非主流”到“主流”的华丽转身:miRNA如何逆天改命
2025-01-28杨帅陈璐吴尽魏红燕于文强
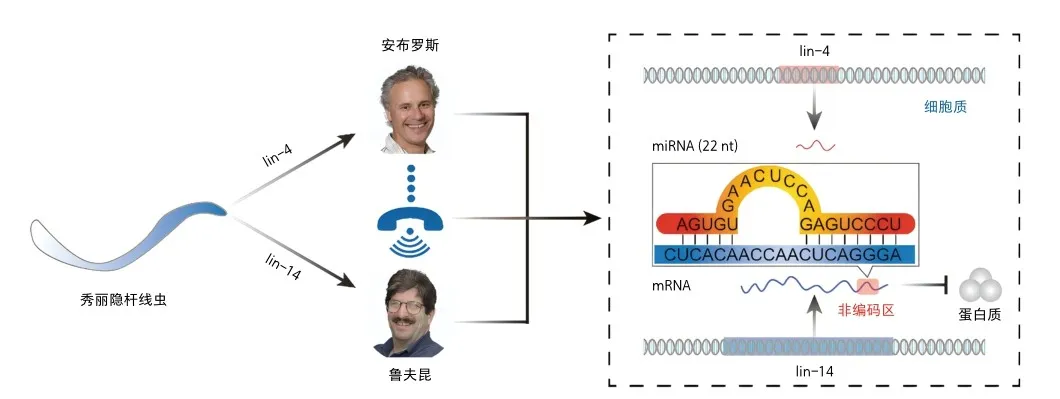
微RNA(microRNA,miRNA)是一类长度约为22个核苷酸的内源性非编码单链RNA分子,在不同的细胞活动及生命进程中都发挥重要的调控作用。1993年,安布罗斯(V.Ambros)和鲁夫昆(G.Ruvkun)在《细胞》(Cell)杂志以背靠背形式发表两篇研究论文[1,2],惊人地发现秀丽隐杆线虫(C.elegans,以下简称线虫)中22个核苷酸的lin-4竟能与lin-14mRNA的3’UTR部分互补,从而抑制其翻译成蛋白质。然而,由于lin-4仅存在线虫中,这一重要发现被当时的科学界所忽视。7年后,鲁夫昆团队在线虫中发现第二个miRNA——let-7,不仅能靶向lin-413’UTR降低其表达,而且在果蝇和斑马鱼等动物界高度保守[3]。随后,成千上万的miRNA在人以及小鼠、拟南芥等动植物中被发现,由此开启了RNA调控基因的全新领域。目前,miRNA靶向抑制基因理论已经成为经典,但却让miRNA研究由“热”转“冷”。近些年,核内miRNA靶向增强子激活基因理论正悄然兴起,能否借诺贝尔奖之东风掀起miRNA研究的新浪潮,让我们拭目以待!
兴趣碰撞开启miRNA新纪元
1953年,安布罗斯出生于美国新罕布什尔州,家里有8个孩子,其父亲是波兰人,因躲避战火连中学都没有念完。他为父亲感到惋惜,懂得珍惜学习机会,自小立志成为一名科学家。他在申请麻省理工学院(MIT)读书时就表明,“我想当个科学家”。随后,他进入MIT学习天文,但发现自己对物理学兴趣一般,在室友的熏陶下,痴迷于揭示分子生物与基因组学的奥秘,彻底爱上了分子生物学。在博士期间,他师从巴尔的摩教授(D.Baltimore,1975年获诺贝尔生理学或医学奖),研究脊髓灰质炎病毒的基因组结构和复制。在此期间,霍维茨教授(H.R.Horvitz,2002年获诺贝尔生理学或医学奖)来到MIT建立实验室,进行了线虫研究的学术报告,让安布罗斯对线虫产生浓厚兴趣。1979年,他加入霍维茨实验室进行博士后训练,研究lin-4和unc-86对线虫发育的调控作用。
1952年,鲁夫昆出生在美国加州伯克利市的犹太家庭,其父母鼓励他对科学的热爱。童年时期,他对科学充满兴趣,因爱好无线电,对电子学和物理学很着迷,后来他进入加州大学伯克利分校学习电气工程。1973年,鲁夫昆获得学士学位,恰逢经济萧条,对未来困惑不已。于是,他买了一辆面包车,沿美国西海岸旅行直到玻利维亚,曾尝试应聘电台DJ等工作都未成功,最后得到酒吧的种树工作,与满怀理想的年轻嬉皮士共同种树和生活。然而,一次偶然的机会,他被《科学美国人》杂志所吸引,内心科研的火种被再次点燃,命运的齿轮也由此反转。1976年,他返回美国进入哈佛大学攻读博士学位,师从植物分子生物学家奥苏贝尔(F.Ausubel),并共同解开了植物固氮的诸多谜团。1982年,他获得生物物理学博士学位后,决定改变研究方向,在哈佛大学吉尔伯特(W.Gilbert,1980年获诺贝尔化学奖)和MIT的霍维茨实验室进行博士后研究,关注线虫发育相关的信号通路,并与安布罗斯相遇。
1980年代,安布罗斯和鲁夫昆在霍维茨实验室中共同探究lin-14在线虫发育中的作用机制,但并未解开未知之谜。随后,他们分别加入哈佛大学的不同团队继续聚焦lin-14研究,尽管两人保持相对独立,但又紧密合作。后来,安布罗斯和鲁夫昆分别独立推导lin-4和lin-14的序列信息,在1992年6月11日晚上交换彼此的结果,对比后惊奇地发现,lin-4非编码RNA在lin-14mRNA的3’UTR存在多个结合位点,像拉链一样吻合。两个团队进一步证实lin-4通过结合在lin-14mRNA的3’UTR抑制其翻译,并于1993年将论文同时发表在《细胞》杂志上[1,2]。一种以miRNA为媒介的新型基因调控方式被发现,但当时并未引起科学界的关注。直到2000年,鲁夫昆团队证实线虫中let-7在动物界具有高度保守性[3],突显了miRNA抑制基因的普适性,才正式开启miRNA研究新领域。
miRNA掌控细胞命运转换
研究表明,miRNA生成是一个被精心编排的生物学过程。首先,在细胞核内,基因组DNA转录产生长链的初级miRNA(primarymiRNA,pri-miRNA),通常包含一个或多个发夹状结构,是miRNA成熟的关键信号。接着,DGCR8蛋白与Drosha酶等相互作用并结合pri-miRNA,Drosha酶将pri-miRNA剪切成约70个核苷酸长的前体miRNA(precursormiRNA,pre-miRNA)。然后,pre-miRNA在exportin-5蛋白协助下,从细胞核被转运至细胞质,被Dicer酶进一步剪切形成双链RNA,与AGO蛋白组成miRNA诱导的沉默复合体(miRNA-inducedsilencingcomplex,miRISC)并完成双链解旋,最终导致RNA双链中仅有一条链与AGO蛋白稳定结合,该链被称为引导链,即成熟miRNA。目前,最全面的miRNA公共数据库——miRBase已收录来自271个物种、超过4万个miRNA的信息,其中,人类miRNA共1917个,可能在疾病和发育进程中起重要的调控作用。
miRNA通过调控基因表达影响细胞增殖、分化和凋亡等生物学功能,在个体发育、行为表现以及疾病发生发展中至关重要。例如,最早发现的两个miRNA——lin-4和let-7都能调控线虫的发育时序。其中,lin-4通过抑制lin-14和lin-28表达,分别调控线虫L1~L2期和L2~L3期的转变[1];let-7通过调控lin-41、hbl-1等靶基因,调控线虫从L4期到成虫的转变[4]。另外,miR-iab4/iab8突变则显著影响果蝇幼虫的自我纠正能力[5],进而影响其行为表现。然而,miRNA表达异常则导致靶基因表达失控,与肿瘤、自身免疫性疾病以及神经退行性疾病等密切相关。以乳腺癌为例,低表达的miR-339通过降低抑癌基因表达促进乳腺癌发生发展[6]。那么,miRNA如何影响个体发育和疾病进程呢?
我们认为,miRNA通过改变时空维度上细胞的身份及状态影响发育和疾病过程。事实上,miRNA具有很强的组织细胞特异性,如肌肉特异性miR-1和肝脏特异性miR-122等。其中,小鼠miR-122随着胚胎发育逐渐升高,在出生时急剧升高,这与出生后肝脏代谢功能密切相关。另外,小鼠被敲除miR-122后导致脂肪在肝脏积累,逐渐获得脂肪细胞储肪功能,丢失部分肝脏细胞排除脂肪的能力,引起肝炎,最终在11月龄时发展成肝癌。此外,miR-17~92家族参与Th细胞身份的塑造,而miR-7在成熟的胰腺β细胞身份维持中发挥重要作用。因此,miRNA组织特异性表达的特征与细胞特定身份密切相关,其异常表达会造成细胞身份转变及疾病发生与进展,但具体作用机制尚不完全清楚。
NamiRNA打破基因沉默的魔咒
目前,沉默基因表达是miRNA调控基因的经典途径,主要发生在转录后水平。在细胞质中,成熟miRNA与AGO蛋白形成miRISC复合体并通过碱基互补配对原则与mRNA结合,负向调节其翻译效率和稳定性抑制基因表达。一方面,miRISC复合体通过阻止翻译起始因子被招募到mRNA的5’端非编码区或者影响核糖体沿mRNA的移动,抑制核糖体的翻译[7]。另一方面,miRISC复合体会激活去腺苷化酶,将mRNA3’端的多腺苷酸尾切除,进一步导致mRNA的5’端帽结构丢失,加速mRNA被核酸外切酶降解,降低基因表达。然而,动植物中miRNA与mRNA的结合方式并不完全相同。在植物中,miRNA常以完全匹配的方式结合mRNA并形成稳定的双链结构沉默基因表达,而在动物中,miRNA与mRNA的结合通常是不完全匹配的,极大增加miRNA抑制靶标结合位点预测的复杂性和难度[8]。与此相反,miRNA能与启动子相互作用以非经典途径在转录水平上激活基因表达。例如,细胞核中的miR-373能够与E-钙黏蛋白基因的启动子区域序列互补并促进mRNA的转录,揭示miRNA更为复杂的生物学功能。
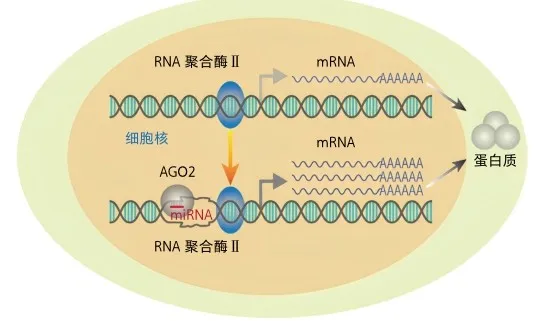
近些年,复旦大学于文强团队发现了一种全新的非经典途径——细胞核内miRNA靶向增强子激活基因转录,并将这类miRNA命名为核内激活miRNA(nuclearactivatingmiRNA,NamiRNA)。2009年,该团队发现大多数miRNA在基因组位置上与基因激活元件增强子高度重叠,提示miRNA可能具有激活基因的功能。经过8年潜心研究,团队证实miRNA能够定位于细胞核内,并揭示了核内miRNA激活基因的功能机制,创造性地提出了NamiRNA-增强子-基因激活的全新理论[9,10]。NamiRNA指的是一类在细胞核内的miRNA,能够通过与增强子相互作用促进基因转录。具体来说[10],miRNA作为楔子,打开基因组DNA双链,AGO2识别增强子与miRNA的杂交链,维持DNA单链状态,促进RNA聚合酶Ⅱ对基因的转录。事实上,NamiRNA不仅能够激活与其位置相邻的靶基因表达,还能够激活全基因组范围内的基因表达,从而影响细胞身份及功能改变。NamiRNA的发现开启了一个新的研究领域,实现了miRNA从沉默基因到激活基因的华丽转身,为miRNA的基础研究和临床应用转化提供了新的视角和方向。
借诺贝尔奖东风创miRNA研究新浪潮
截至2024年12月,PubMed检索“miRNA”文章已超过17万篇,涵盖病毒、细菌、真菌、植物和动物自然界五大类生物,不仅揭示了miRNA调控微生物繁殖及对宿主的作用,而且探究了miRNA在动植物的发育及不同疾病过程的重要作用,尤其在miRNA的生成加工过程、生物功能以及基因调控模式等方面都取得很大进展。然而,miRNA文章自2021年开始逐年减少,2024年发文总量锐减近50%,似乎意味着miRNA研究正由“盛”转“衰”,其背后原因值得我们深思。
首先,miRNA的基础研究似乎早已陷入“科研怪圈”:过表达miRNA能够诱导基因的差异表达,但大多数研究者仅仅关注下调的基因,对上调基因视而不见。相应地,miRNA上调基因的研究少之又少,且主要是miRNA通过沉默中间基因导致下游基因的上调。那么,miRNA能否激活基因?如前所述,答案是肯定的。如何探究其正向的基因调控作用呢?NamiRNA-增强子-基因激活理论为科研工作者指明了具体方向,细胞核内的miRNA可以作为激活剂,活化基因组增强子并与其相互作用,打开DNA双链,激活基因转录。目前,NamiRNA研究尚处于早期阶段,还有诸多未知值得深入探究。我们相信,在不远的未来,NamiRNA研究的新生力量必将涌现,共同实现miRNA基础研究的繁荣与复兴!
其次,miRNA的临床应用似乎总是“扑朔迷离”,尤其是成药极其困难。2008年,丹麦制药公司SantarisPharma宣布SPC3649(Miravirsen)进入临床试验,是全球首个靶向miRNA的核酸药物,能特异性结合miR-122,旨在降低丙肝病毒(hepatitisCvirus,HCV)载量。随后的临床Ⅱ期试验显示,该药物用于慢性丙肝病毒感染患者呈现剂量依赖性的丙肝病毒RNA的降低[11],但后报道称Miravirsen会诱导HCV的UTR区域突变,没有进一步的进展。2016年,首个miR-34a类似物MRX34的多中心临床I期试验因严重的免疫副作用致死而终止[12]。目前,尚无临床可用的靶向miRNA核酸药物。近些年,核酸药物的修饰以及递送系统已取得巨大进步,不仅能降低核酸药物的免疫原性,而且能促进其向靶组织器官的运输。那么,决定miRNA成药的关键是什么呢?我们认为,靶点筛选是miRNA成药的核心,而筛选策略是重中之重。与经典抑制理论不同,NamiRNA-增强子-基因激活理论让我们更关注miRNA对全基因组的激活作用,有望引领一种全新的miRNA筛选潮流,突破miRNA成药难的困境。我们期待,药物研发团队及生物医药企业能够重拾信心,提升靶向miRNA核酸药物的研发投入,加快miRNA的临床应用转化!
借着诺贝尔奖的东风,miRNA研究2.0时代已经开启,让我们共同努力,推动基础研究向临床应用的转化,催生临床可用的靶向miRNA核酸药物,为人类与疾病的斗争贡献力量!
[1]LeeRC,FeinbaumRL,AmbrosV.TheC.elegansheterochronicgenelin-4encodessmallRNAswithantisensecomplementaritytolin-14.Cell,1993,75(5):843-854.
[2]WightmanB,HaI,RuvkunG.Posttranscriptionalregulationoftheheterochronicgenelin-14bylin-4mediatestemporalpatternformationinC.elegans.Cell,1993,75(5):855-862.
[3]PasquinelliAE,ReinhartBJ,SlackF,etal.Conservationofthesequenceandtemporalexpressionoflet-7heterochronicregulatoryRNA.Nature,2000,408(6808):86-89.
[4]ReinhartBJ,SlackFJ,BassonM,etal.The21-nucleotidelet-7RNAregulatesdevelopmentaltiminginCaenorhabditiselegans.Nature,2000,403(6772):901-906.
[5]Picao-OsorioJ,JohnstonJ,LandgrafM,etal.MicroRNA-encodedbehaviorinDrosophila.Science,2015,350(6262):815-820.
[6]LiangY,LuQ,LiW,etal.ReactivationoftumoursuppressorinbreastcancerbyenhancerswitchingthroughNamiRNAnetwork.NucleicAcidsResearch,2021,49(15):8556-8572.
[7]MeijerH,KongY,LuW,etal.TranslationalrepressionandeIF4A2activityarecriticalformicroRNA-mediatedgeneregulation.Science,2013,340(6128):82-85.
[8]LewisBP,ShihIH,Jones-RhoadesMW,etal.PredictionofmammalianmicroRNAtargets.Cell,2003,115(7):787-798.
[9]XiaoM,LiJ,LiW,etal.MicroRNAsactivategenetranscriptionepigeneticallyasanenhancertrigge.RNABiology,2017,14(10):1326-1334.
[10]YangS,ZouQ,LiangY,etal.miR-1246promotesosteosarcomacellmigrationviaNamiRNA-enhancernetworkdependentonArgonaute2.MedComm,2024,5(4):e543.
[11]JanssenHL,ReesinkHW,LawitzEJ,etal.TreatmentofHCVinfectionbytargetingmicroRNA.NewEnglandJournalofMedicine,2013,368(18):1685-1694.
[12]HongDS,KangYK,BoradM,etal.Phase1studyofMRX34,aliposomalmiR-34amimic,inpatientswithadvancedsolidtumours.BritishJournalofCancer,2020,122(11):1630-1637.
关键词:诺贝尔奖miRNA沉默基因NamiRNA基因激活■
