松墨天牛GST基因克隆及高温胁迫下的表达特性分析
2025-01-26李子纯郝德君李慧李长燕许丹雯仪杨华磊赵培渊





摘要:【目的】克隆松墨天牛(Monochamus alternatus)谷胱甘肽S转移酶(glutathione S-transferases, GST)相关基因,明确GST基因在松墨天牛响应高温胁迫中的效用,为探究亚热带地区松墨天牛的耐热分子机制提供理论依据。【方法】克隆3条松墨天牛GST基因,结合DNAMAN 9.0、I-TASSER等软件分析松墨天牛GST基因的结构特征;利用qRT-PCR技术测定分析松墨天牛成虫和4龄幼虫在不同高温、不同处理时长后GST基因的相对表达量;通过纸盘扩散法验证3条松墨天牛GST基因在保护机体免受氧化应激中的作用。【结果】克隆3条松墨天牛GST基因的cDNA序列,分别命名为MaltGSTe1、MaltGSTe2和MaltGSTt1。MaltGSTe1与MaltGSTe2均属于GST的Epsilon家族,MaltGSTt1属于GST的Theta家族。3条GST基因三维蛋白结构具有指示性结构特征,属于胞质型GST。松墨天牛4龄幼虫在高温胁迫下MaltGSTe1、MaltGSTe2和MaltGSTt1的相对表达量均出现显著变化,MaltGSTe2相对表达水平上调幅度最大;MaltGSTt1在松墨天牛雄虫体内相对表达量出现明显下调;异源表达3条GST基因蛋白的大肠杆菌表现出较强的抗氧化能力,其中,MaltGSTe2具有更强的抗氧化能力。【结论】克隆获得3条松墨天牛GST基因,发现高温胁迫可诱导GST基因表达量上调;纸盘扩散分析结果表明异源表达GST基因蛋白具有抗氧化能力,推测GST基因具有通过保护机体免受氧化应激来参与松墨天牛幼虫的高温胁迫响应机制。
开放科学(资源服务)标识码(OSID):
关键词:松墨天牛;高温胁迫;谷胱甘肽S转移酶;GST基因;氧化应激;基因克隆;表达分析;生物信息学
中图分类号:S763.38""""""" 文献标志码:A文章编号:1000-2006(2025)01-0028-09
Cloning of glutathione S-transferases gene from Monochamus alternatus and its expression characteristics under heat stress
LI Zichun, HAO Dejun*, LI Hui, LI Changyan, XU Danwenyi, YANG Hualei, ZHAO Peiyuan
(Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China)
Abstract: 【Objective】To clone the glutathione S-transferases (GST) genes of Monochamus alternatus (Coleoptera: Cerambycidae) and to determine the expression levels of these genes under heat stress in adult males and females, as well as at different developmental stages of M. alternatus, we used molecular biology and bioinformatics methods. 【Method】 Three GST cDNA sequences were cloned, and their structural characteristics were analyzed using DNAMAN 9.0 and I-TASSER software. qRT-PCR was employed to measure the relative expression levels of GST genes in adult and fourth instar larvae of M. alternatus under varying temperatures and treatment durations. The role of these GST genes in protecting the organism from oxidative stress was assessed through disc diffusion assays.【Result】Three GST cDNA sequences were cloned and named MaltGSTe MaltGSTe" and MaltGSTt1. MaltGSTe1 and MaltGSTe2 belong to the Epsilon family, while MaltGSTt1 belongs to the Theta family. Analysis of" three-dimensional protein structures indicated that these GST are cytoplasmic. The relative expression levels of MaltGSTe MaltGSTe2" and MaltGSTt1 in fourth instar larvae significantly changed under heat stress, with MaltGSTe2 showing the greatest change. In males, the expression level of MaltGSTt1 was significantly down-regulated. Escherichia coli expressing the GST genes demonstrated enhanced antioxidant capacity, with MaltGSTe2 exhibiting the strongest activity.【Conclusion】We successfully cloned three GST genes and investigated their expression characteristics under high temperature stress in M. alternatus. High temperature stress was found to induce up-regulation of GST gene expression. Disc diffusion assays confirmed that heterogeneously expressed GST proteins have antioxidant capabilities. These findings suggest that GST genes play a role in the response mechanism to high temperature stress by protecting against oxidative stress, providing a theoretical foundation for exploring the heat resistance mechanisms of M. alternatus in subtropical regions.
Keywords:Monochamus alternatus; heat stress; glutathione S-transferases; GST gene; oxidative stress; gene clone; express analysis; bioinformatics
昆虫作为典型的小型变温动物,极易受到环境温度的影响,而高温胁迫会影响昆虫的形态、生长发育、行为以及生理生化等生命活动,从而引起昆虫死亡或繁殖力下降[1-2]。研究表明,高温会干扰细胞内活性氧(reactive oxygen species, ROS)的产生,打破有效的抗氧化防御的平衡状态,引起细胞变化和氧化应激[3],致使昆虫体内积累过多的活性氧,导致脂质和蛋白质的过氧化[4],造成细胞凋亡[5-6]。为抵御不良高温环境,昆虫逐渐演化出完备的响应机制[7],例如,通过改变体内激素的合成和分泌进而调控自身生长发育和繁殖[8],或产生抗氧化酶和解毒酶以应对高温胁迫导致的氧化应激[9],或合成热激蛋白(heat shock proteins, HSPs)以响应高温胁迫[10],这些响应机制在一定程度上帮助昆虫抵御高温带来的不利影响,也是昆虫耐热性研究的核心内容。
谷胱甘肽S转移酶(glutathione S-transferases, GST)作为内源性抗氧化剂,它的增强被称为氧化应激准备(preparation for oxidative stress, POS)[11]。昆虫体内已发现胞质型和微粒体两类GST[12]。GST可以催化还原型谷胱甘肽(glutathione, GSH)与多种亲电子物质结合[13],还可以与烯醛(alkenals)、有机氢过氧化物(organic hydroperoxides)、邻醌(ortho-quinones)等由细胞氧化产生的物质相结合,防止细胞氧化应激[14]。另外,昆虫体内的GST具有谷胱甘肽过氧化物酶(GSH-Px)的活性,可以减少有机氢过氧化物[15],解毒外源性物质,消除氧化应激过程中氧代谢产生过多的活性氧[16-17],以及作为信号转导通路的调节剂控制细胞增殖和死亡[18]。目前,已有诸多研究发现GST参与昆虫高温胁迫的反应与保护过程,GST基因的上调也被认为是昆虫响应高温胁迫的重要指标[19-20]。
松墨天牛(Monochamus alternatus)是松材线虫(Bursaphelenchus xylophilus)的主要媒介昆虫[21-24],松墨天牛的分布和扩散是决定松材线虫发生范围的关键因素[25-30]。松墨天牛幼虫在室内的最适生长发育温度为 25" ℃[31],但中国南方地区夏季白天最高气温会超过40" ℃,表明松墨天牛具有一定的耐热性。目前,对松墨天牛基于热激蛋白的应对高温胁迫响应机制研究已有报道[32-34],然而,基于内源性抗氧化的耐热性尚未见研究报道。为此,本研究拟克隆松墨天牛GST基因,探究高温胁迫下松墨天牛GST基因的表达特性,明确松墨天牛受到高温胁迫后GST基因的表达模式,为解析松墨天牛耐热的分子机制,以及GST基因在松墨天牛耐热性中的作用提供理论依据。
1 材料与方法
1.1 供试昆虫及处理
松墨天牛成虫由松材线虫病疫木羽化获得,采样地为江苏省南京市(118°22″~119°14″E,31°14″~32°37″N),位于长江下游中部地区,属亚热带季风气候,夏季炎热,降雨充沛。选择在气温(25±1) ℃、相对湿度(70±10)%、自然光照条件下饲养至第3代的松墨天牛用于后续试验。随机挑选羽化14 d的成虫,每5只雌虫或5只雄虫作为1组,温度分别设置为(25±0.5)、(35±0.5)、(40±05)和(45±05) ℃,处理1、3、6和12 h,相对湿度(70±5)%,光(L)暗(D)周期为12 h L+12 h D。根据李慧[34]研究记载松墨天牛4龄幼虫可以承受35~45" ℃高温的背景,挑取正常发育至4龄的幼虫在(25±05)、(35±05)、(40±05)和(45±05)" ℃处理1、3和6 h,每头幼虫作为1个重复,设置3个生物学重复及3个技术重复,25 ℃为正常气温(对照)。所有样本在液氮中速冻,后置于-80 ℃保存备用。
1.2 松墨天牛总RNA制备与cDNA合成
采用动物组织总RNA提取试剂盒(天根生化科技有限公司)提取松墨天牛成、幼虫总RNA。水平电泳仪购自BIO-RAD(赫拉克勒斯,美国),用Nano Drop 2000紫外分光光度计(赛默飞世尔科技公司,美国)及1%(质量分数)琼脂糖凝胶电泳检测RNA浓度及质量,将质量检测合格的RNA通过Evo M-MLV反转录预混型试剂盒(长沙艾科瑞生物工程有限公司)进行单链cDNA的合成,通过Nano Drop 2000紫外分光光度计测定cDNA浓度。
1.3 GST基因克隆与序列分析
基于前期构建的高温处理前后的松墨天牛转录组数据[35-37],选出表达量较高的3条松墨天牛GST基因并利用Primer 3Plus(https://www.primer3plus.com/)设计验证引物。将PCR扩增产物经电泳凝胶分离并切胶回收,连接T/A blunt vector载体转化至DH5α化学感受态细胞进行测序。运用ExPASy(https://web.expasy.org/)预测蛋白的分子质量、等电点以及亲、疏水性。参见文献[34]通过在线网站http://cello.life.nctu.edu.tw/预测GST基因的亚细胞定位[38]。三维结构预测使用在线软件I-TASSER(https://zhanggroup.org/I-TASSER/)。在NCBI在线网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索其他昆虫的GST氨基酸序列,利用DNAMAN 9.0软件进行GST基因间多序列对比,通过IQ-TREE软件以最大似然法进行1 000次计算构建系统发育进化树。
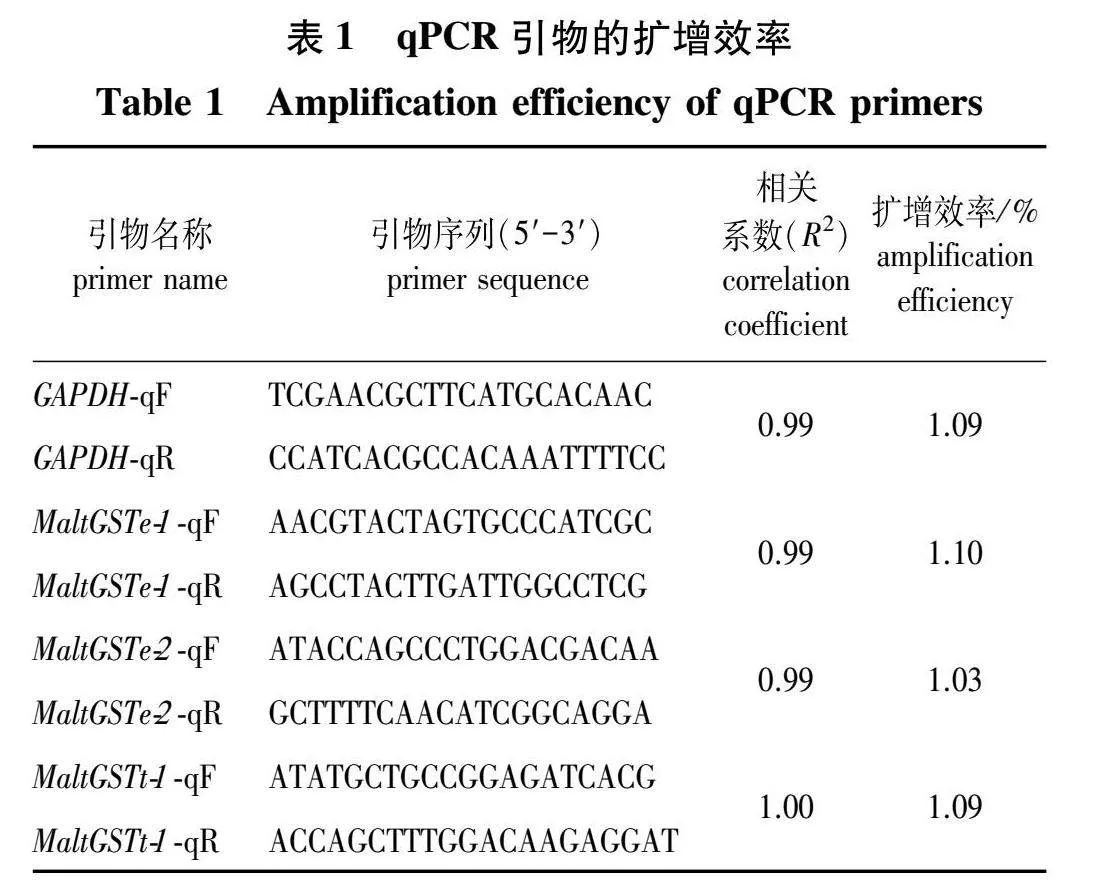
1.4 荧光定量qRT-PCR
使用NCBI在线网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计荧光定量PCR引物将稀释至200 ng/μL的cDNA进行10倍梯度稀释,5个梯度,以6管cDNA为模板进行序列扩增,测定循环阈值(Ct值),绘制标准曲线计算引物扩增效率,选择松墨天牛GAPDH基因作为内参基因(表1)。反应体系为SYBR Green Master Mix 10 μL、上游引物04 μL、下游引物0.4 μL、cDNA模板2 μL、RNase-free water 7.2 μL,总体积20 μL,在Applied Biosystem 7500 System工作平台(赛默飞世尔科技公司,美国)上进行扩增,反应程序:95" ℃ 5 min;9" ℃ 10 s,60" ℃ 40 s,循环40次;95" ℃ 15 s,60" ℃ 60 s,95" ℃ 15 s形成溶解曲线。以各处理温度的0小时为对照组,通过2-ΔΔCT法[36]计算热胁迫后幼虫与雌雄成虫体内GST基因的相对表达量,将2-ΔΔCT值取log2进行作图,以数据平均值±标准误差表示(n=3)。
1.5 松墨天牛GSTs基因的原核表达
以高温处理的松墨天牛幼虫的cDNA作为模板,使用StructureEditor(https://rna.urmc.rochester.edu/GUI/html/StructureEditor.html)设计特异性引物(表2)。将PCR扩增产物经电泳凝胶分离并切胶回收,使用限制性内切酶Bam H I和Hind Ⅲ双酶切将3条GST基因序列连接至 pET-28a (+)载体,构建MaltGSTe1-pET-28a (+)、MaltGSTe2-pET-28a (+)和MaltGSTt1-pET-28a (+)重组质粒。连接产生的环形质粒转化至 DH5α感受态细胞进行克隆测序,将测序正确的菌液扩大培养,提取3种重组质粒和空载pET-28a (+)质粒分别转化至BL21 (DE3)中,挑取阳性克隆使用T7F和T7R引物进行测序验证。将测序正确的菌株接种于含有Kana抗生素和氯霉素的LB液体培养基中,在摇床内37" ℃培养至OD600为0.4~0.6,以终浓度1 mmol/L的IPTG诱导表达,28" ℃培养12 h。用125%(质量分数)SDS-PAGE电泳分离检测。
1.6 氧化应激下的纸盘扩散分析
将含有对照的空载pET-28a(+)和过度表达MaltGSTe1、MaltGSTe2和MaltGSTt1蛋白的大肠杆菌 BL21(DE3),按细胞约 5×108个/板将大肠杆菌均匀涂布到Kana和氯霉素抗性的固体LB培养基上。在 37" ℃ 恒温培养箱(埃朗科技国际贸易有限公司,上海)内倒置培养 1 h 后,将无菌滤纸片(直径 6 mm)置于培养基表面,在纸片中心滴加10 μL不同浓度的异丙苯过氧化氢,待异丙苯过氧化氢被完全吸收后,将平板倒置于 37" ℃ 培养。24 h后使用ImageJ软件分析测量抑菌圈。
1.7 数据处理与分析
所用数据处理软件为 SPSS 20,GST基因相对表达量采用单因素方差分析(One-way ANOVA)和多重比较Tukey检验显著性,差异显著性水平设为0.05。纸盘扩散试验结果利用单因素方差分析不同处理间的显著性。
2 结果与分析
2.1 松墨天牛GST基因克隆和序列分析
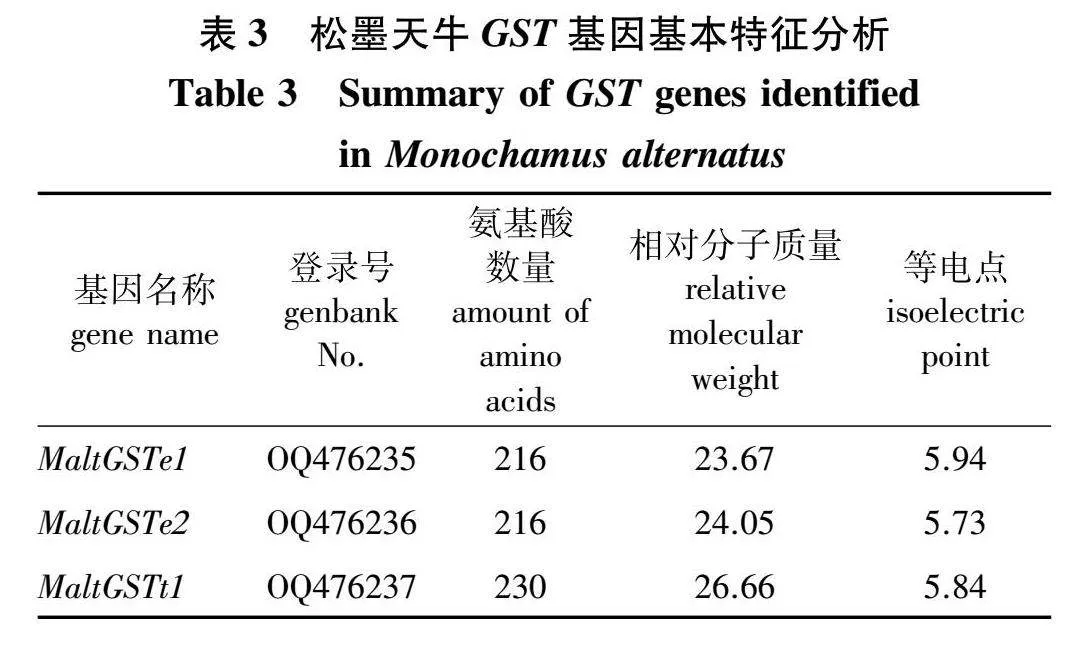
对松墨天牛GST基因进行克隆,结果见表3。由表3可知,克隆出3条松墨天牛GST基因,分别命名为MaltGSTe1(OQ476235)、MaltGSTe2(OQ476236)和MaltGSTt1(OQ476237),开放阅读框长度为651、651和693 bp,分别编码216、216和230个氨基酸残基;相对分子质量分别为23.67、2405和26.66;等电点分别为5.94、5.73和5.84。3条GST基因均具亲水性且位于胞质中。
将MaltGSTe1、MaltGSTe2和MaltGSTt1的氨基酸序列与NCBI数据库中光肩星天牛(Anoplophora glabripennis)、马铃薯甲虫(Leptinotarsa decemlineata)、玉米象(Sitophilus zeamais)以及蜂箱小甲虫(Aethina tumida)的GST基因氨基酸序列进行Motif分析,结果如图1所示。可知MaltGSTe1和MaltGSTe2具有6个Motif保守区域,与同一家族其他昆虫具有相同的4个保守结构域,MaltGSTe2与光肩星天牛的保守Motif区域保持相对一致,同源性更高;MaltGSTt1与Theta家族其他基因有4个保守结构域。
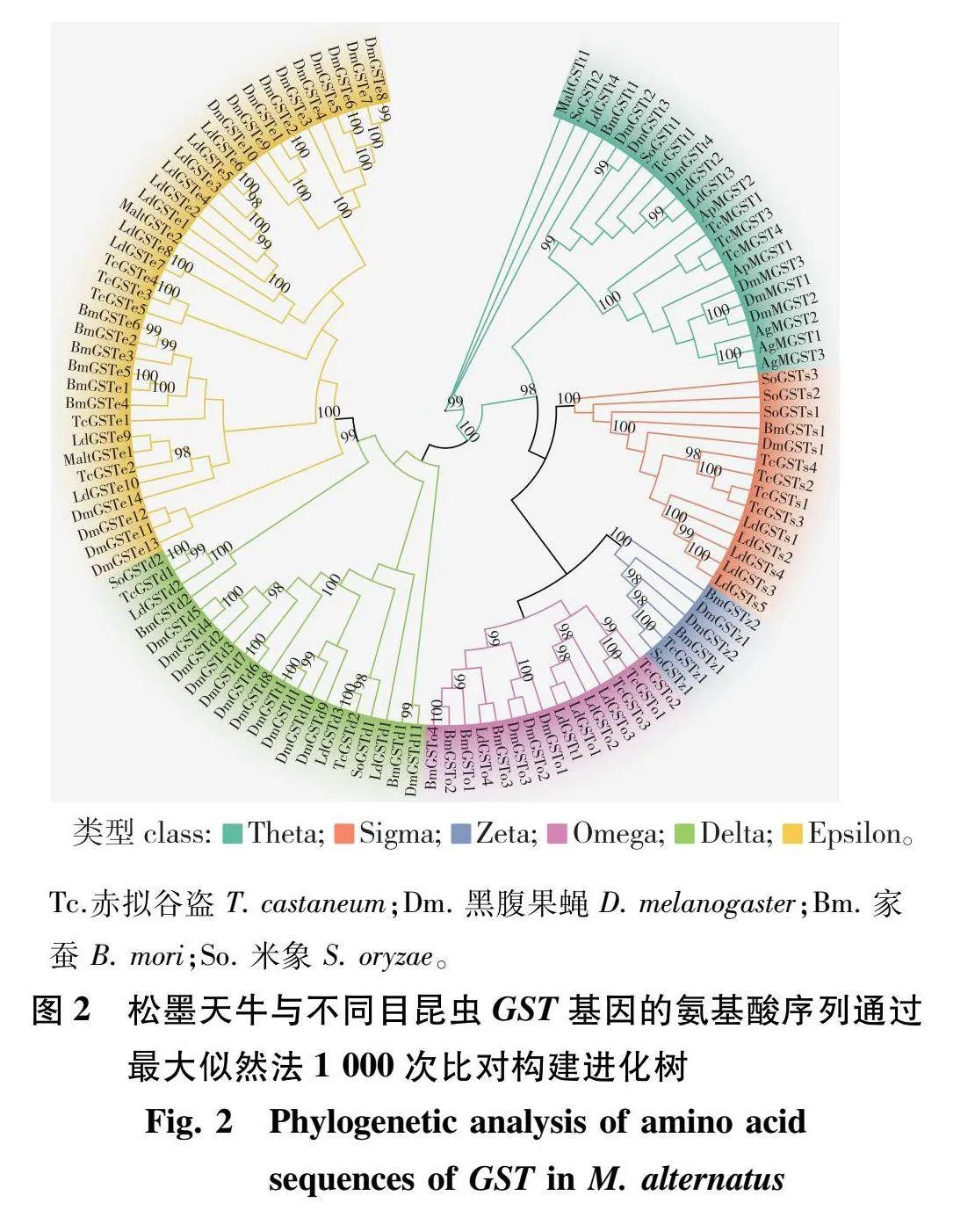
103个氨基酸序列构建系统发育树见图 克隆的3条松墨天牛GST基因同马铃薯甲虫、赤拟谷盗(Tribolium castaneum)、黑腹果蝇(Drosophila melanogaster)、家蚕(Bombyx mori)与米象(Sitophilus oryzae)中Omega(14个)、Zeta(6个)、Sigma(14个)、Theta(10个)、Epsilon(35个)和Delta(21个)家族中,MaltGSTe1与MaltGSTe2均与马铃薯甲虫的GST基因氨基酸序列同源性较高;MaltGSTt1与米象GST基因的氨基酸序列有99%的相似性。
对松墨天牛GST基因进行序列分析见图3。由图3可以看出,MaltGSTe1和MaltGSTe2基因氨基酸序列中分别有8个可能与底物结合的氨基酸位点残基,整个结构域中包括4个β-折叠和8个α-螺旋,MaltGSTe2在碱基序列第591~596位点存在1个多腺苷酸化信号(AATAAA);MaltGSTt1有9个可能与底物结合的氨基酸位点残基,结构域中包括5个β-折叠和10个α-螺旋。
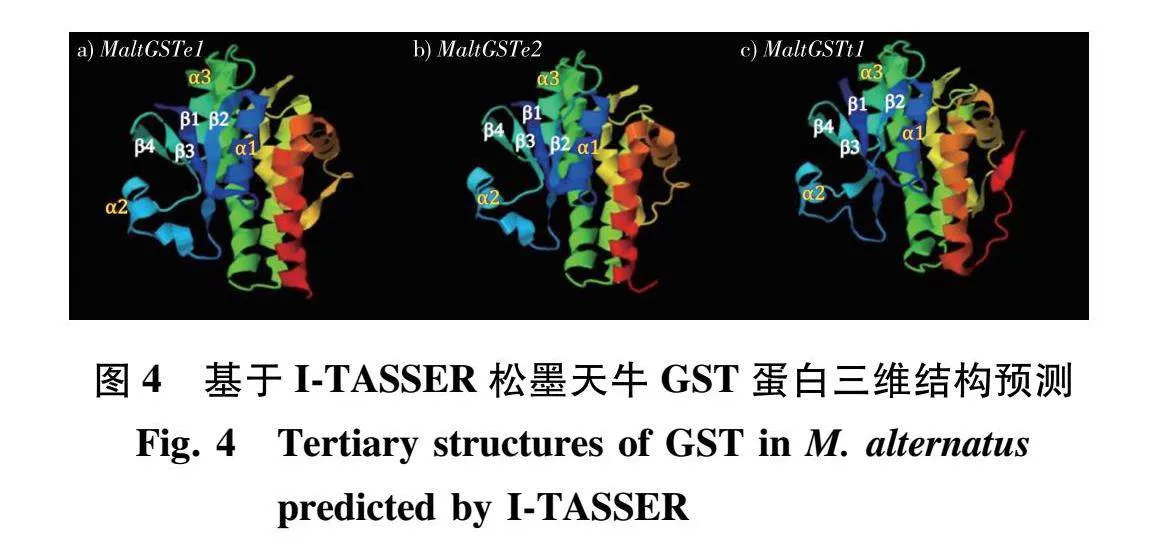
3条基因的三维结构预测(图4)中N-末端均含有4个β-折叠和3个α-螺旋,符合胞质型GST的指示性特征。
2.2 GST基因mRNA在松墨天牛幼虫中的相对表达量
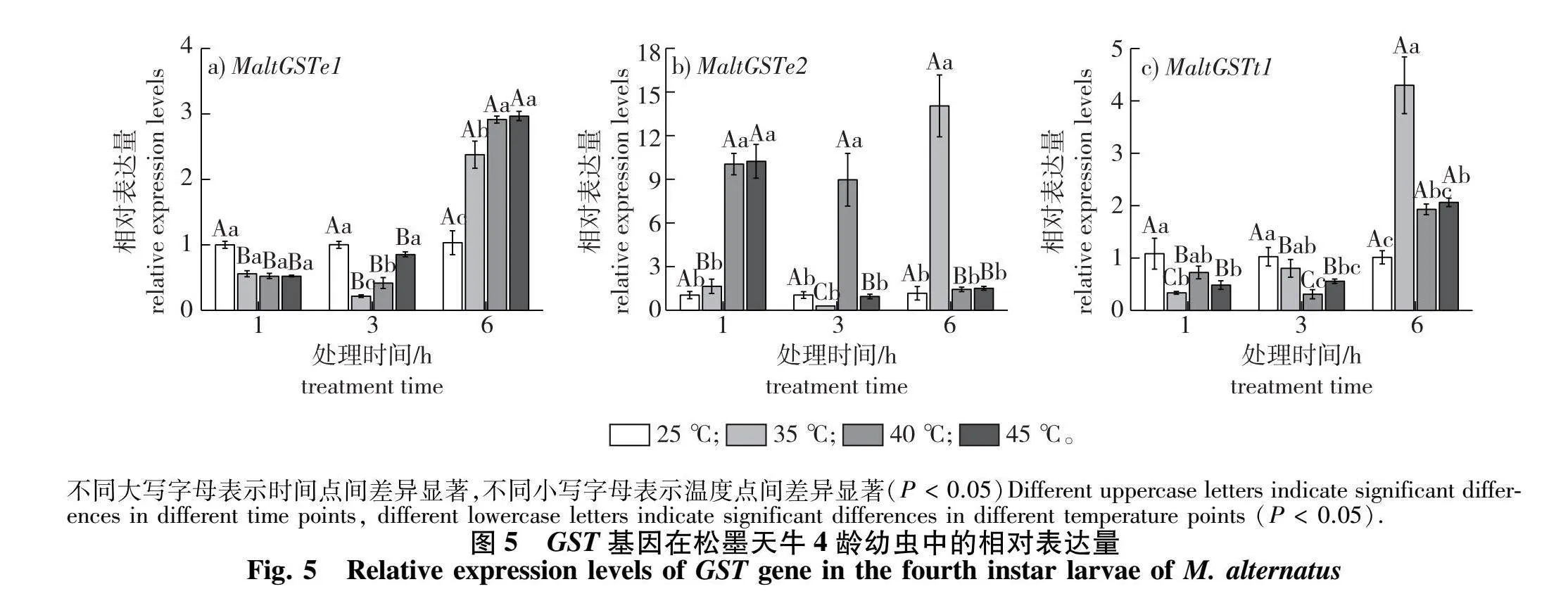
经分析可知,松墨天牛4龄幼虫受到高温胁迫后,3条GST基因的相对表达量(以0 ℃为对照)均呈现不同程度的上调(图5)。MaltGSTe1相对表达量在不同高温处理6 h后出现显著上调(图5a),为对照组的237~2.97倍(P lt; 0.05);40、45" ℃处理6 h后,与35" ℃处理组相比基因表达量有显著上调。MaltGSTe2的相对表达量(图5b)在35" ℃处理6 h时表达量上调最明显,为对照组的14.05倍,40" ℃处理1、3 h和45" ℃处理1 h后均显著上升(P lt; 005),相对表达量分别增加10.06、8.96和10.25倍。MaltGSTt1的相对表达量(图5c)在不同高温处理6 h后均显著上调(P lt; 0.05),35" ℃处理6 h上调量最高,为对照组的4.30倍,而35" ℃下处理1 h、40" ℃下处理3 h后该基因的相对表达量显著下调,为对照组的30%左右(P lt; 0.05)。
2.3 GST基因mRNA在松墨天牛成虫中的相对表达量
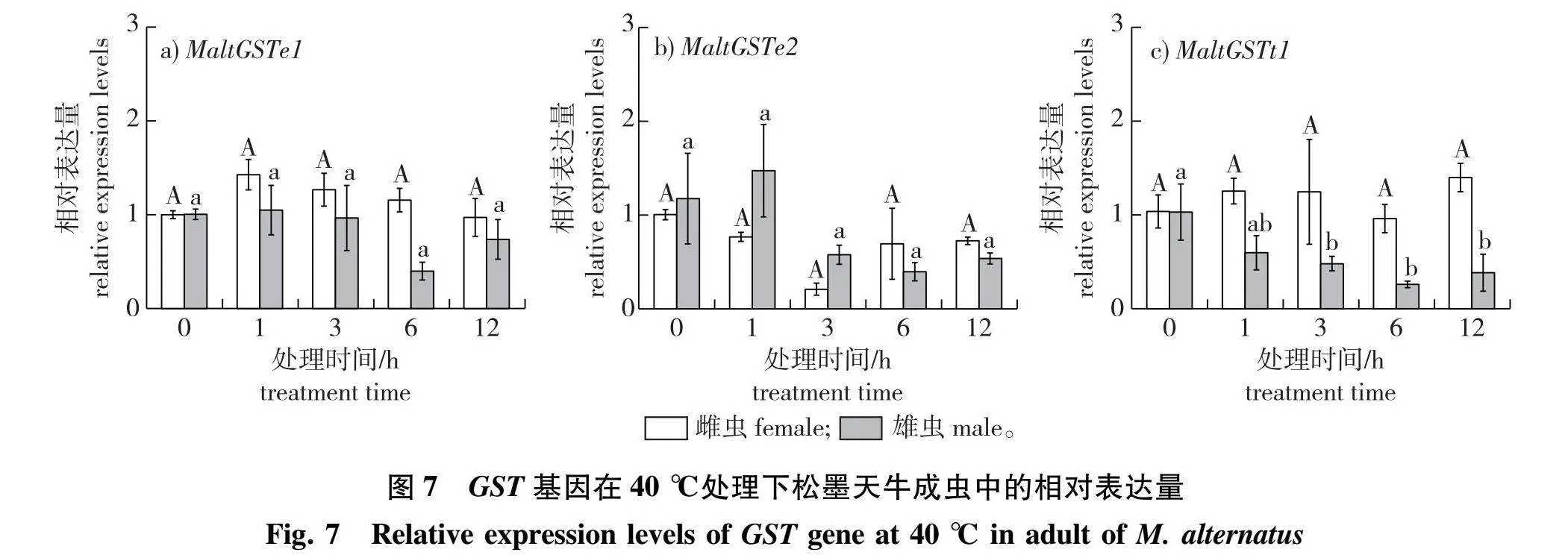
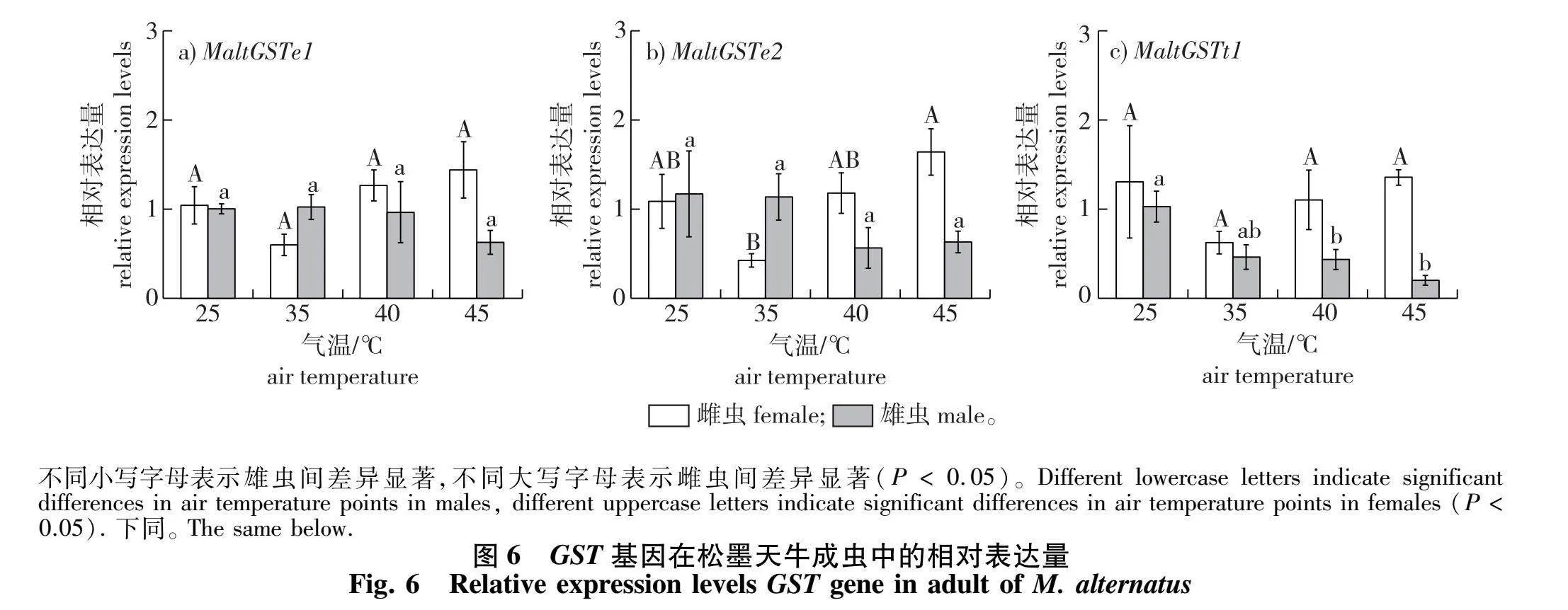
经分析(图6)可知,高温处理3 h后,MaltGSTe1的相对表达量在松墨天牛成虫体内均无明显上或下调。MaltGSTe2相对表达量在雄虫体内无显著差异;在雌虫中,MaltGSTe2相对表达量在35和45" ℃两处理组间存在显著差异(P lt; 005),但所有高温处理组与25 ℃(对照组)之间无显著差异。较特殊的是,各高温处理下的雄虫体内MaltGSTt1基因相对表达量表现出下调趋势,下调范围为452%~80.3%,40与45" ℃处理组显著下调(P lt; 005),在45" ℃时下调最多,为25 ℃的19.7%(图6c)。3条GST基因在40和45" ℃高温下都表现出雌虫相对表达量高于雄虫的现象。
根据不同温度处理3 h的实时荧光定量分析,3条GST基因在雌虫体内相对表达量与对照组相比无显著上下调,只有MaltGSTt1基因在雄虫体内相对表达量有显著下降(P lt; 0.05)。因此,挑选40" ℃固定高温下处理不同时间后的松墨天牛成虫进行qRT-PCR检验(图7)。40" ℃处理不同时间后MaltGSTe1和MaltGSTe2基因(图7a、7b)在雌、雄虫体内相对表达量均无显著差异。MaltGSTt1基因(图7c)在40" ℃高温处理6 h后雄虫体内相对表达量下降至最低(P lt; 005),为对照组的25.92%。
2.4 松墨天牛GST基因的原核表达
经研究发现,在 28 "℃ 1 mmol/L 的 IPTG诱导12 h下,MaltGSTe1、MaltGSTe2和MaltGSTt1蛋白均只存在于菌液上清液中。蛋白电泳结果如图8所示,相较于空载体,IPTG诱导后的 MaltGSTe1-pET-28a(+)和MaltGSTe2-pET-28a(+)菌液的上清液中有分子质量约为24 ku的蛋白条带,IPTG诱导后的 MaltGSTt1-pET-28a(+)菌液的上清液中有分子质量约为27 ku的蛋白条带,这与前期预测结果一致。
2.5 GST基因的抗氧化性分析
通过纸盘扩散试验检测蛋白MaltGSTe1、MaltGSTe2和MaltGSTt1的抗氧化活性结果(图9)表明,在不同浓度的异丙苯过氧化氢处理下,空载与过表达MaltGSTe1、MaltGSTe2和MaltGSTt1大肠杆菌间均有显著性差异。随着异丙苯过氧化氢浓度的增加,大肠杆菌受到的氧化损伤越强,表达MaltGSTe1、MaltGSTe2和MaltGSTt1蛋白的大肠杆菌开始表现出较强的抗氧化能力,滤纸片周围的抑菌圈明显小于空载大肠杆菌中的抑菌圈。其中,MaltGSTe2具有更强的抗氧化能力。
3 讨 论
温度被认为是促氧化因子,高温胁迫能够激活昆虫体内的抗氧化应激防御[37],避免过多ROS的积累和氧化损伤,从而增强昆虫的耐热水平。松墨天牛的耐热性高于温带其他昆虫[35],意味着松墨天牛抵御高温胁迫的响应机制比其他温带地区昆虫完备。针对松墨天牛响应高温胁迫的氧化应激途径的分子机制,本研究利用分子生物学和生物信息学方法,成功克隆松墨天牛2条Epsilon家族和1条Theta家族GST基因的cDNA全长,且这3条基因均符合典型胞质型GST家族的结构特征[38]。松墨天牛4龄幼虫和成虫不同高温不同时长的胁迫处理结果表明,高温胁迫可以诱导松墨天牛幼虫GST基因表达水平的上调,说明高温胁迫下松墨天牛幼虫体内发生了活性氧积累产生内源性毒素的生理反应,MaltGSTe1、MaltGSTe2和MaltGSTt1基因参与松墨天牛幼虫期对细胞代谢产生活性氧的防御以及解毒响应。MaltGSTe2基因对高温响应最为显著,表明MaltGSTe2基因上调表达在松墨天牛4龄幼虫的耐热性发展中起着重要作用。
不同类型的GST基因在昆虫不同组织或不同发育阶段的表达有差异[39-40],研究发现方斑瓢虫(Propylaea quatuordecimpunctata)GST活性在32~38" ℃间持续下降(P lt; 0.05)[41],雷氏萤(Aquatica leii)在不同性别成虫之间GST基因表达不稳定[42],烟蚜茧蜂(Aphidius gifuensis)雌虫暴露于30和35" ℃中GST基因表达水平显著高于雄虫,正常温度下低于雄虫,且雌虫死亡率小于雄虫[10]。本研究还发现,MaltGSTt1在松墨天牛雄虫受到高温胁迫后显著受到抑制,相对表达量出现明显下调,而在雌虫中GST基因表达量则高于雄虫。MaltGSTt1在松墨天牛成虫中的差异性表达表明,极端高温可导致MaltGSTt1表达异常,暗示着松墨天牛不同性别的耐热性存在差异。纸盘扩散法结果与表达中华蜜蜂(Apis cerana cerana)GST基因蛋白的纸盘扩散试验[43]一致,证明MaltGSTe1、MaltGSTe2和MaltGSTt1的过表达能够增强大肠杆菌对氧化刺激的抗性,相较于其他两条GST基因,MaltGSTe2基因在纸盘扩散试验中表现出了更强的抗氧化能力。
本研究克隆获得3条松墨天牛GST基因,探究了高温胁迫下松墨天牛不同虫态、不同性别体内GST基因的表达模式,发现高温胁迫可诱导GST基因表达量上调;纸盘扩散试验结果表明,异源表达GST基因蛋白具有抗氧化能力。说明松墨天牛GST基因通过消除高温胁迫下机体氧化应激过程中氧代谢产生的过多ROS,保护机体免受氧化应激,从而参与松墨天牛高温胁迫响应机制,帮助松墨天牛抵御高温带来的不利影响。此外,是否有其他抗氧化酶基因参与松墨天牛对高温胁迫的分子响应等问题需要进一步研究。
参考文献(reference):
[1]GARRAD R, BOOTH D T, FURLONG M J. The effect of rearing temperature on development, body size, energetics and fecundity of the diamondback moth[J]. Bull" Entomol" Res, 2016, 106(2): 175-181. DOI: 10.1017/S000748531500098X.
[2]钱雪, 王月莹, 谢欢欢, 等. 温度对西伯利亚蝗呼吸代谢关键酶活性的影响[J]. 昆虫学报, 2017, 60(5): 499-504. QIAN X, WANG Y Y, XIE H H, et al. Effects of temperature on the activities of key enzymes related to respiratory metabolism in adults of Gomphocerus sibiricus (Orthoptera: Acrididae)[J]. Acta Entomol" Sin, 2017, 60(5): 499-504. DOI: 10.16380/j.kcxb.2017.05.001.
[3]TURRENS J F. Mitochondrial formation of reactive oxygen species[J]." J"" Physiol, 2003, 552(2): 335-344. DOI: 10.1113/jphysiol.2003.049478.
[4]HALLIWELL B. Antioxidants: the basics, what they are and how to evaluate them[J]. Adv" Pharmacol, 1996, 38: 3-20. DOI: 10.1016/s1054-3589(08)60976-x.
[5]SLIMEN I B, NAJAR T, GHRAM A, et al. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage:" a review[J]. Int" J" Hyperthermia, 2014, 30(7): 513-523. DOI: 10.3109/02656736.2014.971446.
[6]HABASHY W S, MILFORT M C, REKAYA R, et al. Cellular antioxidant enzyme activity and biomarkers for oxidative stress are affected by heat stress[J]. Int" J" Biometeorol, 2019, 63(12): 1569-1584. DOI: 10.1007/s00484-019-01769-z.
[7]李慧, 郝德君, 徐天, 等. 高温胁迫对植食性昆虫影响研究进展[J]. 南京林业大学学报(自然科学版), 202" 46(6): 215-224. LI H, HAO D J, XU T, et al. The effects of heat stress on herbivorous insects: an overview and future directions[J]. J Nanjing For Univ (Nat Sci Ed), 202" 46(6): 215-224. DOI: 10.12302/j.issn.1000-2006.202209041.
[8]RIX R R, CUTLER G C. Review of molecular and biochemical responses during stress induced stimulation and hormesis in insects[J]. Sci Total Environ, 202" 827: 154085. DOI: 10.1016/j.scitotenv.2022.154085.
[9]ZHANG S Z, FU W Y, LI N, et al. Antioxidant responses of Propylaea japonica (Coleoptera: Coccinellidae) exposed to high temperature stress[J]. J" Insect Physiol, 2015, 73: 47-52. DOI: 10.1016/j.jinsphys.2015.01.004.
[10]KANG Z W, LIU F H, LIU X, et al. The potential coordination of the heat-shock proteins and antioxidant enzyme genes of Aphidius gifuensis in response to thermal stress[J]. Front" Physiol, 2017, 8: 976. DOI: 10.3389/fphys.2017.00976.
[11]MOREIRA D C, PAULA D P, HERMES-LIMA M. Changes in metabolism and antioxidant systems during tropical diapause in the sunflower caterpillar Chlosyne lacinia (Lepidoptera: Nymphalidae)[J]." Insect Biochem Mol" Biol, 202 134: 103581. DOI: 10.1016/j.ibmb.2021.103581.
[12]WANG Y J, QIU L, RANSON H, et al. Structure of an insect epsilon class glutathione S-transferase from the malaria vector Anopheles gambiae provides an explanation for the high DDT-detoxifying activity[J]. J" Struct" Biol, 2008, 164(2): 228-235. DOI: 10.1016/j.jsb.2008.08.003.
[13]OAKLEY A. Glutathione transferases: a structural perspective[J]. Drug Metab Rev, 201 43(2): 138-151. DOI: 10.3109/03602532.2011.558093.
[14]MANNERVIK B. Five decades with glutathione and the GSTome[J]. J" Biol" Chem, 201" 287(9): 6072-6083. DOI: 10.1074/jbc.X112.342675.
[15]GALL , BELA K, HAJNAL , et al. Crosstalk between the redox signalling and the detoxification:GSTs under redox control?[J]. Plant Physiol Biochem, 202 169: 149-159. DOI: 10.1016/j.plaphy.2021.11.009.
[16]HAYES J D, FLANAGAN J U, JOWSEY I R. Glutathione transferases[J]. Annu Rev Pharmacol Toxicol, 2005, 45: 51-88. DOI: 10.1146/annurev.pharmtox.45.120403.095857.
[17]RAZA H. Dual localization of glutathione S-transferase in the cytosol and mitochondria: implications in oxidative stress, toxicity and disease[J]. FEBS J, 201 278(22): 4243-4251. DOI: 10.1111/j.1742-4658.2011.08358.x.
[18]LABORDE E. Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death[J]. Cell Death"" Differ, 2010, 17(9): 1373-1380. DOI: 10.1038/cdd.2010.80.
[19]ZHU G D, XUE M, LUO Y, et al. Effects of short-term heat shock and physiological responses to heat stress in two Bradysia adults, Bradysia odoriphaga and Bradysia difformis[J]. Sci Rep, 2017, 7(1): 13381. DOI: 10.1038/s41598-017-13560-4.
[20]ZHAO Y, LI Y Y, HE M, et al. Antioxidant responses of the pest natural enemy Hylyphantes graminicola (Araneae: Linyphiidae) exposed to short-term heat stress[J]. J" Therm Biol, 2020, 87: 102477. DOI: 10.1016/j.jtherbio.2019.102477.
[21]ALVES M, PEREIRA A, MATOS P, et al. Bacterial community associated to the pine wilt disease insect vectors Monochamus galloprovincialis and Monochamus alternatus[J]. Sci" Rep, 2016, 6: 23908. DOI: 10.1038/srep23908.
[22]TOGASHI K. Population density of Monochamus alternatus adults (Coleoptera: Cerambycidae) and incidence of pine wilt disease caused by Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae)[J]. Res Popul" Ecol, 1988, 30(2): 177-192. DOI: 10.1007/BF02513243.
[23]王立超, 陈凤毛, 董晓燕, 等. 松墨天牛取食和产卵特性研究[J]. 南京林业大学学报(自然科学版), 2023, 47(2): 219-224. WANG L C, CHEN F M, DONG X Y, et al. A study on feeding and oviposition characteristics of Monochamus alternatus[J]. J Nanjing For Univ (Nat Sci Ed), 2023, 47(2): 219-224. DOI: 10.12302/j.issn.1000-2006.202103022.
[24]陈宏健, 郝德君, 田敏, 等. 室内饲养松墨天牛幼虫不同肠段细菌的群落结构及功能分析[J]. 南京林业大学学报(自然科学版), 202 45(3): 143-151. CHEN H J, HAO D J, TIAN M, et al. The community structure and functional analysis of intestinal bacteria in Monochamus alternatus larvae reared indoors[J]. J Nanjing For Univ (Nat Sci Ed), 202 45(3): 143-151. DOI: 10.12302/j.issn.1000-2006.202004009.
[25]田开慧,陈怡帆,周宏威. 湖南湘西州马尾松毛虫和松材线虫病发生非线性建模与预测 [J]. 森林工程, 202" 38 (6): 38-44. TIAN K H, CHEN Y F, ZHOU H W. Prediction of occurrence trend of Dendrolimus punctatus and pine wilt disease in Xiangxi Prefecture[J]. For Eng, 202" 38 (6): 38-44.
[26]王洋, 陈军, 陈凤毛, 等. 松墨天牛取食期间传播松材线虫的特性[J]. 南京林业大学学报(自然科学版), 2019, 43(6): 1-10. WANG Y, CHEN J, CHEN F M, et al. Transmission of Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae) through feeding activity of Monochamus alternatus (Coleoptera: Cerambycidae)[J]. J Nanjing For Univ (Nat Sci Ed), 2019, 43(6): 1-10. DOI: 10.3969/j.issn.1000-2006.201903001.
[27]ZHAO L L, ZHANG S, WEI W, et al. Chemical signals synchronize the life cycles of a plant-parasitic nematode and its vector beetle[J]. Curr" Biol, 2013, 23(20): 2038-2043. DOI: 10.1016/j.cub.2013.08.041.
[28]OHSAWA M, AKIBA M. Possible altitude and temperature limits on pine wilt disease: the reproduction of vector sawyer beetles(Monochamus alternatus), survival of causal nematode (Bursaphelenchus xylophilus), and occurrence of damage caused by the disease[J]. Eur" J" For Res, 2014, 133(2): 225-233. DOI: 10.1007/s10342-013-0742-x.
[29]吴佳雯, 尹艳楠, 谈家金, 等. 蜡样芽孢杆菌NJSZ-13菌株诱导马尾松抗松材线虫病研究[J]. 南京林业大学学报(自然科学版), 202" 46(4): 53-58. WU J W, YIN Y N, TAN J J, et al. A preliminary study on resistance of Pinus massoniana induced by Bacillus cereus NJSZ-13 strain to Bursaphelenchus xylophilus[J]. J Nanjing For Univ (Nat Sci Ed), 202" 46(4): 53-58. DOI: 10.12302/j.issn.1000-2006.202006051.
[30]杨帆,零雅茗,舒红,等. 松材线虫Bx-TIMP克隆及功能研究 [J]. 森林工程, 202" 38 (2): 14-19. YANG F,LING Y M,SHU H, et al. Cloning and functional analysis of Bursaphelenchus xylophilus Bx-TIMP[J]. For Eng, 202" 38 (2): 14-19.
[31]李慧, 何玄玉, 陶蓉, 等. 松墨天牛小热激蛋白基因的克隆、表达谱及对温度胁迫的响应[J]. 昆虫学报, 2018, 61(7): 749-760. LI H, HE X Y, TAO R, et al. cDNA cloning and expression profiling of small heat shock protein genes and their response to temperature stress in Monochamus alternatus(Coleoptera: Cerambycidae)[J]. Acta Entomol Sin, 2018, 61(7): 749-760. DOI: 10.16380/j.kcxb.2018.07.001.
[32]LI H, QIAO H, LIU Y J, et al. Characterization, expression profiling, and thermal tolerance analysis of heat shock protein 70 in pine sawyer beetle,Monochamus alternatus Hope (Coleoptera: Cerambycidae)[J]. Bull "Entomol" Res, 202 111(2): 217-228. DOI: 10.1017/S0007485320000541.
[33]CAI Z L, CHEN J X, CHENG J, et al. Overexpression of three heat shock proteins protects" Monochamus alternatus (Coleoptera: Cerambycidae) from thermal stress[J]. J" Insect Sci, 2017, 17(6): 113. DOI: 10.1093/jisesa/iex082.
[34]李慧. 热激蛋白在松墨天牛响应高温胁迫中的功能研究[D]. 南京: 南京林业大学, 2021. LI H. Function analysis of heat shock protein in Monochamus alternatus response to high temperature[D]. Nanjing: Nanjing For" Univ, 2021. DOI: 10.27242/d.cnki.gnjlu.2021.000015.
[35]LI H, ZHAO X Y, QIAO H, et al. Comparative transcriptome analysis of the heat stress response in" Monochamus alternatus Hope (Coleoptera: Cerambycidae)[J]. Front Physiol, 2020, 10: 1568. DOI: 10.3389/fphys.2019.01568.
[36]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR[J]. Methods, 200" 25(4): 402-408. DOI: 10.1006/meth.2001.1262.
[37]RAJARAPU S P, MAMIDALA P, HERMS D A, et al. Antioxidant genes of the emerald ash borer(Agrilus planipennis): gene characterization and expression profiles[J]. J" Insect Physiol, 201 57(6): 819-824. DOI: 10.1016/j.jinsphys.2011.03.017.
[38]SANDAMALIKA W M G, PRIYATHILAKA T T, LEE S, et al. Immune and xenobiotic responses of glutathione S-Transferase theta (GST-θ) from marine invertebrate disk abalone (Haliotis discus discus): with molecular characterization and functional analysis[J]. Fish"" Shellfish Immunol, 2019, 91: 159-171. DOI: 10.1016/j.fsi.2019.04.004.
[39]SUN L L, YIN J J, DU H, et al. Characterisation of GST genes from the Hyphantria cunea and their response to the oxidative stress caused by the infection of Hyphantria cunea nucleopolyhedrovirus (HcNPV)[J]. Pestic" Biochem" Physiol, 2020, 163: 254-262. DOI: 10.1016/j.pestbp.2019.11.019.
[40]李长春, 宁青, 戴余军, 等. 拟环纹豹蛛谷胱甘肽S-转移酶基因的克隆及表达分析[J]. 江苏农业学报, 2019,35(5): 1068-1074. LI C C, NING Q, DAI Y J, et al. Cloning and expression analysis of glutathione S-transferase gene in" Pardosa pseudoannulata[J]. Jiangsu J Agri Sci, 2019, 35(5): 1068-1074. DOI: 10.3969/j.issn.1000-4440. 2019.05.010.
[41]YANG Q, LIU J P, WYCKHUYS K A G, et al. Impact of heat stress on the predatory ladybugs" Hippodamia variegata and Propylaea quatuordecimpunctata[J]. Insects, 202" 13(3): 306. DOI: 10.3390/insects13030306.
[42]YANG X J, ZHENG H L, LIU Y Y, et al. Selection of reference genes for quantitative real-time PCR in Aquatica leii (Coleoptera: Lampyridae) under five different experimental conditions[J]. Front" Physiol, 2020, 11: 555233. DOI: 10.3389/fphys.2020.555233.
[43]张媛英. 中华蜜蜂谷胱甘肽S-转移酶和小分子热激蛋白基因的生物学功能分析[D]. 泰安: 山东农业大学, 2014. ZHANG Y Y. Biological analysis of glutathione S-transferase and small heat shock protein genes in Apis cerana cerana[D]. Tai’an: Shandong Agricul" Univ, 2014. DOI: 10.7666/d.Y2587648.
(责任编辑 王国栋)
