海(咸)水入侵对莱州湾南岸含水层微生物群落结构的影响
2025-01-24陈宏帆支传顺胡晓农黄宪瑞陈耿

摘要: 为了探究海(咸)水入侵对含水层微生物群落结构影响及微生物丰度与环境因素关系,在莱州湾南岸白浪河下游沿岸3眼监测井内,采集各含水层中地下水和沉积物样品;根据高通量测序结果,研究海(咸)水入侵对含水层微生物群落结构影响。结果表明: 地下水中微生物丰富度和多样性均高于沉积物中的; 随着海(咸)水入侵的加剧,地下水中微生物的丰富度和多样性降低,沉积物中微生物的丰富度和多样性则呈现波动变化并有升高的趋势;地下水中微生物以变形菌门、 拟杆菌门为主,而沉积物中以变形菌门、 放线菌门为主,在门以下微生物群落结构差异性较大,涅斯特连科氏菌属可作为识别海(咸)水入侵的标志微生物; 地下水的Cl-、 HCO-3含量和酸碱度对微生物群落结构影响显著,溶解性总固体、 化学需氧量、 全盐量对沉积物中微生物群落结构影响显著。
关键词: 海(咸)水入侵; 地下水; 微生物群落结构; 莱州湾
中图分类号: X523
文献标志码: A
开放科学识别码(OSID码):
Influence of Sea(Salt) Water Invasion on Microbial Community
Structure in Aquifer on the South Bank of Laizhou Bay
CHEN Hongfan, ZHI Chuanshun, HU Xiaonong, HUANG Xianrui, CHEN Gen
(School of Water Conservancy and Environment, University of Jinan, Jinan 250022)
Abstract: To investigate the influence of sea(salt) water intrusion on the structure of microbial communities in aquifers and the relationship between microbial abundance and environmental factors,groundwaterandsedimentsamplesfromvarious aquifers were collected in 3 monitoring wells along the downstream of the Bailang River on the south bank of Laizhou Bay. Sequencing analysis was conducted using high-throughput sequencingmethodsto studytheimpactofsea(salt) water intrusion on the microbial community structure in aquifers. The results show the microbial richness and diversity in groundwater surpass their counterparts in sediment. With the intensification of sea (salt) water intrusion, the richness and diversity of microbials in groundwater also decrease, while those of the microbials in sediments fluctuate and increase. In groundwater, Proteobacteria and Bacteroidetes are dominant, while in sediments, Proteobacteria and Actinomyces are dominant, and the community structure of microbials below the phyla is significantly different. It is found that Nesterenkonia can be used as a marker to identify the invasion of sea (salt) water. Cl-, HCO- content and pH value in groundwater significantly affect the microbial community structure, and the total dissolved solids, chemical oxygen demand, and total salinity significantly affect the microbial community structure in sediments.
Keywords: sea (salt) water intrusion; groundwater; microbial community structure; Laizhou Bay
沿海地带所处地理区位地势较低, 岩相构造隔水性差, 温室效应造成海平面上升和不合理人为地下水资源(如淡水、 卤水等)开采利用, 近海岸逐渐形成地下水漏斗,并破坏了原有的咸-淡水的平衡界面,致使海(咸)水入侵问题日益突出[1-2]。传统的海(咸)水入侵调查研究主要借助水化学法、 地球物理勘测法、 同位素示踪法等非生物参数指标进行分析[3-4]; 海(咸)水入侵不仅改变含水层中酸碱度、 离子含量等环境因素,进而会影响微生物的群落结构组成[5-7]。近年来,许多学者开始关注海(咸)水入侵对地下水水化学及微生物群落的影响,如在我国的广西北海[8]、 印度尼西亚的瓜哇岛[9]、 韩国的济州岛[10]的地下含水层中发现了甲基单胞菌科Methylomonadaceae、 海杆菌属Marinobacter、 红杆菌科Rhodobacteraceae和黄杆菌科Flavobacteriaceae微生物群落,在澳大利亚西部[11]沉积物中发现咸水球形菌属Salinisphaera、 黄单胞菌科Xanthomonadaceae微生物群落。还有研究[10]发现,高盐度地下水样本与海水共享的细菌种类占比为6.7%,而其他地下水样本所占比例不到0.5%。上述典型微生物在一定程度上可以指示海(咸)水入侵的发生,提供了海(咸)水入侵区域含水层微生物群落的变化依据。
莱州湾南岸是我国海(咸)水入侵最为严重的区域之一[2, 4]。Chen等[5]在山东省龙口市地下水中发现的微生物海洋螺菌目Oceanospirillales和交替单胞菌科Alteromonadaceae为该区域海(咸)水入侵标志微生物; Sang等[6]对龙口市海(咸)水入侵区核心土壤微生物群落分布分析发现,影响微生物群落分布的最重要的环境因子是土壤深度、 酸碱度、 有机碳和总氮。王庆兵等[12]对比龙口市和大沽河不同海岸带沿海地下水微生物特征,发现不同地域环境差异性影响较大。目前,针对莱州湾南岸不同含水层海(咸)水入侵程度及微生物响应特征研究鲜有报道,缺乏含水层中地下水与沉积物样品的对比分析。本文中在莱州湾南岸白浪河下游选择典型剖面,通过钻探取样、 水化学分析、 高通量测序等手段,分析不同深度含水层的水化学特征、 海(咸)水入侵程度、 地下水及沉积物微生物群落组成,揭示含水层微生物对海(咸)水入侵的响应特征及规律。
1 材料与方法
1.1 样品采集
根据已有钻探资料,选定莱州湾南岸白浪河下游3眼水质监测井,分别为ZK1、 ZK2、 ZK3,地理坐标分别为(119.162 7°E, 36.866 4°N)、 (119.162 5°E, 36.881 8°N)、 (119.162 3°E, 36.895 6°N)。
3眼监测井共有6个含水层, 从每个含水层采集沉积物及地下水样品, 采样深度分别为: ZK1井,12.2 m; ZK3井,30.5 m;ZK2巢式井,15.5、 102.5、 158.5、 175.4 m。采样时间为2022年10月至12月枯水期。含水层取样分为沉积物和地下水两部分,其中在钻孔取岩芯过程中,取质量为1 kg样品密封在聚乙烯包装袋,共6组样品,置于常温保存用于理化指标分析,同时采集3个平行样品,置于灭菌的离心管,放入干冰保温桶中冷藏(温度为-80 ℃)。成井后依据《地下水环境监测技术规范》(HJ 164—2020)[13]洗井,待水质参数仪显示酸碱度、 温度、 电导率等参数稳定后,利用气囊式低流量采样仪与电动超深井采水机采样。用容积为1 L的硬质塑料瓶采集6组地下水样品,置于常温用于水化学分析。现场真空抽滤2 L水样,将孔径为0.22 μm的滤膜置于无菌离心管,在温度为-80 ℃冷藏,用于地下水微生物分析。为了方便对比分析,将地下水样品按溶解性总固体(TDS)含量由小到大即海(咸)水入侵程度由轻到重依次编号为W1、 W2、 …、 W6,相同层位的沉积物样品编号为S1、 S2、 …、 S6。
1.2 地下水和沉积物理化分析
采用离子选择电极法测试土壤酸碱度, 采用质量法和电导法测试全盐量, 采用凯氏滴定法测试总氮(TN), 采用重铬酸钾氧化-还原容量法测试有机碳(SOC), 利用Winner 2008型激光粒度仪分析土壤粒度组成(各个粒级在土壤中所占的相对比例)。
采用EasuProbe20型便携式水质参数仪测定水的酸碱度及TDS含量,用离子色谱法测定水中阴、 阳离子(Ca2+、 Mg2+、 Na+、 Cl-、SO2-4、 HCO-3)含量, 用高锰酸钾法测定水中化学需氧量(COD)。
1.3 脱氧核糖核酸提取与聚合酶链式反应扩增
采用MO-BIO PowerSoil DNA Isolation Kit试剂盒提取样品脱氧核糖核酸(DNA),以琼脂糖的质量分数为1.2%的凝胶进行电泳检测; 针对细菌V4-V5(序列长度为303 bp)的可变区内目标基因,加入特异引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)、 引物926R(5′-CCGTCAATTCMTTTGAGTTT-3′)[14],采用ABI 9700型聚合酶链式反应(PCR)仪扩增目标基因片段。热循环仪程序如下: 94 ℃保持2 min, 36个循环(94、 55、 72 ℃时分别保持30 s); 72 ℃保持5 min, 降温至10 ℃时保温2 min。再次使用琼脂糖质量分数为1.2%的凝胶以电泳法检测扩增效果, 采用AxyPrepDNA凝胶回收试剂盒回收PCR产物, 用TC-3000TM型实时PCR仪定量分析,将样本按照等物质的量比混匀后二次PCR扩增,添加测序需要的接头,二次PCR热循环条件为: 94 ℃时保持2 min,8个循环(94、 55、 72 ℃时分别保持30 s); 72 ℃时保持5 min,10 ℃时保温2 min。再次以琼脂糖质量分数为2%的凝胶进行电泳检测,用AxyPrepDNA 凝胶回收试剂盒回收。将提取合格的DNA样品用Illumina平台进行高通量测序。
1.4 数据分析
利用Excel 2018软件处理数据, 采用统计产品与服务解决方案(SPSS)19软件分析数据的相关性。 采用R软件中的ggplot2、 vegan、 ade4包,根据不同距离测度如Bray-Curtis相异度绘制主坐标分析(PCoA)图,寻找各样品间微生物群落结构的差异; 用ggplot2、 pheatmap包对样品在门、 纲、 目水平的不同丰度数据绘制垂直柱状图和属水平的丰度热图, 直观体现物种的群落结构特征, 并结合环境因素与微生物种群开展典范对应分析(CCA)。
2 结果与讨论
2.1 沉积物与地下水理化特征
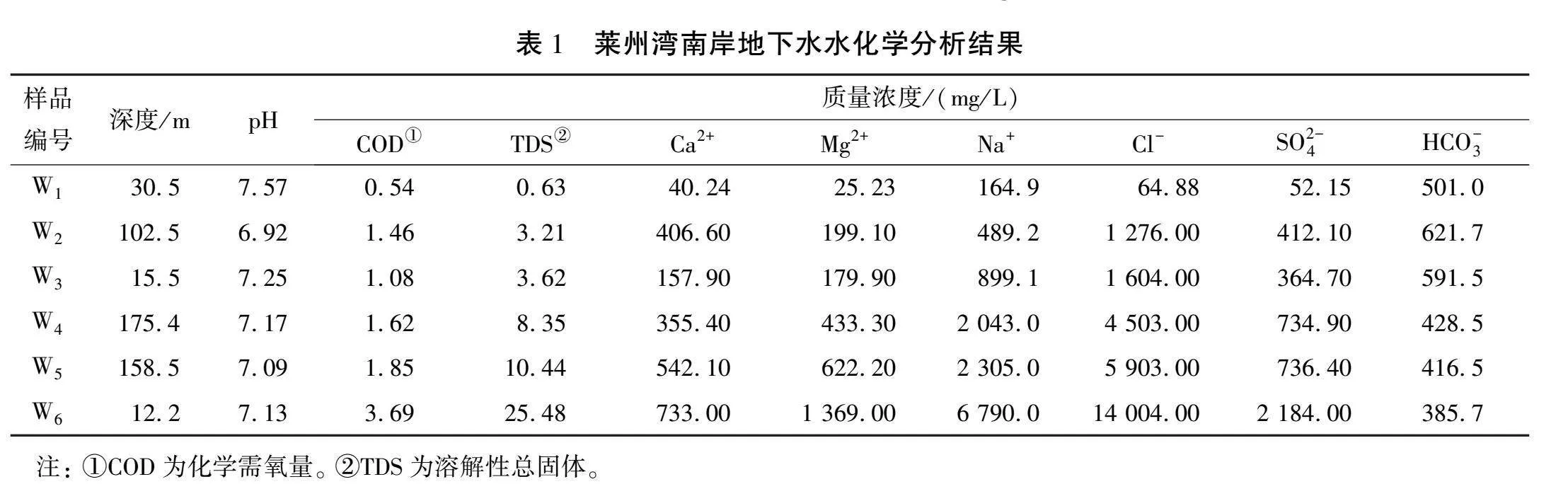
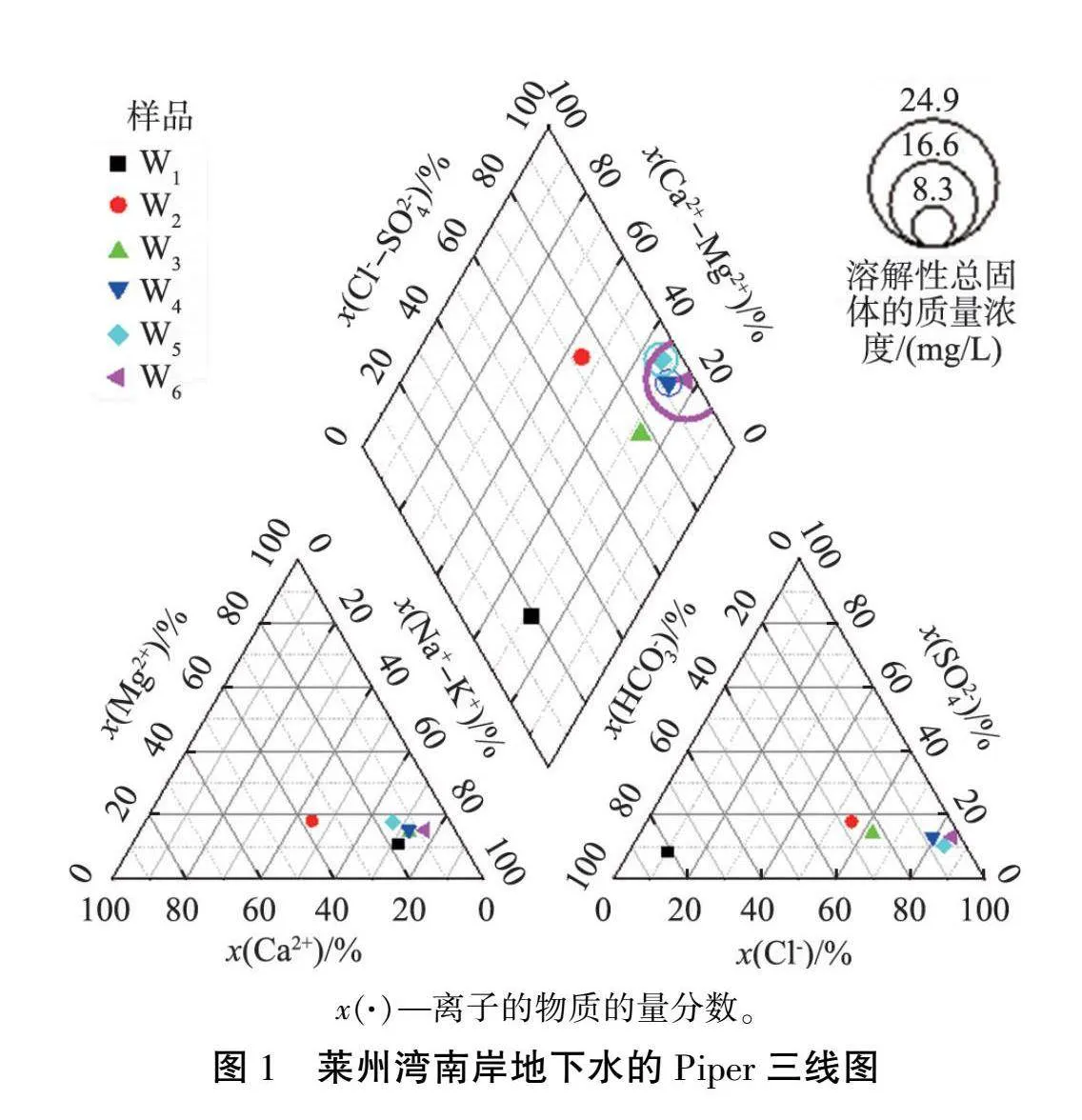
3眼水质监测井内6层含水层主要为第四系松散岩类孔隙水, 水化学分析结果见表1。 由表可见, 水体样品酸碱度以中性偏弱碱性为主, 样品W6的TDS质量浓度ρ(TDS)最大, 为 25.48 g/L,比W1样品的大约40倍。 根据Allan Freeze等[15]提出的地下水分类方法: 样品W1为淡水, ρ(TDS)lt;1 g/L; 样品W2、 W3、 W4为微咸水, 1 g/L≤ρ(TDS)lt;10 g/L; 样品W5、 W6为咸水, 10 g/L≤ρ(TDS)lt;100 g/L。
依据舒卡列夫分类法进行水化学类型分类,莱州湾南岸地下水的Piper三线图如图1所示,可以清晰展示K+、 Ca2+、 Mg2+、 Na+、 Cl-、SO2-4、 HCO-3离子含量间的关系。从图中可知,样品W1为Ca-HCO3型水,样品W2为Ca·Na-Cl型水,其余样品均为Na-Cl型水。将水中Cl-的质量浓度250 mg/L作为海(咸)水入侵简易判断指标[16],样品W1中Cl-的质量浓度最小,为64.88 mg/L,其余样品的Cl-的质量浓度均大于250 mg/L,其中样品W6中Cl-的质量浓度最接近海水的,达14 004 mg/L。此外,海水中典型阴离子Cl-与地下水中典型阴离子SO2-4、 HCO-3含量差距较大,当海(咸)水入侵发生时可对比 Cl-与HCO-3、 Cl-与SO2-4的质量浓度比值是否发生明显变化[17]。经过计算, 地下水样品中Cl-与HCO-3的质量浓度比值为0.13~36.3,Cl-与SO2-4的质量浓度比值为1.24~8.02,因此样品W1基本未受到海(咸)水入侵影响,样品W2、 W3、 …、 W6所在含水层受海(咸)水入侵影响依次递增,将样品W1含水层划分为淡水层,样品W2、W3含水层划分为轻度海(咸)水入侵层, 样品W4、 W5含水层划分为中度海(咸)水入侵层, 样品W6含水层划分为重度海(咸)水入侵层。
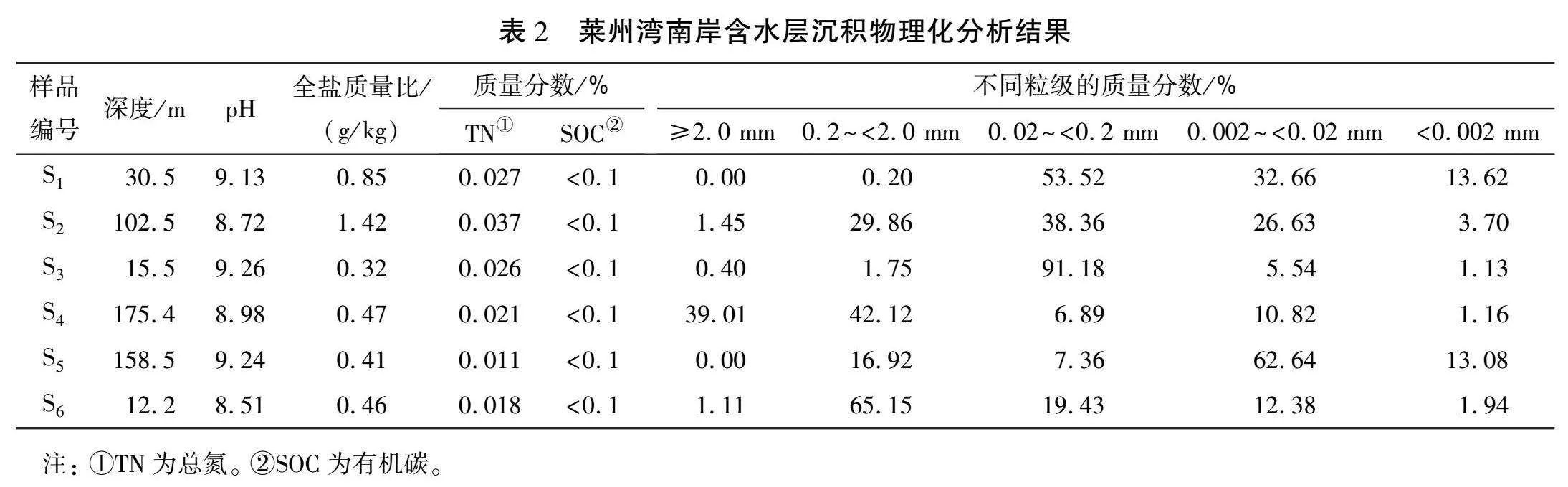
表2所示为莱州湾南岸含水层沉积物理化分析结果。根据土壤机械组成分析,沉积物主要由粉砂、中砂、 粗砂砂性土壤构成。由表可见,沉积物样品的酸碱度pH为8.51~9.26,属弱碱性土壤为主且均为非盐渍土,除样品S3、 S6的全盐量比较高外,其他样品全盐质量比为0.3~0.4 g/kg。样品S5中TN的含量最低,质量分数仅为0.011%,样品S3中的最高,质量分数为0.037%。含水层整体SOC含量较低,质量分数均小于0.1%。
2.2 沉积物与地下水微生物群落组成
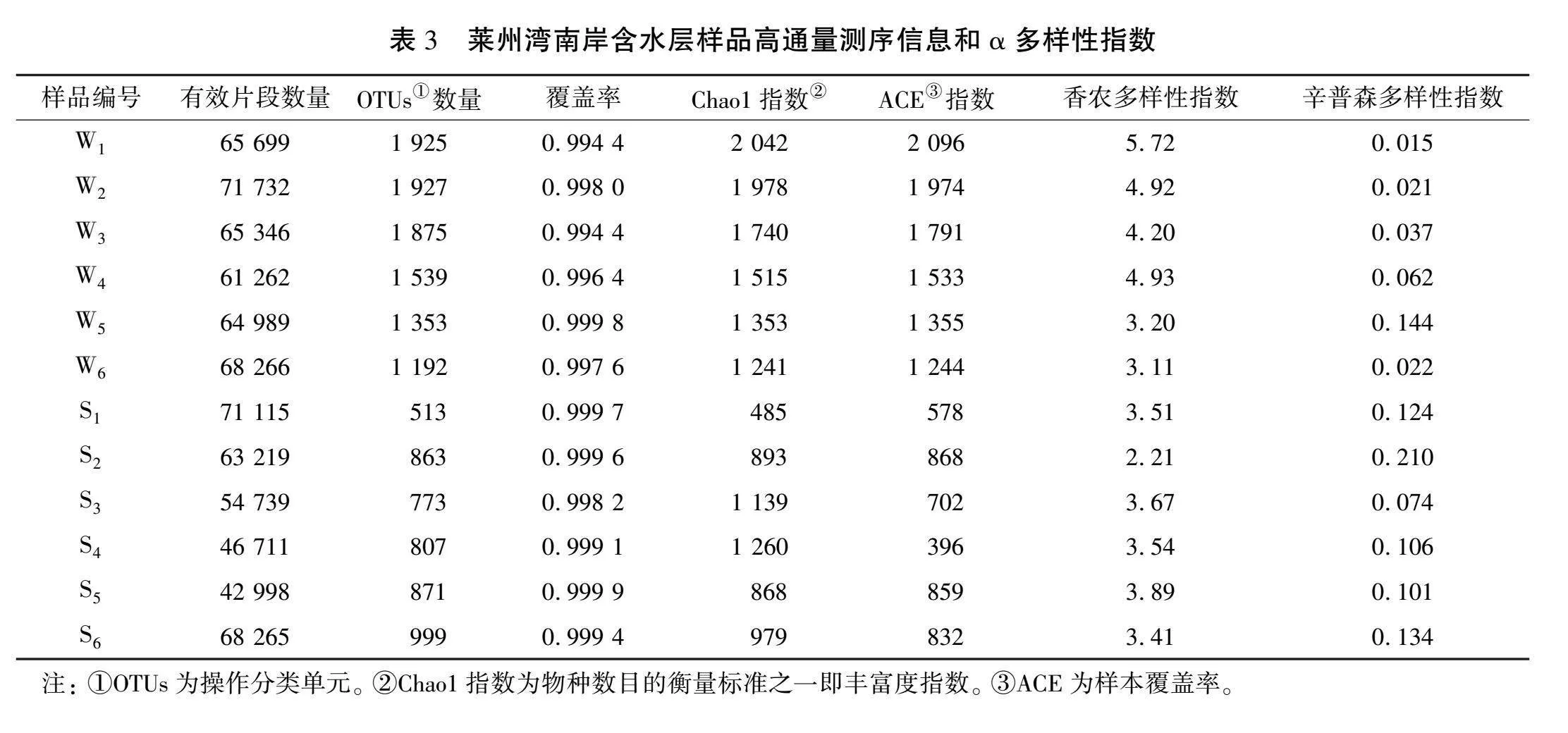
莱州湾南岸含水层样品测序信息和α多样性指数分析结果见表3。 由表可以看出, 在莱州湾南岸地下水6个样品中获得的有效基片段个数为61 262~71 732,从沉积物样品中获取的片段个数为42 998~71 115,其中样品W4、 S5中最少, 样品W2、 S1中最多。在相似性水平为97%的条件下,地下水中分类操作单元(OTUs)物种个数为1 192~1 927,沉积物中OTUs物种个数为513~999,其中位于淡水层和重度海(咸)水入侵层的样品S1、 W6中数量最少, 样品W1、 S6中数量最多,地下水中OTUs数量均大于沉积物中的,说明地下水中微生物丰富度比沉积物中的高。对OTUs数据均一化处理后用于多样性指数分析,各个样品中丰富度Chao1指数和样本覆盖率(ACE)指数与OTUs数值相近。地下水样品中的香农(Shannon)多样性指数为3.11~5.72,沉积物样品中的为2.21~3.89。地下水样品中的辛普森(Simpson)多样性指数为0.015~0.144,沉积物样品中的为0.074~0.210,表明地下水中的微生物多样性比沉积物中的高。从表3中各参数变化规律可知,随着海(咸)水入侵的加剧,地下水中物种丰富度和多样性降低,沉积物中物种丰富度和多样性波动变化,并有升高的趋势。全部样品覆盖率达到95%以上,说明本文中的高通量测序数据可以全面反映莱州湾南岸含水层中地下水与沉积物之中的微生物的种类特征。
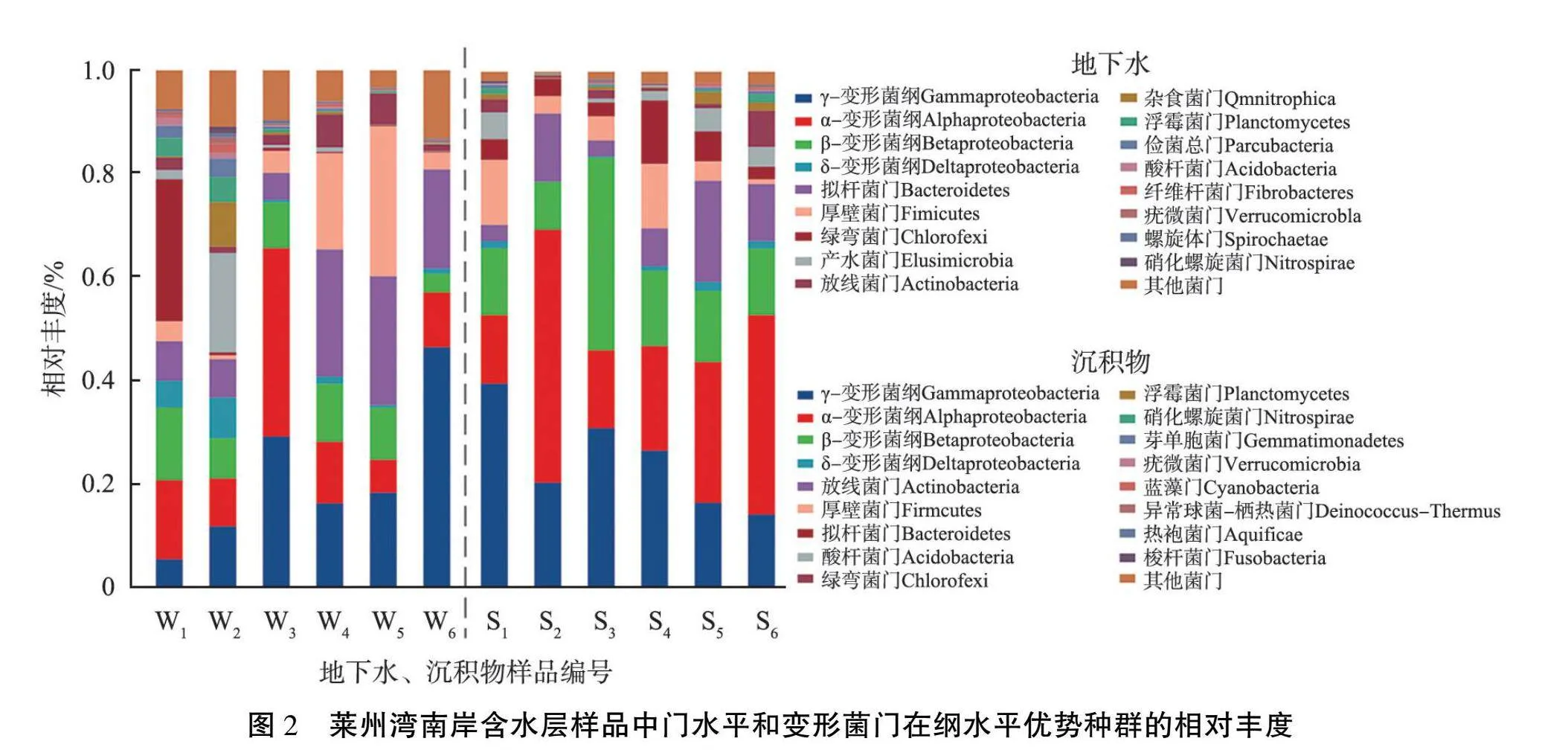
莱州湾南岸含水层样品中门水平和变形菌门在纲水平优势种群相对丰度如图2所示。根据图中微生物门水平的分析发现:莱州湾南岸地下水微生物以变形菌门Proteobacteria、 拟杆菌门Bacteroidetes为主, 相对丰度大于47%, 沉积物中以变形菌门、 放线菌门Actinobacteria为主,相对丰度大于70%; 地下水中变形菌门的相对丰度除了在样品W3、 W5中较高外, 其他样品的相对丰度都低于沉积物中的。 整体样品中变形菌门的相对丰度均高于拟杆菌门和放线菌门的, 相对丰度位居前3名的菌门与Chen等[5]在莱州湾东岸地下水中发现的含量主导的菌门一致。 厚壁菌门Firmicutes在水、 土环境中的相对丰度也较高, 分别为0.7%~29.1%、 0.9%~12.6%。此外, 有的微生物只在地下水中发现, 如俭菌总门Parcubacteria、 螺旋体门Spirochaetae,异常球菌-栖热菌门Deinococcus-Thermus则仅在沉积物中发现。 从变形菌门在纲水平下的微生物群落组成可知: 水体与沉积物中相对丰度排行前三的均为γ-变形菌纲Gammaproteobacteria、 α-变形菌纲Alphaproteobacteria、 β-变形菌纲Betaproteobacteria,3种菌纲在地下水中的相对丰度为31.7%~60.6%,在沉积物中的为57.3%~83.3%, 上述菌纲属于沿海生态系统中最具优势的菌纲组合[18]。随着海(咸)水入侵的加剧, 地下水盐度增加, 整体上地下水中γ-变形菌纲相对丰度增大, α-变形菌纲和β-变形菌纲的减小, 沉积物中γ-变形菌纲相对丰度减小, α-变形菌纲增大, 而β-变形菌纲是先增大后减小。 γ-变形菌纲、 α-变形菌纲在水土环境中的丰度变化趋势截然不同, 与吴鹏等[19]在珠江口沉积物微生物研究中得到的结果类似, 在水体盐度增大的情况下, γ-变形菌在沉积物和水体中的相对丰度变化规律相反。
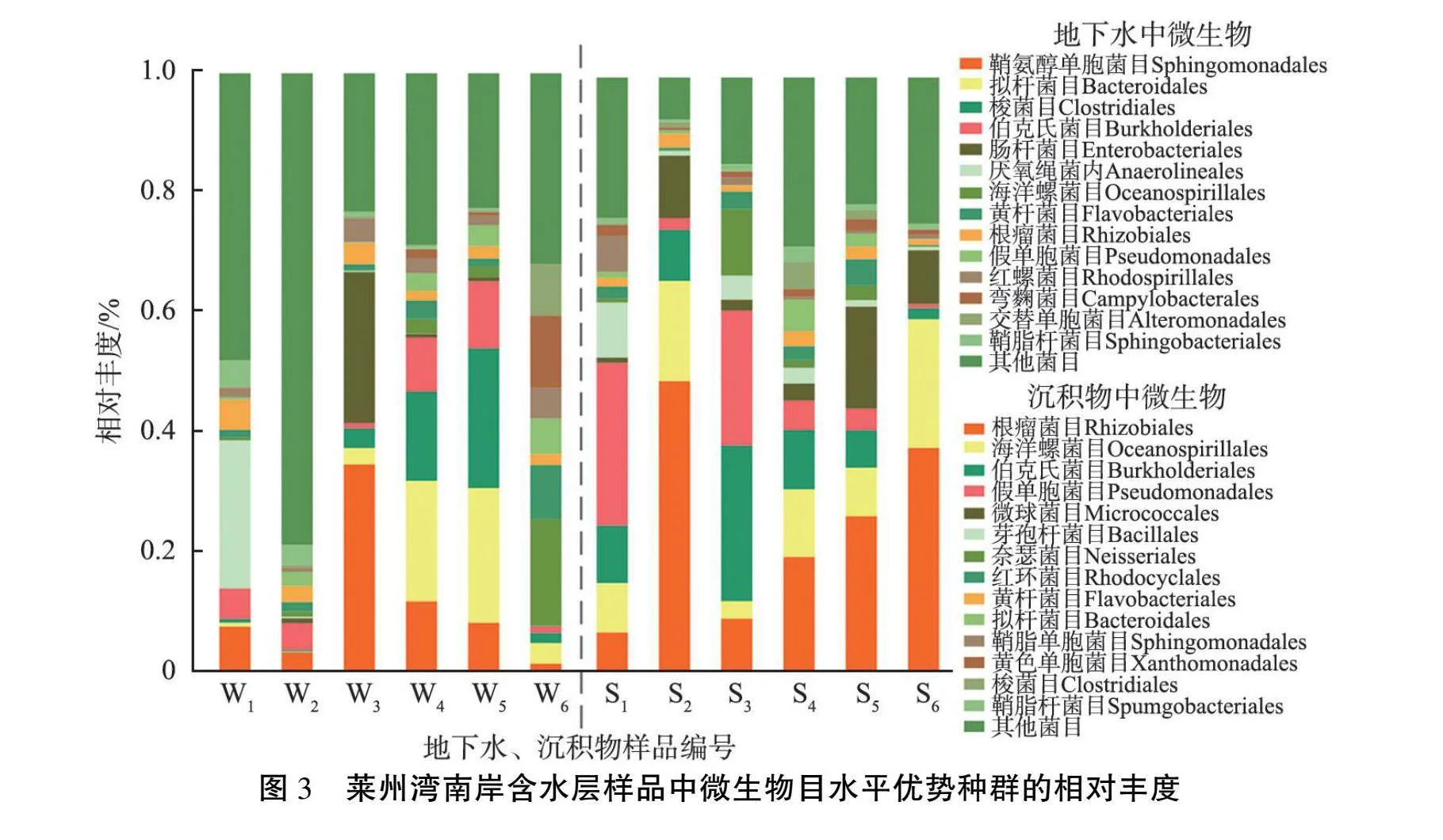
莱州湾南岸含水层样品中微生物目水平优势种群相对丰度如图3所示。 由图可见: 地下水中相对丰度较高的是鞘脂单胞菌目Sphingomonadales、 拟杆菌目Bacteroidales, 沉积物中相对丰度较高的是根瘤菌目Rhizobiales、 海洋螺菌目Oceanospirillales、伯克氏菌目Burkholderiales。 鞘脂单胞菌目能够降解多环芳烃, 具有增强植物的抗旱、抗盐碱、抗重金属的能力[20]。 海洋螺菌目主要栖息于含盐量高的环境中并能分解水中有机物获取能量[21], 在样品W6、 S6所在的重度海(咸)水入侵层中相对丰度为17.9%和21.8%, 在其余样品中的相对丰度最低为0.4%, 最高为16.9%, 在淡水含水层数量极少。 交替单胞菌目Alteromonadales在地下水样品中的下级交替单胞菌科Alteromonadaceae来自于海洋, 只有在Na+含量一定的环境中才能生存[22]。 将海洋螺菌目、 交替单胞菌科的丰度与水中Cl-含量进行皮尔逊(Person)相关性分析, 结果发现, 两者都和Cl-含量显著正相关(p值小于0.05),表明它们属于海(咸)水入侵的指示微生物,与Chen等[5]在龙口市地下水研究中得到的结论一致。此外,根瘤菌目和伯克氏菌目在土壤中常见, 能够参与生物固氮、 解磷过程,促进植物对氮、 磷元素的吸收[23]。
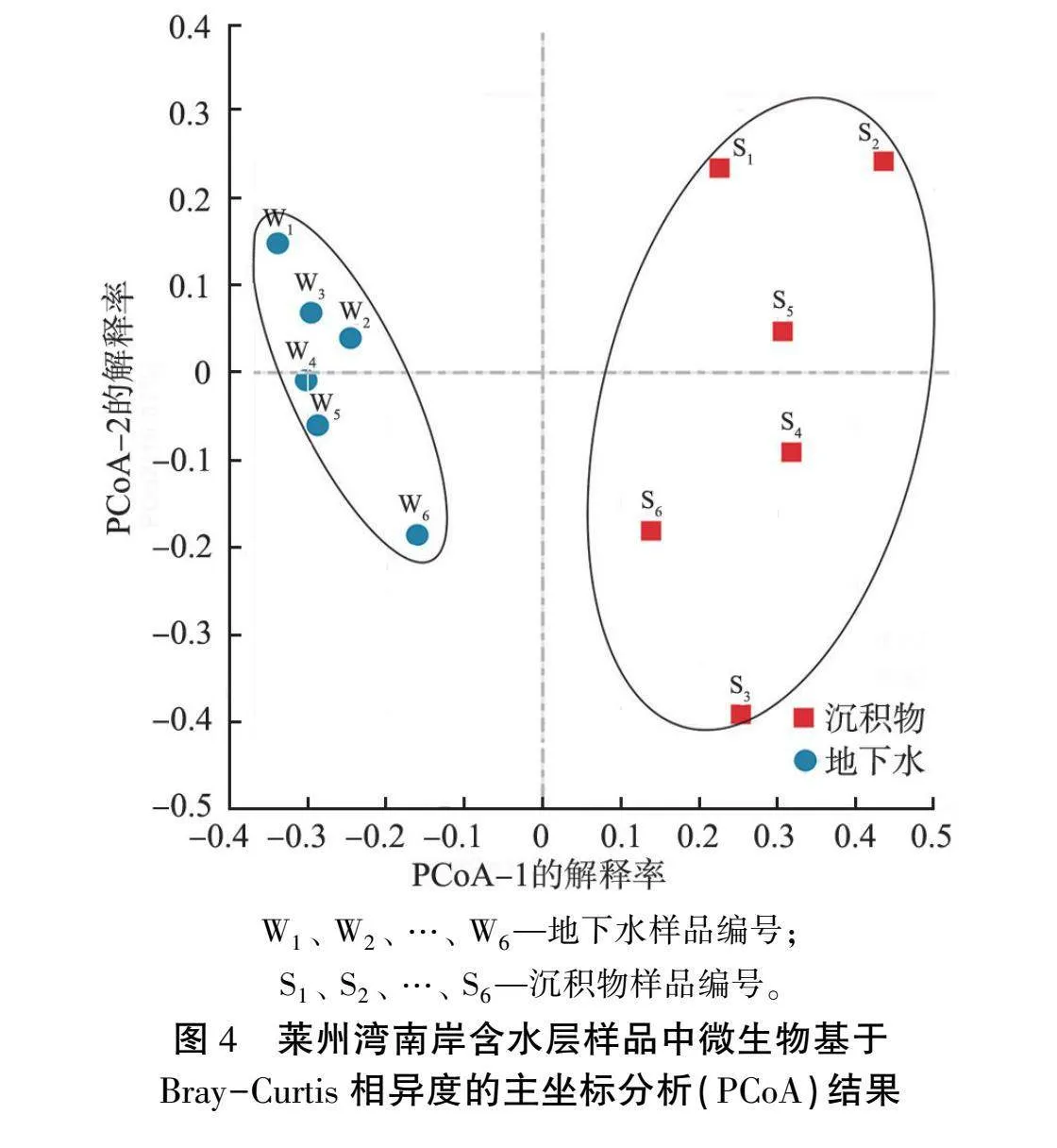
莱州湾南岸含水层样品中微生物Bray-Curtis相异度主坐标分析结果如图4所示,其中PCoA-1解释率为42.14%,PCoA-2解释率为16.07%。从图中可以发现, 莱州湾南岸地下水、 沉积物中微生物群落分布组成差异较大,其中地下水样品与沉积物样品分别聚集于PCoA-1正、 负半轴两侧, 与样品W2、 W3和样品W4、 W5距离较近, 与样品W1、 W6距离较远, 表明微生物群落差异与海(咸)水入侵程度有关。 沉积物样品间距离较远,表明海(咸)水入侵导致沉积物样品中微生物群落分布差异远大于地下水样品中的。 另外, 样品W6、 S6间距离较近, 说明在高盐含水层环境下微生物的群落组成趋于相似。
莱州湾南岸含水层样品中微生物属水平的相对丰度如图5所示。 由图可以看出, 地下水中的优势菌属有噬氢菌属Hydrogenophaga、新鞘氨醇杆菌属Novosphingobium、 拟杆菌属Bacteroides、 硫单胞菌Sulfurimonas, 沉积物中相对丰度较高的菌属种类有阿利霍夫莱亚菌属Aliihoeflea、 盐单胞菌属Halomonas、 不动杆菌Acinetobacter、 涅斯特连科氏菌属Nesterenkonia。 微生物在属水平的分布也可以从侧面反映环境的状况, 如: 噬氢菌属、 假单胞菌属Pseudomonas是自然界中的参与反硝化的细菌,可分解水中硝酸盐为氮气等不溶性气体[24-25]; 硫单胞菌Sulfurimonas是分布于深海热液区的化能自养硫氧化菌, 可氧化氢气和多种还原性硫化物,也能耦合硝酸盐还原进行厌氧氧化[26]; 从潮滩中分离出的阿利霍夫莱亚菌属具有氧化亚砷酸盐的能力, 可去除地下水中砷污染[27]; 盐单胞菌属、 涅斯特连科氏菌属Nesterenkonia、 海水噬冷菌属Algoriphagus都属于嗜盐细菌, 常分布于海洋、 盐湖等盐度较高的环境里[28-29], 在中度和重度海(咸)水入侵层中丰度最高, 说明海(咸)水入侵已明显改变了原有含水层原有微生物的分布, 并且将一些原在海洋中栖息的菌群迁移到大陆地下水中。 涅斯特连科氏菌属在莱州湾南岸6个含水层样品中均有分布, 并与Cl-、 TDS、 电导率显著正相关(p值小于0.05), 说明该菌属受到海水入侵的影响十分显著,可以作为海(咸)水入侵微生物指标之一,也进一步说明,在海(咸)水持续入侵下,含水层环境改变也促使微生物群落发生适应性变化。
2.3 环境因素对含水层微生物群落影响
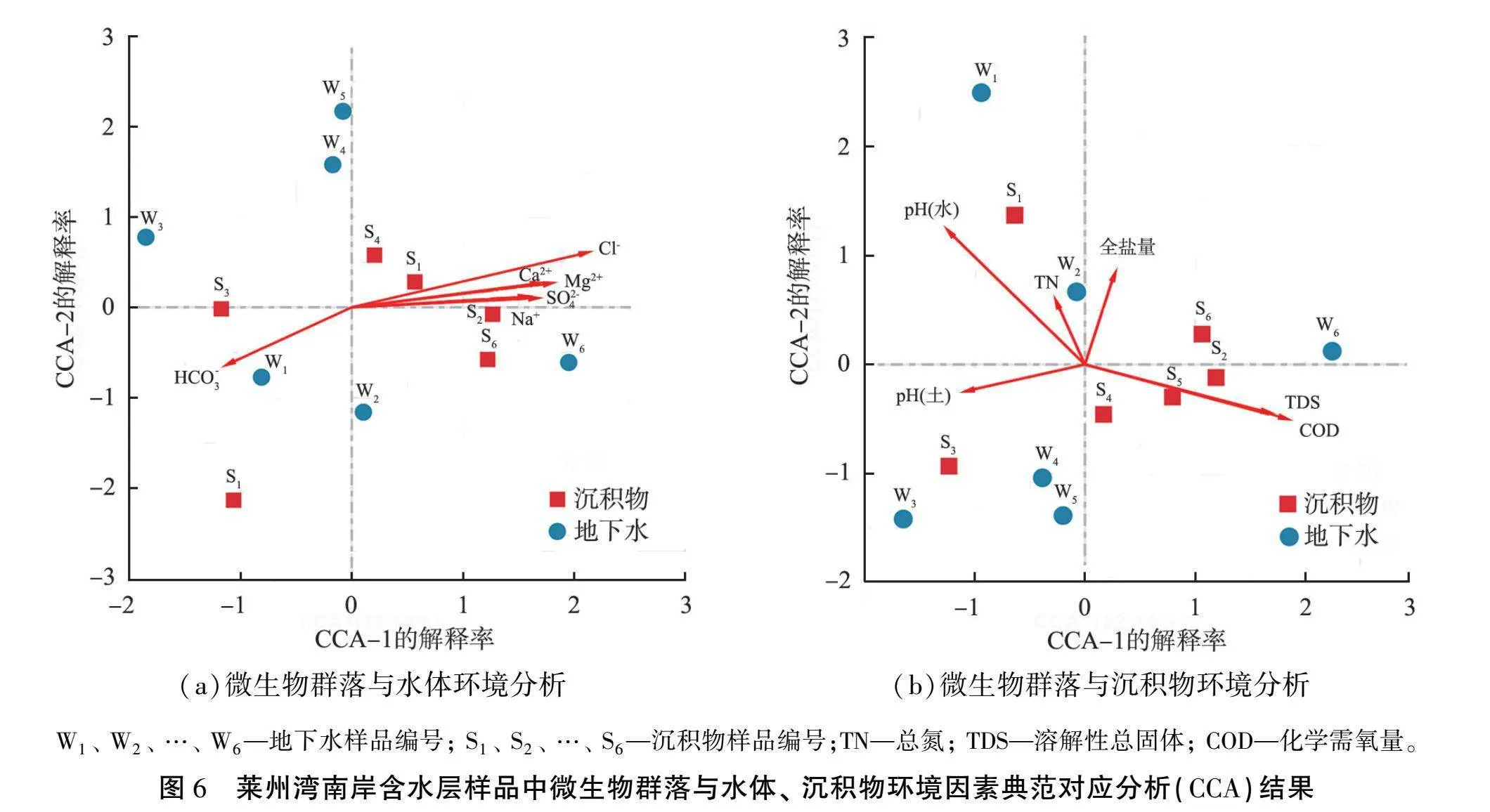
采用CCA方法对莱州湾南岸含水层样品中微生物群落组成和环境因素进行典范对应分析,结果如图6所示。 由图可见: 海(咸)水入侵相关的离子中的Cl-和HCO-3影响最大, 其中Cl-对沉积物样品S2、 S4、 S5、 S6和地下水样品W4、 W5、 W6的微生物组成影响明显(p值小于0.05)。 Cl-能使环境渗透压力增大, 对微生物有毒害作用[30], 是影响海(咸)水入侵区域地下水微生物的重要指标之一[8-10,12]。 HCO-3是淡水含水层中的代表性阴离子, 对海(咸)水入侵程度较低的样品W1、 W2、 W3、 S1、 S3中微生物组成影响显著(p值小于0.05)。图6(b)地下水中的TDS、 COD、 全盐量主要对沉积物样品S2、 S4、 S5、 S6中微生物群落影响显著(p值小于0.05), 而水体的酸碱度与土壤酸碱度之间呈正相关关系, 对微生物群落的影响更显著(p值小于0.05);能够干扰微生物细胞膜通透性与生物酶活性, 也是影响海(咸)水入侵区域微生物的重要指标[11,14]。 TN对微生物群落的影响较弱(p值大于0.05)。
3 结论
本文中以莱州湾南岸含水层为研究对象,通过钻探取样、 水化学分析、 高通量测序等手段,分析不同深度含水层水化学特征、 海(咸)水入侵程度及微生物群落组成,揭示含水层微生物对海(咸)水入侵的响应特征及规律,得到以下主要结论:
1)莱州湾南岸海(咸)水入侵区域微生物样品中有效基因片段数量为6 126~71 115,地下水与沉积物OTUs物种数量分别为1 192~1 927和513~999,在α多样性分析中,地下水中微生物丰富度和多样性均高于沉积物中的。随着海(咸)水入侵的加剧,地下水中微生物的丰富度和多样性降低,沉积物中微生物的丰富度和多样性则呈现波动变化并有升高的趋势。
2)地下水中微生物以变形菌门、 拟杆菌门为主,相对丰度大于47%,沉积物中微生物以变形菌门、 放线菌门为主,相对丰度大于70%。在变形菌门中,随着海(咸)水入侵加重,地下水中γ-变形菌纲的相对丰度增大, α-变形菌纲的相对丰度减小, 而沉积物中的微生物则呈现相反的变化规律。 地下水中优势菌属是噬氢菌属、 新鞘氨醇杆菌属、 拟杆菌属、 硫单胞菌, 沉积物中优势菌属为阿利霍夫莱亚菌属、 盐单胞菌属、 不动杆菌、 涅斯特连科氏菌属。 从整体微生物群落结构分析, 相同含水层环境中水体和沉积物中的微生物群落结构组成差异性较大。
3)涅斯特连科氏菌属与海(咸)水入侵指标Cl-显著正相关(p值小于0.05),可作为识别该区域海(咸)水入侵的指示微生物。
4)PCoA结果显示,微生物群落分布在沉积物样品与地下水样品中差异明显,随着海(咸)水入侵程度增加,两者中的微生物群落结构趋向相似发展;微生物群落分布与环境因素典范对应分析结果显示,Cl-、 HCO-3分别对中、 重度,轻度海(咸)水入侵含水层中微生物组成影响显著(p值小于0.05),TDS、 COD、 全盐量对沉积物样品中的微生物组成影响显著(p值小于0.05),地下水中酸碱度对微生物组成影响显著(p值小于0.05)。
本文中主要探究了环境因素对微生物群落组成的影响,难以深入了解微生物参与具体物质循环过程,下一步可以开展莱州湾南岸含水层中微生物代谢通路与功能基因研究,以便更好地阐述海(咸)水入侵对微生物群落组成的影响。
参考文献:
[1] 王天宝, 戴维, 白莹. 莱州湾东岸海水入侵现状及发展趋势分析[J]. 西部资源, 2020(5): 115.
[2] 王秋贤, 任志远, 孙根牛. 莱州湾东南沿岸地区海水入侵灾害研究[J]. 海洋环境科学, 2002, 21(3): 10.
[3] 李雪, 叶思源. 海水入侵调查方法研究进展[J]. 海洋地质与第四纪地质, 2016, 36(6): 211.
[4] 胡云壮, 李红, 李影, 等. 山东莱州湾南岸典型剖面海(咸)水入侵过程的水文地球化学识别[J]. 地质调查与研究, 2015, 38(1): 41.
[5] CHEN L, HU B X, DAI H, et al. Characterizing microbial diversity and community composition of groundwater in a salt-freshwater transition zone[J]. Science of the Total Environment, 2019, 678: 574.
[6] SANG S L, DAI H, HU B X, et al. Distribution characteristics and factors influencing microbial communities in the core soils of a seawater intrusion area in Longkou City, China[J]. Hydrogeology Journal, 2022, 30(6): 1833.
[7] NELSON T M, STRETEN C, GIBB K S, et al. Salt-water intrusionhistoryshapestheresponseofbacterial communities upon rehydration[J]. Science of the Total Environment, 2015, 502: 143.
[8] MA Z L, GAO L, SUN M X, et al. Microbial diversity in groundwateranditsresponsetoseawaterintrusioninBeihai City, Southern China[J]. Frontiers in Microbiology, 2022, 13: 876665.
[9] ADYASARI D, HASSENRECK C, OEHLER T, et al. Microbial communitystructureassociatedwithsubmarinegroundwaterdischargeinnorthernJava(Indonesia)[J].ScienceoftheTotal Environment, 2019, 689: 590.
[10] UNNO T, KIM J, KIM Y, et al. Influence of seawater intrusion onmicrobialcommunitiesingroundwater[J].Science of the Total Environment, 2015, 532: 337.
[11] LEE E, SHIN D, HYUN S P, et al. Periodic change in coastal microbial community structure associated with submarine groundwater discharge and tidal fluctuation[J].LimnologyandOcean-ography, 2017, 62(2): 437.
[12] 王庆兵, 陈麟, 支传顺, 等. 不同海岸带地下水微生物群落结构与多样性差异研究[J]. 中国地质, 2024, 51(3): 1008.
[13] 生态环境部生态环境监测司, 生态环境部法规与标准司. 地下水环境监测技术规范: HJ 164—2020[S]. 北京: 中国环境出版集团有限公司, 2020.
[14] WASIMUDDIN, SCHLAEPPI K, RONCHI F, et al. Evaluation ofprimerpairsformicrobiomeprofilingfrom soils to humans within the One Health framework[J]. Molecular Ecology Resources, 2020, 20(6): 1558.
[15] FREEZE R A, CHEERY J A. Groundwater[M]. Hoboken: Prentice Hall, 1979: 124.
[16] BALLESTEROSBJ,MORELLI,GARCA-MENNDEZO,etal. A standardized index for assessing seawater intrusion in coastal aquifers:theSITEindex[J].WaterResourcesManagement, 2016, 30(13): 4513.
[17] 李志威, 张晓影, 张明珠, 等. 海水入侵指标对比分析与评价: 以珠江口地下水含水层为例[J]. 海洋环境科学, 2020, 39(1): 16.
[18] XU Z X, WU J, LI H Z, et al. Characterizing heavy metals in combined sewer overflows and its influence on microbial diversity[J]. Science of the Total Environment,2018, 625: 1272.
[19] 吴鹏, 刘永, 李纯厚, 等. 珠江口沉积物中重金属和石油污染对微生物群落结构的影响[J]. 海洋湖沼通报, 2022, 44(1): 106.
[20] FENG D Z ,WEN X C ,ZHE Z, et al. Sphingomonas hominis sp. nov., isolated from hair of a 21-year-old girl[J]. Antonie van Leeuwenhoek, 2020, 113(10): 1523.
[21] BELILA A, El-CHAKHTOURA J, OTAIBI N, et al.Bacterial community structure and variation in a full-scale seawater desalination plant for drinking water production[J]. Water Research, 2016, 94: 62.
[22] MATA A J, BJAR V, BRESSOLLIER P, et al. Characterization ofexopolysaccharidesproducedbythreemoderatelyhalophilic bacteria belonging to the family Alteromonadaceae[J]. Journal of Applied Microbiology, 2008, 105(2): 521.
[23] 张珂飞, 钟永嘉, 孙丽莉, 等. 植物有益伯克霍尔德氏菌的研究进展及其在农业中的应用[J]. 微生物学报, 202 61(8): 2205.
[24] AHNJ,KIMW,PARKJ,etal.Temporalchangesofgeochemistry andmicrobialcommunityinlowandintermediatelevelwaste (LILW) repository, South Korea[J]. Annals of Nuclear Energy, 2019, 128: 309.
[25] FAN X, NIE L, CHEN ZJ,etal.Simultaneousremovalofnitrogen and arsenite by heterotrophic nitrification and aerobic denitrification bacterium Hydrogenophaga sp. H7[J]. Frontiers in Microbiology, 2023, 131103913.
[26] WANGSS,JIANGLJ,HUQT, et al.Characterization of Sulfurimonashydrogeniphila sp.nov.,anovel bacterium predominant in deep-seahydrothermalventsandcomparativegenomic analysesofthegenusSulfurimonas[J].FrontiersinMicrobiology,202 12: 626705.
[27] LUCIAC,ANNAC,VINCENZAA,etal.Draftgenomesequenceofthearsenite-oxidizingstrainAliihoeflea sp. 2WW, isolatedfromarsenic-contaminatedgroundwater[J].GenomeAnnouncements, 2013, 1(6): e01072-13.
[28] 任培根, 周培瑾. 中度嗜盐菌的研究进展[J]. 微生物学报, 2003, 43(3): 427.
[29] XIE CL,XIAJM,WANGJS,etal.MetabolomicinvestigationsonNesterenkoniaflavarevealedsignificantdifferencesbetween marine and terrestrial actinomycetes[J]. Marine drugs, 2018, 16(10): 356.
[30] PARKS,KIMS,JUNGYT,etal.Algoriphagusconfluentis sp.nov.,isolatedfromthejunctionbetweenthe ocean and a freshwaterlake[J].InternationalJournalofSystematicandEvolutionaryMicrobiology, 2016, 66(1): 118.
(责任编辑:刘 飚)
