柔嫩艾美耳球虫表面抗原SAG12对鸡的免疫保护效果评价
2025-01-16王磊游怡宁吴天乐孙雪王冰楠毕师诚周荣琼


摘要:
为评估柔嫩艾美耳球虫(Eimeria tenella, E. tenella)表面抗原(Surface antigen, SAG)SAG12对鸡的免疫保护效果, 首先构建EtSAT12/pET-32a原核表达载体, 对EtSAG12重组蛋白进行纯化并制备多克隆抗体; 然后进行动物试验, 将100只1日龄海兰灰雏公鸡分成5个组, 分别是感染对照组(PC)、 空白对照组(NC)、 EtSAG12重组蛋白50 μg、 100 μg和150 μg组。 通过统计相对增质量率、 卵囊减少率、 抗球虫指数(ACI)和血清中特异性IgG抗体等指标评价EtSAG12重组蛋白的免疫保护效果。 结果显示: 成功表达出EtSAG12重组蛋白, 大小约为43 Ku, 主要以可溶性形式表达; Western Blot结果显示所制备的多克隆抗体有较强的特异性。 免疫保护试验结果显示: 与PC组相比, 3个重组蛋白组的平均增质量显著增加(p<0.05)、 病变计分显著降低(p<0.05), 且均能有效降低卵囊产量, 其中重组蛋白150 μg组相对增质量率(97.34%)和卵囊减少率(52.54%)均为最高, ACI值达到165.34, 具有中效抗球虫效果; 3个重组蛋白组血清中特异性IgG抗体水平与PC组和NC组相比, 在p<0.05水平差异均有统计学意义, 且二免7 d后血清中特异性IgG抗体水平达到最高, 其中重组蛋白150 μg组特异性IgG抗体水平最高, 且显著高于另外两个重组蛋白组(p<0.05)。 综上所述, EtSAG12重组蛋白能减轻因球虫感染导致的增质量损失和肠道病变, 减少卵囊排出, 刺激宿主产生体液免疫, 具有一定的免疫保护作用。
关" 键" 词:
柔嫩艾美耳球虫; EtSAG12重组蛋白; 原核表达; 免疫保护效果; 表面抗原
中图分类号:
S852.4
文献标志码:A
文章编号:16739868(2025)02001709
DOI: 10.13718/j.cnki.xdzk.2025.02.002
王磊, 游怡宁, 吴天乐, 等. 柔嫩艾美耳球虫表面抗原SAG12对鸡的免疫保护效果评价 [J]. 西南大学学报(自然科学版), 2025, 47(2): 17-25.
收稿日期:20240613
基金项目:
国家自然科学基金项目(32473075)。
作者简介:
王磊, 硕士研究生, 主要从事寄生虫分子生物学的研究。
通信作者: 周荣琼, 教授。
Evaluation of the Immunoprotective Effect of
Surface Antigen SAG12 of Eimeria tenella on Chickens
WANG Lei," YOU Yining," WU Tianle," SUN Xue,
WANG Bingnan," BI Shicheng," ZHOU Rongqiong
School of Veterinary Medicine, Southwest University, Rongchang Chongqing 402460, China
Abstract:
To evaluate the immunoprotective effect of the surface antigen (SAG) SAG12 of Eimeria tenella (E. tenella) on chickens. The prokaryotic expression vector EtSAT12/pET-32a was constructed. The EtSAG12 recombinant protein was purified and polyclonal antibody was prepared. In the animal experiment, 100 one-day-old Hy-Line Sonia male chicks were divided into five groups: infection control group (PC), blank control group (NC), and EtSAG12 recombinant protein 50 μg, 100 μg, and 150 μg groups. The immunoprotective effect was assessed by measuring relative weight gain, oocyst reduction rate, lesion score, anti-coccidial index (ACI) and the levels of IgG in serum. The results showed that the EtSAGR12 recombinant protein was about 43 Ku in size and mainly expressed in soluble form. Western Blot showed that the antibody had good specificity. Compared to the PC group, the three immunized groups showed significantly higher weight gain (p<0.05), lower lesion scores (p<0.05), and reduced oocyst output. In the group immunized with 150 μg, the relative weight gain (97.34%) and the oocyst reduction rate (52.54%) were the highest, with an ACI of 165.34, indicating moderate anticoccidial effects. The levels of IgG in serum antibody levels were significantly higher in the immunized groups than in the PC and NC groups (p<0.05), and reached peak at 7 days after the second immunization, with the 150 μg group showing the highest levels (p<0.05). In summary, The EtSAG12 recombinant protein can reduce weight loss and oocyst shedding, stimulate humoral immunity in the host, and have a certain degree of immunoprotective effect against coccidial infection.
Key words:
Eimeria tenella; EtSAG12 recombinant protein; prokaryotic expression; immunoprotective effect; surface antigen
鸡球虫病(Coccidiosis)是由艾美耳科(Eimeriidae)艾美耳属(Eimeria)的一种或多种球虫寄生于鸡肠道中而引起的一种原虫病, 该病呈全球分布, 发病率为50%~70%, 死亡率最高可达到80%[1-2]。 目前报道的鸡球虫有7种, 其中柔嫩艾美耳球虫(E. tenella)是致病力最强的虫种, 由此虫种导致的原虫病使鸡盲肠显著出血肿胀, 肠内出现黄白色干酪样坏死物, 引起鸡贫血、 消瘦、 生长发育不良和产蛋性能下降等症状[3]。 据统计, 该病每年会对全球家禽养殖业造成约30亿美元的损失[4]。 目前对于球虫病的防治主要依赖于药物和弱毒苗。 然而过度使用药物, 会导致虫株产生耐药性, 并出现药物残留、 环境污染等问题。 尽管弱毒苗有良好的抗球虫效果, 但同时也存在毒力恢复的风险[5]。 重组亚单位疫苗是通过抗原蛋白与佐剂混合形成的具有免疫效果的疫苗, 与弱毒苗相比不仅安全稳定, 而且具有生产时间短和经济效益好的优点, 因此筛选出有良好免疫保护性的抗原是制备出优秀亚单位疫苗的关键[6]。
表面抗原SAG(Surface antigen)是顶复门原虫中一类富含半胱氨酸的蛋白质, 该蛋白均在N段末端有一疏水的信号肽, 且在C段末端含有糖基化磷脂酰肌醇(Glycosylphosphatidylinositol, GPI)的结构区域[7]。 SAG利用自身的GPI结构锚定在宿主细胞膜表面, 主要在虫体的入侵和存活、 免疫调节、 诱导炎症反应等过程中发挥重要作用。 弓形虫(Toxoplasma gondii)SAG1与宿主细胞表面硫化肝素发生特异性结合, 促进虫体入侵[8]; 恶性疟原虫(Plasmodium falciparum)分泌的SAG蛋白与裂殖子发生交联, 进而有效阻断裂殖子黏附和入侵红细胞, 从而保证虫体存活[9]; 犬新孢子虫(Neospora caninum)SAG1可以促进细胞因子IFN-γ和IL-4上调, 激发机体的Th1和Th2型免疫反应[10]; E. tenella SAG4和SAG5可促进巨噬细胞产生白介素-1β并分泌NO, 诱导宿主发生炎症反应[11]。
目前关于EtSAG12的免疫原性和免疫保护作用尚无报道, 本研究构建EtSAT12/pET-32a原核表达载体, 制备多克隆抗体, 通过动物试验评价EtSAG12重组蛋白的免疫保护效果, 为E. tenella重组亚单位疫苗的研制提供参考。
1" 材料与方法
1.1" 虫株与实验动物
试验虫株为西南大学动物医学院寄生虫实验室保存的E. tenella上海株, 试验前经感染无球虫鸡传代增殖得到大量柔嫩艾美耳球虫孢子化卵囊。 新西兰大白兔购自西南医科大学实验动物中心。 1日龄海兰灰雏公鸡购自重庆华裕畜禽有限公司。
1.2" 材料
HRP标记的山羊抗兔IgG购自Sangon Biotech公司, Ni-NTA纯化树脂预装柱、 EasyPure胶回收试剂盒、 质粒提取试剂盒购自北京TransGen Biotech(全式金)公司; BCA蛋白浓度测定试剂盒和TMB显色液均购自北京索莱宝科技有限公司; 弗氏完全佐剂和弗氏不完全佐剂购自碧云天生物技术(上海)有限公司。
1.3" 裂殖子的提取
取10只1日龄海兰灰雏公鸡饲养于经甲醛蒸熏消毒无鸡球虫的房间内, 并且饲养所用鸡笼、 水盘和饲料盘等用具都经过高温消毒处理, 试验期间全程使用未添加抗球虫药物的饲料。 待雏鸡长至14日龄后, 每只雏鸡经口感染E. tenella孢子化卵囊按5×104个, 并在感染后120 h剖杀试验鸡只收集盲肠。 按照文献[12]的方法提取E.tenella裂殖子, 最后将提取的裂殖子放入液氮保存。
1.4" 引物的设计与合成
根据柔嫩艾美耳球虫EtSAG12基因组数据(GenBank: XM_013375898), 利用Primer-Premier 6.0对EtSAG12进行引物设计。 原核表达引物(F2: 5′-CCCCGAATTCATGAGCGACGGAACGCCTG-3′, 引入酶切位点EcoRI; R2: 5′-CCCCCTCGAGTTACAGTGCTGTAATTCCGAATGCG-3′, 引入酶切位点XhoⅠ)送至重庆擎科兴业生物科技有限公司进行合成。
1.5" EtSAT12/pET-32a原核表达载体的构建
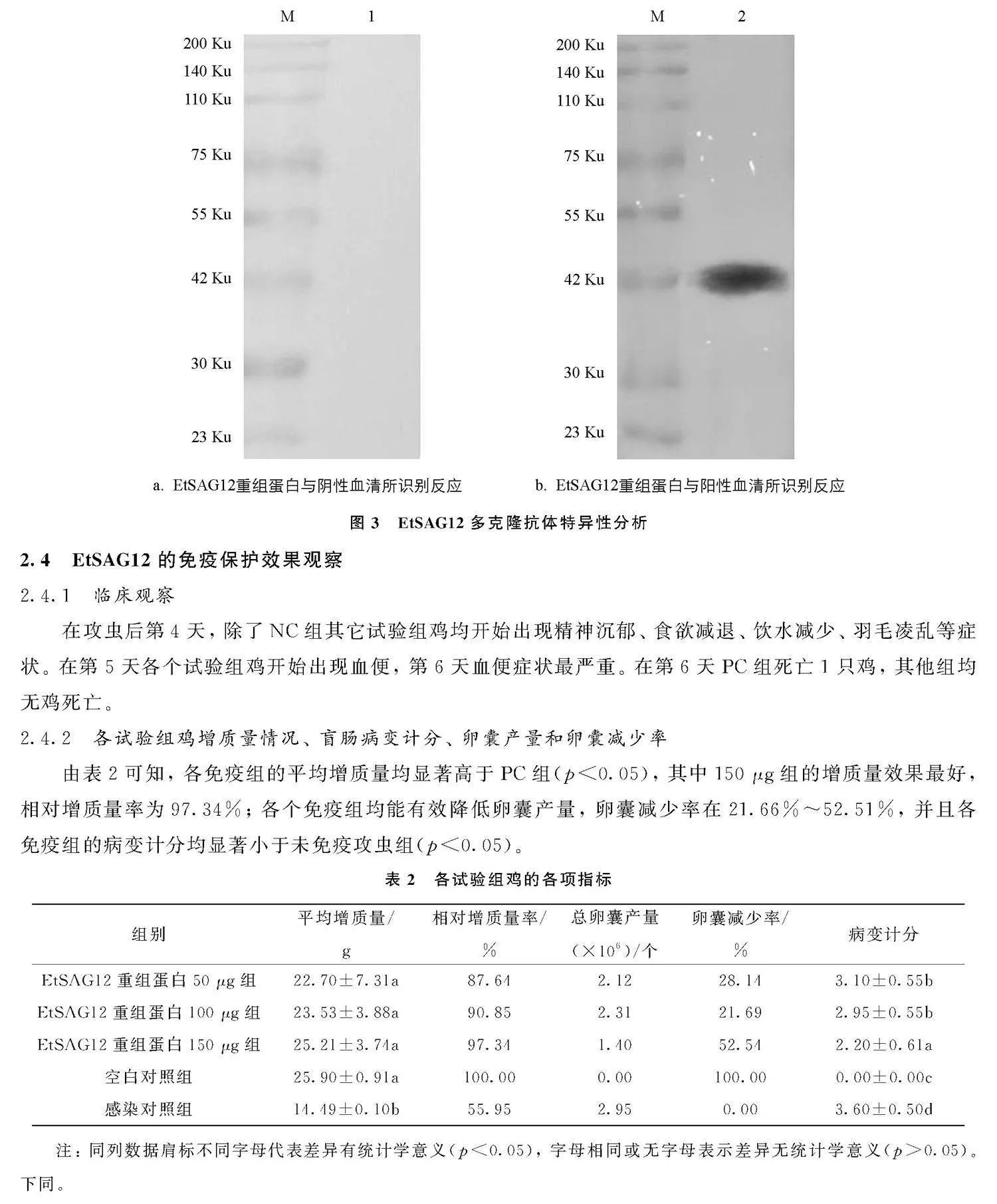
采用TRIzol法提取第二代裂殖子总RNA, 再反转录合成cDNA, 由cDNA为模板进行PCR扩增。 PCR反应条件为: 94 ℃预变性5 min、 94 ℃变性30 s、 63 ℃退火30 s、 72 ℃延伸30 s, 共30个循环, 最后72 ℃延伸10 min。 将扩增产物经1%琼脂糖凝胶电泳检测, 并用胶回收试剂盒回收PCR产物。 回收产物与pMD19-T (simple)Vector载体进行连接, 再将连接产物转化至大肠杆菌(Escherichia coli)DH5α感受态细胞中, 将菌液PCR鉴定为阳性的重组菌液送至重庆擎科兴业生物技术有限公司测序。 然后按质粒提取试剂盒说明书提取阳性重组质粒EtSAT12/pMD19-T和pET-32a质粒, 经限制性内切酶EcoRI和XhoⅠ双酶切, 将切胶回收的目的基因EtSAT12与pET-32a质粒连接, 再将重组表达质粒转化至DH5α感受态细胞; 最后提取重组质粒, 进行双酶切和测序鉴定。
1.6" EtSAG12重组蛋白的诱导表达和纯化
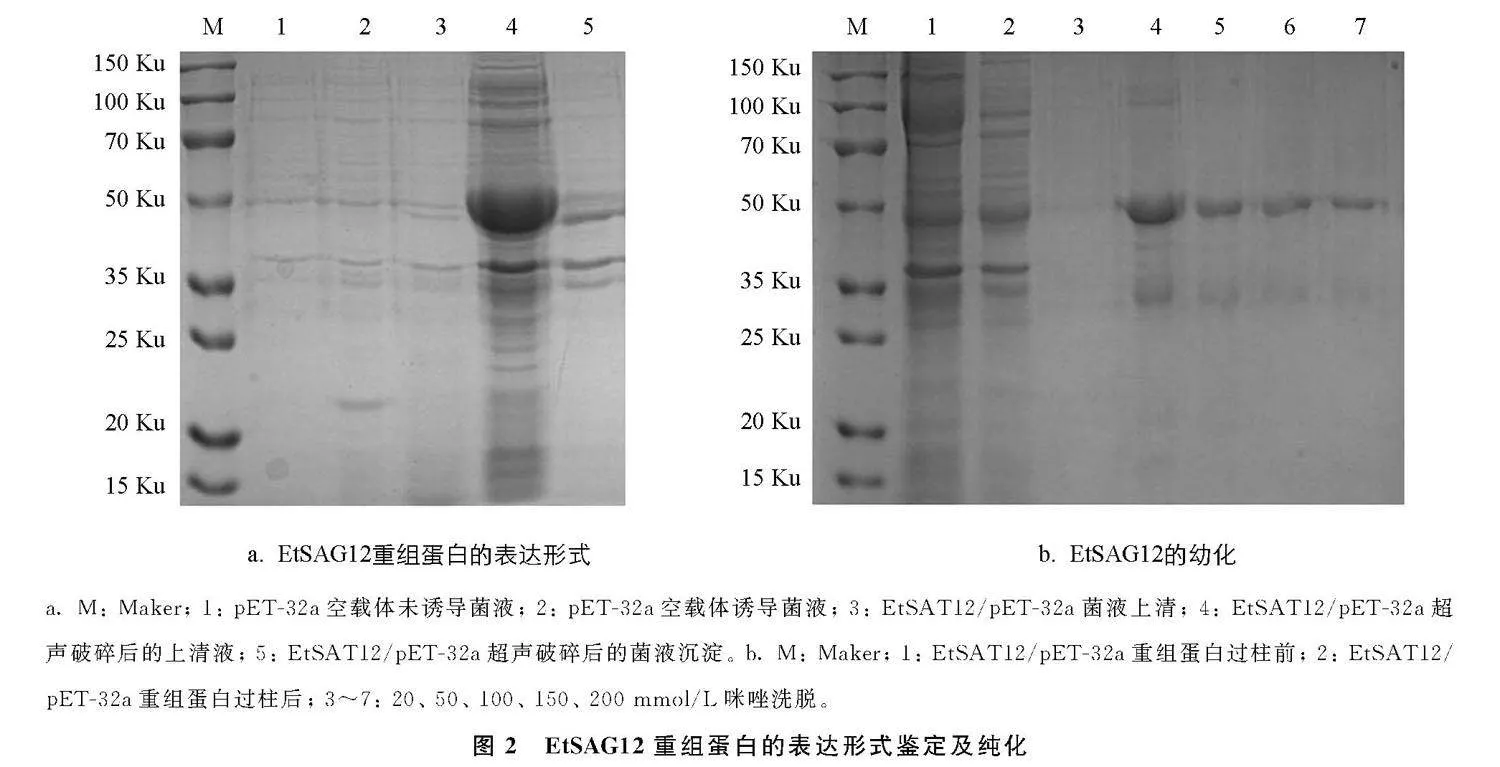
挑选阳性菌, 经PCR鉴定后提取质粒, 并将其转化至BL21(DE3)感受态细胞, 挑单菌落接种于LB/Amp+液体培养基中, 振荡培养4 h, 加入0.4 mmol/L的IPTG 37 ℃诱导8 h; 离心收集菌体, 加入缓冲液重悬菌体, 并进行超声破碎、 离心, 取破碎后上清液和破碎后沉淀进行SDS-PAGE电泳检测; 用Ni-NTA亲和层析柱纯化重组蛋白, 并选择20、 50、 100、 150、 250 mmol/L的咪唑洗脱液对目的蛋白进行洗脱, 最后用SDS-PAGE电泳检测蛋白纯化结果。
1.7" 多克隆抗体的制备
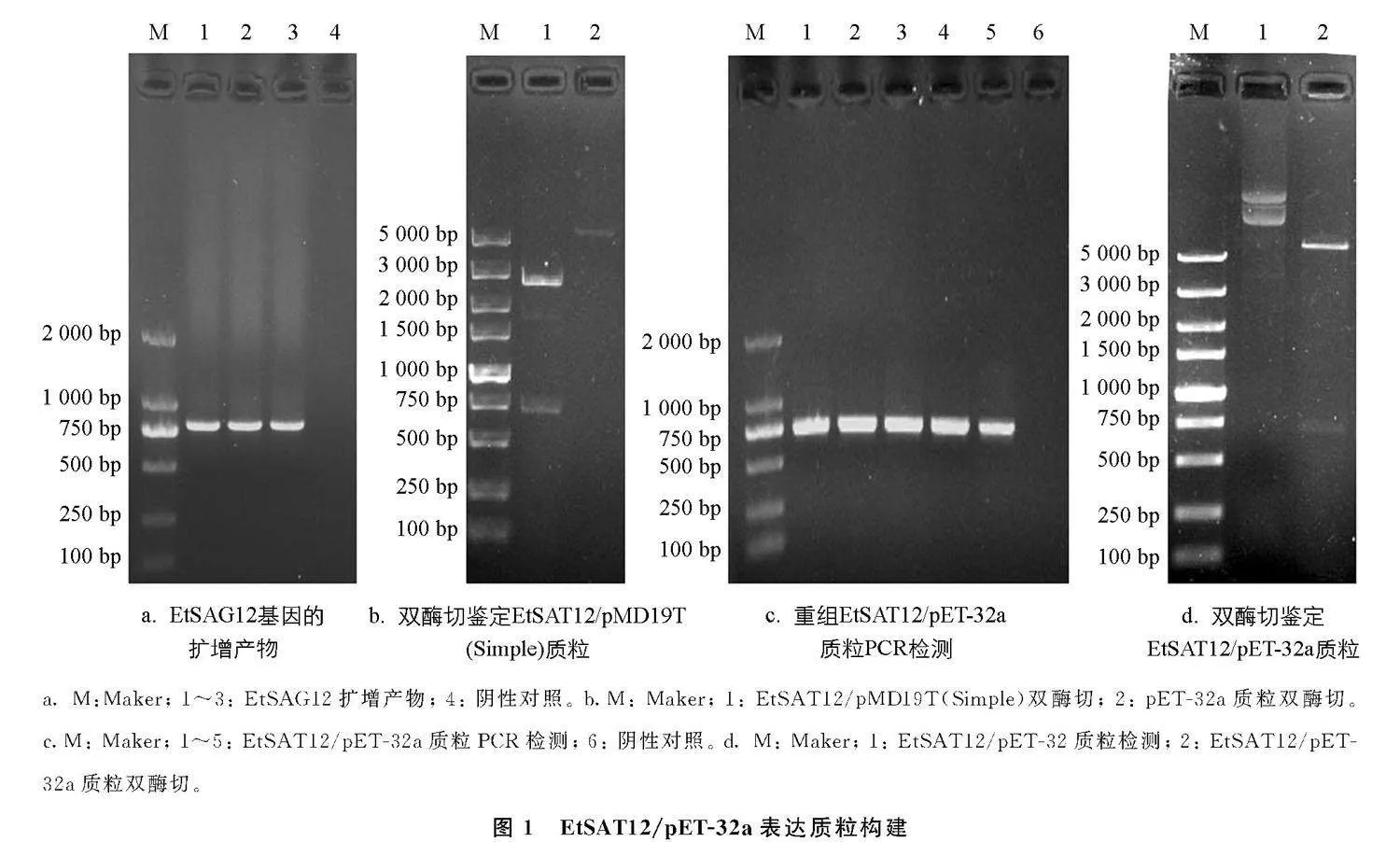
按照文献[13]的方法进行多克隆抗体的制备, 将EtSAG12重组蛋白与佐剂混合, 对新西兰大白兔进行免疫, 共计免疫4次, 并在末次免疫7 d后采血, 离心取血清。 再利用间接ELISA法检测抗体效价, 酶标仪检测OD450值, 检测孔与阴性孔的比值大于或等于2.1时的最大稀释倍数为该血清最高的抗体效价。 达到所需效价后采血制备, 纯化多克隆抗体, 进行Western Blot检测。
1.8" 免疫保护效果的评价
1.8.1" 试验设计及免疫程序
试验共分为5个组, 即感染对照组(PC)、 空白对照组(NC)、 EtSAG12重组蛋白50 μg组、 EtSAG12重组蛋白100 μg组、 EtSAG12重组蛋白150 μg组, 每组20只1日龄海兰灰雏公鸡。 各组的免疫程序见表1。 其中雏鸡饲养环境要求与1.3相同。
1.8.2" 亚单位疫苗的制备
用无菌的PBS稀释EtSAG12重组蛋白至各个免疫组所需的浓度, 再将重组蛋白与佐剂以1∶1的比例进行混合(首次免疫选用弗式完全佐剂, 第二次免疫选用弗式不完全佐剂), 混合液经超声乳化后, 用于免疫接种。
1.8.3" 免疫保护效果评价指标
参照文献[14]的方法, 以存活率、 平均增质量、 相对增质量率、 卵囊减少率、 卵囊值、 盲肠病变计分和抗球虫指数(Anti-coccidial index, ACI)作为免疫保护效果的评价指标。
1.8.4" 血清中特异性IgG抗体检测
分别在7 d、 14 d、 21 d, 各个试验组随机选取4只鸡心脏采血1ml并分离血清。 参考文献[15], 运用ELISA法检测血清中特异性IgG抗体变化水平。
1.8.5" 统计学分析
用SPSS 27.0将得到的数据进行一维方差描述性统计分析, 并用Duncan氏新复极差法对组间平均值进行多重比较, p<0.05表示差异有统计学意义, p>0.05表示差异无统计学意义。
2" 结果和分析
2.1" EtSAT12/pET-32a原核表达载体的构建
EtSAG12基因通过1%琼脂糖凝胶电泳检测, 结果显示目的条带大小约为780 bp, 与预期大小相符(图1a)。 将测序成功的EtSAG12基因亚克隆至pET-32a, 经菌液PCR检测, 可见1%琼脂糖凝胶电泳结果具有清晰明亮的条带, 且大小与预期相符(图1c)。 通过双酶切鉴定, 表明EtSAG12已成功连接至pET-32a(图1d)。
2.2" EtSAG12重组蛋白的诱导表达及纯化
SDS-PAGE结果显示EtSAG12重组蛋白大小约为43 Ku, 表达产物大多数都是以可溶性蛋白的形式存在于上清液中, 只有少量存在于沉淀中(图2a)。 纯化后的蛋白无明显杂带, 且在筛选纯化条件时, 选择50 mmol/L咪唑洗脱液进行洗脱的蛋白浓度更高, 效果更好(图2b)。
2.3" 多克隆抗体的鉴定
利用间接ELISA法测定兔抗EtSAG12多克隆抗体的效价, 结果显示抗体滴度大于1∶640 000。 Western Blot检测结果显示兔抗EtSAG12多克隆抗体能和EtSAG12重组蛋白特异性结合(图3b), 表明其具有较好的特异性。
2.4" EtSAG12的免疫保护效果观察
2.4.1" 临床观察
在攻虫后第4天, 除了NC组其它试验组鸡均开始出现精神沉郁、 食欲减退、 饮水减少、 羽毛凌乱等症状。 在第5天各个试验组鸡开始出现血便, 第6天血便症状最严重。 在第6天PC组死亡1只鸡, 其他组均无鸡死亡。
2.4.2" 各试验组鸡增质量情况、 盲肠病变计分、 卵囊产量和卵囊减少率
由表2可知, 各免疫组的平均增质量均显著高于PC组(p<0.05), 其中150 μg组的增质量效果最好, 相对增质量率为97.34%; 各个免疫组均能有效降低卵囊产量, 卵囊减少率在21.66%~52.51%, 并且各免疫组的病变计分均显著小于未免疫攻虫组(p<0.05)。
2.4.3" ACI检测
根据存活率、 平均增质量率、 病变计分和卵囊值这些参数综合进行ACI分析。 由表3可知, EtSAG12重组蛋白150 μg组的ACI值为165.34, 具有中效抗球虫水平; 50 μg 和100 μg EtSAG重组蛋白组的ACI值介于120到160之间, 属于低效抗球虫水平。
2.4.4" 血清中特异性IgG抗体水平变化
利用间接ELISA法检测血清中IgG抗体的变化水平, 结果显示免疫前各试验组血清中特异性IgG抗体水平差异无统计学意义(p>0.05)。 首免和二免后3个免疫组血清中特异性IgG抗体均显著提高(p<0.05), 其中二免后血清中特异性IgG抗体迅速产生, 且EtSAG12重组蛋白150 μg组产生IgG抗体效果最好(表4)。
3" 讨论与结论
3.1" 讨论
SAG具有维持细胞活力、 增强虫体感染力、 促进虫体入侵和免疫逃避等多种生物学功能。 Toxoplasma gondii SAG1蛋白与蛋白激酶C1受体(Receptor of activated protein kinase C1, RACK1)相互作用, 调控RACK1发生自噬, 进而维持宿主细胞的活力[16]。 堆型艾美尔球虫(E.acervulina)SAG能减少宿主体内黏蛋白2(mucoprotein2, MUC2)基因的表达量, 间接增强虫体的感染力[17]。 E. tenella SAG1蛋白外表面的正电荷区域与宿主细胞表面带负电荷的硫酸化多糖区域相互结合, 能促进虫体入侵宿主细胞[18]。 此外, E. tenella SAG10能够促进纳虫空泡的形成, 使虫体不能被淋巴细胞识别, 从而逃避宿主免疫反应[19] 。
SAG对球虫具有一定的免疫保护效果, 有利于减少宿主因感染球虫而造成的体重损失、 卵囊产量降低和肠道病变等作用。 大型艾美耳球虫(E. magna)SAG11能减少球虫感染造成的体重损失, 并且提高饲料利用率[20]; 斯氏艾美耳球虫(E. stiedae)SAG13可以减缓球虫入侵机体, 并有效抑制其在肠道内的发育, 从而显著降低卵囊产量[21]; E. tenella SAG16和SAG22能显著降低肠道病变计分, 缓解因球虫感染造成的盲肠出血、 盲肠肿大、 盲肠壁增厚等症状[22]。 本试验利用EtSAG12重组蛋白制备亚单位疫苗免疫雏鸡, 结果显示3个免疫组均能有效减少因球虫感染而导致的增质量损失, 卵囊排出量减少和盲肠病变。 其中EtSAG12重组蛋白150 μg组抗球虫效果最好, 相对增质量率为97.34%, 卵囊减少率为52.54%, 病变计分最低, ACI值达到165.34, 具有中效抗球虫效果。 证明EtSAG12重组蛋白对球虫感染具有一定的保护性。
血清中的IgG抗体可与球虫表皮膜抗原结合, 激活补体溶解球虫的裂殖子, 从而抑制球虫的生长发育[23], 因此血清中特异性IgG抗体水平和抗球虫效果呈现一定相关性。 文献[24]发现母源抗体越高的雏鸡其抗球虫能力越强; 文献[25]用E.acervulina MIC3、 MAR3和MAR6制备亚单位疫苗免疫雏鸡, 结果显示EaMIC3免疫组产生特异性IgG抗体最高, 并且其ACI值也最高。 本试验通过间接ELISA法检测血清中IgG抗体水平, 结果显示免疫后的3个免疫组IgG抗体水平较PC组和NC组显著上升(p<0.05), 在二免后7天抗体水平达到最高, 并且IgG抗体水平随免疫剂量的增加而升高。 说明EtSAG12重组蛋白诱导机体产生了体液免疫反应。 通过比较各个免疫组IgG抗体水平和ACI值发现, 150 μg组血清中的 IgG特异性抗体水平最高, 其ACI值也最高。 然而血清中的IgG抗体水平与抗球虫效果并非均呈正相关关系。 文献[26]用毒害艾美耳球虫(E.necatrix)ApiAP2重组蛋白制备3个浓度梯度(低、 中、 高浓度)的亚单位疫苗免疫雏鸡, 结果显示高剂量组产生的IgG抗体水平最高, 而低剂量组的抗球虫效果最好, 即此处IgG抗体水平与抗球虫效果有负相关性。 但在本试验中并未出现类似现象, 因此其具体的作用机制还有待进一步研究。
3.2" 结论
本试验成功表达并纯化了EtSAG12重组蛋白, 动物试验结果显示该重组蛋白能有效减少卵囊排出和减轻肠道病变程度, 并激发机体自身的体液免疫, 对E. tenella感染有一定的免疫保护效果。
参考文献:
[1]
DEBBOU-IOUKNANE N, BENBAREK H, AYAD A. Prevalence and Aetiology of Coccidiosis in Broiler Chickens in Bejaia Province, Algeria [J]. The Onderstepoort Journal of Veterinary Research, 2018, 85(1): e1-e6.
[2]" 由焕霞. 鸡球虫病防治措施研究 [J]. 吉林畜牧兽医, 2023, 44(7): 89-90.
[3]" THABET A, HONSCHA W, DAUGSCHIES A, et al. Quantitative Proteomic Studies in Resistance Mechanisms of Eimeria tenella Against Polyether Ionophores [J]. Parasitology Research, 2017, 116(5): 1553-1559.
[4]" BLAKE D P, TOMLEY F M. Securing Poultry Production from the Ever-Present Eimeria Challenge [J]. Trends in Parasitology, 2014, 30(1): 12-19.
[5]" SHIRLEY M W. Development of a Live Attenuated Vaccine Against Coccidiosis of Poultry [J]. Parasite Immunology, 1989, 11(2): 117-124.
[6]" GUPTA S K, SHUKLA P. Advanced Technologies for Improved Expression of Recombinant Proteins in Bacteria: Perspectives and Applications [J]. Critical Reviews in Biotechnology, 2016, 36(6): 1089-1098.
[7]" TABARS E, FERGUSON D, CLARK J, et al. Eimeria tenella Sporozoites and Merozoites Differentially Express Glycosylphosphatidylinositol-Anchored Variant Surface Proteins [J]. Molecular and Biochemical Parasitology, 2004, 135(1): 123-132.
[8]" 高俊莹, 张东超, 李璇, 等. 弓形虫表面抗原SAG1黏附宿主细胞表面硫化肝素的特性研究 [J]. 畜牧兽医学报, 2019, 50(9): 1874-1881.
[9]" GILSON P R, NEBL T, VUKCEVIC D, et al. Identification and Stoichiometry of Glycosylphosphatidylinositol-Anchored Membrane Proteins of the Human Malaria Parasite Plasmodium Falciparum * S [J]. Molecular amp; Cellular Proteomics, 2006, 5(7): 1286-1299.
[10]刘梦丽, 许正茂, 吉尔格勒, 等. 新孢子虫NcSRS2和NcSAG1重组蛋白免疫小鼠诱导的免疫应答 [J]. 中国动物传染病学报, 2017, 25(5): 47-52.
[11]CHOW Y P, WAN K L, BLAKE D P, et al. Immunogenic Eimeria tenella Glycosylphosphatidylinositol-Anchored Surface Antigens (SAGs) Induce Inflammatory Responses in Avian Macrophages [J]. PLoS One, 2011, 6(9): e25233.
[12]刘立恒, 李俊, 徐立新, 等. 柔嫩艾美耳球虫第二代裂殖子的分离纯化 [J]. 畜牧与兽医, 2006, 38(12): 38-40.
[13]吴天乐, 王磊, 王冰楠, 等. 犬弓首蛔虫超氧化物歧化酶的分子特性及原核表达 [J]. 西南大学学报(自然科学版), 2024, 46(2): 62-70.
[14]王礼跃, 蔡为民, 张阿敏, 等. 柔嫩艾美耳球虫3种重组配子体蛋白免疫雏鸡的抗球虫免疫保护效果 [J]. 中国兽医科学, 2022, 52(6): 744-752.
[15]毕天奇, 肇英池, 马丹, 等. 堆型艾美耳球虫重组亚单位疫苗的制备及其免疫效果评价 [J]. 中国生物制品学杂志, 2022, 35(7): 790-794, 801.
[16]张梓轩. 弓形虫表面抗原1与宿主细胞互作蛋白的筛选及鉴定 [D]. 锦州: 锦州医科大学, 2021.
[17]ZHAO Y L, WANG C M, LU Y M, et al. Prokaryotic Expression and Identification of 3-1E Gene of Merozoite Surface Antigen of Eimeria Acervulina [J]. Parasitology Research, 2011, 109(5): 1361-1365.
[18]JAHN D, MATROS A, BAKULINA A Y, et al. Model Structure of the Immunodominant Surface Antigen of Eimeria tenella Identified as a Target for Sporozoite-Neutralizing Monoclonal Antibody [J]. Parasitology Research, 2009, 105(3): 655-668.
[19]LIU G L, ZHU S H, ZHAO Q P, et al. Molecular Characterization of Surface Antigen 10 of Eimeria tenella [J]. Parasitology Research, 2019, 118(10): 2989-2999.
[20]PU J Y, XIAO J, BAI X, et al. Prokaryotic Expression of Eimeria magna SAG10 and SAG11 Genes and the Preliminary Evaluation of the Effect of the Recombinant Protein on Immune Protection in Rabbits [J]. International Journal of Molecular Sciences, 2022, 23(18): 10942.
[21]罗跃军, 任永军, 白鑫, 等. 斯氏艾美耳球虫重组表面抗原SAG13和SAG14对兔的免疫保护效果初步观察 [J]. 畜牧兽医学报, 2022, 53(3): 883-893.
[22]ZHAO P F, WANG C F, DING J, et al. Evaluation of Immunoprotective Effects of Recombinant Protein and DNA Vaccine Based on Eimeria tenella Surface Antigen 16 and 22 in Vivo [J]. Parasitology Research, 2021, 120(5): 1861-1871.
[23]高建广, 杨文平, 郑明学. 柔嫩艾美尔球虫实验感染雏鸡体液免疫机制研究 [J]. 家禽科学, 2005(7): 9-13.
[24]郑明学, 高建广, 史喜菊. 柔嫩艾美耳球虫(Eimeria tenella)感染鸡IgG生成细胞及血清IgG变化 [J]. 中国兽医学报, 2001, 21(5): 447-450.
[25]刘佳斌, 张杨, 王茗悦, 等. 巨型艾美耳球虫微线蛋白3结构域蛋白的免疫保护作用 [J]. 中国兽医学报, 2021, 41(8): 1539-1545.
[26]王乐乐, 王礼跃, 蔡为民, 等. 鸡球虫重组蛋白rEnApiAP2对鸡免疫保护效果的观察 [J]. 畜牧兽医学报, 2024, 55(4): 1716-1727.
责任编辑" 崔玉洁""" 廖坤
