柿叶提取物对H2O2诱导IEC-6细胞铁死亡的影响及机制研究
2025-01-15张雪侠周敏周红艳王莉飞李华妮刘长河徐洪德张明利



关键词柿叶提取物;溃疡性结肠炎;铁死亡;Nrf2/HO-1信号通路
溃疡性结肠炎(ulcerativecolitis,UC)是炎症性肠病的主要类型之一,其发病率在全球范围内不断上升[1]。长期以来,氧化应激被学界认为是UC的重要致病因素[2]。在UC的发病过程中,肠道炎症反应的发生可促进细胞过度产生活性氧(reactiveoxygenspecies,ROS),当ROS的生成超过机体的抗氧化缓冲能力时,会导致脂质过氧化的发生,并进一步诱发铁死亡[2]。可见,铁死亡主要由脂质过氧化累积所致,减轻机体氧化应激反应可有效抑制铁死亡。研究指出,无论是UC还是用于UC治疗的药物都会增加患者并发症(如结肠癌、皮肤癌、宫颈癌、骨骼疾病、焦虑抑郁等)的发生风险,若不及时治疗,这些并发症将导致不良的用药依从性、更高的医疗费用、更快的疾病进展,从而严重影响患者的生活质量[3―4]。
柿叶(persimmonleaf,PL)提取物多年来被广泛用作炎症性疾病的治疗剂。研究显示,PL提取物具有抗炎、抗氧化的作用[5],其主要活性成分槲皮素可通过降低丙二醛(malondialdehyde,MDA)和ROS水平、抑制铁死亡来减轻缺血再灌注或叶酸诱导的急性肾损伤[6]。本课题组前期研究发现,PL提取物对UC具有保护作用[7],但这种作用是否与氧化应激和铁死亡相关并不清楚。实验表明,过氧化氢(H2O2)可诱导细胞发生铁死亡[8]。基于此,本研究拟以H2O2致铁死亡的IEC-6细胞(具隐窝样上皮细胞特征,是UC相关体外研究的常用细胞)作为体外模型,初步探讨PL提取物对该细胞模型的影响,以期为UC治疗新药的研发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括IncubatorCO2-PU-90A型CO2培养箱(上海搏旅仪器有限公司)、Ti20型倒置荧光显微镜(日本Nikon公司)、EXL800型酶标仪(美国BioTek公司)、Navios型流式细胞仪(美国BeckmanCoulter公司)、K5500Plus型实时聚合酶链反应(realtimePCR,RT-PCR)仪(北京凯奥科技发展有限公司)等。
1.2 主要药品与试剂
PL(产地安徽亳州,批号20210314)购自安徽亳州药材市场,由河南省中西医结合医院中药研究所刘长河副研究员鉴定为柿树科植物柿DiospyroskakiThunb.的干燥叶。
铁死亡抑制剂ferrostatin-1(Fer-1)的对照品(批号HY100579,纯度99.96%)购自美国MedChemExpress公司;胎牛血清(fetalbovineserum,FBS;批号2181654CP)购自美国Gibco公司;MTT试剂、DMEM高糖培养基、胰蛋白酶、超氧化物歧化酶(superoxidedismutase,SOD)试剂盒、MDA试剂盒、线粒体膜电位JC-1试剂盒(批号分别为20210508、20210903、20210804、20210323、20210303、20210412)均购自北京索莱宝科技有限公司;PCR试剂盒购自凯杰生物工程(深圳)有限公司;Trizol试剂(批号20210316)购自北京康为世纪生物科技有限公司;Revert-AidTMFirstStrandcDNA合成试剂盒(批号00780630)购自美国ThermoFisherScientific公司;ROS试剂盒(荧光探针法,批号D3861)购自美国Invitrogen公司;兔源胱氨酸/谷氨酸反向转运体(cystine/glutamateanti-porter,xCT)、谷胱甘肽过氧化物酶4(glutathioneperoxidase4,GPX4)抗体(批号分别为ab307601、ab125066)均购自英国Abcam公司;兔源核转录因子红系2相关因子2(nuclearfactor-erythroid2-relatedfactor2,Nrf2)、铁蛋白重链(ferritinheavychain,FTH)抗体(批号分别为#AF0639、#DF6278)均购自美国Affinity公司;兔源还原型烟酰胺腺嘌呤二核苷酸磷酸/醌氧化还原酶1(NADPH/quinoneoxidoreductase-1,NQO-1)、血红素氧合酶1(hemeoxygenase-1,HO-1)抗体(批号分别为GB11282、GB11549)均购自武汉赛维尔生物科技有限公司;兔源甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号10494-1)购自武汉三鹰生物科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G二抗(批号162607)购自北京鼎国昌盛生物技术有限责任公司。
1.3 细胞
大鼠IEC-6细胞由北京协和医学院基础学院细胞库提供。
2 方法
2.1 药液的制备
PL提取物药液的制备参考本课题组前期已发表的文献[8]。
2.2 细胞培养与处理
将IEC-6细胞接种于含5%FBS的DMEM高糖培养基(以下简称“完全培养基”)中,在37℃、5%CO2、饱和湿度条件(培养条件后同)下培养,每2~3d换液1次,待细胞生长至对数期进行后续实验。
2.3 PL提取物毒性考察及药物干预浓度筛选
2.3.1 PL提取物毒性考察
取对数生长期的IEC-6细胞,按1×105个/mL接种于96孔板中,每孔100μL,培养。待细胞融合至80%左右时,将其分为空白对照组和PL提取物不同质量浓度组,每组设置5个复孔。对照组加入完全培养基200μL,各药物组加入含不同质量浓度PL提取物(根据预实验结果设置,质量浓度分别为25、50、100、200、400μg/mL,以PL提取物质量计)的完全培养基200μL。培养24h,每孔加入0.5%MTT溶液20μL,避光反应2h;弃去培养基,每孔加入二甲基亚砜150μL,振摇5min,使用酶标仪于490nm波长处检测各孔的吸光度值,并计算细胞存活率(细胞存活率=实验组细胞的平均吸光度值/对照组细胞的平均吸光度值×100%),以考察PL提取物对细胞活力的影响。
2.3.2 H2O2作用浓度筛选
取对数生长期的IEC-6细胞,按1×105个/mL接种于96孔板中,每孔100μL,培养。待细胞融合至80%左右时,吸弃培养液,以磷酸盐缓冲液(PBS)清洗1次后,将其分为空白对照组和H2O2不同浓度组,每组设置6个复孔。对照组加入完全培养基200μL,其余各组分别加入含不同浓度H2O2(参考相关文献[9]设置,浓度分别为30、40、50、60、70、80μmol/L)的完全培养基200μL。培养24h,按“2.3.1”项下方法检测各组细胞存活率,以筛选H2O2的作用浓度。
2.3.3 PL提取物干预浓度筛选
取对数生长期的IEC-6细胞,按1×105个/mL接种于96孔板中,每孔100μL,培养。待细胞融合至80%左右时,吸弃培养液,以PBS清洗1次后,将其分为空白对照组和PL提取物不同质量浓度组,每组设置6个复孔。对照组加入不含H2O2的完全培养基200μL,其余各组分别加入含H2O260μmol/L和PL提取物25、50、100、200μg/mL的完全培养基200μL(H2O2和PL提取物干预浓度参考“2.3.2”“2.3.1”项下结果设置)。培养24h,按“2.3.1”项下MTT法检测细胞存活率,以进一步筛选后续实验PL提取物的干预浓度。
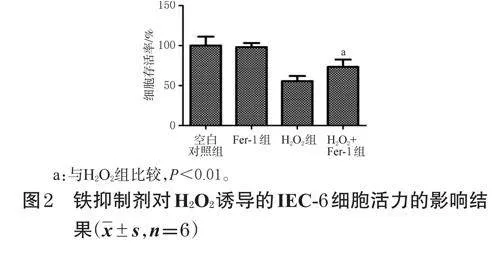
2.4 铁死亡抑制剂对H2O2诱导的IEC-6细胞活力的影响检测
取对数生长期的IEC-6细胞,按1×105个/mL接种于96孔板中,每孔100μL,培养。待细胞融合至80%左右时,吸弃培养液,以PBS清洗1次,将其分为空白对照组、Fer-1组、H2O2组、H2O2+Fer-1组,每组设置6个复孔。对照组加入完全培养基200μL,Fer-1组加入含Fer-11μg/μL的完全培养基200μL,H2O2组加入含H2O260μmol/L的完全培养基200μL,H2O2+Fer-1组加入含Fer-11μg/μL、H2O260μmol/L的完全培养基200μL(Fer-1干预浓度参考相关文献[10]设置,H2O2干预浓度参考“2.3.2”项下结果设置)。培养24h,按“2.3.1”项下MTT法检测细胞存活率,以考察H2O2导致的IEC-6细胞损伤是否与铁死亡相关。
2.5 PL提取物对H2O2诱导的IEC-6细胞氧化应激的影响检测
取对数生长期的IEC-6细胞,按1×105个/mL接种于96孔板中,每孔100μL。待细胞贴壁后,将其分为对照组(Control组)、H2O2组、H2O2+PL25μg/mL组、H2O2+PL50μg/mL组,每组设置6个复孔。Control组加入完全培养基200μL,H2O2组加入含H2O260μmol/L的完全培养基200μL,H2O2+PL25、50μg/mL组分别加入含H2O260μmol/L和PL提取物25、50μg/mL的完全培养基200μL(H2O2、PL提取物干预浓度分别参考“2.3.2”“2.3.3”项下结果设置)。培养24h,收集细胞上清液,按照相应试剂盒说明书方法操作,使用酶标仪检测其MDA含量和SOD活性。
按上述方法进行细胞分组、造模、处理。培养24h后,收集各组细胞,加入ROS试剂盒中BODIPYTM581/591C11试液(以无血清培养基稀释,终浓度为2μmol/L)1mL,于37℃下孵育30min;弃去上清液,细胞用PBS1mL清洗2次,加入胰蛋白酶1mL,消化3min后,加入培养基1mL终止消化。收集细胞悬液,于4℃下以10000r/min离心3min,吸弃培养基,细胞用预冷的PBS1mL清洗2次后,再以预冷的PBS400μL稀释,使用流式细胞仪检测细胞内ROS水平。
2.6 PL提取物对H2O2诱导的IEC-6细胞线粒体膜电位的影响
按“2.5”项下方法进行细胞分组、造模、处理。培养24h后,收集各组细胞,加入JC-1荧光探针试液(以二甲基亚砜为溶剂,终浓度为10μg/mL),于37℃下孵育20min;细胞用PBS轻柔洗涤2次后,再以PBS5mL稀释,使用倒置荧光显微镜观察细胞状态(JC-1聚合物呈红色荧光,JC-1单体呈绿色荧光),分析每张显微图的平均荧光强度并计算细胞线粒体膜电位(mitochondrialmembranepotential,MMP;MMP=红色平均荧光强度/绿色平均荧光强度),以反映各组细胞线粒体膜的去极化程度(MMP与去极化程度成反比)。
2.7 PL提取物对H2O2诱导的IEC-6细胞中铁死亡相关mRNA表达的影响检测
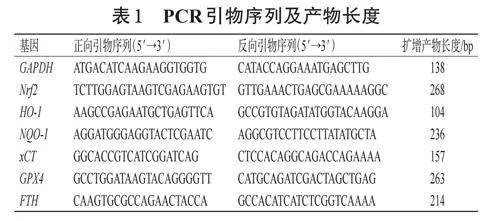
采用定量RT-PCR法检测。按“2.5”项下方法进行细胞分组、造模、处理。培养24h后,收集各组细胞,使用Trizol试剂提取其总RNA,检测其浓度和纯度后,使用反转录试剂盒将其反转录为cDNA,然后以此为模板进行PCR扩增。PCR反应体系包括SYBR®PremixExTaqTM酶(2×)10μL、PCR正/反向引物各0.8μL、cDNA模板2μL和无菌水6.4μL。PCR反应条件为:95℃预变性2min;95℃变性2s,60℃退火10s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法分析Nrf2、HO-1、NQO-1、xCT、GPX4、FTHmRNA的表达水平,结果以Control组为参照进行归一化处理。PCR引物由苏州金唯智生物科技有限公司设计、合成,具体序列及产物长度见表1。
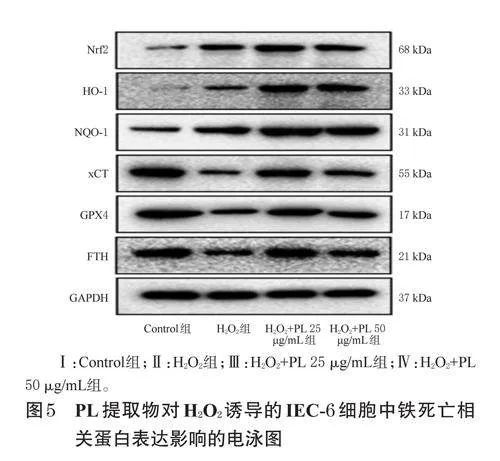
2.8 PL提取物对H2O2诱导的IEC-6细胞中铁死亡相关蛋白表达的影响检测
采用Westernblot法检测。按“2.5”项下方法进行细胞分组、造模、处理。培养24h后,收集各组细胞,用RIPA裂解液提取总蛋白,以BCA法测定蛋白浓度后加热变性。取变性蛋白适量,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转移到聚偏二氟乙烯膜上,用5%脱脂牛奶封闭1h;洗膜后,加入Nrf2、HO-1、NQO-1、xCT、GPX4、FTH、GAPDH一抗(稀释比例均为1∶1000),于4℃下孵育过夜;洗膜后,加入相应二抗(稀释比例1∶2000),于室温下孵育2h;使用化学发光试剂显色后置于凝胶成像仪下成像。以GAPDH为内参,使用ImageJ软件量化Nrf2、HO-1、NQO-1、xCT、GPX4、FTH蛋白的表达水平,结果以Control组为参照进行归一化处理。
2.9 统计学方法
采用GraphPadPrism9软件对数据进行统计分析并绘图。实验数据以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 PL提取物毒性考察及药物干预浓度筛选结果
当PL提取物质量浓度为200、400μg/mL时,细胞存活率(平均值分别为77.85%、36.60%)均较空白对照组显著降低(P<0.05或P<0.01);当PL提取物质量浓度为25、50、100μg/mL时,细胞存活率(平均值分别为100.77%、104.42%、86.25%)与空白对照组比较差异均无统计学意义(P>0.05)。结果见图1A。
当H2O2浓度分别为30、40、50、60、70、80μmol/L时,细胞的平均存活率分别为82.68%、73.32%、59.16%、52.04%、34.55%、20.98%。为保证细胞有足够的活力进行后续实验,本研究选用60μmol/L作为H2O2诱导浓度。结果见图1B。
当PL提取物质量浓度为100、200μg/mL时,随着药物质量浓度的增加,细胞存活率呈下降趋势;当PL提取物浓度为25、50μg/mL时,随着药物浓度的增加,细胞存活率有所升高,提示上述质量浓度的PL提取物可抑制H2O2所导致的细胞存活率降低。因此,本研究选用25、50μg/mL作为后续实验PL提取物的干预质量浓度。结果见图1C。
3.2 铁死亡抑制剂对H2O2诱导的IEC-6细胞活力的影响
当只加Fer-1时,细胞的平均存活率为98.19%,接近于空白对照组,提示此质量浓度的Fer-1对细胞几乎没有毒性;当在H2O2诱导的细胞中加入Fer-1后,细胞的存活率较H2O2组显著升高(P<0.01)。由此可见,H2O2诱导的IEC-6细胞死亡可能与铁死亡相关。结果见图2。
3.3 PL提取物对H2O2诱导的IEC-6细胞氧化应激的影响
与Control组比较,H2O2组细胞上清液中SOD活性显著降低,MDA含量、ROS水平均显著升高(P<0.05或P<0.01)。与H2O2组比较,H2O2+PL50μg/mL组细胞上清液中SOD活性显著升高,ROS水平显著降低(P<0.05)。结果见表2、图3。
3.4 PL提取物对H2O2诱导的IEC-6细胞MMP的影响
与Control组(MMP为2.01±0.21)比较,H2O2组细胞的红色荧光明显减弱,绿色荧光明显增强,MMP(0.63±0.15)显著降低(P<0.01);与H2O2组比较,H2O2+PL25、50μg/mL组细胞的红色荧光有所增强,绿色荧光有所减弱,MMP[1.17±0.15、1.63±0.15]均显著升高(P<0.05或P<0.01)。结果见图4。
3.5 PL提取物对H2O2诱导的IEC-6细胞中铁死亡相关mRNA及蛋白表达的影响
与Control组比较,H2O2组细胞中Nrf2、NQO-1mRNA及Nrf2、HO-1蛋白的表达均显著上调,xCT、GPX4、FTHmRNA及GPX4、FTH蛋白的表达均显著下调(P<0.05或P<0.01);与H2O2组比较,各药物组细胞中Nrf2、HO-1、NQO-1、xCT、GPX4、FTHmRNA及蛋白的表达均有不同程度上调,部分指标组间比较差异有统计学意义(P<0.01或P<0.05)。结果见表3、表4、图5。
4 讨论
中药因作用靶点多、价格低的优势,在慢性疾病治疗领域得到了越来越多的关注和应用。研究指出,PL提取物可通过调节Jun激酶途径来抑制T细胞的活化,从而改善小鼠的特应性皮炎[11];其可提高大鼠口腔溃疡组织中SOD活性并降低MDA含量,减轻口腔黏膜下层的炎症细胞浸润,对醋酸诱导的口腔溃疡有一定的改善作用,上述作用可能是通过抗炎和抗氧化而实现的[4];此外,PL提取物可通过活化Nrf2/HO-1信号通路来发挥抗氧化作用,从而减缓阿尔茨海默病的进程[12]。研究表明,PL提取物中的黄酮类成分金丝桃苷不仅可直接清除细胞内的ROS、螯合金属离子,而且可增加GPX4、SOD、HO-1等抗氧化酶的生物活性[13]。可见,PL提取物具有一定的抗炎、抗氧化作用。
铁死亡与人体生理、病理进程密切相关,特别是在炎症性、神经性、代谢异常等疾病的发生及发展过程中发挥了重要作用[14]。早有研究表明,使用铁螯合剂可以缓解UC患者的临床症状,而使用铁剂则可能加重相关症状[15]。随后,有学者指出,过量的铁会加重肠道炎症,且人群的高膳食铁摄入量可促进UC的发展[16―17]。此外有学者发现,UC患者结肠黏膜中ROS的增加与疾病活动度成正比,而铁螯合剂可减少ROS的生成,并改善UC的结肠症状[18]。由此可见,铁死亡与UC的发生发展密切相关,抑制铁死亡的发生可能对治疗UC有益。
氧化应激长期被认为是UC的重要致病因素。ROS由细胞线粒体产生,正常情况下具有杀菌作用;但在UC的发病过程中,肠道炎症反应的发生可促进细胞过度生成ROS,超过机体抗氧化缓冲能力,从而引发脂质过氧化、肠道黏膜屏障损伤和炎症反应[19]。SOD、MDA是氧化应激的重要指标。其中,MDA是ROS诱导脂质过氧化反应的产物之一,也是机体组织氧化损伤的重要指标,MDA水平越高,表明机体组织损伤越严重;SOD是一种抗氧化酶,能够清除氧自由基,若机体对氧自由基的抑制作用减弱,可导致氧自由基在体内过量积累,从而增加细胞膜的通透性,使体内炎症因子水平升高[20]。本研究结果表明,在50μg/mLPL提取物的作用下,IEC-6细胞氧化应激模型的ROS水平显著降低,SOD活性显著升高,提示PL提取物可抑制H2O2诱导的IEC-6细胞的氧化应激损伤。
肠道内抗氧化防御系统的过度损伤与UC的发病机制密切相关,Nrf2/HO-1信号通路是体内对抗氧化应激的主要防御机制之一,可影响疾病的转归[12]。近年研究表明,UC患者体内Nrf2蛋白的表达水平显著低于对照组,但UC相关结肠癌患者体内Nrf2蛋白的表达水平显著高于对照组[21];此外,有研究显示,与健康对照组比较,磷酸化的Nrf2蛋白在中/重度UC患者体内呈高表达,但非磷酸化的Nrf2蛋白在中/重度UC患者体内的表达则明显下调[22]。上述研究表明,Nrf2蛋白的表达水平及表达形式与疾病进程有关。现有研究表明,中医药治疗UC的作用可能与调节线粒体的生物发生、动力学平衡等有关[23]。ROS主要在线粒体中产生,适量的ROS可维持体内各通路的信号转导,而过量的ROS则可能造成MMP降低,从而导致线粒体功能障碍[24]。本研究结果表明,PL提取物可显著提高H2O2诱导的IEC-6细胞的MMP,抑制线粒体去极化的发生;同时,PL提取物可激活Nrf2蛋白,上调下游HO-1、NQO-1、xCT、GPX4、FTH蛋白及mRNA的表达,从而发挥抗氧化应激和抑制铁死亡的作用。
综上所述,PL提取物能减轻H2O2所导致的细胞线粒体膜损伤、ROS异常堆积,上述作用可能与激活Nrf2/HO-1信号通路从而抑制铁死亡有关。
