“三新”视域下高中化学综合实验题的解题策略与备考建议
2024-12-31金敖然






基于“新课标、新教材、新高考”的“三新”视域下,新高考化学综合实验题以新颖真实的情境为背景材料,考查学生的综合实验能力,信息的获取、加工、处理能力,及逻辑思维、创新能力等.能够全面考查学生的化学学科核心素养,试题综合性强、区分度比较大,备受命题者青睐,是高考、模拟考中必考题型.本文通过分析综合实验题的命制特点,提出解题策略,并应用于试题解答中,最后提出化学综合实验题的备考建议,以期为教师和学生的高三复习备考提供有价值的参考.
一、化学综合实验题的试题结构分析与解题策略
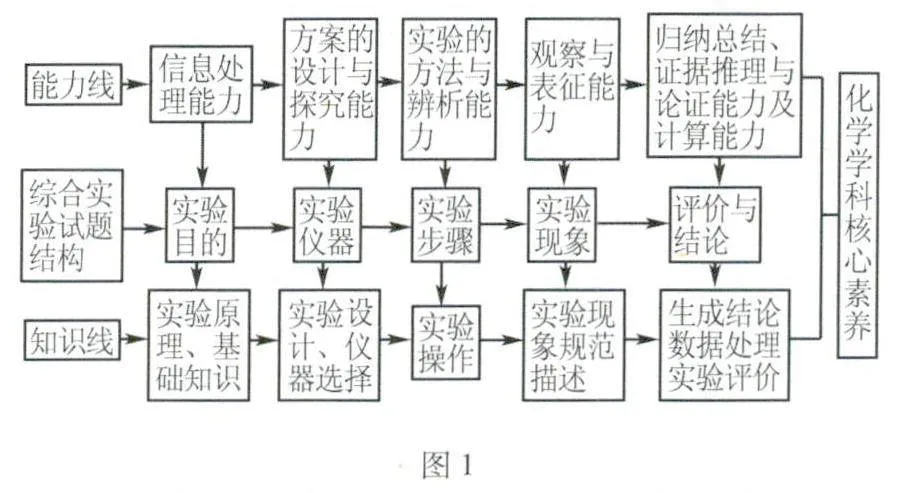
综合实验题取材广泛、形式多样,试题结构特征鲜明.其结构特征如图1所示.
结合综合实验题的结构提出以下解题策略.
1.认真分析“实验目的”,“实验目的”通常涉及物质的制备、物质组成结构的判定、物质的检验,以及探究物质的性质、反应的原理等.通过分析实验目的结合试题中给出的信息和已有的化学知识,依照实验原理选择合适的实验试剂;
2.选择合适的“实验仪器”,围绕实验目的,进行实验仪器的选择与连接,过程中体现实验设计与探究的能力,同时注意绿色化学思想;
3.根据实验的目的,实验的安全性等设计实验步骤,体现了实验方法与辨析能力;
4.注意观察“实验现象”,规范描述实验现象;
5.最后通过实验过程与现象的分析,结合实验数据的处理,生成结论,最后对实验设计进行综合评价.
二、应用解题策略解决实际问题
例题1 (2024.山东青岛·一模)三氯化硼可用于有机反应催化剂、电子工业等,其熔点为- 107℃,沸点为12.5℃,易水解.模拟工业以B2O3、木炭和氯气为原料制备三氯化硼的装置如图2所示(夹持装置略).
实验步骤:
(i)连接仪器,检验装置的气密性,盛装药品;打开K1,通一段时间N2;
(ii)关闭K1,加入适量浓盐酸,接通冷凝装置,加热管式炉;
(iii)待反应结束,停止加热,打开K1,再通一段时间N2.
回答下列问题:
(1)仪器甲的名称为____,试剂X为____,F处碱石灰的作用是____.
(2)装置D的产物中含有极性的二元化合物分子,则该反应的化学方程式为____;判断该反应结束的实验现象是____.
(3)反应结束后通人N2的目的是____;图示装置存在的缺陷是____.
(4)已知AgSCN是一种白色沉淀且Ksp(AgSCN)<Ksp(AgCl).BCl3产率的测定方法如下(不考虑杂质的反应):
①m g B2O3与足量木炭、氯气反应,取产品的20%于水解瓶中完全水解,稀释至100. 00 mL.
②取10. 00 mL该溶液于锥形瓶中,加入V1 mLc.mol·L-1 AgNO3溶液,加入适量硝基苯,用力摇动,将沉淀表面完全覆盖.
③以NH4Fe(SO4):溶液为指示剂,用c2 mol·L-1KSCN标准溶液滴定过量AgNO3溶液,消耗标准溶液V2 mL.
判断滴定终点的现象是____;实验所得产品的产率是____,若未加硝基苯,则测定结果将____(填“偏大”、“偏小”或“无影响”).
解题策略分析 A为制备氯气的装置,该方法制备的氯气中有HCl和水蒸气杂质,需要依次通过饱和食盐水和浓硫酸除去,D为反应装置,F为尾气处理装置且可防止空气中的水蒸气进入E中;整个过程中需要注意三氯化硼熔点为- 107℃,沸点为12.5℃,易水解.
解析 试题分析与解析见表1.
例2 (2024·河北沧州·二模)亚硝酸钙是一种白色粉末,易潮解,在钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂,实验室中采用如图3所示装置制取少量亚硝酸钙.
回答下列问题:
(1)装置Ⅰ中仪器a的名称是____,装置中发生主要反应的化学方程式为____.
(2)装置Ⅱ的作用是____.
(3)如图3装置中,能用来替代装置Ⅲ的是____(填标号).
(4)滴入稀硝酸前,需要向装置中通入一段时间N2,待反应结束后还需继续通人一段时间N2,两次通N2的目的分别是____;____.
(5)若缺少装置V,产生的影响是____.
(6)装置Ⅵ中氮元素被氧化成+5价,则反应的离子方程式为____.
(7)若所得亚硝酸钙产品中仅含少量硝酸钙杂质,可用如下实验操作测定其纯度:称量mg产品溶于水,先加入足量Na2SO4溶液,充分搅拌后过滤,除去Ca2+,再加入适量(NH4)2SO4饱和溶液,加热煮沸3 min,将NO2-转化为N2.然后向所得溶液中加入25. 00 mL a mol·L-1(NH4)2Fe(SO4)2溶液,并用稀硫酸酸化,充分反应后用6 mol·L-1 K2Cr2O7标准溶液滴定过量的Fe2+,消耗标准溶液的体积为V mL.
①除去NO2-时,反应的离子方程式为____.
②计算可知,所得产品的纯度为____(用含m、a、b、V的式子表示).
解题策略分析 用CaO2与NO制备亚硝酸钙,实验开始前先通氮气是为了排除装置内的空气,在装置I中由铜和稀硝酸反应制取一氧化氮3Cu +8HNO3(稀)=3Cu(NO3)2 +2NO ↑ +4H2O产生的气体中混有少量的NO2,可用Ⅱ装置进行除杂,则Ⅱ装置中盛放的试剂为蒸馏水,发生反应的化学方程式为:
3NO2 +H2O =2HNO3 +NO
装置Ⅲ为干燥装置,通过Ⅳ中与过氧化钙反应生成亚硝酸钙,装置V为防止尾气处理装置中的水蒸气进入装置Ⅳ中,装置Ⅵ为尾气吸收装置,据此分析解题.
解析 试题分析与解析见表2.
例题3 (原创试题)二氯化六氨合镍(Ⅱ)是一种化工试剂,化学式为[Ni(NH3)6]Cl2.某实验小组制备二氯化六氨合镍(Ⅱ)的实验如下:
已知:[Ni(NH3)6]Cl2易溶于冷水、稀氨水,不溶于浓氨水、乙醇、乙醚.
步骤Ⅰ:制备NiSO4(流程如图4所示)
步骤Ⅱ:制备[Ni(NH3)6]Cl2
反应的原理和实验装置图如5所示(夹持装置和搅拌装置略).
回答下列问题:
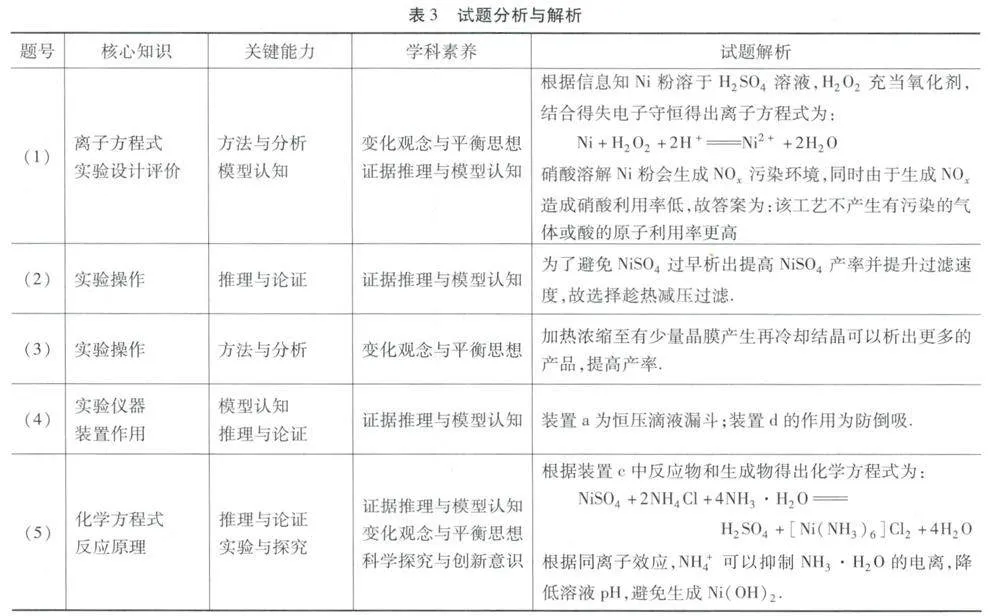
(1)Ni粉溶解反应的离子方程式为____,与传统的硝酸溶解Ni粉工艺相比该工艺的优点____(至少写出1条);
(2)为了提高NiSO4产率并提升过滤速度,操作a为____;
A.冷却结晶再过滤 B.趁热减压过滤
C.煮沸趁热过滤
(3)操作6加热浓缩至____,操作c为冷却结晶再过滤,依次用浓氨水、乙醇洗涤,空气中干燥得到NiSO4;
(4)装置a的名称____,装置d的作用____;
(5)装置c中生成[Ni(NH3)6]Cl2的化学方程式为____,加入NH4Cl的作用是降低NH3·H2O溶液的pH,避免生成Ni(OH)2,其原理为____(利用平衡理论解释).
解题策略分析 步骤Ⅰ:制备NiSO4,将3g Ni粉溶于15 mL 6 mol/L硫酸,再加入10 mL 30%的H2O2助溶,生成NiSO4溶液,趁热减压过滤除Ni粉,再蒸发浓缩、冷却结晶、过滤洗涤干燥获得NiSO4晶体,步骤Ⅱ:制备[Ni(NH3)6] Cl2,在三颈烧瓶内NiSO4溶液与浓氨水和NH4Cl反应生成[Ni(NH3)6]Cl2,装置b盛有稀硫酸溶液作用为吸收尾气NH3,装置d的作用为防倒吸,据此分析解题.
解析 试题分析与解析见表3.
三、关于综合实验复习的备考建议
首先要夯实实验基础,重视课本实验.课本上的18个化学实验都是对应章节知识的经典实验内容,是学生学习实验相关知识的重要阵地,历年高考中经常出现课本实验或以其衍生的实验;其次,注重培养学生建模意识,即建立起“实验目的→实验仪器→实验步骤→实验现象→评价与结论”的综合实验思维解题模型,借助模型逐条分析实验题;最后,要注意规范答题,提升化学表征能力,对于实验现象及实验操作的表述,方程式的书写,实验原理、反应原理的阐述上,要训练使用科学、规范、准确的化学用语.
(收稿日期:2024 - 05 - 28)
