从学科素养角度阐释2024高考中的氧族元素
2024-12-31孙晶





核心素养视角下的试题命制要以核心素养为测试宗旨,以实际问题为测试任务,以真实情境为测试载体,以化学知识为解决问题的工具,本文结合氧族元素及其化合物对核心素养中的“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”5个维度进行分述,以期与新高考命题的新思路接轨.
维度一 宏观辨识与微观探析
视角1:能从不同角度认识物质的多样性,并对物质进行分类.
视角2:能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念.
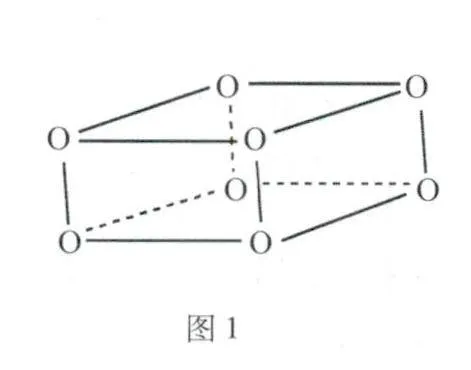
例题1 (2024.湖北卷)O2在超高压下转化为平行六面体的O8分子(结构如图1所示).下列说法错误的是( ).
A.O2和O8互为同素异形体
B.O8中存在不同的氧氧键
C.O2转化为O8是熵减反应
D.常压低温下O8能稳定存在
解析O2和O8是氧元素形成的不同单质,两者互为同素异形体,A项正确;O8分子为平行六面体,由其结构知,O8中存在2种氧氧键:上下底面中的氧氧键、上下底面间的氧氧键,B项正确;O2转化为O8可表示为:
4O =超高压 O8
气体分子数减少,故O2转化为O8是熵减反应,C项正确;O2在超高压下转化成O8,则在常压低温下O8会转化成O2,不能稳定存在,D项错误.答案:D
素养启迪 该题以新颖的视角、凝练的语言、直观的图形考查了最新合成的O8单质,考查了基本概念、物质结构、化学方程式的构建和对题意的领悟迁移能力,基础之中见能力,朴实之中显功力.
维度二 变化观念与平衡思想
视角1:能认识物质是运动和变化的,知道化学变化需要一定条件,并遵循一定的规律.
视角2:认识化学变化的本质是有新物质生成,并伴有能量的转化;认识化学变化有一定限度,是可以调控的.
视角3:能多角度、动态的分析化学反应,运用化学反应原理解决实际问题.
例题2 (2024.安徽卷)室温下,为探究纳米铁去除水样中SeO2-4的影响因素,测得不同条件下SeO2-4浓度随时间变化关系如图2所示.
下列说法正确的是( ).
A.实验①中,0-2h内平均反应速率v(SeO2-4)=2.0 mol·L-1·h-1
B.实验③中,反应的离子方程式为:2Fe+ SeO2-4+ 8H+=2Fe3+ + Se +4H2O
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始pH越小,SeO2-4的去除效果越好
解析 A.实验①中,0-2小时内平均反应速率v(SeO2-4)=(5.0×10-3-1.0×10-3)mol·L-1/2h=2.0×10-3mol·L-1·h-1,A不正确;B.实验③中水样初始pH =8,溶液显弱碱性,发生反应的离子方程式中不能用H+配电荷守恒,B不正确;C.综合分析实验①和②可知,在相同时间内,实验①中SeO2-4浓度的变化量大,因此,其他条件相同时,适当增加纳米铁质量可加快反应速率,C正确;D.综合分析实验③和②可知,在相同时间内,实验②中SeO2-4浓度的变化量大,因此,其他条件相同时,适当减小初始pH,SeO2-4的去除效果越好,但是当初始pH太小时,H+浓度太大,纳米铁与H+反应速率加快,会导致与SeO2-4反应的纳米铁减少,因此,当初始pH越小时SeO2-4的去除效果不一定越好,D不正确,答案:C
素养启迪 硒酸(H2SeO4)的性质与硫酸类似,但比硫酸酸性弱;亚硒酸(H2SeO3)的性质与亚硫酸类似,既具有氧化性,也具有还原性.以硫及其化合物的性质为知识原型,运用同主族元素性质具有相似性和递变性这一知识模型可以把碎片化的知识和内容变得厚实、完整和系统.
维度三 证据推理与模型认知
视角1:具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪.
视角2:建立观点、结论和证据的逻辑关系.
视角3:通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,从而建立模型.
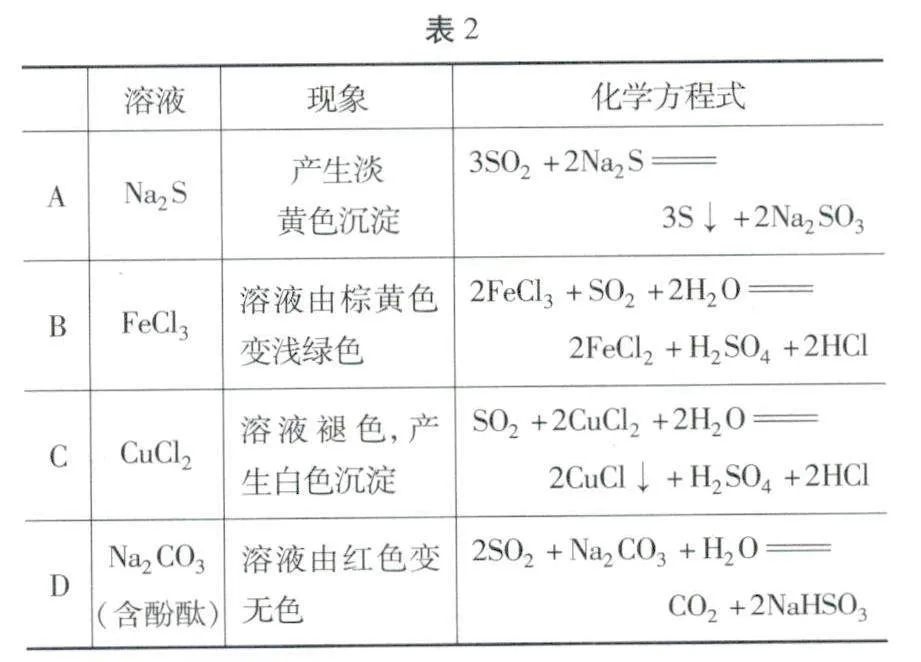
例题3 (2024·湖北卷)过量SO2与以下0.1 mol·L-1的溶液反应(见表2),下列总反应的化学方程式错误的是( ).
解析 过量SO2与0.1 mol·L-1的Na2S溶液反应,生成的淡黄色沉淀是S,还生成NaHSO3,SO2过量不能生成Na2SO3,因此,总反应的化学方程式为:SSO2 +2Na2S +2H2O =3S↓+4NaHSO3A错误;过量SO2与0.1 mol·L-1的FeCl2溶液反应,生成FeCl2、H2SO4、HCl,总反应的化学方程式为:2FeCl3 +SO2 +2H2O =2FeCl2 +H2SO4 +2HClB正确;过量SO2与0.1 mol·L-1的CuCl2溶液反应,生成的白色沉淀是CuCl,总反应的化学方程式为:SO2 +2CuCl2 +2H2O=2CuCl↓+H2SO4 +2HClC正确;Na2CO3水解使溶液显碱性,其水溶液能使酚酞变红;过量SO2与0.1 mol·L-1的Na2CO3溶液反应,生成CO2、NaHSO3,NaHSO3溶液显酸性,因此,溶液由红色变无色,总反应的化学方程式为:2SO2+ Na2CO3+ H2O =CO2 ↑+2NaHSO3.D正确.答案:A
素养启迪 过量二氧化硫与亚硫酸钠不共存,很容易判断A项错误;本题的易错选项是C项,学生若忽略CuCl2溶液中的Cu2+具有氧化性,对于CuCl是白色沉淀存在知识盲区,很容易落人命题陷阱,这就要求学生重点把握铜的变价性质及其构建Cu2+具有弱氧化性的知识体系,丰盈自己的知识储备,方可在高考中得心应手.
维度四 实验探究与创新意识
视角1:能发现和提出有探究价值的问题,能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究.
视角2:在科学探究中学会合作,面对“异常”现象敢于提出自己的见解.
例题4 (2024.黑吉辽卷)H2O2分解的“碘钟”反应美轮美奂,将一定浓度的3种溶液(①H2O2溶液;②淀粉、丙二酸和MnSO4混合溶液;③KIO3、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色,下列说法错误的是( ).
A.无色一蓝色:生成I2
B.蓝色一无色:I2转化为化合态
C.H2O2起漂白作用
D.淀粉作指示剂
解析分析该“碘钟”反应的原理:①在Mn2的催化下H2O2与IO3-反应生成I2,在淀粉指示剂的作用下溶液变蓝色;②生成的I2又会与H2O2反应生成IO3-,使溶液变回无色;③生成的I2可以与丙二酸反应生成琥珀色的ICH(COOH)2,溶液最终会变成蓝色.A.根据分析,溶液由无色变为蓝色说明有I:生成,A正确;溶液由蓝色变为无色,是将I:转化为IO3-,I2转化为化合态,B正确;H2O2在此过程中参加反应,不起到漂白作用,C错误;在此过程中,因为有I2的生成与消耗,淀粉在这个过程中起到指示剂的作用,D正确,答案:C.
素养启迪 过氧化氢既有氧化性又有还原性,在遇到不同的物质时,其性质随时而变,要建立起变化观念和证据推理的学科素养来看待双氧水的多重角色;同时要从价类二维观念建构氧气及其常见化合物的性质及其转化关系,如图3所示.
维度五 科学态度与社会责任
视角1:具有严谨求实的科学态度,具有探索未知、崇尚真理的意识.
视角2:赞赏化学对社会发展的重大贡献,具有可持续发展意识和绿色化学观念,能对与化学有关的社会热点问题做出正确的价值判断.
例题5 (2024.浙江高考1月卷)H2S可用于合成光电材料.某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图4所示,化学方程式为:
CaS+ MgCl2 +2H2O =CaCl2+Mg(OH)2+H2S↑
已知:①H2S的沸点是- 61℃,有毒;②装置A内产生的H2S气体中含有酸性气体杂质.
请回答:
(1)仪器X的名称是____.
(2)完善虚框内的装置排序:
A→B→_____→F→G
(3)下列干燥剂,可用于装置C中的是____.
A.氢氧化钾 B.五氧化二磷
C.氯化钙 D.碱石灰
(4)装置G中汞的2个作用是:
①平衡气压;②____.
(5)下列说法正确的是____.
A.该实验操作须在通风橱中进行
B.装置D的主要作用是预冷却H2S
C.加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S
D.该实验产生的尾气可用硝酸吸收
(6)取0.680 g H2S产品,与足量CuSO4溶液充分反应后,将生成的CuS置于已恒重、质量为31. 230 g的坩埚中,煅烧生成CuO,恒重后总质量为32. 814 g.产品的纯度为____.
解析 A作为H2S的发生装置,由于不能骤冷,所以D、E都是冷却H2S的装置,C装置干燥H2S,F冷却并收集H2S,G作为平衡气压和尾气处理装置.(1)仪器X的名称是圆底烧瓶;(2)制备气体的装置包括发生装置,除杂装置,收集装置和尾气处理,由于不能骤冷,要逐步冷却,所以B连E,E连C,C连D,D连F;(3)H2S是酸性气体,不可以用碱性干燥剂,所以不可以用氢氧化钾和碱石灰,故选BC;(4)装置G中汞的2个作用是:①平衡气压:②处理尾气H2S;(5)A.H2S有毒,该实验操作须在通风橱中进行,故A正确;B.气体不能骤冷,装置D的主要作用是预冷却H2S,故B正确;C.加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S,故C正确;D.该实验产生的尾气不可用硝酸吸收,硝酸的氧化性虽然可以把H2S氧化为S单质,但是稀硝酸产生的NO或者浓硝酸产生的NO2,会污染空气,故D错误;故选ABC. (6)氧化铜的质量为32. 814 g - 31. 230 g=1.584 g,则氧化铜物质的量为0. 0198 mol,根据铜元素守恒关系有:
CuS~Cu0
1 1
n 0. 0198 mol
硫化铜物质的量为0. 0198 mol,则H:S物质的量为0. 0198 mol,H2S的质量为0.6732 g,产品纯度为0.06732g/0.680×100% =99%.
答案:(1)圆底烧瓶 (2)E→C→D (3)BC
(4)处理尾气H2S (5)ABC (6)99%
素养启迪 1.从化合价角度理解硫化氢的还原性;硫及化合物转化关系如图5所示.
2.产品纯度或者物质含量计算的要点:根据元素质量守恒法、关系式法、得失电子守恒法等,求出混合物中某一成分的质量,再除以样品的总质量,即可得出其纯度或者百分含量.
(收稿日期:2024 -06 - 16)
