基于荧光探针技术检测粮油储运中的赭曲霉毒素A
2024-12-31杜瑞亭

摘 要:为实现粮油储运中真菌毒素的快速检测,本文建立基于荧光探针技术检测赭曲霉毒素A(Ochratoxin A,OTA)的荧光传感方法。通过制备硫化铜纳米颗粒(Copper Sulfide Nanoparticles,CuS NPs)以及在CuS NPs上修饰OTA单体克隆抗体(Antibody,Ab)形成硫化铜纳米颗粒-OTA单克隆抗体免疫信号标记物(CuS-Ab NPs)进行荧光检测,采用外标法定量。结果显示,OTA浓度在0.1~200.0 ng·mL-1线性关系良好,方法检出限为0.01 ng·mL-1,加标回收率为93.89%~109.96%,相对标准偏差为2.37%~5.12%。该方法检测灵敏度及准确性高、特异性好,适用于粮油储运中OTA的检测。
关键词:荧光探针技术;赭曲霉毒素A(OTA);加标回收率
Detection of Ochratoxin A in Grain and Oil Storage and Transportation Based on Fluorescence Probe Technology
DU Ruiting
(Hohhot Grain and Oil Quality Testing Center, Hohhot 010070, China)
Abstract: In order to realize the rapid detection of mycotoxins in grain and oil storage and transportation, a fluorescence sensing method based on fluorescence probe technology was established to detect ochratoxin A (OTA). Copper sulfide nanoparticles (CuS NPs) were prepared and OTA monoclonal antibody (Ab) was modified on CuS NPs to form copper sulfide nanoparticles-OTA monoclonal antibody immune signal marker (CuS-Ab NPs) for fluorescence detection, and external standard method was used for quantification. The results showed that the linear relationship of OTA concentration was good in the range of 0.1 ng·mL-1 to 200.0 ng·mL-1, the detection limit of the method was 0.01 ng·mL-1, the recovery rate was 93.89% to 109.96%, and the relative standard deviation was 2.37% to 5.12%. This method has high sensitivity, accuracy and specificity, and is suitable for OTA detection in grain and oil storage and transportation.
Keywords: fluorescent probe technology; ochratoxin A (OTA); spiked recovery rate
近年来,随着经济的快速发展以及生活水平的提高,人们对粮油质量的关注度日益增加[1]。绿色、无毒无害的食品不仅能够满足人们日常所需的营养膳食,且不会对人体造成任何伤害。然而,在粮油储运过程中,食品易受到真菌毒素、杀虫剂等物质的污染,对人们健康造成严重威胁[2]。因此,有必要采取有效的技术手段对粮油质量进行检测,从而确保粮油安全。粮油中最具代表性的毒素包括赭曲霉毒素A(Ochratoxin,OTA)、玉米赤霉烯酮毒素(Zearalenone,ZEN)、伏马毒素(Fumonisin,FB1)、呕吐毒素(Deoxynivalenol,DON)及黄曲霉毒素(Aflatoxin B1,AFB1)和T-2毒素等[3]。有研究发现,OTA与动物的肾毒性相关,并有可能造成动物肝脏受损[4],对人体健康产生极大威胁。目前,针对粮油中真菌毒素检测常用的技术手段包括色谱分析、传感器以及免疫分析[5]等。其中,基于荧光探针的检测技术具有灵敏度高、快速、样品消耗低等优点,但该方法在检测OTA的应用研究中鲜少报道。基于此,本文建立基于荧光探针技术检测粮油储运中OTA的方法,以实现真菌毒素的快速、高效检测。
1 材料与方法
1.1 材料及试剂
玉米、咖啡和大豆,购自某大型超市。
巯基乙酸,阿拉丁试剂有限公司;氯化铜,国药集团化学试剂有限公司;NaOH、浓硫酸,天津市风船化学试剂科技有限公司;硫代乙酰胺,天津博迪化工股份有限公司;戊二醛50%,天津市大茂化学试剂厂;2-吗啉乙磺酸,天津渤化化学试剂有限公司;N-N二甲基甲酰胺,北京金泰宏达生物科技有限公司;N-羟基琥珀酰亚胺、牛血清白蛋白,北京索莱宝科技有限公司。上述所有试剂均为分析纯。
标准品OTA(1 mg·mL-1)、ZEN(1 mg·mL-1)、FB1(5 mg·mL-1)、DON(5 mg·mL-1)、AFB1(10 mg·mL-1)和T-2毒素(10 mg·mL-1),北京坛墨质检科技有限公司;OTA单克隆抗体(5 mg·mL-1)、抗原(4 mg·mL-1),山东绿都科技有限公司。实验中所用水均为超纯水。
1.2 实验仪器
S210 pH计、AL240电子天平,瑞士梅特勒-托利多公司;MK3酶标仪、F1微量移液器、Nicolet iS50傅里叶变换红外光谱仪,美国赛默飞世尔公司;DHG-9245A恒温培养箱,上海恒科仪器有限公司;F97Pro荧光分光光度计,上海棱光技术有限公司;Mili-Q纯水系统,美国Millipore公司;LS13320激光粒度,美国贝克曼库尔特公司;JEM-2100F扫描电镜、D/max 2500 X射线衍射仪,日本理学株式会社。
1.3 实验方法
1.3.1 纳米颗粒及免疫信号标记物的制备
(1)硫化铜纳米颗粒(Copper Sulfide Nanoparticles,CuS NPs)的制备。在100 mL超纯水中加入1.705 g CuCl2·2H2O和13.85 mL巯基乙酸,混合搅拌30 min,加入浓度为20 mg·mL-1的NaOH溶液,使溶液的pH值达到9.0。然后,加入0.751 g硫代乙酰胺,在50 ℃条件下反应6 h并通入N2,以充分去除氧气。最后用超滤离心管离心洗涤3次,并将其分散于超纯水中,制备得到CuS NPs。
(2)硫化铜纳米颗粒-OTA单克隆抗体免疫信号标记物(CuS-Ab NPs)的制备。分别取100 μL浓度为32 mg·mL-1的N-羟基琥珀酰亚胺和浓度为20 mg·mL-1的N-N二甲基甲酰胺(用2-吗啉乙磺酸缓冲液配制,pH=5.5)溶液,与1 mL CuS NPs悬浮液混合,活化CuS NPs表面的羧基,在25 ℃条件下反应2 h,离心后去除上清液,再将1 mL浓度为220 μg·mL-1的OTA单克隆抗体加入其中,于4 ℃下振荡孵育12 h,离心。最后用磷酸盐缓冲液(PBS)洗涤3次,制备得到CuS-Ab NPs。
1.3.2 定量检测方法及标准曲线的绘制
①对黑色聚苯乙烯微孔板的表面用200 μL浓度为2.5%的戊二醛(PBS缓冲液溶解)氨基活化2 h,之后使用PBS洗涤3次;②在活化后的微孔板上加入50 μL浓度为30 μg·mL-1的OTA抗原,37 ℃孵育2 h以固定OTA抗原,用PBS缓冲液洗涤3次后,再加入120 μL浓度为5%的牛血清白蛋白溶液,再次用PBS缓冲液洗涤3次;③将50 μL浓度为0.7 mg·mL-1的CuS-Ab NPs和不同浓度的OTA加入到固定有OTA抗原的微孔板中,37 ℃反应60 min,并用PBS缓冲液洗涤3次;④为溶解CuS-Ab NPs免疫标记物的Cu2+,将200 μL浓度为0.1 mol·L-1的盐酸溶液加入到微孔板中,于37 ℃下振荡反应30 min;⑤加入5 μL浓度为0.5 mg·mL-1的铜离子荧光探针继续振荡45 min,进行荧光检测。实验中,用PBS缓冲液将OTA的标准品稀释为不同浓度梯度(0.1 ng·mL-1、1.0 ng·mL-1、10.0 ng·mL-1、100.0 ng·mL-1和200.0 ng·mL-1)的OTA,并依据相应的荧光强度来绘制标准曲线。
1.3.3 特异性实验
在检测中可能存在被多种真菌毒素污染的现象,因此选取AFB1、DON、ZEN、FB1以及T-2毒素等干扰物质进行特异性实验。这些毒素与OTA单克隆抗体相结合时,会发生假阳性。在实验中,选取OTA浓度为1 ng·mL-1,其他毒素浓度为10 ng·mL-1,进行3次平行实验。
1.3.4 样品前处理方法
分别称取1 g大豆面、玉米面和咖啡面置于5 mL离心管中,加入2 mL浓度为10 ng·mL-1的OTA标准液,漩涡振荡5 min,然后在转速为10 000 r·min-1条件下离心15 min,取上清液,并过0.45 μm微滤膜,最后用PBS缓冲液稀释。
2 结果与分析
2.1 实验条件的优化
2.1.1 CuS-Ab NPs浓度的优化
通过研究不同浓度CuS-Ab NPs对应荧光强度的变化,可知CuS-Ab NPs浓度为0.5~0.7 mg·mL-1时,其对应的荧光强度随CuS-Ab NPs浓度的增大而增强;当浓度在0.7~0.9 mg·mL-1时,其对应的荧光强度基本不变。因此,选择CuS-Ab NPs浓度为0.7 mg·mL-1进行后续实验。
2.1.2 OTA抗原浓度的优化
通过研究不同OTA抗原浓度下荧光强度的变化,可知OTA抗原浓度为10~30 μg·mL-1时,荧光强度随OTA抗原浓度的增加而增强;当OTA抗原浓度为30~50 μg·mL-1时,荧光强度保持不变。因此,选择OTA抗原浓度为30 μg·mL-1进行后续实验。
2.1.3 反应时间的优化
通过研究不同反应时间对荧光强度的影响,可知在20~60 min,Cu2+探针发生开环导致水解反应产物逐渐增多,且荧光强度增大;当反应时间超过60 min后,CuS-Ab NPs和OTA抗原的浓度、荧光强度均降低。因此,选择反应时间为60 min进行后续实验。
2.2 标准曲线的绘制
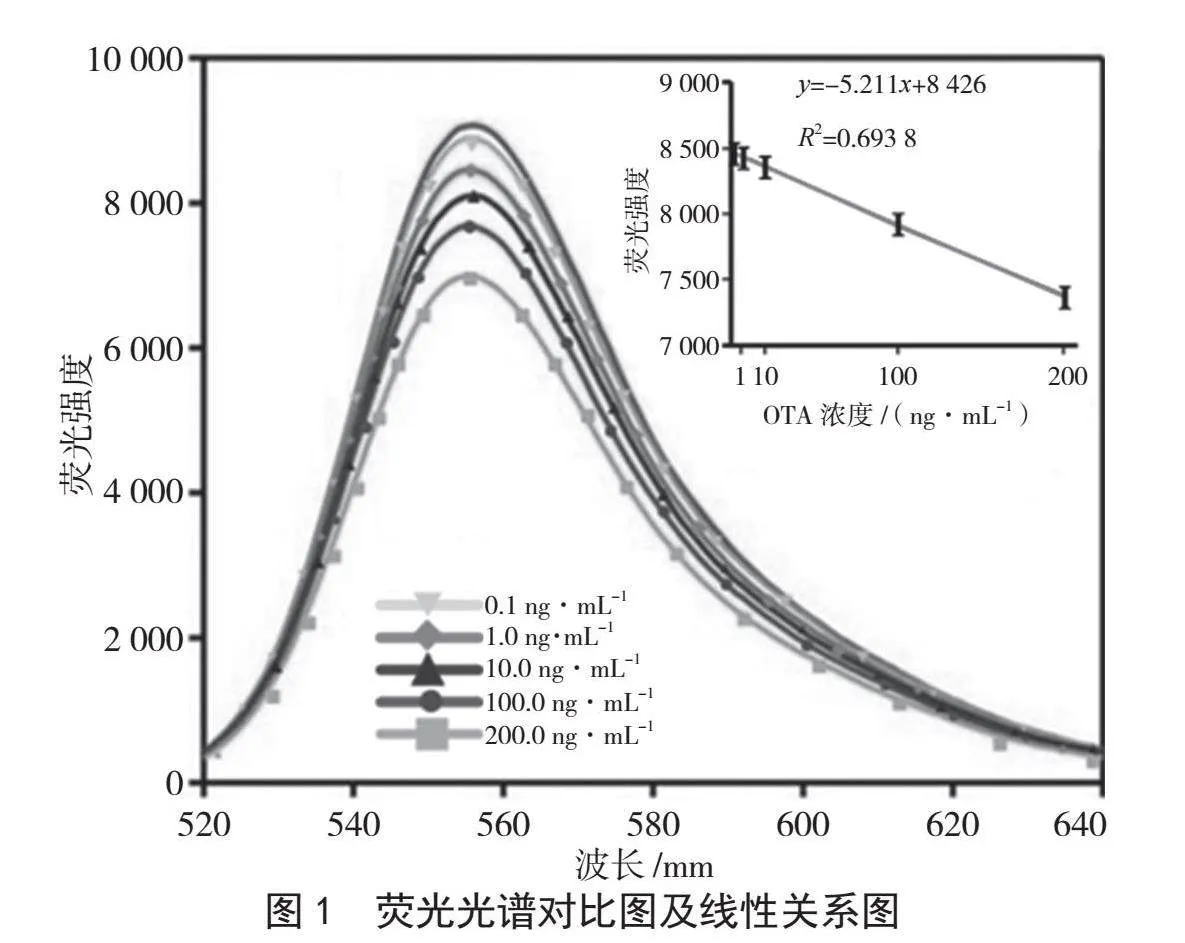
按照1.3.2项所示方法,进行荧光检测,发现目标产物在495 nm激发光极下发出508~650 nm的发射光,且与荧光强度成正比,荧光强度在554 nm处达到峰值。因此,选取在554 nm荧光强度下对OTA进行定量检测,结果如图1所示。以OTA浓度为横坐标,以其对应的荧光强度为纵坐标,建立标准曲线,线性方程为y=-5.211x+8 426,相关系数为R2=0.693 8,表明OTA浓度在0.1~200.0 ng·mL-1线性关系良好。
2.3 检出限
以3倍信噪比(S/N=3)对应的浓度为检出限,计算得到检出限为0.01 ng·mL-1,表明该方法能够实现对粮油样品中OTA的快速检测,且灵敏度高。
2.4 特异性实验
为验证基于荧光探针检测粮油中毒素OTA的特异性,选取1.3.3项中提到的5种毒素作为干扰物质,测定结果如图2所示。图2中,纵坐标为空白对照组(F0)/实验组(F)。当只加入OTA时,F0/F值最大;当加入5种干扰物时,F0/F值较小且相差较小,表明干扰物质不能与OTA结合。结果表明,OTA和抗体间具有高结合作用,特异性良好。
2.5 加标回收实验
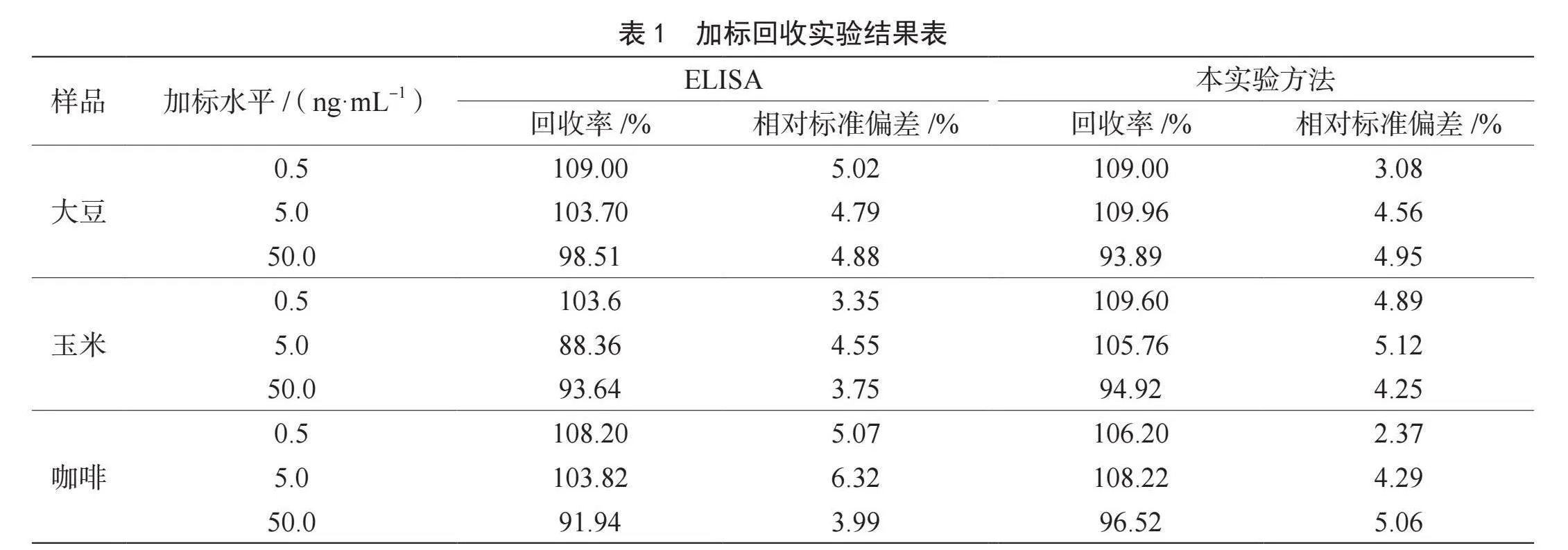
选取被OTA污染的玉米、大豆和咖啡按照本研究中建立的方法进行检测,以研究基于荧光探针技术对粮油中真菌毒素检测的适用性。同时,采用传统的酶联免疫吸附方法(Enzyme-Linked Immunosorbent Assay,ELISA)进行对比,结果如表1所示。
由表1可知,在0.5 ng·mL-1、5.0 ng·mL-1和50.0 ng·mL-1的加标水平下,按照ELISA法测定不同样品中OTA的加标回收率为88.36%~109.00%,而按照本研究中建立方法所测定的结果为93.89%~109.96%;ELISA方法计算得到相对标准偏差为3.35%~6.32%,而基于本研究中建立方法的结果为2.37%~5.12%。对比可知,两种方法结果基本保持一致,表明基于荧光探针技术对粮油中OTA含量的检测结果准确性较高。
3 结论
本文建立了一种基于荧光探针技术检测OTA的荧光传感方法。结果表明,OTA浓度在0.1~200 ng·mL-1线性关系良好,方法检出限为0.01 ng·mL-1,加标回收率为93.89%~109.96%,相对标准偏差为2.37%~5.12%。该方法检测灵敏度及准确性高、特异性好,适用于粮油储运中OTA的检测。
参考文献
[1]李群,牛瀚璐,张胜男.气相色谱技术在粮油食品质量检测中的应用[J].中国食品工业,2024(12):103-105.
[2]宗振,孙森森,陈晨.粮油检验在粮油储存安全中的重要性探索[J].山西农经,2021(10):176-177.
[3]李文廷,叶沛,刘玲,等.粮食作物中真菌毒素脱毒技术及其防控措施研究进展[J].粮食与油脂,2024,37(9):1-7.
[4]杜瑞亭.动态微波辅助技术在粮食真菌毒素和农药残留识别中的应用[J].现代食品,2024,30(12):170-172.
[5]黄力,杨静,李滑滑.不同前处理方法对粮油中黄曲霉毒素B1检测效果对比[J].中国粮油学报,2022,37(1):182-186.
