一种用于防治花椒根腐病复合微生物菌剂GF-1的制备
2024-12-31田凤鸣陈强何九军张晓娜王国斌

关键词:花椒;根腐病;微生物菌剂;生物防治
作为甘肃省花椒主产区的陇南市,近年来花椒产量不断提升,2023年花椒花椒产量4.7万吨,比2022年增长7.8%.随着花椒种植面积的不断扩大和产业的快速发展,研究花椒病害防治也越来越受到学者的重视.其中花椒根腐病是一种严重威胁花椒品质和产量的土传病,病害发生时可使花椒产区90%以上的树体染病,导致树势衰弱而死亡,产量下降50%以上[1].为了进一步明确陇南花椒根腐病的发病因素,田凤鸣等人获得了陇南花椒根腐病病原菌腐皮镰孢菌(Fusariumsolani)[2],结果与朱天辉和陈第文[3]、李智敏等[4]、李志克等[5]和阮钊等[6]分别对四川汉源、云南昭通、四川茂县和陕西凤县花椒根腐病植株中分离得到的病原菌一致.
化学防治是花椒根腐病防治的主要方式,在实际生产中普遍存在椒农重视化学农药的治疗而忽略生物预防的现象,化学农药的过度使用造成问题日益严重[7],因此开发利用花椒根腐病的生防资源实现绿色防治显得尤为重要.郭志斌等[8]研究发现:淡紫拟青霉(Paecilomyceslilacinus)的发酵液对花椒根腐病菌的抑制作用良好.李姝江等[9]从花椒根际土壤中分离到蜡样芽孢杆菌(Bacilluscereus)B3生防菌,并对其进行突变菌株筛选,最终得到对花椒根腐病有抑制作用且耐链霉素300mg/L的突变菌株,突变株的发酵液具有很好的生防效果.田凤鸣等人发现:用绿色木霉和哈茨木霉按照1∶1的比例复配后对腐皮镰刀菌的抑制率高达88%[10],并从陇南花椒根际土壤中分别分离到3株生防菌株:贝莱斯芽孢杆菌(Bacillusvelezensis)T-1[11]、贝莱斯芽孢杆菌(Bacillusvelezensis)W-1[12]和枯草芽孢杆菌W-5[13],对花椒根腐病病原菌的抑制率分别为70%、89%和82%.卓平清等[14]从健康花椒根部土壤中分离筛选出一株腐皮镰刀菌较高拮抗作用的细菌KS-16,经鉴定为多粘类芽孢杆菌(Paenibacilluspolymyxa),对病原菌的抑制率为53.6%.丁俊园等[15]研究发现:生防菌贝莱斯芽孢杆菌P87的发酵滤液对花椒根腐病菌的抑菌活性可达70.86%.李梦玮等[16]从花椒侧根中筛选得到一株植物内生菌草酸青霉(Peniciliumoxalicum),其盆栽试验对花椒根腐病的防效达56%以上.随着国内外对土壤微生物的深入研究,发现了根际土壤微生物巨大的应用潜力,在农业绿色防控和化学药剂的减施增效方面表现的尤为突出,是微生物农药和微生物肥料中的主要菌种来源[17].
微生物菌剂具有改善土壤微生物群落结构、抵御植物病害、增加土壤肥力、减少化肥和农药使用、提质增产、提高食品安全等特点,是一种环境友好型的绿色环保肥料,是一条重要的实现农业可持续化发展途径[18-20].单一微生物菌剂相比复合微生物菌剂存在功能单一、适应能力差等问题.将不同功能菌株混合培养后获得更强、更稳定的微生物复合菌剂,是未来发展微生物菌剂的趋势[21].近年来越来越多的功能型微生物复合菌剂已研制成功.Siddiqui等[22]将两种菌根瘤菌(Rhizobia)和荧光假单胞菌(Pseudomonasfluorescens)复配,研制出的复合菌剂在防治豌豆枯萎病中表现出了良好的效果.王文丽等[23]将链霉菌WL-3和WL-4进行复配,复合菌剂处理对番茄有显著的促生作用,对单发青枯病、根结线虫防效分别为75%、53.57%,对二者复合病害防效达60%.乔柳等[24]将细菌SR13-2、HT-6、ST-1、W-7和放线菌Sy115种菌进行复合发酵,培养后的菌液对致病疫霉菌丝生长和孢子囊萌发的抑制作用显著优于其中抑菌效果最为突出的单一菌株HT-6;进一步发现5种菌的复合发酵菌液在马铃薯离体组织和盆栽植株上对晚疫病的防效也显著优于HT-6单一菌株的效果.
目前关于腐皮镰孢菌引起花椒根腐病的生物防治研究方面也只是单一菌株的研究与开发[18],而对于利用不同菌株进行复配来提高花椒根腐病生防效果的研究尚未见.本研究拟在前期试验的基础上对已筛选出的贝莱斯芽胞杆菌T-1、贝莱斯芽胞杆菌W-1和枯草芽胞杆菌W-5进行复配,对其最佳配方进行研究并测定复合菌剂对病原菌的抑菌效果和广谱抑菌效果,以期为花椒根腐病的生防菌资源的深入研究和开发提供科学依据.
1 材料与方法
1.1 供试菌种
3种生物拮抗菌贝莱斯芽孢杆菌T-1[11]、贝莱斯芽孢杆菌W-1[12]和枯草芽孢杆菌W-5[13]是前期试验中分离于健康花椒根系土壤,花椒根腐病病原菌腐皮镰孢菌分离于患病花椒根部,以上试验菌均已进行形态学和分子生物学鉴定,保存于研究组实验室.
1.2 主要培养基
PDA培养基:马铃薯200.0g/L,葡萄糖20.0g/L,琼脂15.0~20.0,摇动容器直至溶质溶解,用离子水定容至1L,103.4kPa灭菌21min后倒平板.
LB培养基:胰蛋白胨10.0g/L,酵母提取物5.0g/L,NaCl10.0g/L,5.0mol/LNaOH调pH值至7.0,去离子水定容至1L,103.4kPa灭菌21min.
NYBD培养基:酵母浸粉5.0g/L,牛肉浸粉8.0g/L,葡萄糖10.0g/L,调pH值至7.5,加蒸馏水至1L.
1.3 主要试剂及仪器设备
孔雀石绿染色液和番红O染色液(北京索莱宝科技有限公司);气浴式摇床(常州高德仪器制造有限公司);立式压力蒸汽灭菌器(上海申安医疗器械厂),台式高速离心机(湖南湘仪),722N可见分光光度计(上海仪电分析仪器有限公司产品),超净工作台(苏州净化设备有限公司)
1.4 试验方法
1.4.1 生防菌间的拮抗作用
将需检测的三株花椒根腐病拮抗菌W-1、W-5和T-1分别接种于LB琼脂培养基上,在32℃恒温培养箱中倒置培养48h,根据生长程度来判断生防菌间是否存在拮抗作用.
1.4.2 芽孢率的测定
采用Scharffer-Fulton法进行芽孢率的测定:在载玻片上滴加一滴无菌水,将培养好的生防菌用无菌接种环取菌,制成适当厚度的细菌涂片,自然干燥,快速通过火焰外焰4次来加热固定.在固定好的载玻片上滴加适量孔雀石绿染色液于涂片上染色10min,同时水洗至无明显染色液脱出.然后滴加番红O染色液进行复染约2~3min,水洗至无染液脱出为止.待干后油镜观察,菌体呈红色,芽孢呈绿色.每个样品取3个视野计数,在油镜视野下计数芽孢的个数及总体菌数.直到芽孢率达80%停止发酵(芽孢率=芽孢数/总菌数×100%)
1.4.3 复合生防菌发酵浓缩液的制备
在前期试验中通过响应面法确定了生防菌的最佳发酵条件[25,12-13],以最优的发酵条件培养生防菌,且直到发酵液中的芽孢率达到80%时停止发酵,将3种生防菌发酵液按照1∶1∶1的比例混合,4000r/min转速离心15min,使得浓缩液的活菌量达到2.0×108CFU/mL备用.
1.4.4 载体的筛选及母粉的制备
称量30g载体置于烧杯中,将浓缩好的发酵液倒入盛有载体的烧杯中,同时用玻璃棒不断地进行搅拌,观察到烧杯中不结块且无流水时停止发酵液的加入,记录好浓缩液的使用量,用v做标记,每个载体样本重复3次,计算载体的最大吸附量,用H标记.将加好浓缩液的载体,在室温吸附2h,32℃恒温干燥箱中直至烘干,粉碎机烘干成粉末后作为母粉测定其活菌数,每个处理重复3次.载体的筛选以吸附量和活菌数作为筛选指标,吸附量的计算式为:H=v/m,其中v为发酵液的使用量(L),m为载体质量(g)
1.4.5 分散剂的筛选
以试验方法1.4.4中筛选到的最佳载体为基础,以5%的增加量将聚乙烯醇、吐温80、羧甲基纤维素钠、十二烷基硫酸钠、木质素磺酸钠分别与同等质量的母粉混合均匀,每个处理重复3次,测定复合菌剂的活菌量,筛选最佳分散剂.
1.4.6分散剂用量的筛选
将试验方法1.4.5中筛选的最佳分散剂按2%、4%、6%、8%、10%、12%、14%、16%的增加量与同等质量的复合菌剂混匀,测定复合菌剂的活菌量,筛选最佳分散剂用量,每个处理重复3次.
1.4.7 紫外保护剂的筛选
以上述的复合菌剂作为基础,以5%的增加量分别将海藻酸钠、羧甲基纤维素、糊精添加到复菌剂中,置于超净工作台距紫外灯管(UVC200-280nm,100μW/cm2)15cm处的正下方照射30min,以不加保护剂作对照,测定对照组和处理组的活菌量,每个处理重复3次.
1.4.8 紫外保护剂用量的筛选
在以上复合菌剂的基础上,将筛选最佳紫外保护剂按2%、4%、6%、8%、10%、12%的增加量与同等质量复合菌剂混合均匀,采用1.4.7中的方法进行处理,测定复合菌剂的活菌数,每个处理重复3次.
1.5 复合菌剂的质量检测及生防效果测定
1.5.1 复合生防菌粉有效活菌数的测定
有效活菌数测定参照GB20287-2006的方法:精确称取1g复合菌剂,置于20mL无菌水三角瓶中,将灭好菌的玻璃珠加入三角瓶,室温静置20min后,30ºC摇床200r/min充分振荡混匀30min,即成母液菌悬液.将上述悬液用移液器移取1mL置于10mL的灭菌离心管中,加入9mL的无菌水混匀,以无菌水进行10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8梯度稀释,以后面三个梯度为样品,分别用移液枪取0.1mL涂布到琼脂计数培养基(NA)中,在恒温培养箱30℃培养24h后,单菌落出现时计算菌落数,每个梯度3个重复.
1.5.2 复合生防菌粉水分的测定
水分的测定参照GB20287-2006的方法:将带盖铝盒置于105℃±2K干燥箱中烘干至恒重,带盖铝盒冷却30min后称量并记录质量m0.然后称取样品2g(精确到0.01g),每份样品设置三个平行样,分别加入铝盒中后称重并记录质量m1.将装有样品的铝盒按照上述方法进行烘干,6h后至恒重后取出,冷却30min后称重记录质量m2.水分含量计算为:ω(%)=(m1-m2)(m1-m0)×100%.
1.5.3 复合生防菌粉pH值的测定
pH值的测定参照GB20287-2006方法:将复合菌剂称取1g置于灭菌的烧杯中,按照1∶5的比例加入无菌水,玻璃棒搅拌均匀后,室温静置30min后测样品悬液的pH值,做3次平行.
1.5.4 复合生防菌粉广谱抑菌测定试验
采用平板对峙法:将直径为6mm病原菌菌饼腐皮镰孢菌、梅毒镰刀菌、松针刺盘孢菌、禾谷镰刀菌、核桃炭疽病置于PDA固体培养基中央,距离病原菌菌饼2cm处接种复合菌剂,28℃恒温培养5天后测定各病原菌菌丝直径,设置3个平行.计算:抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)×100%.
1.5.5 不同稀释倍数复合生防菌粉对花椒根腐病病原菌菌丝的抑制效果
称取1g复合菌剂溶解于10mL的无菌水中混匀,用无菌水稀释500、1000、2000的倍数,取0.1mL的混匀液涂布于PDA培养基上,再在培养基中央接入6mm花椒根腐病菌饼,然后测定其抑制率.
1.6 数据统计分析
数据用SPSS18.0软件进行分析处理.
2 结果分析
2.1 生防菌间的拮抗作用测定
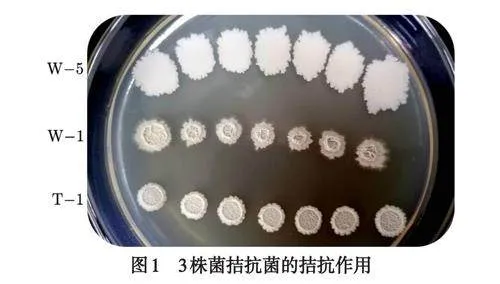
三株生防菌间的拮抗作用测定结果显示:拮抗菌W-1、W-5和T-1在LB固体琼脂培养基上生长状态良好,相互之间没有出现拮抗作用,可用于复合菌剂的相互混合使用(如图1).
2.2 载体吸附能力的测定及载体的筛选
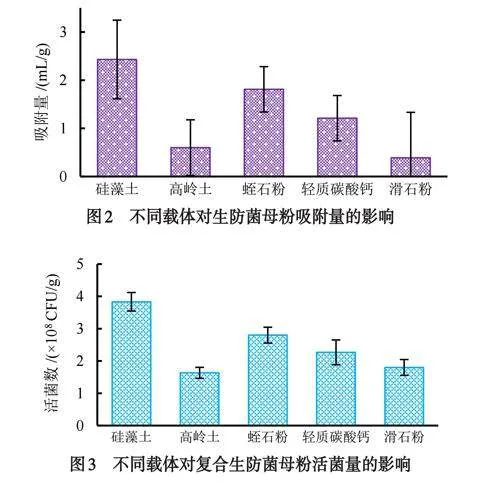
对5种载体(硅藻土、蛭石粉、轻质碳酸钙、高岭土、滑石粉)的吸附效果和不同载体对复合发酵液活菌量的影响进行测定的结果表明,载体对复合发酵液的吸附能力依次是:硅藻土gt;蛭石粉gt;轻质碳酸钙gt;高岭土gt;滑石粉,硅藻土的吸附量高达2.48mL/g,而滑石粉的吸附能力最差,为0.39mL/g(图2).将各载体制备的母粉干燥研磨粉碎后测定其活菌数,结果表明:硅藻土制备的载体活菌数最高,为3.83×108CFU/g,高岭土活菌量最低,仅为1.63×108CFU/g(图3).综合考虑载体的吸附效果及所含活菌量,选择硅藻土作为生防菌粉剂GF-1的载体.
2.3 分散剂的筛选
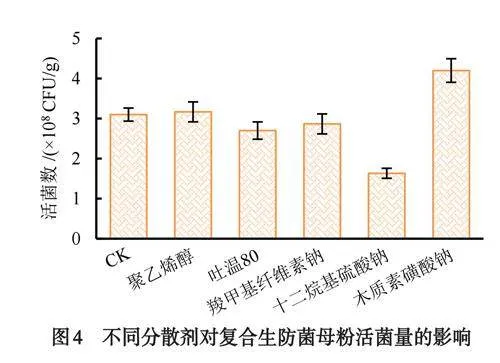
将5种不同的分散剂(聚乙烯醇、吐温80、羧甲基纤维素钠、十二烷基硫酸钠、木质素磺酸钠)分别加入以硅藻土为载体的复合母粉中测定不同分散剂对复合菌剂GF-1的活菌数量.结果表明:聚乙烯醇和木质素磺酸钠效果较好(如图4),活菌数量均高于对照组CK,其中木质素磺酸钠效果最佳,活菌量最高达4.20×108CFU/g,显著高于母粉对照组活菌量3.10×108CFU/g;聚乙烯醇效果次之,活菌量达3.17×108CFU/g,与母粉对照组差异不显著;吐温80、羧甲基纤维素钠、十二烷基硫酸钠效果较差,其所含活菌量均低于母粉对照组.综上考虑,选择木质素磺酸钠作为生防菌GF-1粉剂最佳分散剂.
2.4 复合菌剂GF-1分散剂用量的筛选
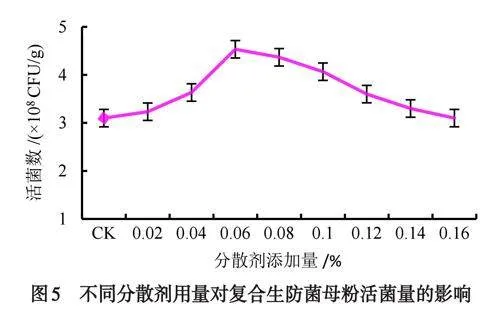
以木质磺酸钠作为复合菌剂的分散剂,对其增加量进行了筛选,由图5可知,随着木质磺酸钠用量的增加,生防菌GF-1母粉活菌量逐渐提高.当木质磺酸钠增加量为母粉的6%时,母粉活菌量最高达4.53×108CFU/g,当增加量超过母粉的6%时,其母粉活菌量逐渐下降,增加量在4%~12%之间,其母粉的活菌数均高于对照组.从节约成本考量,选择6%木质磺酸钠为复合菌剂GF-1的最佳增加量.
2.5 紫外保护剂的筛选
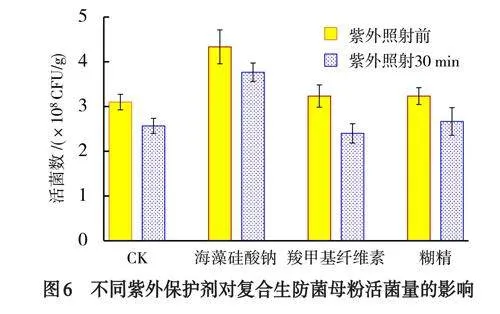
以3种紫外保护剂(海藻酸钠、羧甲基纤维素、糊精)作为筛选对象,测定对复合菌剂活菌数的影响.结果表明(图6):复合菌剂在未经紫外照射处理时,添加海藻酸钠的菌剂所含活菌量高于羧甲基纤维素、糊精及处理组,达4.33×108CFU/g;在经30min的紫外照射后,添加了3种紫外保护剂的复合菌剂的活菌数菌出现下降的现象,在单处理组中,海藻酸钠的活菌数依然高于其他紫外保护剂和对照组,达3.76×108CFU/g.综上考虑,选择海藻酸钠为复合生防菌粉剂GF-1最佳的紫外保护剂.
2.6 紫外保护剂用量的筛选
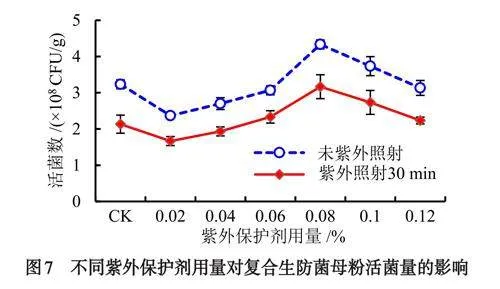
以海藻酸钠为最佳的紫外保护剂的基础上对其增加量进行了研究,结果表明(图7):在未经紫外照射处理时,随着海藻酸钠用量的增加,混合制剂的活菌量也逐渐增加;当海藻酸钠用量8%时,混合制剂的活菌量达最高,为4.33×108CFU/g,在8%~10%之间均高于其他增加量的处理组和对照组;在30min紫外照射处理后,随着海藻酸钠用量的增加,混合制剂的活菌量呈逐渐递增趋势;当用量8%时,混合制剂的活菌量达最高,为3.17×108CFU/g,与对照组制剂和其他处理组的制剂相比,其活菌数达到最高,效果最佳,因此,复合菌剂紫外保护剂的用量以8%的增加量为最佳效果.
2.7 复合菌剂GF-1的质量检测
以最佳载体、最佳分散剂、最佳紫外保护剂和混合发酵液混匀制成复合生防菌剂.该菌剂的自然状态为粉剂、无结块、无聚集、颜色为淡黄色(如图8).复合生防菌剂的质量指标的测定结果见表2.
2.8 复合生防菌剂的广谱抑菌测定
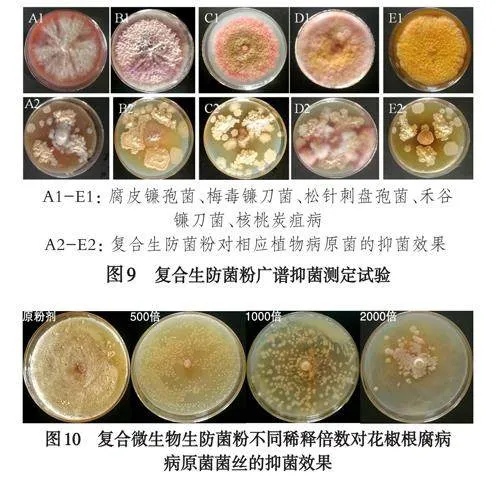
经平板对峙法测定复合菌剂的广谱抑菌实验显示:复合菌剂对供试的5种植物病原菌均表现出良好抑菌效果(如图9),对腐皮镰孢菌、梅毒镰刀菌、松针刺盘孢菌、禾谷镰刀菌、核桃炭疽病病原菌菌丝的抑制率分别为83.3%、79.3%、74.7%、89%、83.7%.以上结果表明:复合菌剂良好的抑菌效果,可用于后续的生产实践.对复合菌剂进行不同倍数的稀释后测定对花椒根腐病腐皮镰孢菌的抑菌效果(图10),发现复合菌剂的原粉剂、500倍的稀释、1000倍的稀释均能完全抑制住病原菌菌丝的生长,2000的稀释倍数使病原菌菌丝的抑制率在95%以上.
3 讨论
为了确保复合生防菌剂的防治效果,本研究对复合菌剂GF-1进行了最佳载体、分散剂和紫外保护剂的筛选.将硅藻土作为复合菌剂的最佳载体,这与贺振宁等[26]、应万里[27]、朱海霞等[28]分别对枯草芽孢杆菌B1514可湿性粉剂载体、解淀粉芽孢杆菌GZ-5菌株可湿性粉剂最佳载体和制备内生菌株HL-1可湿性粉剂的载体筛选结果一致.与蛭石粉、轻质碳酸钙、高岭土、滑石粉载体相比,复合菌液与载体硅藻土的相容性更好.据研究发现,硅藻土有着丰富的资源且价格低廉,因其结构疏松多孔,具有良好的吸附性,为生防菌的生存环境提供良好的空间[29].在微生物菌剂研制中硅藻土有着广泛的应用价值.
除此之外,本研究对复合菌剂的助剂也进行了筛选.发现木质磺酸钠为最佳分散剂,分散剂的添加进一步防止了菌粉凝聚结块,同时提高了菌粉的均匀程度和分散性.木质素类分散剂具有价格低廉来源广、良好的分散性能等优势,在国内外均有大量的研究与应用[28].生防菌剂富含有效菌受室外紫外线的干扰,筛选最佳的紫外保护剂对菌剂的活性十分重要.本研究选取海藻酸钠作为复合生防菌粉剂GF-1的紫外保护剂.同时对其用量进行了初步筛选,最终获得复合生防菌粉剂GF-1的配方为:载体为硅藻土,按吸附量2.48mL/g,制备母粉,烘干粉碎,以母粉的增加量分别添加分散剂(木质磺酸钠)6%和紫外保护剂(海藻酸钠)8%.
本研究对粉剂质量进一步检测,确定其使用的有效性和稳定性.根据初步筛选的配方制备的复合生防菌粉剂GF-1,其活菌量达到3.17×108CFU/g超过农用微生物菌剂的国家标准2.0×108CFU/g.
pH值作为微生物菌剂有效活菌数生存的重要环境条件之一,过高或者过低均会加速有效活菌的死亡,在复合生防粉剂GF-1中检测到的pH值为6.75,该值在农用微生物菌剂国家标准规定微生物菌剂pH的范围之内,这说明本文研制的复合生防粉剂GF-1的pH值是符合三种拮抗菌生长要求的.同时试验还测定出了复合生防粉剂GF-1的水分含量为0.25%,该菌剂的水分含量达到GB20287-2006农用微生物菌剂国家标准,但该菌剂水分含量远低于国家标准,是否会对菌剂中复合生防粉剂GF-1有效活菌数造成影响,还需进一步研究.
本研究最后采用平板对峙试验,初步研究了复合生防粉剂GF-1的生防效果,结果显示该复合菌剂具有较为广泛的抑菌活性,且在稀释2000倍时对花椒根腐病致病菌腐皮镰孢菌抑菌率达到95%,进一步验证了粉剂的生防效果.复合生防粉剂GF-1在未来花椒生产中具有较好的应用潜力,可进一步的推广试用.
