紫薇种子无菌萌发与快繁技术研究
2024-12-20闫娜王春彦华雨欣何岭



摘要 以花瓣深粉红色的紫薇品种“彩霞满天”(Lagerstroemia indica ‘Caixia Mantian’)的自然结实种子为试验材料,建立种子无菌萌发体系,以试管苗探索基本培养基类型、植物生长调节剂种类及浓度对不定芽增殖和根系诱导的影响,筛选出无菌苗“一步法”增殖、生根培养基。结果表明:紫薇种子无菌萌发最佳消毒方案为先用75%乙醇消毒2 min后,用2.5% NaClO消毒5 min;相同灭菌方案下接种于WPM培养基的紫薇较接种于MS的紫薇褐化率总体偏少,且较接种于1/2MS和MS中无菌萌发苗的茎粗壮且叶色浓绿;筛选出紫薇“一步法”增殖、生根最佳培养基为WPM+6-BA 1.5 mg/L+IBA 0.05 mg/L,试管苗叶色浓绿,增殖系数达到3.09,平均芽长为5.21 cm,平均生根率达75.00%,单株平均生根数为2.78。
关键词 紫薇;无菌萌发;离体培养;继代增殖
中图分类号 S 722 文献标识码 A 文章编号 0517-6611(2024)23-0118-04
doi:10.3969/j.issn.0517-6611.2024.23.025
Study on Aseptic Germination and Rapid Propagation of Lagerstroemia indica Seeds
YAN Na, WANG Chun-yan, HUA Yu-xin et al
(Jinling Institute of Technology, Nanjing, Jiangsu 210038)
Abstract In this study, the naturally fertile seeds of Lagerstroemia indica ‘Caixia Mantian’ with dark pink petals were used as test material to establish the seed aseptic germination system, the effects of basic medium type, plant growth regulator type and concentration on adventitious bud proliferation and root induction were explored with test-tube seedlings, and the one-step breeding and rooting medium of bacteria-free seedlings was screened. The results showed that the optimal disinfection scheme for the seed germ-free germination of Lagerstroemia was: disinfection with 75% alcohol for 2 min, then disinfection with 2.5% NaClO for 5 min;the browning rate of L. indica inoculated in WPM medium was lower than that inoculated in MS, and the stems were thicker and the leaves were darker green than those inoculated in 1/2MS and MS. The optimal medium for one-step proliferation and rooting was WPM+6-BA 1.5 mg/L+IBA 0.05 mg/L;the leaf color of the test tube seedlings was dark green, the proliferation coefficient reached 3.09, the average bud length was 5.21 cm, the average rooting rate was 75%, and the average rooting number per plant was 2.78.
Key words Lagerstroemia indica;Aseptic germination;Culture in vitro;Proliferation
基金项目 2021年南京市绿化园林局科技项目(YLKJ202111JH)。
作者简介 闫娜(1981—),女,安徽利辛人,副教授,硕士,从事植物与植物生理教学与研究。*通信作者,教授,硕士,从事园林植物与观赏园艺研究。
收稿日期 2024-01-05
紫薇(Lagerstroemia indica L.),千屈菜科(Lythraceae)紫薇属(Lagerstroemia)落叶灌木或小乔木[1]。我国是紫薇属植物种质资源的世界分布中心和栽培起源中心,有1 600余年的栽培历史[2]。紫薇花姿优美、花色艳丽、花期长达100 d,触碰树干则上部枝条会随之震颤,因此又有百日红、痒痒树等别称;适宜生长的温度范围较大,被广泛应用于园林绿化中[3]。紫薇的根、叶、皮还可入药,具有清热解毒、活血止血之效,种子还可制成农药[4-5];紫薇枝干光滑、柔软,生长缓慢,可以经人工盘扎形成各种造型。因此,紫薇在我国乃至世界都被广泛栽培和大量应用[6]。
紫薇传统的繁殖方式主要有播种和扦插,但繁殖速度较慢,限制了其苗木产量和推广应用[7-8]。采用植物组织培养技术可大幅缩短优良种质苗木的培育周期[9],是快速繁殖植物优良品种脱毒苗的重要途径,且不受季节限制,还可用于种质保存、体细胞无性变异和突变体筛选、次生代谢物的生产以及林木育种等[10]。前人对不同品种紫薇的组培快繁体系进行了大量研究。刘晓等[11]分别以矮首领紫薇的当年生半木质化带腋芽茎段、硬枝茎段和叶片为外植体进行快繁技术研究,结果表明:茎段为较好的外植体。曹受金等[12]以无果紫薇带芽嫩茎为外植体,得出最佳诱导培养基为MS+NAA 0.05 mg/L+6-BA 0.5 mg/L+KT 0.5 mg/L,最佳增殖培养基为MS+NAA 0.05 mg/L+6-BA 2.0 mg/L+KT 1.0 mg/L,适合的生根培养基为1/2MS+NAA 0.5 mg/L+6-BA 0.1 mg/L。饶丹丹等[8]研究发现,“紫玉”紫薇带腋芽茎段在改良的DKW+6-BA 1.0 mg/L +NAA 0.25 mg/L培养基上增殖芽健壮,在1/2MS+0.5 mg/L上获得较好的生根效果。“紫精灵”紫薇适宜的初代培养基和增殖培养基分别为DKW+6-BA 1.5 mg/L+NAA 0.2 mg/L和MS+6-BA 2.0 mg/L+NAA 0.4 mg/L[5]。以矮生紫薇(L.indica cv.Petite Pinkie)种子进行无菌播种,在不含任何激素的培养基上的无菌萌发率明显低于含有一定浓度激素培养基的;而以获得的无菌苗进行增殖培养时,采用 6-BA 和 KT 2种激素搭配使用,增殖效果较好[13]。红叶紫薇种子无菌萌发最佳萌发培养基为1/2MS,WPM对红叶紫薇的生长萌发没有明显效果[14]。可见,在紫薇外植体选取、基本培养基以及激素种类和浓度配比方面表现出品种差异。
“彩霞满天”紫薇分枝较多,花序也较多,花瓣红色,花径5.5 cm,属于大花品种,可作为紫薇种质创新的材料[15]。目前对于该紫薇品种的组培快速繁殖研究报道较少。种子作为植物组培材料一般具有材料量大,易获取,不伤害母株等优点,且无菌萌发可以解决其种子自然萌发率低的问题,易在短期内获得无菌增殖材料[16-17]。笔者以紫薇 “彩霞满天”(Lagerstroemia indica ‘Caixia Mantian’)品种的自然结实种子为试验材料,建立种子无菌萌发体系,通过对无菌苗带腋芽茎段诱导,筛选出无菌苗“一步法”增殖、生根培养基,以缩短紫薇组培快繁周期,以期为紫薇品种的离体快繁提供理论参考。
1 材料与方法
1.1 试验材料
金陵科技学院校园内选择生长健壮的紫薇“彩霞满天”(Lagerstroemia indica ‘Caixia Mantian’)优良单株。
1.2 试验方法
1.2.1 外植体灭菌方案的筛选。
2022年10月中旬采摘紫薇饱满未开裂果实,在自来水下流水冲洗,然后将紫薇果实及经高压灭菌后的组培空瓶、水、滤纸、解剖刀、镊子和培养基等物品置于超净工作台上紫外线消毒杀菌20 min。用解剖刀和镊子取出种子,无菌水冲洗1~2次,先用75%乙醇浸洗2 min,无菌水冲洗2~3次,再分别用2.5% NaClO 和5.0% NaClO消毒,消毒时间分别为1、3、5 min,消毒过程中使种子全部浸入溶液并不断振荡装有种胚的组培瓶,无菌水冲洗3~5次,用无菌滤纸吸干种子表面水分。
1.2.2 种子无菌萌发。
初代培养过程中,把灭过菌的种胚分别接种到含有蔗糖20 g/L的MS、1/2MS和WPM的固体培养基上,每个处理90瓶,每瓶接种1粒种子,重复3次。然后将其转入培养室进行培养,观察记录种子萌发生长情况,28 d后统计污染率、褐化率、无菌萌发率以及幼苗生长状况。
污染率=污染外植体数/接种外植体总数×100%
褐化率=褐化的外植体/存活的外植体×100%
无菌萌发率=萌芽的外植体数/存活的外植体总数×100%[10,18]
1.2.3 无菌苗一步法增殖、生根培养基筛选。
采取基本培养基(A因素)和6-BA(B因素)2个因素,A设置3个水平,即A1(MS)、A2(1/2MS)和A3(WPM),B设置2个水平,即B1(1.0 mg/L)和B2(1.5 mg/L),进行双因素随机试验,每个培养基分别添加0.05 mg/L IBA +蔗糖30 g/L+琼脂6.3 g/L。将无菌萌发获得的腋芽剪取约1.5 cm接种到以上培养基上,每处理30瓶,每瓶接种3个芽,重复3次。培养28 d,观察其生长情况,统计增殖系数、苗高、叶长、叶宽、生根率及单株生根数。
增殖系数=统计时有效芽数/接种芽数[8,10]。
1.2.4 培养条件。
培养基pH调至6.7,置于121 ℃高压灭菌20 min。培养容器为100 mL 塑料锥形组培瓶,接种后置于温度为(23±2)℃,光照强度为3 000~4 000 lx,光照时间为16 h/d的培养室内培养。
1.3 数据统计
使用Microsoft Excel 2019对数据进行计算及图表处理,用IBM SPSS 25.0 软件对数据进行极差分析、方差分析和Duncan’s多重比较。
2 结果与分析
2.1 不同灭菌方案对外植体污染率、无菌萌发率及褐化率的影响
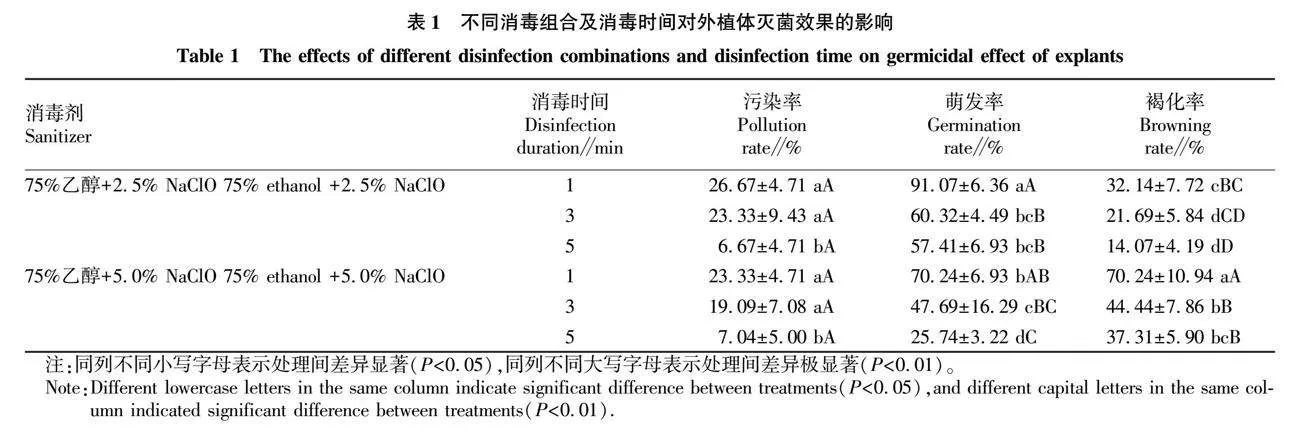
外植体灭菌是植物组织培养无菌系建立的关键环节[9]。将紫薇种子经不同灭菌方式处理后接入WPM培养基,结果见表1。通过双因素方差分析发现,消毒时间对污染率有显著作用(P<0.05)。进一步分析简单效应和事后多重比较可知,75%乙醇消毒2 min之后,2.5% NaClO和5.0% NaClO消毒不同时间对紫薇种子灭菌效果不同,但外植体污染率均随着消毒时间的延长逐渐降低,说明消毒时间越长,灭菌效果越好。其中,75%乙醇消毒2 min之后,用2.5% NaClO消毒5 min和5.0% NaClO消毒5 min的处理污染率分别降至6.67%和7.04%,显著低于其他处理(P<0.05)。
NaClO浓度和消毒时间均对无菌萌发率有极显著作用(P<0.01)。在相同消毒剂处理下随着消毒时间的延长无菌萌发率呈下降趋势,说明随着消毒时间的延长进一步加剧了对外植体的伤害。其中,75%乙醇消毒2 min之后,2.5% NaClO消毒1 min的平均无菌萌发率最高,极显著高于其他各处理(P<0.01);5.0% NaClO处理整体较2.5% NaClO处理下的无菌萌发率下降幅度大,5.0% NaClO消毒5 min的无菌萌发率降至25.74%。
NaClO浓度和消毒时间均对褐化率的作用呈极显著水平(P<0.01)。相同灭菌方案下,褐化率随消毒时间的延长整体呈下降趋势。其中,75%乙醇消毒2 min之后,5.0% NaClO处理下随着消毒时间的延长,褐化程度降低,消毒1 min处理下褐化率极显著高于3 min和5 min处理(P<0.01),平均褐化率由70.24%降至37.31%;2.5% NaClO处理下褐化程度整体较5.0% NaClO处理轻。经观察,无菌接种后第8天开始陆续出现褐化现象,此后不再有新增褐化苗,且部分紫薇褐化后仍能继续萌发,甚至其中少部分苗长势良好(图1)。相同灭菌方案下,发现接种于WPM培养基的紫薇较接种于MS的紫薇褐化率总体偏少。接种于1/2MS培养基的无菌萌发苗较为矮小,且叶色黄绿;MS培养基中子叶大而浓绿,第1真叶长势较弱;WPM培养基中的无菌萌发苗长势较好,茎粗壮且叶色浓绿(图2)。
综合考虑,用75%乙醇消毒2 min+2.5% NaClO消毒5 min是紫薇种子无菌萌发的最佳灭菌方案;紫薇种子无菌萌发的适宜基本培养基为WPM。
2.2 不同培养基对紫薇“一步法”快速繁殖的影响
将紫薇种子无菌萌发苗茎段接入增殖、生根培养基,结果见表2。双因素方差分析结果表明,基本培养基(A因素)以及基本培养基(A因素)与6-BA浓度(B因素)的交互作用对增殖系数、芽长、生根率和单株生根数具有显著影响(P<0.05);B因素对生根率亦影响显著(P<0.05);A、B因素以及AB交互项对叶长和叶宽均无显著影响(P>0.05)。进一步分析简单效应和事后多重比较,A3B2处理下增殖系数和芽长均显著高于其他各处理(P<0.05),因此A因素为主效应下各水平对增殖系数促进程度表现为WPM>MS>1/2MS;A3B2 和A1B1处理下生根率和单株生根数显著高于其他处理(P<0.05),生根率以A2B1处理最低,单株根数以A2B2处理最低。可见,A因素为主效应下各水平对生根率和单株生根数的促进程度表现为WPM>MS>1/2MS。因此,以WPM为基本培养基,添加1.5 mg/L 6-BA和0.05 mg/L IBA对紫薇“一步法”成苗效果最佳。
3 结论与讨论
植物组织培养中的污染主要来源于外植体,因此,外植体灭菌是植物组培无菌系建立的关键环节之一,是组织培养取得成功的重要因素[9-10]。培育种子无菌苗作为外植体,可减少污染,提高组培的成功率[19],也可解决其种子自然萌发率低的问题[17]。褐化问题在紫薇属植物组织培养过程中比较突出,目前国内外鲜见较为系统的研究报道[9]。李芳菲等[20]研究发现,“红火球”紫薇组培中易出现褐化现象,这主要由于植物体内含较多的酚类物质,且初代培养时外植体褐化严重,并指出能否克服褐化问题是其组培成功的关键因素。褐变一般与培养基的成分、激素种类与配比以及外植体灭菌等因素密切相关。吕铭等[14]研究认为,低质量浓度的无机盐和合适的激素配比可以适当减轻材料的褐变程度,其中细胞分裂素BA或KT 能提高多酚氧化酶的活性。段丽君等[21]通过试验得出,适宜的灭菌时间能显著减少外植体的褐化和污染,从而有效提高外植体的存活率。笔者于10月中旬以紫薇饱满未开裂果实中获取的种子作为外植体,经不同灭菌方式处理后接入WPM培养基发现,经75%乙醇消毒2 min之后,用2.5%NaClO消毒5 min和用5.0% NaClO消毒5 min的污染率低,前种方案处理下的褐化率亦低于其他处理,而且较高的NaClO浓度导致无菌萌发率下降,前人在用升汞作为消毒剂也得到类似结果,即消毒时间越长,污染率越低,而死亡率和褐化率越高[19]。因此,紫薇种子无菌萌发最佳消毒方案为:先用75%乙醇消毒2 min之后,用2.5% NaClO消毒5 min,这与陈磊[7]以紫薇品种“彩霞满天”为材料、茎段为外植体,最佳灭菌方案为多菌灵浸泡5 min、0.1%升汞浸泡6 min有所不同,说明同一品种外植体选取部位不同,最佳灭菌方案亦有差别。对于成熟的种子而言,无菌萌发培养基中往往不添加任何激素,在对红叶紫薇[14]、丽江山慈姑[17]等植物种子无菌萌发研究中发现,最适宜萌发条件为不含激素的1/2MS培养基。该试验发现,相同灭菌方案下接种于WPM培养基的紫薇较接种于MS的紫薇褐化率总体偏小,且较接种于1/2MS和MS中无菌萌发苗的茎粗壮且叶色浓绿。
植物组织培养快速繁殖是为了在最短时间内生产出最多的优质种苗,既要缩短培养周期,又要扩大种苗的繁殖系数[18]。培养基是组培外植体营养物质的来源,因此合适的培养基类型对植物组织培养至关重要[16]。陈磊[7]以紫薇品种“彩霞满天”茎段为外植体进行组培试验,结果表明最佳诱导培养基、增殖培养基和生根培养基分别为MS+BA 1.0 mg/L+NAA 0.1 mg/L,MS+BA 1.0 mg/L +NAA 0.1 mg/L和1/2MS+NAA 0.5 mg/L;而以叶片为外植体的最佳诱导培养基为 MS+2,4-D 1.0 mg/L +BA 1.0 mg/L。Zhang等[3]以紫薇“彩霞满天”种子为外植体获得的无根苗茎段转接到MS+4.44 μmol/L 6-BA+0.54 μmol/L α-NAA的增殖培养基上扩繁,并添加一定浓度秋水仙碱成功建立了体外诱导紫薇四倍体的方法。王闯等[13]以矮生紫薇(L.indica cv.Petite Pinkie)种子进行无菌播种,发现其试管苗适宜的诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L,适宜的快繁培养基为MS+6-BA 2.0 mg/L+KT 1.0 mg/L +NAA 0.01~0.05 mg/L,适宜的生根培养基为 MS+NAA 0.5 mg/L。蔡能等[22]以“紫韵”紫薇带腋芽的幼嫩茎段为外植体,发现适合的初代培养基为 DKW+BA 1.0 mg/L+NAA 0.05 mg/L,而增殖培养及生根培养最佳配方分别为 WPM+BA 0.5 mg/L+NAA 0.05 mg/L和1/2 MS+NAA 0.2 mg/L+AC 300 mg/L。“一步法”快速繁殖是植物组织培养过程中利用优化的培养基及培养条件,将传统的芽增殖和生根2个步骤合二为一,从而大大提高繁殖速率[14]。该试验通过双因素试验设计,研究“一步法”对紫薇的增殖和生根效果,发现WPM+6-BA1.5 mg/L+IBA 0.05 mg/L对紫薇的生长和生根效果最佳,叶色浓绿,增殖系数达到3.09,平均芽长为5.21 cm,平均生根率达75.00%,单株平均生根数为2.78。该研究得出的紫薇快速繁殖方法可为紫薇规模化生产,以及转基因育种中将有用的候选基因转移到紫薇品种中,从而改善其生长习性、栽培适应性以及观赏特性提供参考。
参考文献
[1] 王金凤,柳新红,陈卓梅.紫薇属植物育种研究进展[J].园艺学报,2013,40(9):1795-1804.
[2] 顾翠花.中国紫薇属种质资源及紫薇、南紫薇核心种质构建[D].北京:北京林业大学,2008.
[3] ZHANG Q Y,LUO F X,LIU L,et al.In vitro induction of tetraploids in crape myrtle(Lagerstroemia indica L.)[J].Plant cell tissue and organ culture,2010,101(1):41-47.
[4] 赵芳.南紫薇扦插繁育及栽培技术管理研究[D].重庆:西南大学,2020.
[5] 黄菲颖.‘紫精灵’紫薇组织培养及内源激素含量变化研究[D].长沙:中南林业科技大学,2022.
[6] MARGARET P.Crapemyrtle[C]//ANDERSON N O.Flower breeding and genetics:Issues,challenges and opportunities for the 21st century.Dordrecht,the Netherlands:Springer,2006:439-457.
[7] 陈磊.紫薇无性系建立及多倍体诱导技术研究[D].天津:天津大学,20c8250a16569c88081f29c41d77aeba9d91cd9c4bf126410424fe699ed2a275b511.
[8] 饶丹丹,王湘莹,蔡能,等.紫叶紫薇良种组培快繁研究[J].中南林业科技大学学报,2020,40(12):75-82.
[9] 梁建,刘世晗,刘桢,等.紫薇属植物组织培养技术研究进展[J].北方园艺,2021(23):142-149.
[10] 吴玲利,柯镔峰,龚春,等.白木通组织培养及快速繁殖[J].植物生理学报,2015,51(6):903-908.
[11] 刘晓,李卓,唐丽丹,等.紫薇茎段离体培养体系的优化[J].河南农业科学,2017,46(3):112-117.
[12] 曹受金,刘辉华,田英翠.紫薇的组织培养与快速繁殖[J].北方园艺,2010(8):149-151.
[13] 王闯,刘敏,刘殿红,等.矮生紫薇的组织培养与再生技术研究[J].安徽农业科学,2010,38(8):3914-3915,3924.
[14] 吕铭,王肖雄,何汝峰,等.红叶紫薇“一步法”快速繁殖试验[J].江苏林业科技,2017,44(3):15-18,22.
[15] 王献.我国紫薇种质资源及其亲缘关系的研究[D].北京:北京林业大学,2004.
[16] 刘燕,王济红,陈训,等.大白杜鹃组培与快繁研究:基本外植体和初代培养基筛选[J].种子,2010,29(8):34-37.
[17] 张祖珍,李疑,阮金华,等.丽江山慈姑种子无菌萌发和组培快繁技术研究[J].特种经济动植物,2022,25(1):14-18.
[18] 彭洋,赵杨.皂荚种子无菌萌发和组培技术[J].林业科技通讯,2023(11):130-133.
[19] 宦智群,耿兴敏.杜鹃花属植物组织培养技术研究进展[J].中国野生植物资源,2021,40(11):54-62.
[20] 李芳菲,杨利平,刘资华,等.“红火球”紫薇组培快繁与抗褐化研究[J].林业调查规划,2021,46(4):44-47,152.
[21] 段丽君,李国瑞,童俊,等.紫薇离体茎段快速繁殖体系研究[J].江西农业大学学报,2013,35(4):709-714.
[22] 蔡能,王晓明,李永欣,等.‘紫韵’紫薇组培快繁技术研究[J].湖南林业科技,2017,44(6):16-20.
