刺儿菜镉富集特征及其根际细菌群落对镉胁迫的响应
2024-12-20李明菲刘佳丽陈鉴武全伟陈颖慧孙潇彤丁瑞雪赵福强齐麟于佳
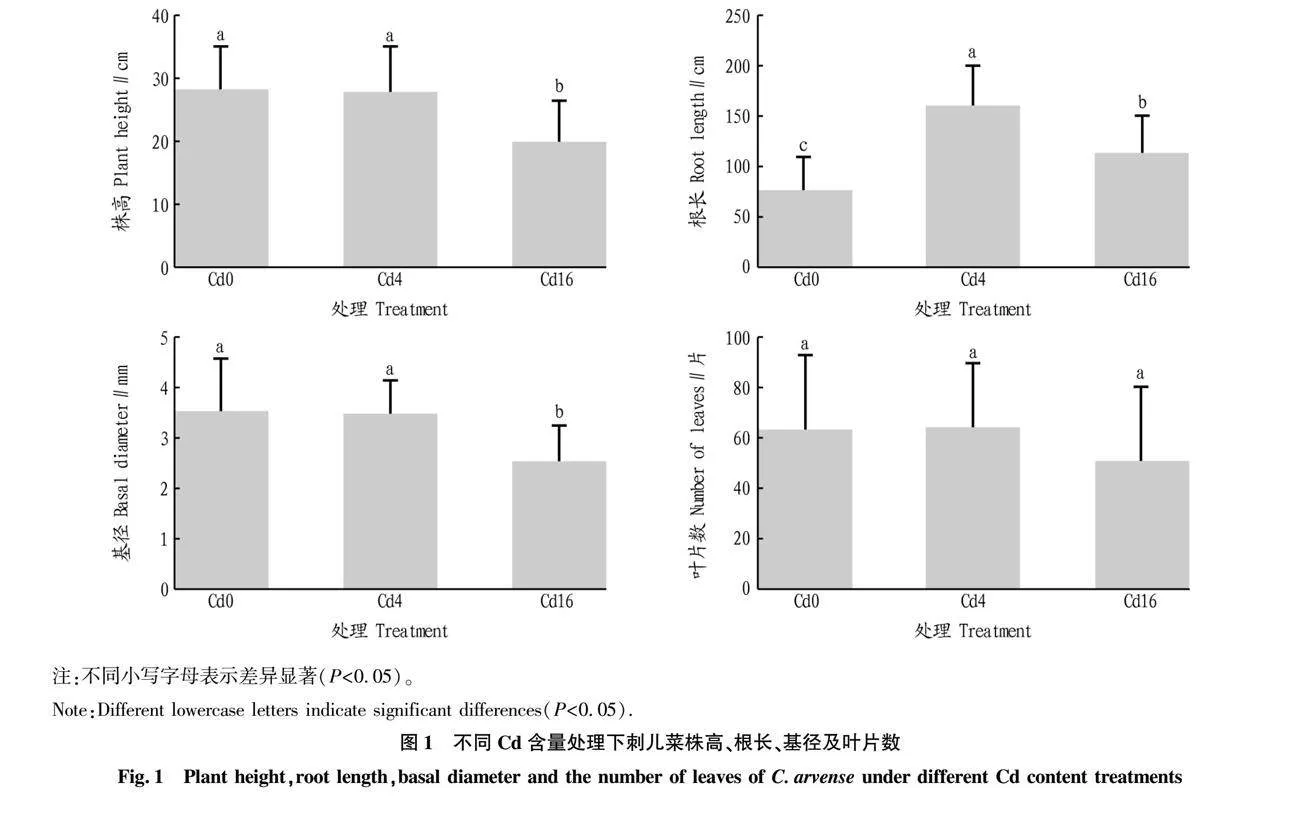
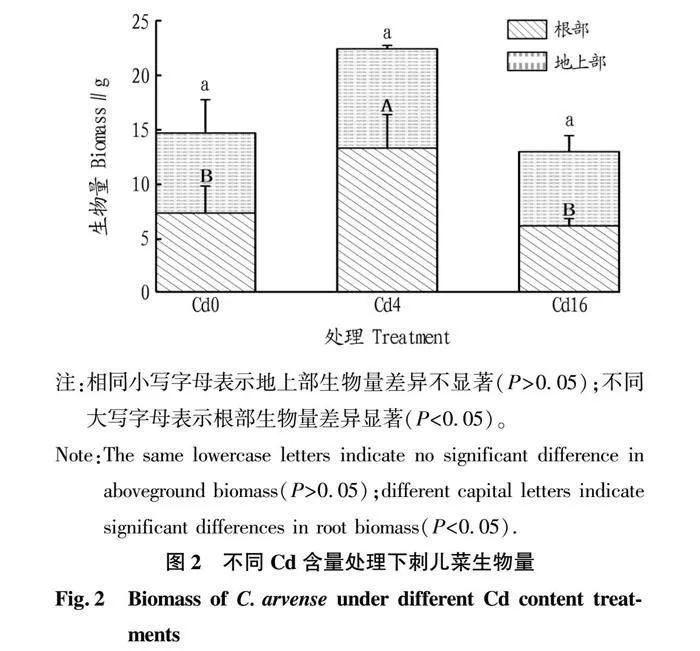
摘要 [目的]探明刺儿菜在重金属Cd胁迫下的生长、Cd积累特性以及根际细菌群落变化规律。[方法]通过温室盆栽试验,对比不同Cd含量(0、4和16 mg/kg)土壤中刺儿菜的生长和Cd积累特征差异,利用16S rDNA基因高通量测序技术,探究刺儿菜根际细菌群落结构在不同土壤Cd梯度下的变化规律。[结果]刺儿菜地上部和根部对Cd胁迫的响应明显不同。株高、基径和叶片数均随土壤Cd含量增加而降低,根长随土壤Cd含量增加而先增加后减少。Cd胁迫对刺儿菜生物量呈现出“低促高抑”的作用,在4 mg/kg土壤中生长的刺儿菜生物量比对照组(0 mg/kg)高52.68%。刺儿菜具有优良的Cd积累和转运能力,其富集系数大于5,转移系数大于4。Cd胁迫对刺儿菜根际细菌群落组成有明显影响,不同Cd含量土壤中刺儿菜根际菌优势菌门的相对丰度存在明显差异。[结论]刺儿菜能够在含Cd土壤(低于16 mg/kg)中生长,且富集能力强,是一种潜在的Cd污染植物修复资源,其根际细菌群落组成也会对Cd胁迫作出响应。
关键词 刺儿菜;镉;富集特征;植物修复;细菌群落结构
中图分类号 X 171.4 文献标识码 A 文章编号 0517-6611(2024)23-0065-04
doi:10.3969/j.issn.0517-6611.2024.23.015
Cd Accumulation Characteristics of Cirsium arvense var. Integrifolium and Response of Rhizosphere Bacterial Communities to Cd Stress
LI Ming-fei1, LIU Jia-li1, CHEN Jian2 et al
(1.College of Life Science and Bioengineering, Shenyang University, Shenyang, Liaoning 110044;2.Party Committee United Front Work Department of Shenyang University, Shenyang, Liaoning 110044)
Abstract [Objective] To investigate the growth and accumulation characteristics of C. arvense under heavy metal Cd stress and the impact on the rhizosphere bacterial community. [Method] Through greenhouse potting experiments, we compared the differences in growth and Cd accumulation characteristics of C. arvense in soils with different Cd contents (0, 4 and 16 mg/kg). We utilized high-throughput sequencing of 16S rDNA genes to determine the changing rules of the rhizosphere bacterial community structure of C. arvense under different soil Cd gradients. [Result] The responses of C. arvense to Cd stress in the aerial part and root part were significantly different: plant height, basal diameter and the number of leaves all decreased with increasing soil Cd gradients, but root length increased first and then decreased with increasing soil Cd gradients. Cd stress showed a “low-promoting and high-suppressing” effect on the biomass of C. arvense.The biomass of C. arvense grown in 4 mg/kg soil was 52.68% higher than that of the control group(0 mg/kg). C. arvense had excellent Cd accumulation and transport capacity, with a bioaccumulation factor greater than five and a translocation factor greater than four. Cd stress had an effect on the rhizosphere bacterial community composition, and there is a significant difference in the relative abundance of dominant phyla in soil with different Cd gradients.[Conclusion] C. arvense can grow in Cd-containing soil (less than 16 mg/kg) and has an excellent accumulation ability, making it a potential Cd contaminated phytoremediation resource, and its rhizosphere bacterial community composition also responds to Cd stress.
Key words C. arvense;Cd;Enrichment characteristics;Phytoremediation;Bacterial community structure
基金项目 2023年度沈阳市科学技术计划项目(23-407-3-16)。
作者简介 李明菲(1998—),女,辽宁葫芦岛人,硕士研究生,研究方向:植物修复。*通信作者,副教授,博士,硕士生导师,从事生态修复研究。
收稿日期 2024-01-22;修回日期 2024-03-18
随着工农业及城市化的快速发展,重金属通过一系列生产活动进入土壤,使土壤重金属镉(Cd)污染程度加剧[1]。重金属离子在土壤中滞留期长,致使土壤环境质量持续下降,不仅对植物产生毒害,更能够通过食物链进入人体,危害食品安全和人体健康[2]。因此,有必要对重金属Cd污染的土壤进行治理,降低其对生态环境的破坏及人类福祉的威胁。
区别于传统的物理、化学土壤重金属污染治理方法,植物修复技术具有成本低廉、对环境扰动小、可治理范围广等优势,适用于大面积、中低浓度污染的原位修复,是修复重金属污染土壤的一项重要技术。但植物修复技术本身存在一些局限性,受被污染的土壤结构不良等因素影响,富集植物生长缓慢、生物量小,迫使修复时间较长、效率低下。为了在植物修复过程中最大限度发挥植物提取的效率,有必要发掘新的、生物量大的、适应不同生境条件且具有较高积累金属能力的植物,丰富超累积植物资源,并明确其富集特征和响应机理。刺儿菜是在全国各地农田中广泛生长的一种杂草,生长迅速且生物量较大,并具有较强的抗逆性。一些研究显示,刺儿菜在Cd污染的废弃矿山生长,具备一定的Cd累积能力[3-4],是一种具有潜力的重金属Cd富集植物。因此,有必要对其Cd耐受和富集能力开展深入研究。
在各种生物富集机制中,独特的根际环境是影响富集植物提取Cd的重要条件,包括降低土壤pH、提高金属生物有效性或降低其毒性、增加根际微生物活性等[5]。根际环境会影响植物在胁迫环境中的生长与Cd提取效率[6],影响物质转化、有机质分解、能量流动和信息传递[7]。土壤中细菌群落结构对环境变化的反应以及对植物生长具有重要意义,但土壤细菌可能受到生物或非生物因素扰动的影响,从而引起其群落组成和功能的变化[8]。根际微生物在Cd胁迫下的变化方式与程度在不同的植物与土壤互作中存在很大差异。因此,需要系统地认识根际细菌在Cd胁迫下的变化情况。
该研究采用外源Cd添加盆栽试验,探究不同Cd胁迫强度下刺儿菜生长、Cd累积特征及根际细菌群落的变化规律,为利用刺儿菜开展植物修复研究,降低土壤Cd污染、改善环境提供参考依据。
1 材料与方法
1.1 试验材料与准备
2023年3—7月在实验室进行盆栽试验。供试种子采购自山东省潍坊市。试验所用土壤采自室外0~20 cm的表层土壤。土壤样品通过4 mm筛网,去除石块及植物残体,混匀备用。外源投加重金属Cd为CdCl2·2.5H2O(分析纯)。设置Cd浓度梯度为0 mg/kg(Cd0)、4 mg/kg(Cd4)、16 mg/kg(Cd16)。将制备好的土壤在温室中平衡30 d,其间每7 d翻土混合以保证土壤充分混匀。
1.2 试验设计
将不同Cd含量的土壤装入直径20 cm、高30 cm的塑料盆中,每盆装土6 kg,每个处理设置3个重复。试验前挑选大小一致、籽粒饱满的刺儿菜种子用2%的H2O2消毒20 min,而后用去离子水洗净,并常温浸泡过夜。次日直接将种子播撒于塑料盆中,每盆5粒,种子出土后,每盆留3株生长状态一致的幼苗。定期浇自来水,保持土壤含水量在田间持水量的60%~70%,每10 d调整花盆位置,期间注意清除杂草、防治病虫害。
1.3 数据采集
150 d后,将刺儿菜植株整株收获,分为根、茎、叶3个部分。茎、叶用去离子水多次冲洗;根置于20 mmol/L的Na2-EDTA中超声清洗15 min,再用去离子水冲洗3次。植物样品用烘箱80 ℃烘干至恒重,称量各部分质量得到生物量。之后将植物各部分样品研磨、粉碎、消解(消解使用HNO3与HClO4,体积比为4∶1),用原子吸收分光光度法测定植物中Cd含量。
土壤样品是附着在根系周围的土壤,采集后立刻使用液氮进行速冻,置于-80 ℃的冰箱中保存待用,用于分析土壤微生物群落组成。
1.4 数据分析
1.4.1 微生物群落组成分析。
土壤微生物DNA提取、16S rDNA扩增、测序及生物信息学分析参照Li等[9]的试验方法。用515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R(5′-CCGTCAATTCCTTTGAGTTT-3′)引物对V4+V5可变区进行PCR扩增,用于分析细菌多样性。
采用SPSS 27.0单因素方差分析(ANOVA)等基本统计检验比较不同土壤Cd胁迫强度下植物生长(株高、基径、根长、叶片数和生物量)和根际细菌优势微生物类群组成的差异。
1.4.2 刺儿菜Cd富集特征计算。
富集系数(BCF)和转移系数(TF)的计算公式如下:
地上部分Cd含量=(茎Cd含量×茎生物量+叶Cd含量×叶生物量)/(茎生物量+叶生物量)
BCF=地上部分Cd含量/土壤Cd含量
TF=地上部分Cd含量/根部Cd含量
2 结果与分析
2.1 不同Cd胁迫强度对刺儿菜生长的影响
从图1可以看出,刺儿菜地上部和地下部对不同Cd胁迫强度的响应存在明显差异。刺儿菜的株高、基径和叶片数随着外源Cd添加量的升高而降低,叶片数在不同Cd含量土壤中无显著差异。根长的差异显著,在有外源Cd添加的处理中刺儿菜根长显著高于对照组(Cd0),Cd4与Cd16处理中其根长分别是对照组的2.11、1.48倍。
从图2可以看出,刺儿菜生物量在不同Cd含量处理下存在明显差异。在土壤Cd含量为0~16 mg/kg时,刺儿菜可以正常生长。在Cd4处理中,刺儿菜生物量达到最高(22.38 g),与Cd0相比增加了52.68%,Cd16与Cd0则无显著差异。值得注意的是,Cd4中植株生物量的升高主要来源于根部生物量的增加,在Cd4中根部生物量显著增加,与Cd0相比增加了81.84%,而地上部生物量在不同Cd含量土壤中无显著差异。
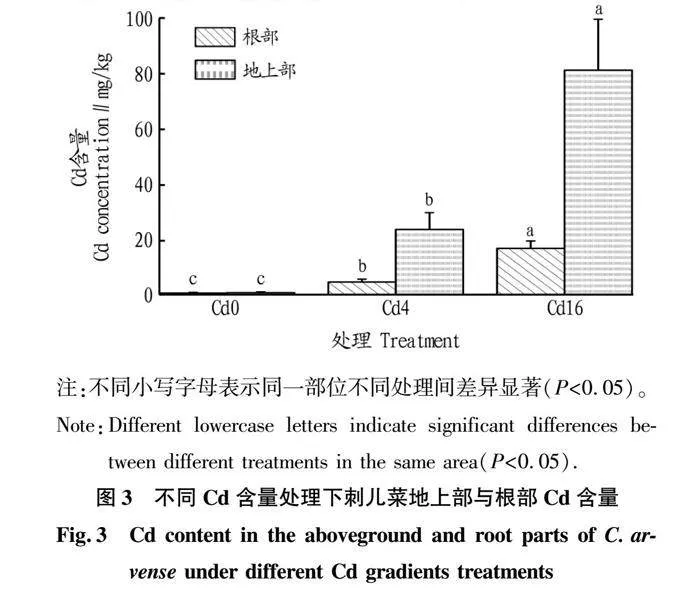
2.2 刺儿菜对重金属Cd的积累特征
从图3可以看出,刺儿菜具有良好的Cd富集特征。植株地上部和根部Cd含量均随土壤Cd含量的升高而升高,且地上部上升的程度显著高于根部,在Cd16土壤中刺儿菜地上部Cd含量最高。在Cd4与Cd16处理中,刺儿菜地上部Cd含量均显著高于根部,说明其能够将根部吸收的Cd转移至地上部,具有良好的
转移并富集Cd的能力。Cd4、Cd16处理中刺儿菜对Cd的转移系数平均值分别为5.14、4.88;Cd4、Cd16处理中刺儿菜对Cd的富集系数平均值分别为5.91、5.07。
2.3 不同Cd胁迫强度对刺儿菜根际细菌群落多样性和组成的影响
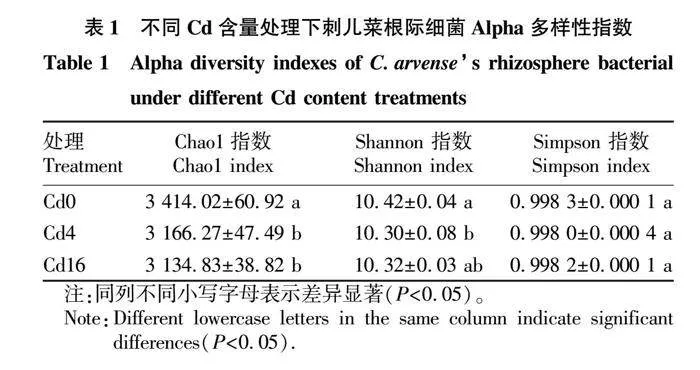
从表1可以看出,不同Cd含量处理下,刺儿菜根际细菌群落Alpha多样性指数存在明显差异。随着土壤Cd含量的升高,各处理中刺儿菜根际细菌群落的Chao1指数与Shannon指数均明显下降,而Simpson指数没有显著差异。其中Cd4和Cd16处理的Chao1指数较Cd0相比分别下降了7.26%和8.18%,Shannon指数较Cd0相比分别下降了1.15%和0.96%。说明重金属Cd的添加会造成刺儿菜根际细菌丰富度和多样性的降低。
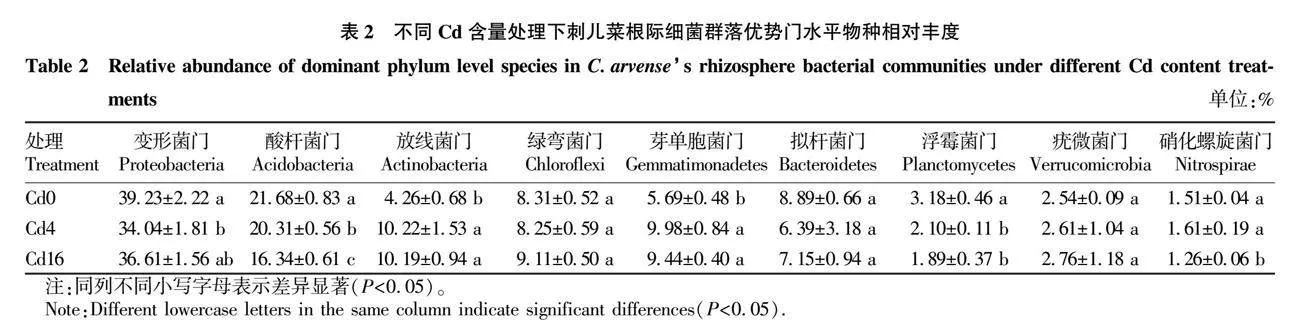
从根际土壤样品中共鉴定出48个细菌门。共有9个平均相对丰度大于1%的细菌门,将这9个细菌门划分出来称为优势细菌门,总计占比超过了95%。从表2可以看出,相对丰度最高的细菌门是变形菌门(Proteobacteria),为34.04%~39.23%;其他优势类群与其相对丰度分别为酸杆菌门(Acidobacteria)16.34%~21.68%、放线菌门(Actinobacteria)4.26%~10.22%、绿弯菌门(Chloroflexi)8.25%~9.11%、芽单胞菌门(Gemmatimonadetes)5.69%~9.98%、拟杆菌门(Bacteroidetes)6.39%~8.89%、浮霉菌门(Planctomycetes)1.89%~3.18%、疣微菌门(Verrucomicrobia)2.54%~2.76%、硝化螺旋菌门(Nitrospirae)1.26%~1.61%。在这9个优势细菌门中,含Cd土壤(Cd4、Cd16)中相对丰度与Cd0相比显著上升的有放线菌门和芽单胞菌门;与Cd0相比,变形菌门、酸杆菌门、浮霉菌门的相对丰度在含Cd土壤中明显下降;硝化螺旋菌门在Cd4土壤中与Cd0相比其相对丰度无显著差异,土壤Cd含量进一步升高后,在Cd16土壤中其相对丰度显著下降;绿弯菌门、拟杆菌门、疣微菌门相对丰度在Cd0、Cd4、Cd16土壤中保持稳定,无显著差异。
3 讨论与结论
Cd是一种最主要最普遍的污染物,在土壤中具有很强的持久性和迁移能力[10]。在中等强度的重金属Cd胁迫下,刺儿菜生物量不仅没有降低反而上升,说明其对Cd胁迫有良好的耐受能力,对Cd的毒害作出了积极响应,符合重金属富集植物的标准,具备修复重金属Cd污染土壤的潜力。当土壤Cd含量进一步升高,刺儿菜植株地上部及根部重金属Cd含量均显著升高,这说明在较高Cd含量的土壤中,刺儿菜依然可以通过根部吸收土壤中Cd并转移至植物地上部分。与此同时重金属的毒害作用对植物生长产生影响,刺儿菜生物量有所下降,这可能是由于其体内积累Cd含量过多导致的活性氧浓度过高,根部吸收养分的能力下降,地上部分植物叶绿素含量减少,光合和呼吸作用受阻造成的[11]。
研究表明,根际微生物中某些关键细菌类群,包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)等的富集,可以增强植物吸收根际养分的能力,从而帮助植物有效应对Cd胁迫[12]。变形菌门的相对丰度最大且在含Cd土壤中有所升高,这说明其对重金属Cd的耐受性较强,这可能是多种环境因子和微生物间彼此作用的结果[13]。尽管酸杆菌门对Cd胁迫的抵御能力较差,但其可以产生大量的胞外多糖,从而促进植物生长[14]。放线菌门可以利用多种土壤肥力作为能源与其他菌群共存,共同抵御Cd胁迫[15],从而提高自身的优势度。由此可见,在Cd胁迫下,根际微生物的群落结构会根据所在环境的改变而作出相应调整。可能是因为植物生长在胁迫环境中,受到重金属侵害以及土壤理化性质的影响,植物为了更好地在Cd胁迫环境下生存从而选择性地组装根际微生物群落,改变生存策略[16]。
综上所述,当Cd胁迫小于16 mg/kg时,刺儿菜能够正常生长,并将土壤中的Cd转移到地上部,而且在4 mg/kg土壤中具有较强的修复效率。同时Cd胁迫下根际细菌生长策略的调整,使得植物更好地适应胁迫环境。因此,刺儿菜具备富集植物的基本条件,具有能够成为植物修复资源的潜力。
参考文献
[1] SOMAYAJI A,SARKAR S,BALASUBRAMANIAM S,et al.Synthetic biology techniques to tackle heavy metal pollution and poisoning[J].Synthetic and systems biotechnology,2022,7(3):841-846.
[2] LI M,KUANG S P,KANG Y,et al.Recent advances in application of iron-manganese oxide nanomaterials for removal of heavy metals in the aquatic environment[J].The science of the total environment,2022,819:1-11.
[3] 罗少辉,王秀英,吴浩,等.高寒地区刺儿菜对重金属镉污染土壤修复效果研究[J].环境污染与防治,2018,40(1):40-43.
[4] 赵爱山,俞春花.外源镉在刺儿菜中的富集及对其生长的影响[J].甘肃农业科技,2015,46(9):42-45.
[5] HAN H,WU X J,HUI R Q,et al.Synergistic effects of Cd-loving Bacillus sp.N3 and iron oxides on immobilizing Cd and reducing wheat uptake of Cd[J].Environmental pollution,2022,305:1-12.
[6] BIAN F Y,ZHONG Z K,LI C Z,et al.Intercropping improves heavy metal phytoremediation efficiency through changing properties of rhizosphere soil in bamboo plantation[J].Journal of hazardous materials,2021,416:1-11.
[7] LIU C J,LIN H,LI B,et al.Responses of microbial communities and metabolic activities in the rhizosphere during phytoremediation of Cd-contaminated soil[J].Ecotoxicology and environmental safety,2020,202:1-10.
[8] RAJKUMAR M,PRASAD M N V,SWAMINATHAN S,et al.Climate change driven plant-metal-microbe interactions[J].Environment international,2013,53:74-86.
[9] LI X,CHEN D,LI B Q,et al.Cd accumulation characteristics of Salvia tiliifolia and changes of rhizospheric soil enzyme activities and bacterial communities under a Cd concentration gradient[J].Plant and soil,2021,463(1):225-247.
[10] ZHANG X Y,CHEN D M,ZHONG T Y,et al.Assessment of cadmium(Cd)concentration in arable soil in China[J].Environmental science and pollution research international,2015,22(7):4932-4941.
[11] 汪洪,赵士诚,夏文建,等.不同浓度镉胁迫对玉米幼苗光合作用、脂质过氧化和抗氧化酶活性的影响[J].植物营养与肥料学报,2008,14(1):36-42.
[12] WANG X,FANG L C,BEIYUAN J Z,et al.Improvement of alfalfa resistance against Cd stress through rhizobia and arbuscular mycorrhiza fungi co-inoculation in Cd-contaminated soil[J].Environmental pollution,2021,277:1-12.
[13] CHEN Y,JIANG Y M,HUANG H Y,et al.Long-term and high-concentration heavy-metal contamination strongly influences the microbiome and functional genes in Yellow River sediments[J].Science of the total environment,2018,637/638:1400-1412.
[14] KIELAK A M,BARRETO C C,KOWALCHUK G A,et al.The ecology of Acidobacteria:Moving beyond genes and genomes[J].Frontiers in microbiology,2016,7:1-16.
[15] BAO Y Y,DOLFING J,GUO Z Y,et al.Important ecophysiological roles of non-dominant Actinobacteria in plant residue decomposition,especially in less fertile soils[J].Microbiome,2021,9(1):1-17.
[16] LOPES L D,DE CSSIA PEREIRA E SILVA M,ANDREOTE F D.Bacterial abilities and adaptation towards the rhizosphere colonization[J].Frontiers in microbiology,2016,7:1-13.
