组蛋白甲基化转移酶SMYD3在肺癌中的研究进展
2024-12-18宋志鑫王晓玲孟粤朱殷栋祁菁菁黄沁琳刘军
[摘" "要]" "组蛋白甲基化转移酶SET和MYND结构域蛋白3(SET and MYND domain-containing protein 3, SMYD3)是催化组蛋白和非组蛋白底物甲基化的酶,在许多生物学环境中发挥关键作用,如肌肉发育和部分癌症的进展。本综述对SMYD3进行相关的基本介绍,并探讨SMYD3在肺癌中的研究,旨在为SMYD3在肺癌中的进一步研究提供依据。
[关键词]" "肺癌;组蛋白赖氨酸甲基化转移酶;SET和MYND结构域蛋白3;肿瘤微环境;免疫逃逸
[中图分类号]" "R734.2" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)05-0479-04
Research progress of histone methyltransferase SMYD3 in lung cancer*
SONG Zhixin WANG Xiaoling MENG Yue ZHU Yindong QI Jingjing HUANG Qinlin LIU Jun (1Department of Abdominal Pelvic Oncology, Ganzhou Cancer Hospital, Jiangxi 341000; 2Department of Oncology Chemotherapy, Affiliated Hospital of Nantong University)
[Abstract]" "Histone methyltransferase SET and MYND domain-containing protein 3(SMYD3) is an enzyme that catalyzes the methylation of histone and non-histone substrates and plays a key role in many biological environments, such as muscle development and partial cancer progression. This review provides a basic introduction to SMYD3 and discusses the study of SMYD3 in lung cancer, aiming to provide a basis for further research on SMYD3 in lung cancer.
[Key words]" "lung cancer; histone lysine methyltransferase; SET and MYND domain-containing protein 3; tumor microenvironment; immune escape
肺癌作为全球死亡率第一的恶性肿瘤,主要分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC)[1]。NSCLC主要包括肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)、肺腺癌(lung adenocarcinoma, LUAD)和肺大细胞癌等,约占所有肺癌病例的80%[2]。随着我国第二产业占比的提高,化石能源使用量的增加,大气污染情况也日益严重,这导致我国肺癌的发病率逐年稳步上升,因此肺癌的防治工作变得愈加重要[3]。大部分肺癌患者确诊时就已经属于中晚期,其5年生存率不足20%[4]。缺少有效的肺癌检测指标使肺癌不能及早发现是目前肺癌治疗效果不佳的一个重要因素。而对肺癌发病机制的认识不足,则成为限制肺癌治疗取得进展的另一个瓶颈。表观遗传修饰对于调节包括癌症在内的许多生物学过程非常重要。表观遗传是指基因表达发生了可遗传的改变,但同时不涉及DNA序列的变化[5]。这种可遗传的改变主要利用表观遗传修饰来实现,表观遗传学修饰机制包括组蛋白修饰、染色质重塑和RNA干扰、DNA甲基化[5-6]。组蛋白修饰是指在组蛋白特定的氨基酸残基上进行各种酶促翻译后修饰,包括丝氨酸磷酸化、赖氨酸乙酰化以及赖氨酸与精氨酸的甲基化,这些翻译后的修饰与肿瘤的发生和发展密切相关[7]。组蛋白甲基化是组蛋白修饰的一种特殊类型。其中组蛋白甲基化的标志是被组蛋白甲基转移酶所标记上的,并且可以被去甲基酶“擦除”[8]。蛋白质赖氨酸甲基转移酶家族(protein arginine methyl-transferase, PKMT)是由一、二或三甲基赖氨酸残基组成的酶[8]。SET和MYND结构域蛋白(SET and MYND domain-containing proteins, SMYD)家族属于PKMT家族,包括SMYD1、SMYD2、SMYD3、SMYD4和SMYD5等5个成员。在SMYD家族中,SMYD2和SMYD3由于在多种癌症类型中过度表达而迅速引起人们的关注[6]。虽然SMYD3的综合功能尚不清楚,但其已与包括肺癌在内的多种癌症的发病机制有关,使其成为有潜力的抗癌药物靶点[5-6, 9]。最近的报道[10]表明,SMYD3在肿瘤微环境(tumor microenvironment, TME)、血管生成或免疫逃避的调节功能中起着重要作用,而对于细胞增殖直接作用较小。越来越高效和选择性的化学探针的发现有助于完善关于SMYD3病理生理功能的假设。
本综述重点讨论SMYD家族中的成员SMYD3,并分析其结构与功能相关的基本机制和临床意义,特别针对SMYD3与肺癌的发病机制及靶向SMYD3的药物研究进展进行综述,目的是强调SMYD3在肺癌中的临床意义和诊疗可能性。
1" "组蛋白甲基化酶SMYD3
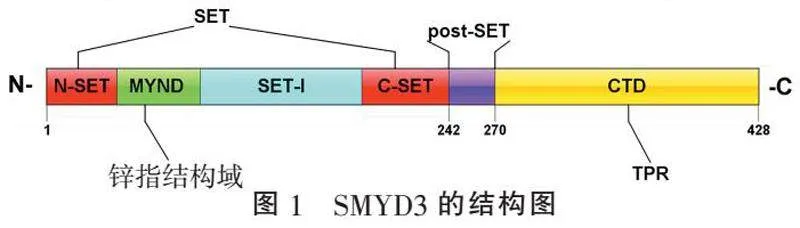
1.1" "SMYD3的结构" "SMYD3是由R.HAMAMOTO等[11]于2004年在研究人肝癌及结肠癌细胞时利用RT-PCR技术及cDNA芯片首次发现。SMYD3基因位于人类染色体1q44,由1 477个碱基对组成,其中有16个外显子编码428个氨基酸的蛋白质。SMYD3由5个结构域组成,为两叶结构,分别为N端叶和C端叶,两叶由数量不定的非保守序列链接(图1)。N端叶具有4个结构域,分别是SET结构域、MYND结构域、SET-I结构域和post-SET结构域。其中,具有催化作用的SET结构域位于N端叶的中间,称C-SET结构域。MYND结构域是一个含锌指的结构域,和SET-I结构域将SET结构域分为两个结构域,即N-SET结构域和C-SET结构域,并促进蛋白质-蛋白质和蛋白质-DNA的相互作用[12]。与SET结构域密切相关的还有另外两个结构域:post-SET和SET-I,有助于辅助因子结合、底物结合和蛋白质稳定[13]。
C端叶只有C末端结构域(C-terminal peptide binding domain, CTD)结构域,其功能尚未完全阐明。蛋白质结晶学似乎提示CTD结构域可能通过增强和抑制蛋白质的甲基转移酶活性而具有酶的调节功能[12]。SMYD3还在CTD上存在四肽重复序列(tetratrico-peptide repeat, TPR)。在SMYD3中,TPR样结构域调节包括热休克蛋白90在内的其他蛋白质在机体发挥作用。最后,TPR类结构域是一个相互作用模块,它招募伴侣并简化多蛋白复合体的形成[13]。
1.2" "SMYD3的组织表达" "M.S.KIM等[14]利用质谱数据分析正常成人和胎儿人体组织中SMYD家族的组织表达模式。在胎儿组织中,SMYD3在心脏高表达,在卵巢和脑中等表达,在肠道和睾丸低表达,在肝脏不表达。在PLT中高表达,在CD8+T细胞中低表达,在大脑、脊髓、视网膜、心脏、卵巢、膀胱和前列腺中低表达。在成人组织中,SMYD3在肝、肺、结肠、直肠、肾、肾上腺、胆囊、胰腺、食管、膀胱、前列腺或单核细胞中不表达。
1.3" "SMYD3的正常功能" "SMYD3已被证实在心脏和骨骼肌发育中起关键作用[12]。研究[15]发现,心脏和骨骼肌表达SMYD3,并在细胞周期停滞期间的合成(S)期和G2~M期主要在细胞核中积累。此外,R.CODATO等[16]结果表明,SMYD3过表达促进了小鼠成肌细胞的肌肉分化和肌管融合。这些结果强调了SMYD3在心肌和骨骼肌生理学中的作用。因此,进一步研究SMYD3在正常状态和人类细胞系统中的功能至关重要。
1.4" "SMYD3的组蛋白和非组蛋白底物" "研究[5-6]表明SMYD3可以通过对组蛋白(H3K4、H4K5、H4K20等)及非组蛋白(如血管内皮生长因子受体1、MAP3K2、AKT1、ER、HER2等)的甲基化来促进细胞的增殖、迁移和侵袭,并与患者的不良预后相关。具体地说,SMYD3可与细胞质蛋白相互作用并将其甲基化,如SMYD3通过甲基化H3K4,从而使染色质空间结构变化,继而影响转录复合物的紧凑程度和开放程度,对基因转录发挥调控作用[11]。血管内皮生长因子受体1被SMYD3甲基化是通过配体依赖的自磷酸化来增强血管生成,并增加激酶活性[17]。在肺癌和胰腺癌中,SMYD3定位于细胞质,它通过MAP3K2激酶的甲基化来增强RAS/ERK信号,阻止其与负调控因子PP2A磷酸酶复合体的相互作用[17]。
1.5" "SMYD3与免疫细胞相关的上游调控通路" "SMYD3是细胞信号通路中重要组成部分。有证据[6]表明SMYD3是转录反应和关键信号通路的调节器,协调多个致癌因素输入,最终促进转录重编程和肿瘤转化。目前,针对其下游信号通路的研究较多,然而也应重视对其上游调控通路的研究。D.E.NAGATA等[18]在对诱导性调节性T细胞(inductive T regulatory cell, iTreg)的调节机制进行研究时发现,SMYD3基因启动子序列具备Smad结合点,iTreg主要有控制体内自身免疫反应性的作用。在Foxp3+iTreg细胞中,TGF-β可利用Smad3通路促进SMYD3基因的表达。通过使用Smad抑制剂,组织细胞中SMYD3和H3K4me3表达降低,与此同时,IL-17产生和iTreg细胞形成受到影响,导致病毒性相关疾病加重[19]。由此推断TGF-β-Smad3通路可能调节SMYD3的表达。
2" "SMYD3表达在肺癌中的研究
2.1" "SMYD3在肺癌中的意义" "目前对于SMYD3的功能研究不仅集中在正常组织中[16],对于其在肿瘤中作用研究势头也方兴未艾。结合体内研究结果表明,SMYD3活性在调节正常细胞的增殖和生存能力中起关键作用,且SMYD3在肿瘤中的表达水平与肿瘤发生过程中获得的特定功能有关,其中它在细胞增殖中的关键作用被进一步放大[6]。SMYD3在癌症中的作用包括:上皮-间充质转化(epithelial-mesenchymal transition, EMT),细胞周期改变,促进细胞增殖、侵袭和转移,抗凋亡,刺激血管生成,增加端粒酶活性,以及细胞永生化[10, 20]。另有研究[6]表明,SMYD3在癌症中上调,通过两个主要功能促进致癌途径的激活:参与细胞增殖和EMT的基因的转录激活,以及通过非组蛋白的甲基化,特别是参与细胞信号传导,并导致细胞生长和细胞迁移的增加。肿瘤活检和肿瘤数据集的表达分析的实验证据[5-6, 21-22]表明,SMYD3在各种形式的癌症中过度表达,较高的SMYD3水平与总体存活率降低和预后不良相关。虽然SMYD3在多种癌症中起作用,但这里将着重介绍SMYD3在肺癌中的研究。
P.K.MAZUR等[23]研究表明,肺癌中SMYD3定位于细胞质,通过MAP3K2激酶的甲基化活化RAS/ERK信号通路,阻止其与负调控因子蛋白磷酸酶2(protein phosphatase 2A, PP2A)磷酸酶复合体的相互作用,从而促进肺癌细胞的增殖;在RAS突变的肺癌小鼠移植瘤模型中发现SMYD3基因敲除小鼠的移植瘤体明显小于对照组,且控制肿瘤的较慢进展;另外,组织学证据表明,敲除SMYD3可以抑制肺腺瘤向肺腺癌的转化。
J.LI等[24]也发现在NSCLC中,癌组织中SMDY3的表达明显高于癌旁组织,SMYD3的高表达和更晚的病理分期、更大的肿瘤直径、脉管侵犯、胸膜侵犯和远处转移有关,且患者的无进展生存期和总生存期更短。并在细胞实验[24]中证实SMYD3可以促进肺癌细胞增殖、侵袭、抗凋亡,并和顺铂的耐药相关。随后,H.W.LV等[25]研究也表明SMYD3和顺铂的耐药相关,并证明SMYD3是以ANKHD1依赖的方式赋予NSCLC细胞对顺铂的化疗耐药性,这为克服NSCLC对顺铂的耐药性提供了新的治疗靶点。
此外,X.S.ZHANG等[26]对NSCLC患者来源的异种移植物对靶向已知NSCLC敏感性的药物的体内治疗反应结果表明,MDM2抑制剂KRT-232、MEK抑制剂曲美替尼bcl-X(L)/bcl-2抑制剂(诱导细胞凋亡的抑制剂)和Navitoclax单药治疗后肿瘤消退率分别为11%、10%和0%。且与耐药肿瘤相比,MEK抑制剂曲美替尼和bcl-X(L)/bcl-2抑制剂(诱导细胞凋亡的抑制剂)联合治疗的KRAS突变NSCLC患者来源的异种移植瘤中SMYD3的表达水平更高。V.LUKINOVIC等[27]发现抑制SMYD3可使细胞对烷化剂敏感并促进小细胞肺癌对化疗的持续反应,SMYD3通过RNF113A甲基化-磷酸化串扰阻碍小细胞肺癌对烷基化损伤的敏感性。SMYD3还可以通过H3K4me3/ANO1轴调节NSCLC细胞的异常增殖[28]。同时,SMYD3在肺癌中对MAP3K2的激活至关重要,而MAP3K2是RAS激活的MAP信号通路中的一个关键激酶。此外,SMYD3与NSCLC的晚期和低生存期相关,并促进细胞增殖、侵袭和化疗耐药表型。这些数据支持SMYD3可作为NSCLC的重要治疗靶点[5],为后续进一步探索SMYD3在肺癌的意义提供思路。
2.2" "SMYD3抑制剂在肺癌中的研究" "SMYD3在癌症中显著过表达,意味着抑制SMYD3可能是一个有效的抗癌靶点[29]。截至2019年4月,有7种SMYD3小分子抑制剂:BCI-121、EPZ030456、EPZ031686、GSK2807、EPZ028862、Bay-6035和四氢吖啶化合物[29]。目前,已知对肺癌的SMYD3抑制剂只有EPZ028862(EPIZYME 附睾酶)。
在体内及体外,EPZ028862都对SMYD3表现出选择性,其作用机制为对S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)的混合型抑制和对MAP3K2底物的非竞争性抑制[29]。M.J.THOMENIUS等[10]为证明EPZ028862与SMYD3在内源水平上的特异性相互作用(而不是像在过度表达的细胞中那样与高水平的SMYD3),进行了细胞热位移分析。在带有和不带有KRAS突变的NSCLC和其他肺癌细胞系中均未发现抗增殖活性。此外,在其他癌细胞系中,无论是单独使用EPZ028862,还是与MAP2K1(MEK1)抑制剂曲美替尼的联合使用也未观察到对细胞生长的影响[29]。但这与P.K.MAZUR等[23]提出的观点相冲突。
综上所述,尽管目前SMYD3在肺癌中的研究不够深入,但是SMYD3在肺癌中确实具有相关功能,SMYD3可作为肺癌的早期诊断及治疗的靶点。
[参考文献]
[1]" "SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249.
[2]" "TRAVIS W D, BRAMBILLA E, BURKE A P, et al. Introduction to the 2015 World Health Organization classification of tumors of the lung, pleura, thymus, and heart[J]. J Thorac Oncol, 2015, 10(9):1240-1242.
[3]" "徐涵. 长链非编码RNA MYU在肺腺癌中的功能及机制研究[D]. 镇江: 江苏大学, 2020.
[4]" "BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424.
[5]" "BERNARD B J, NIGAM N, BURKITT K, et al. SMYD3: a regulator of epigenetic and signaling pathways in cancer[J]. Clin Epigenetics, 2021, 13(1):45.
[6]" "BOTTINO C, PESERICO A, SIMONE C, et al. SMYD3: an oncogenic driver targeting epigenetic regulation and signaling pathways[J]. Cancers, 2020, 12(1):142.
[7]" "姜雅慧, 冯炜炜. 组蛋白甲基化转移酶SMYD3与肿瘤[J]. 肿瘤, 2017, 37(7):807-816.
[8]" "KOUZARIDES T. Histone methylation in transcriptional control[J]. Curr Opin Genet Dev, 2002, 12(2):198-209.
[9]" "PARK K, VEENA M S, SHIN D S. Key players of the immunosuppressive tumor microenvironment and emerging therapeutic strategies[J]. Front Cell Dev Biol, 2022, 10:830208.
[10]" "THOMENIUS M J, TOTMAN J, HARVEY D, et al. Small molecule inhibitors and CRISPR/Cas9 mutagenesis demonstrate that SMYD2 and SMYD3 activity are dispensable for autonomous cancer cell proliferation[J]. PLoS One, 2018, 13(6):e0197372.
[11]" "HAMAMOTO R, FURUKAWA Y, MORITA M, et al. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J]. Nat Cell Biol, 2004, 6(8):731-740.
[12]" "TRACY C, WARREN J S, SZULIK M, et al. The smyd family of methyltransferases: role in cardiac and skeletal muscle physiology and pathology[J]. Curr Opin Physiol, 2018, 1:140-152.
[13]" "BROWN M A, FOREMAN K, HARRISS J, et al. C-terminal domain of SMYD3 serves as a unique HSP90-regulated motif in oncogenesis[J]. Oncotarget, 2015, 6(6):4005-4019.
[14]" "KIM M S, PINTO S M, GETNET D, et al. A draft map of the human proteome[J]. Nature, 2014, 509(7502):575-581.
[15]" "BROWN M A, SIMS R J 3rd, GOTTLIEB P D, et al. Identification and characterization of Smyd2: a split SET/MYND domain-containing histone H3 lysine 36-specific methyltransferase that interacts with the Sin3 histone deacetylase complex[J]. Mol Cancer, 2006, 5:26.
[16]" "CODATO R, PERICHON M, DIVOL A, et al. The SMYD3 methyltransferase promotes myogenesis by activating the myogenin regulatory network[J]. Sci Rep, 2019, 9(1):17298.
[17]" "KUNIZAKI M, HAMAMOTO R, SILVA F P, et al. The lysine 831 of vascular endothelial growth factor receptor 1 is a novel target of methylation by SMYD3[J]. Cancer Res, 2007, 67(22):10759-10765.
[18]" "NAGATA D E, TING H A, CAVASSANI K A, et al. Epigenetic control of Foxp3 by SMYD3 H3K4 histone methyltransferase controls iTreg development and regulates pathogenic T-cell responses during pulmonary viral infection[J]. Mucosal Immunol, 2015, 8(5):1131-1143.
[19]" "李卫奇. SMYD3、LOXL2及E-cad在结肠癌中的表达及临床意义[D]. 承德: 承德医学院, 2018.
[20]" "董尚文. 组蛋白甲基化酶SMYD3促进人食管鳞癌发病的表观遗传机制研究[D]. 天津: 天津医科大学, 2016.
[21]" "ZHU H P, CHAI J L, QIN R, et al. Discovery of tetrahydrofuranyl spirooxindole-based SMYD3 inhibitors against gastric cancer via inducing lethal autophagy[J]. Eur J Med Chem, 2023, 246:115009.
[22]" "WILLIAMS J B, CAO Q, WANG W, et al. Inhibition of histone methyltransferase Smyd3 rescues NMDAR and cognitive deficits in a tauopathy mouse model[J]. Nat Commun, 2023, 14(1):91.
[23]" "MAZUR P K, REYNOIRD N, KHATRI P, et al. SMYD3 links lysine methylation of MAP3K2 to Ras-driven cancer[J]. Nature, 2014, 510(7504):283-287.
[24]" "LI J, ZHAO L F, PAN Y J, et al. SMYD3 overexpression indicates poor prognosis and promotes cell proliferation, migration and invasion in non-small cell lung cancer[J]. Int J Oncol, 2020, 57(3):756-766.
[25]" "LV H W, XING W Q, BA Y F, et al. SMYD3 confers cisplatin chemoresistance of NSCLC cells in an ANKHD1-dependent manner[J]. Transl Oncol, 2021, 14(6):101075.
[26]" "ZHANG X S, ZHANG R, CHEN H Q, et al. KRT-232 and navitoclax enhance trametinib's anti-cancer activity in non-small cell lung cancer patient-derived xenografts with KRAS mutations[J]. Am J Cancer Res, 2020, 10(12):4464-4475.
[27]" "LUKINOVI■ V, HAUSMANN S, ROTH G S, et al. SMYD3 impedes small cell lung cancer sensitivity to alkylation damage through RNF113A methylation-phosphorylation cross-talk[J]. Cancer Discov, 2022, 12(9):2158-2179.
[28]" "ZHONG D, ZHAN Z Q, ZHANG J Q, et al. SMYD3 regulates the abnormal proliferation of non-small-cell lung cancer cells via the H3K4me3/ANO1 axis[J]. J Biosci, 2022, 47:53.
[29]" "FABINI E, MANONI E, FERRONI C, et al. Small-molecule inhibitors of lysine methyltransferases SMYD2 and SMYD3: current trends[J]. Future Med Chem, 2019, 11(8):901-921.
[收稿日期] 2023-03-03
