藁本内酯对慢性神经病理性疼痛模型小鼠的镇痛作用研究
2024-12-18李洁佳王丽云张灏尤文慧朱清

[摘" "要]" "目的:观察藁本内酯(ligustilide, LIG)对神经病理性疼痛(neuropathic pain, NP)模型小鼠疼痛的干预作用以及初步机制探索。方法:建立经典的坐骨神经保留性神经损伤(spared nerve injury, SNI)和慢性压迫性损伤(chronic constriction injury, CCI)诱导的小鼠NP模型,观察LIG单次给药(20、40、80 mg/kg,腹腔注射)以及反复多次给药(40、80 mg/kg,腹腔注射,1次/d,连续7 d)对SNI以及CCI诱导的机械性触诱发痛的影响;在LIG反复多次给药处理(40、80 mg/kg,腹腔注射,1次/d,连续7 d)末次给药的当天行SNI和CCI手术,观察LIG处理对NP的预防作用;在LIG 80 mg/kg反复给药条件下,于SNI术后第5天,ELISA法测定脊髓L4~5节段中促炎因子TNF-α、IL-1β和IL-6的含量;免疫荧光观察小胶质细胞标志物离子钙结合衔接分子1(ionized calcium binding adaptor molecule 1, IBA-1)的阳性细胞数以分析小胶质细胞激活的情况。结果:成功建立SNI和CCI诱导的小鼠NP模型,LIG单次给药与重复多次给药均能显著缓解SNI和CCI诱导的NP症状,作用至少能维持7 d,无耐受性产生倾向。在有效剂量下,LIG并不干扰动物的运动功能,说明其镇痛作用具有特异性。术前LIG反复多次给药,能预防SNI与CCI诱导的早期机械性触诱发痛,但维持时间有限(1~2 d)。LIG反复给药处理能降低SNI模型中促炎症因子TNF-α、IL-1β和IL-6的含量,抑制SNI诱导的小胶质细胞激活。结论:LIG对NP症状具有改善作用,不产生耐受性,术前反复给药对NP有一定的预防作用。LIG抗NP机制可能与其抑制神经炎症及胶质细胞的激活有关。
[关键词]" "神经病理性疼痛;藁本内酯;神经胶质细胞激活;保留性神经损伤;慢性压迫性损伤;小鼠
[中图分类号]" "R741" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)05-0403-08
Analgesic effect of ligustilide on chronic neuropathic pain mouse model*
LI Jiejia1**, WANG Liyun2, ZHANG Hao2, YOU Wenhui2, ZHU Qing2***" " " " (1Center for Translational Research in Neuroscience, the Second Affiliated Hospital of Nantong University, Jiangsu 226014; 2School of Pharmacy, Nantong University)
[Abstract]" "Objective: To investigate the analgesic effect of ligustilide(LIG) on neuropathic pain(NP) mouse model and its possible mechanism. Methods: The mouse models of NP induced by classic spared nerve injury(SNI) and chronic constriction injury(CCI) of the sciatic nerve were established. The effects of a single administration of LIG(20, 40, 80 mg/kg, intraperitoneal injection) and repeated administration of LIG(40, 80 mg/kg, intraperitoneal injection, once per day, for 7 consecutive days) on mechanical allodynia induced by SNI and CCI were investigated. SNI and CCI were performed on the day of the last administration of LIG(40, 80 mg/kg, intraperitoneal injection, once a day for 7 consecutive days), and the preventive effect of LIG treatment on NP was observed. Under the condition of repeated administration of LIG 80 mg/kg, the contents of pro-inflammatory factors such as TNF-α, IL-1β, and IL-6 in the L4-5 spinal cord segment were detected by ELISA on the 5th day after SNI surgery. Immunofluorescence assay was used to observe the number of positive cells for the microglia marker ionized calcium binding adapter molecule 1(IBA-1) to analyze the activation status of microglia. Results: SNI- and CCI-induced NP mouse models were successfully established. Both single administration of LIG and repeated administration of LIG could significantly alleviate SNI- and CCI-induced NP symptoms, and this effect could be maintained for at least 7 days, with no tendency to develop drug tolerance. With an effective dose, LIG did not interfere with the motor function of animals, indicating that its analgesic effect was specific. Repeated administration of LIG before surgery could prevent early mechanical allodynia induced by SNI and CCI, but its maintenance time was limited to 1-2 days. Repeated administration of LIG can decrease the contents of TNF-α, IL-1β and IL-6 in SNI models, and inhibit the SNI-induced activation of microglia. Conclusion: LIG can exert a ameliorative effect on NP symptoms and does not develop tolerance, and repeated administration of LIG before surgery can exert a certain preventive effect on NP. The anti-NP mechanism of LIG may be related to its inhibition of neuroinflammation and activation of glial cells.
[Key words]" "neuropathic pain; ligustilide; glial cell activation; spared nerve injury; chronic constriction injury; mouse
神经病理性疼痛(neuropathic pain, NP)是由躯体感觉神经系统的损伤或疾病引起的疼痛,临床表现为持续或间歇性的自发性痛、诱发痛、痛觉过敏或感觉异常等[1]。NP按损伤或疾病的解剖位置分为周围NP和中枢NP[2]。据流行病学调查[3],美国大约有1/3人口,欧洲有25%~30%人口患有慢性疼痛,其中约有1/5患者经受NP的折磨。NP的人口总体患病率为6.9%~10%[4],据此估计,我国将有数千万甚至上亿人口遭受NP的困扰。NP给患者带来持久的难以忍受的痛苦,并常伴随着焦虑、抑郁及睡眠障碍的发生,给家庭和社会带来了沉重的负担。
NP因病程长、病因复杂、病理机制不明确和对治疗药物产生耐受性,被认为是最难治的疼痛综合征之一,给临床治疗带来了严峻的挑战。目前,临床上广泛使用的镇痛药物常因疗效欠佳及不良反应严重而受限。如传统的非甾体类抗炎药,疗效有限且有胃肠道损伤、肝肾功能损害等不良反应;阿片类镇痛药如吗啡等,长期使用会有呼吸抑制、成瘾、耐受等不良反应;其他药物如抗抑郁药、抗癫痫药等为治疗NP的一线用药,但对中、重度疼痛患者效果不佳[5]。因此,寻找有效、不良反应小、无耐受性及成瘾性的新型治疗靶点的镇痛药物,具有重要的社会和经济学意义。从中草药中寻找抗NP的活性成分并进行相关机制探索是研发新型抗NP药物的重要途径。
藁本内酯(ligustilide, LIG)是传统中药伞形科植物当归挥发油的主要活性成分,也是具有止痛作用的传统中药川芎的主要有效成分之一,分子式为C12H14O2,相对分子质量为190.238。LIG可透过血脑屏障,改善脑微循环和能量代谢,抑制神经细胞调亡,对急慢性脑缺血有明显的治疗作用,可用于防治微循环障碍相关疾病[6-9]。同时,LIG能缓解脂多糖、醋酸或甲醛及完全弗氏佐剂诱导的炎症性疼痛[10-13]。但LIG能否缓解NP,目前尚无报道。由于脊髓神经炎症和神经胶质细胞的激活可能是NP启动和维持所必须经历的一个病理过程[14-15],而LIG被证实具有抑制神经炎症的作用,因此推测LIG对NP也有良好的防治作用。本研究利用经典的保留性神经损伤(spared nerve injury, SNI)和慢性压迫性损伤(chronic constric-tion injury, CCI)动物模型观察LIG对NP的改善作用,并探讨其作用机制是否与神经炎症有关。
1" "材料与方法
1.1 " 实验动物" "雄性ICR小鼠,体质量20~22 g,购于南通大学实验动物中心。实验室保持恒温恒湿:温度(23±1) ℃,湿度(55±10)%,12 h光照(6:00—18:00)。实验之前小鼠适应环境5 d,实验期间小鼠饮食饮水自由。
1.2 " 药品与试剂" "LIG购于南通启翔生物科技有限公司;BCA法蛋白定量试剂盒、NP-40组织蛋白裂解液、PMSF、SDS-PAGE试剂盒、一抗稀释液、二抗稀释液、无RNA酶水、TEMED购于碧云天生物科技有限公司;Tris、甘氨酸、SDS、5×上样缓冲液、蛋白Marker、密理博PVDF膜购于上海优宁维生物科技有限公司。
1.3 " 仪器与设备" "Von-Frey纤维丝:美国Stoelting有限责任公司;YLS-1A多功能小鼠自主活动仪:山东省济南益延仪器科技有限公司;小动物气体麻醉机:上海玉研科学仪器有限公司;多功能酶标仪:美国Bio-Tek公司;BIO-RAD电泳及转印仪、实时荧光PCR仪:美国Bio-Rad公司;化学发光显影仪以及凝胶成像分析系统:美国Thermo Fisher公司;手持式高速匀浆机:上海净信实业公司。
1.4 " SNI模型制备" "SNI手术如文献[16]所述,模型组(Model)小鼠用异氟烷(2%异氟烷混合100%氧气,流速为3 L/min)麻醉,皮肤消毒后,以股骨为标记,在大腿中部做1个1 cm的皮肤切口,钝性分离其肌肉层,暴露其左侧坐骨神经及其3个分支(即腓总神经、胫神经和腓肠神经),在坐骨神经分叉远端,用8-0尼龙缝合结扎腓总神经和胫神经,然后用眼科剪刀剪除这2个分支,每个远端神经残端切除2~4 mm,同时保持腓肠神经完整,避免任何牵拉或接触保留的腓肠神经。同时设立假手术组(Sham),即完成切开皮肤工作,暴露出坐骨神经及其分支,但并不进行对坐骨神经及其分支的手术。然后将肌肉和皮肤缝合。术后置于饲养笼中,正常饮食饮水,第2天测量机械痛缩爪阈值(paw withdrawal threshold, PWT)。
1.5" "CCI模型制备" "如前所述[16],先用2%~3%的异氟烷诱导麻醉,然后1.5%的异氟烷维持麻醉。手术暴露右侧坐骨神经,用6.0号铬制羊肠线将坐骨神经主干松结扎3道,每根结扎线间隔1~2 mm,逐层缝合肌肉和皮肤。术后置于饲养笼中恢复,正常饮食饮水,第2天测量PWT。
1.6" "机械性痛觉阈值测定" "使用Von-Frey纤维丝测定小鼠的PWT。将小鼠置于底部为金属网格的有机分隔玻璃箱中,适应10 min。使用纤维丝对小鼠手术侧后爪的足底边缘脚掌面施加压力(纤维丝稍微弯曲即可)。Von-Frey纤维丝强度按照对数型增加刺激力度(纤维丝弯曲张力等效于0.07、0.16、0.4、0.6、1.0、1.6、2.0 g),每个强度纤维丝在足底测定3次,疼痛阈值记为3次连续测定中至少2次抬足的最小强度。以2.0 g为测量的截断值(cut-off)。
1.7" "小鼠自主活动测定" "使用YLS-1A多功能小鼠自主活动记录仪进行,该设备由1个控制器单元和5个独立的黑色亚克力材质运动腔室组成。每个腔室(12 cm ×15 cm×15 cm)内由四周具有发光束的单元所环绕,并连接到主控制器单元。小鼠在黑暗中被单独放入这些腔室中,在60 min的测试期间记录小鼠自发的运动,当动物穿过1根光束使其被打断时,计为1次。
1.8" "ELISA检测TNF-α、IL-6和IL-1β的含量" "按照ELISA试剂盒说明书操作,检测各组小鼠L4~5节段脊髓组织中TNF-α、IL-6和IL-1β的含量。使用全自动酶标仪检测各组样本的光密度值,计算TNF-α、IL-6和IL-1β的相对含量,并进行统计分析。
1.9" "免疫荧光检测神经胶质细胞的激活" "小鼠麻醉后,用预冷至4 ℃的生理盐水行快速透心灌注,接着灌注4%多聚甲醛溶液约50 mL/只,先快后慢,待小鼠出现全身抽搐的症状时,将滴速调慢约1 滴/min,整个灌注过程约30 min。灌注结束后将脊髓L4~5段小心取出,在4%多聚甲醛溶液中浸泡2 h后固定,随后用20%、30%蔗糖的0.01 mol/L磷酸盐缓冲液(phosphate buffer, PB)进行梯度脱水。然后进行冰冻切片,切片厚25 μm,存放于切片保护液中,-20 ℃保存备用。
每张切片加入含10%山羊血清的工作液(0.5% Triton X-100),在室温下封闭1 h,加入一抗离子钙结合衔接分子1(ionized calcium binding adaptor molecule 1, IBA-1)(1∶500稀释),4 ℃下孵育过夜,第2天加入带荧光标记的二抗(IgG)室温条件下孵育2 h,贴片,用90%甘油防荧光淬灭封片液封片,拍照。在加入各个试剂之前,切片均用0.01 mol/L PB漂洗5 min×3次;在孵育二抗时避光。运用Image J软件进行分析。
1.10" "实验设计
1.10.1" "LIG单次给药对SNI和CCI诱导NP的急性镇痛作用nbsp; "所有小鼠分别于术前测定其PWT基础值(baseline, BL),然后行SNI或CCI手术造模。同时设立假手术组作为空白对照(Sham)。将SNI与CCI模型组各自分成4个组:模型对照组(Vehicle)、LIG 20、40、80 mg/kg 3个剂量组,各组小鼠8只。SNI或CCI术后1 d,即出现明显机械痛阈值降低,给药前测定1次PWT值,然后LIG各剂量组给予各自质量浓度的LIG腹腔注射(10 mL/kg体质量),而Vehicle组给予同等体积的溶剂即0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose, CMC-Na)。给药后30 min开始测定每组PWT值,30 min/次,测定截止时间为4 h。
1.10.2" "LIG反复给药对SNI和CCI诱导的NP的慢性镇痛作用" "上述实验中,LIG 20 mg/kg因为作用不明显,所以只做了LIG 40、80 mg/kg两个质量浓度的慢性给药实验。SNI术后1 d,LIG腹腔注射给药连续7 d,1次/d,并于给药后2 h测定其PWT值(根据急性实验结果得知其最大效应时间为2 h),第8天时不给药,测定其停药后机械痛阈值。
1.10.3" "LIG单次给药对小鼠自主活动的影响" "正常雄性ICR小鼠32只,分成4组,每组8只,即模型对照组(Vehicle)、LIG 20、40、80 mg/kg 3个剂量组。模型对照组给予0.5% CMC-Na。给药后1 h(此时LIG镇痛已经开始起效)在自主活动仪中测定其60 min内自主活动情况。
1.10.4" "术前LIG反复给药对SNI和CCI诱导的NP的预防作用" "正常雄性ICR小鼠24只,分成4组,每组8只,即模型对照组(Vehicle),LIG 40、80 mg/kg 两个剂量组。模型对照组(Vehicle)给予0.5% CMC-Na。LIG 40、80 mg/kg组,给药1 次/d,连续7 d,每隔1 d测定PWT值。于第7天末次给药0.5 h则行SNI术及CCI术,术后24 h测定PWT值,但不予LIG处理,观察其预防作用。
1.10.5" "LIG反复给药对SNI模型诱导的脊髓促炎症因子、胶质细胞激活的影响" "SNI术后1 d给予腹腔注射LIG(40、80 mg/kg)两个剂量,1 次/d。于第5天时,在异氟烷麻醉后,处死小鼠,取材(脊髓L4~5段),分别用于ELISA和免疫荧光实验。研究方案通过南通大学实验动物中心动物实验伦理审查(编号:P20230218-022)。
1.11" "统计学方法" "所有数据均以x±s表示,用Graph Pad Prism 9.0(San Diego, CA, USA)进行统计分析和绘图。Von Frey检验中组间差异采用双因素方差分析(Two-way ANOVA),重复测量以时间为组内因素,剂量为组间因素,采用Bonferroni post hoc分析;其他数据采用单因素方差分析(One-way ANOVA),采用Tukey's HSD post-hoc分析。Plt;0.05表示差异有统计学意义。
2" "结" " " 果
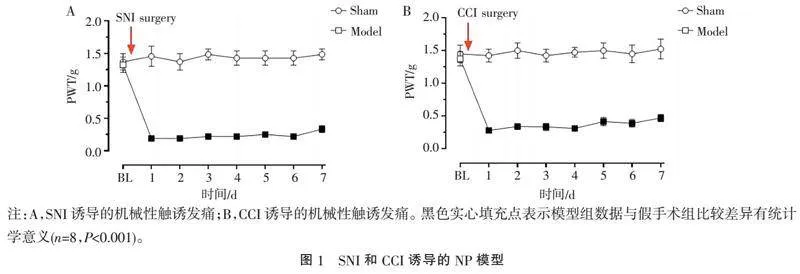
2.1" "SNI和CCI诱导的NP模型的建立" "SNI和CCI诱导的机械性触诱发痛如图1所示,术前各组小鼠机械痛阈BL均相同,而在SNI或CCI术后1 d,模型组(Model)小鼠即出现显著的机械痛觉过敏,而且维持至少7 d,而假手术组(Sham)则在整个测定过程(术后1~7 d)中,均保持在术前的基线值。与假手术组(Sham)相比,在术后1~7 d,模型组(Model)PWT均显著下降(Plt;0.001)。说明SNI和CCI诱导的NP模型建立成功。
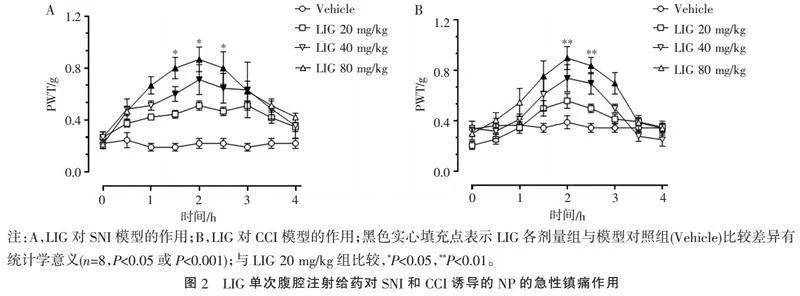
2.2" "LIG单次给药对SNI和CCI诱导的NP的急性镇痛作用" "不同剂量LIG单次腹腔注射给药对SNI和CCI诱导的NP的急性作用如图2所示,LIG呈剂量依赖性缓解SNI和CCI诱导的NP。在SNI模型中,LIG 20 mg/kg组的PWT与Vehicle组相比差异无统计学意义;LIG 40 mg/kg给药后显著提高1.5~3 h的小鼠PWT值(Plt;0.05或Plt;0.001),2 h达最大效应;LIG 80 mg/kg给药后显著提高1.0~3 h的小鼠PWT值(Plt;0.05或Plt;0.001),2 h达最大效应;LIG 80 mg/kg在1.5~2.5 h PWT值显著高于LIG 20 mg/kg组(Plt;0.05)。在CCI模型中,LIG 20 mg/kg组显示差异无统计学意义;LIG 40 mg/kg给药后显著提高2~2.5 h的小鼠PWT值(Plt;0.05或Plt;0.001);LIG 80 mg/kg给药后显著提高1.5~3 h的小鼠PWT值(Plt;0.05或Plt;0.001)。LIG 80 mg/kg在2~2.5 h PWT值显著高于LIG 20 mg/kg组(Plt;0.01)。以上结果说明,LIG单次给药(腹腔注射)对SNI和CCI诱导的NP模型均呈剂量依赖性缓解疼痛过敏的作用,其最大效应时间为2 h,基本在3.5 h时完全消失。
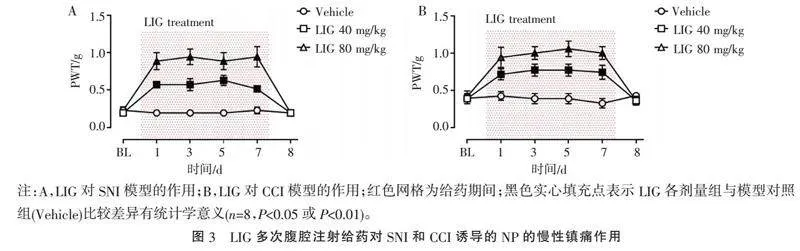
2.3" "LIG反复给药对SNI和CCI诱导的NP的慢性镇痛作用" "进一步观察了LIG反复给药对SNI和CCI模型的镇痛作用是否有产生耐受性倾向,见图3。结果发现,LIG反复给药对SNI和CCI模型的镇痛作用能至少维持7 d,无明显耐受性倾向。LIG 40 mg/kg与80 mg/kg在反复给药期间(1~7 d)均能显著提高SNI模型以及CCI模型小鼠的PWT值(Plt;0.05或Plt;0.001)。LIG停药后第2天,镇痛效应即消失,说明无积累效应,对NP无治愈作用。
2.4" "术前LIG反复给药对SNI和CCI诱导的NP的预防作用" "继续观察在手术造模前给予LIG反复给药处理7 d,对SNI和CCI模型NP的预防作用,见图4。结果发现,LIG反复给药7 d,对SNI和CCI模型NP有一定的预防作用,但仅维持1~2 d。在SNI模型中,LIG 40 mg/kg术前反复给药能提高术后第1天的小鼠PWT值,80 mg/kg术前反复给药能显著提高术后1~2 d的小鼠PWT值(Plt;0.05或Plt;0.001);在CCI模型中,仅有LIG 80 mg/kg术前反复给药能显著提高术后第1天的小鼠PWT值(Plt;0.001),LIG 40 mg/kg术前反复给药有提高趋势,但差异无统计学意义(Pgt;0.05)。说明术前LIG反复给药对SNI和CCI诱导早期NP有一定的改善作用,但作用维持时间不长。
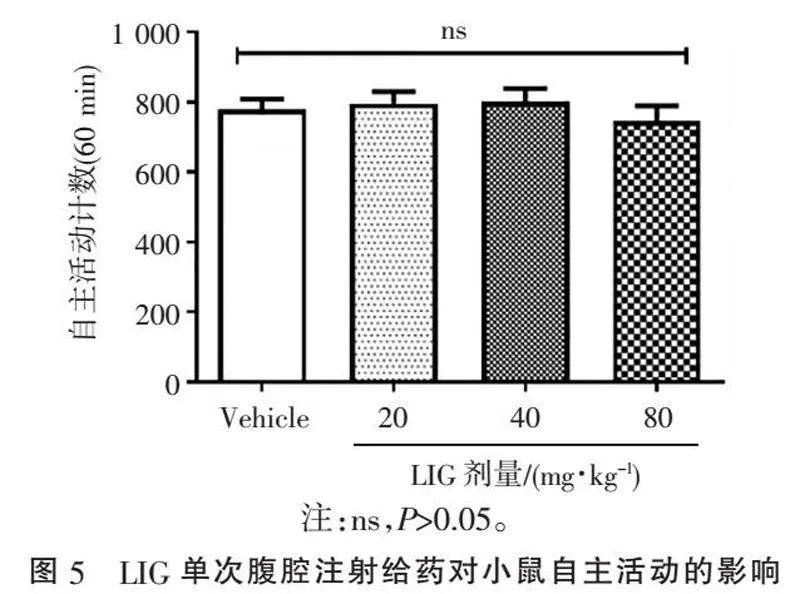
2.5" "LIG单次给药对小鼠自主活动的影响" "为排除LIG通过影响小鼠的运动功能来提高PWT值的假阳性结果,测量了LIG 3种剂量下单次给药对小鼠自主活动的影响,见图5。结果发现,LIG 3个剂量下对小鼠的自主活动均无影响,组间比较差异均无统计学意义(均Pgt;0.05)。说明LIG在镇痛剂量下无镇静效应或损害运动功能,LIG对疼痛过敏的改善作用具有特异性,并不是由镇静或运动损伤等非特异性行为抑制所引起。
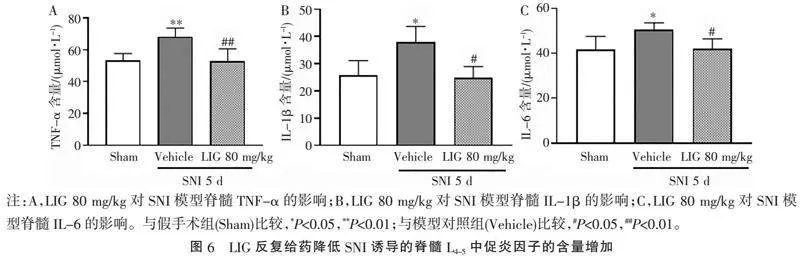
2.6" "LIG反复给药降低SNI诱导的模型脊髓中促炎症因子的含量增加" "检测了LIG 80 mg/kg反复给药期间,在SNI术后第5天小鼠脊髓L4~5中促炎因子TNF-α、IL-1β、IL-6的含量,见图6。结果显示,与Sham组比较,模型对照组(Vehicle)SNI术后第5天脊髓L4~5中TNF-α、IL-1β、IL-6的水平均显著增加(Plt;0.05或Plt;0.01);而与模型对照组(Vehicle)比较,LIG 80 mg/kg反复给药组3种因子的含量均下降(Plt;0.05或Plt;0.001),与Sham组基本齐平。结果表明LIG反复给药能逆转SNI诱导的脊髓促炎因子的增加,可能是LIG缓解神经病理疼痛的作用机制。
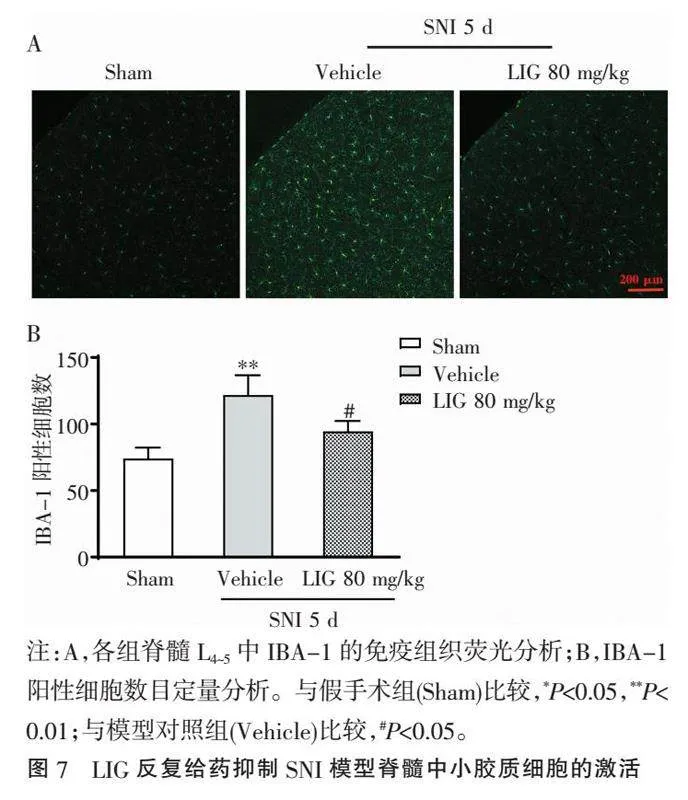
2.7" "LIG反复给药减少SNI模型脊髓中小胶质细胞的激活" "检测了LIG 80 mg/kg反复给药期间,在SNI术后第5天小鼠脊髓L4~5中小胶质细胞激活的情况,见图7。结果发现LIG 80 mg/kg反复给药能抑制SNI诱导脊髓中小胶质细胞标志物IBA-1免疫反应阳性细胞数量的增加,说明LIG能抑制SNI诱导的小胶质细胞的激活。与Sham组相比,SNI模型对照组(Vehicle)小鼠IBA-1阳性细胞数目显著增多(Plt;0.001);而与模型对照组(Vehicle)比较,LIG处理则可明显减少SNI模型中IBA-1阳性细胞数量(Plt;0.05),但并不能逆转至术前正常水平[与Sham组比较,Plt;0.05)]。结果提示,SNI术后第5天时存在明显的小胶质细胞激活情况,而LIG反复给药处理能抑制小胶质细胞激活。
3" "讨" " " 论
本研究发现LIG单次给药与反复多次给药均能显著缓解SNI及CCI诱导的NP症状,作用至少能维持7 d,无耐受性产生倾向。在有效剂量下LIG并不干扰动物的运动功能,说明其镇痛作用具有特异性。术前LIG反复给药能预防SNI与CCI诱导的早期机械痛觉过敏,但维持时间有限(1~2 d)。LIG反复给药处理能降低SNI模型促炎因子TNF-α、IL-1β及IL-6的水平,抑制SNI诱导的小胶质细胞的激活。表明LIG对外周神经损伤导致的NP有防治作用,可能与其抑制神经炎症以及小胶质细胞的激活有关。
NP是源于神经系统病理性功能紊乱的疼痛,其主要原因有带状疱疹感染后引起的神经痛、糖尿病引发的多发性神经痛、三叉神经痛、持续的术后或创伤后疼痛、癌症患者的疼痛和AIDS病毒感染患者的疼痛等[17]。在此基础上于CCI或SNI术后24 h进行LIG单次给药检测其急性治疗作用。结果发现在这两种慢性NP模型中,LIG治疗以剂量和时间依赖性的方式减轻了机械性触诱发痛,最大效应时间为2 h,于3.5 h效应基本消失。由于LIG所使用剂量(20~80 mg/kg)没有显著降低小鼠自发运动活动,说明其对小鼠无镇静作用。因此认为LIG对机械性触诱发痛的改善作用具有特异性,并不是由于镇静或运动损伤等非特异性行为抑制所引起。
慢性疼痛通常被描述为持续3个月以上的持续疼痛状态。慢性疼痛的治疗需要进行反复给药,这可能导致镇痛耐受性。例如,在有效剂量水平,每日使用吗啡等类阿片治疗4~7 d足以产生显著的抗伤害耐受性[18]。因此,检测了LIG反复多次给药对慢性NP的抗痛觉异常作用是否会导致耐受性。在SNI和CCI模型中,LIG(40、80 mg/kg)重复给药治疗呈剂量依赖性地减轻机械性触诱发痛,并且在整个7 d的日常治疗期间没有显示出耐受性的趋势。故推测如果继续延长LIG用于治疗慢性疼痛,在此期间出现耐受性的可能性也比较低。结果还发现,反复每日用LIG(40、80 mg/kg)治疗7 d,而在第8天停止用药,测定其机械性触诱发痛,发现作用消失,说明每次治疗作用不能持续到第2天,无蓄积效应产生,也说明LIG为期7 d的治疗并未产生治愈效应,需要长期服用药物。这与急性LIG治疗的效果在给药3.5 h后几乎完全消失的结果一致。结果表明,重复LIG治疗可能是控制NP的有效策略。此外,在SNI及CCI术前每日用LIG(40、80 mg/kg)给药,连续7 d,以观察LIG对NP的预防作用。使用预防性药物有利于降低疼痛敏感的程度。LIG术前反复处理能稍减轻SNI和CCI手术后1~2 d的机械性触诱发痛程度,说明LIG对SNI与CCI诱导的早期机械性触诱发痛有预防作用,但维持时间有限(1~2 d)。
近年来,神经炎症以及神经胶质细胞的激活在神经病理疼痛中发挥的重要作用受到越来越多的学者关注[15, 19]。当外周神经损伤时,在外周神经与中枢神经中一些促炎因子包括IL-1β、IL-6和TNF-α生成增加。这些促炎因子在神经损伤后的神经炎症反应以及中枢神经系统的致敏中起着至关重要的作用,参与了痛觉过敏、机械性触诱发痛以及神经瘤的形成。中枢神经系统中胶质细胞(主要是星形胶质细胞和小胶质细胞),约占70%,其数量远远超过神经元,在维持系统的稳态中起着重要作用。小胶质细胞和星形胶质细胞在神经系统损伤后表现出动态可塑性,由静止或静止表型转变为反应性表型,然后作为免疫应答细胞调节神经元活动[3]。神经损伤后,神经元释放的分子参与了小胶质细胞的活动,导致小胶质细胞形态发生变化,并迁移到损伤部位,促进其增殖。周围神经损伤后,脊髓内的小胶质细胞被激活并发生明显的形态学改变,且伴随小胶质细胞标志物如CD11b和IBA-1表达增加。另外,小胶质细胞被激活后会导致促炎因子的合成和分泌增加,如TNF-α、IL-1β、IL-6的表达增加。而目前研究[13, 20]已证实这些促炎因子能增强与维持慢性疼痛,鞘内注射促炎因子TNF-α、IL-1β、IL-6会诱发机械性触摸诱发痛以及热痛觉过敏。而给予这些促炎因子的抑制剂则能缓解慢性NP和炎症痛[21]。小胶质细胞激活不仅参与NP的起始阶段,对于NP长期的维持与发展也是必不可少的[22]。本研究结果显示在SNI术后第5天,即出现小胶质细胞激活,而且促炎因子TNF-α、IL-1β、IL-6表达增加,和文献[23]报道一致。而LIG反复给药能降低脊髓促炎因子TNF-α、IL-1β、IL-6表达,抑制脊髓IBA-1的表达上调,提示可能通过抑制脊髓小胶质细胞激活,减少促炎因子的释放,从而达到缓解NP的作用。而本课题组之前报道[13]的LIG能抑制完全弗式佐剂诱导的胶质细胞激活,并减少促炎因子产生也有力支撑了本研究结果。令人奇怪的是,在术前反复给予LIG预防给药7 d,而即使术后停药,也能在一定程度上缓解早期(1~2 d)的NP症状,但是在术后反复给药治疗7 d时,需要长期给药,一旦停药,则对NP镇痛作用消失。因此推测在术前以及围术期给药LIG,对NP的启动因子可能有一定微弱的抑制作用。但术后NP的启动开始后,由于神经炎症的级联反应作用,LIG处理只在有效浓度范围内能减轻炎症,一旦浓度下降,则会导致镇痛作用逐渐消失。
综上所述,LIG剂量依赖性缓解SNI以及CCI诱导的NP症状,其作用能至少维持7 d且不产生耐受性,术前反复给药对NP有一定预防作用,其治疗机制可能与其抑制神经炎症以及小胶质细胞的激活有关。这为LIG在临床上用于NP的防治提供科学实验依据。
[参考文献]
[1]" "JENSEN T S, BARON R, HAANPÄÄ M, et al. A new definition of neuropathic pain[J]. Pain, 2011, 152(10):2204-2205.
[2]" "SCHOLZ J, FINNERUP N B, ATTAL N, et al. The IASP classification of chronic pain for ICD-11: chronic neuropathic pain[J]. Pain, 2019, 160(1):53-59.
[3]" "COHEN S P, MAO J R. Neuropathic pain: mechanisms and their clinical implications[J]. BMJ, 2014, 348:f7656.
[4]" "VAN HECKE O, AUSTIN S K, KHAN R A, et al. Neuropathic pain in the general population: a systematic review of epidemiological studies[J]. Pain, 2014, 155(4):654-662.
[5]" "GILRON I, JENSEN T S, DICKENSON A H. Combination pharmacotherapy for management of chronic pain: from bench to bedside[J]. Lancet Neurol, 2013, 12(11):1084-1095.
[6]" "FENG Z B, LU Y P, WU X M, et al. Ligustilide alleviates brain damage and improves cognitive function in rats of chronic cerebral hypoperfusion[J]. J Ethnopharmacol, 2012, 144(2):313-321.
[7]" "KUANG X, WANG L F, YU L, et al. Ligustilide ameliorates neuroinflammation and brain injury in focal cerebral ischemia/reperfusion rats: involvement of inhibition of TLR4/peroxiredoxin 6 signaling[J]. Free Radic Biol Med, 2014, 71:165-175.
[8]" "LI J J, ZHU Q, LU Y P, et al. Ligustilide prevents cognitive impairment and attenuates neurotoxicity in D-galactose induced aging mice brain[J]. Brain Res, 2015, 1595:19-28.
[9]" "WU X M, QIAN Z M, ZHU L, et al. Neuroprotective effect of ligustilide against ischaemia-reperfusion injury via up-regulation of erythropoietin and down-regulation of RTP801[J]. Br J Pharmacol, 2011, 164(2):332-343.
[10]" "DU J R, YU Y, KE Y, et al. Ligustilide attenuates pain behavior induced by acetic acid or formalin[J]. J Ethnopharmacol, 2007, 112(1):211-214.
[11]" "QIAN B, LI F, ZHAO L X, et al. Ligustilide ameliorates inflammatory pain and inhibits TLR4 upregulation in spinal astrocytes following complete Freund’s adjuvant peripheral injection[J]. Cell Mol Neurobiol, 2016, 36(1):143-149.
[12]" "ZHAO L X, JIANG B C, WU X B, et al. Ligustilide attenuates inflammatory pain via inhibition of NFκB-mediated chemokines production in spinal astrocytes[J]. Eur J Neurosci, 2014, 39(8):1391-1402.
[13]" "ZHU M D, ZHAO L X, WANG X T, et al. Ligustilide inhibits microglia-mediated proinflammatory cytokines production and inflammatory pain[J]. Brain Res Bull, 2014, 109:54-60.
[14]" "JI R R, XU Z Z, GAO Y J. Emerging targets in neuroinflammation-driven chronic pain[J]. Nat Rev Drug Discov, 2014, 13:533-548.
[15]" "ZHANG Z J, JIANG B C, GAO Y J. Chemokines in neuron-glial cell interaction and pathogenesis of neuropathic pain[J]. Cell Mol Life Sci, 2017, 74(18):3275-3291.
[16]" "DECOSTERD I, WOOLF C J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain[J]. Pain, 2000, 87(2):149-158.
[17]" "FINNERUP N B, KUNER R, JENSEN T S. Neuropathic pain: from mechanisms to treatment[J]. Physiol Rev, 2021, 101(1):259-301.
[18]" "BORONAT M A, OLMOS G, GARCÍA-SEVILLA J A. Attenuation of tolerance to opioid-induced antinociception and protection against morphine-induced decrease of neurofilament proteins by idazoxan and other I2-imidazoline ligands[J]. Br J Pharmacol, 1998, 125(1):175-185.
[19]" "INOUE K, TSUDA M. Microglia in neuropathic pain: cellular and molecular mechanisms and therapeutic potential[J]. Nat Rev Neurosci, 2018, 19(3):138-152.
[20]" "LEE J Y, CHOI H Y, JU B G, et al. Estrogen alleviates neuropathic pain induced after spinal cord injury by inhibiting microglia and astrocyte activation[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(7):2472-2480.
[21]" "SOMMER C, LEINDERS M, ÜÇEYLER N. Inflammation in the pathophysiology of neuropathic pain[J]. Pain, 2018, 159(3):595-602.
[22]" "ECHEVERRY S, SHI X Q, YANG M, et al. Spinal microglia are required for long-term maintenance of neuropathic pain[J]. Pain, 2017, 158(9):1792-1801.
[23]" "SCHOLZ J, ABELE A, MARIAN C, et al. Low-dose methotrexate reduces peripheral nerve injury-evoked spinal microglial activation and neuropathic pain behavior in rats[J]. Pain, 2008, 138(1):130-142.
[收稿日期] 2024-08-03
