黄芪甲苷通过调控Wnt/β-catenin信号通路对人成纤维细胞凋亡和肌成纤维细胞转化的作用
2024-12-13肖雪飞刘石符艳游柏稳



〔摘要〕 目的 利用转化生长因子β1(transforming growth factor-β1, TGF-β1)刺激人成纤维细胞HFL-1模拟特发性肺纤维化的病理过程,探讨黄芪甲苷(astragaloside-Ⅳ, AS-Ⅳ)对人成纤维细胞凋亡和肌成纤维细胞转化的作用和机制。方法 采用10 ng/mL TGF-β1刺激HFL-1细胞,给予不同浓度(0、1.25、2.5、5、10 μmol/L)的AS-Ⅳ溶液干预24 h后,利用RT-PCR检测纤连蛋白(fibronectin, FN)mRNA表达量。随后细胞分为空白组、TGF-β1组、TGF-β1+AS-Ⅳ组、TGF-β1+XAV939组。采用流式细胞术检测细胞凋亡率;采用RT-PCR法检测α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、FN、重组人胶原蛋白-1(collagenⅠ)、B淋巴细胞瘤2(B-cell lymphoma 2, Bcl-2)及Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax) mRNA表达情况;采用免疫荧光法检测α-SMA、上皮细胞钙黏蛋白(E-Cadherin)、collagenⅠ、FN、β-联蛋白(β-catenin)及半胱氨酸蛋白酶蛋白-3(Cleaved Caspase-3)的蛋白表达;Western blot检测FN、β-catenin、Cleaved Caspase-3蛋白表达水平。结果 与空白组比较,TGF-β1组细胞凋亡率上升(Plt;0.05),FN、collagenⅠ、α-SMA和Bcl-2 mRNA表达增加(Plt;0.05),Bax mRNA表达减少(Plt;0.05),α-SMA、collagenⅠ、FN、Cleaved Caspase-3及β-catenin蛋白表达增加(Plt;0.05);与TGF-β1组比较,TGF-β1+AS-Ⅳ组和TGF-β1+XAV939组细胞凋亡率下降(Plt;0.05),FN、collagenⅠ、α-SMA和Bcl-2 mRNA表达减少(Plt;0.05),Bax mRNA表达增加(Plt;0.05),α-SMA、collagenⅠ、FN、Cleaved Caspase-3及β-catenin蛋白表达减少(Plt;0.05);与TGF-β1+XAV939组相比较,TGF-β1+AS-Ⅳ组细胞凋亡率下降(Plt;0.05),FN、collagenⅠ、Bcl-2和α-SMA mRNA表达量降低(Plt;0.05),Bax mRNA表达量增加(Plt;0.05)。结论 AS-Ⅳ可抑制TGF-β1诱导的HFL-1细胞凋亡和肌成纤维细胞转化,该作用可能与Wnt/β-catenin信号通路有关。
〔关键词〕 黄芪甲苷;特发性肺纤维化;成纤维细胞;肌成纤维细胞转化;Wnt;β-联蛋白;凋亡
〔中图分类号〕R285.5" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.12.006
Effects of astragaloside-Ⅳ on human fibroblast apoptosis and myofibroblast transformation by regulating Wnt/β-catenin signaling pathway
XIAO Xuefei1, LIU Shi1, FU Yan1, YOU Baiwen2*
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China
〔Abstract〕 Objective To simulate the pathological process of idiopathic pulmonary fibrosis (IPF) by stimulating human fibroblast (HFL-1) cells with transforming growth factor-β1 (TGF-β1), and to explore the effects and mechanism of astragaloside-Ⅳ (AS-Ⅳ) on human fibroblast apoptosis and myofibroblast transformation. Methods HFL-1 cells were stimulated with 10 ng/mL TGF-β1 and then treated with different concentrations (0, 1.25, 2.5, 5, 10 μmol/L) of AS-Ⅳ solution for 24 h. The mRNA expression of fibronectin (FN) was determined by RT-PCR. Subsequently, the cells were divided into blank group, TGF-β1 group, TGF-β1+AS-Ⅳ group, and TGF-β1+XAV939 group. Flow cytometry was used to measure cell apoptosis rate, RT-PCR to examine the mRNA expressions of α-smooth muscle actin (α-SMA), FN, recombinant human collagen-1 (collagen Ⅰ), B-cell lymphoma 2 (Bcl-2), and Bcl-2 associated X protein (Bax), immunofluorescence to determine the protein expressions of α-SMA, E-Cadherin, collagen Ⅰ, FN, β-catenin, and Cleaved Caspase-3, and Western blot to check the protein expression levels of FN, β-catenin, and Cleaved Caspase-3. Results The optimal concentration of AS-Ⅳ for inhibiting FN expression was 5 μmol/L. Compared with the blank group, the cell apoptosis rate in the TGF-β1 group increased (Plt;0.05), the mRNA expressions of FN, collagen Ⅰ, α-SMA, and Bcl-2 were elevated (Plt;0.05), while Bax mRNA expression decreased (Plt;0.05). Additionally, the protein expressions of α-SMA, collagen Ⅰ, FN, Cleaved Caspase-3, and β-catenin also increased (Plt;0.05). Compared with the TGF-β1 group, both the TGF-β1+AS-Ⅳ group and TGF-β1+XAV939 group showed decreased cell apoptosis rates (Plt;0.05), reduced mRNA expressions of FN, collagen Ⅰ, α-SMA, and Bcl-2 (Plt;0.05), increased Bax mRNA expression (Plt;0.05), and decreased protein expressions of α-SMA, collagen Ⅰ, FN, Cleaved Caspase-3, and β-catenin (Plt;0.05). Compared with the TGF-β1+XAV939 group, the cell apoptosis rate in the TGF-β1+AS-Ⅳ group decreased (Plt;0.05), the mRNA expressions of FN, collagen Ⅰ, Bcl-2, and α-SMA decreased (Plt;0.05), while that of Bax increased (Plt;0.05). Conclusion AS-Ⅳ can inhibit TGF-β1-induced HFL-1 cell apoptosis and myofibroblast transformation, which may be related to the Wnt/β-catenin signaling pathway.
〔Keywords〕 astragaloside-Ⅳ; idiopathic pulmonary fibrosis; fibroblast; myofibroblast transformation; Wnt; β-catenin; apoptosis
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种常见的以气道重塑、炎症、肺泡破坏和纤维化为特征的致死性间质性肺病[1-2]。IPF也是进展最快的纤维化疾病之一,其诊断后中位生存期为3.5年[3],5年生存率仅为20%~30%[4]。近十年,IPF相关临床试验呈指数级增长,其中吡非尼酮和尼达尼布这两种药物用于治疗IPF[5-6]。然而,该药物只能减缓患者疾病进展的速度,进行性的肺纤维化最终仍会导致患者死亡。因此,目前迫切需要新的抗纤维化药物延缓IPF患者的疾病进程,改善患者的生活质量。临床研究及荟萃分析结果表明,中药在改善IPF患者的肺功能、运动能力和生活质量等方面具有良好的疗效[7-8]。中医立足于患者整体,其治疗作用具有多环节、多靶点的特点。
目前研究认为,IPF发病的主要原因是反复肺泡上皮细胞(alveolar epithelial cell, AEC)损伤[9-10]。初始损伤会导致AEC异常激活,从而在纤维化环境中聚集产生胶原的成纤维细胞和肌成纤维细胞。肌成纤维细胞不存在于正常肺组织中,但肌成纤维细胞是胶原和其他基质蛋白的重要产生者,促进成纤维细胞凋亡和抑制成纤维细胞向肌成纤维细胞转化,能有效抑制肺纤维化[11]。而转化生长因子β1(transforming growth factor-β1, TGF-β1)促进肌成纤维细胞分化和胶原表达的关键细胞因子,在肺纤维化的进展中起到了重要的作用[12]。迄今为止,已提出通过3种肌成纤维细胞募集机制,肺成纤维细胞的增殖和分化、上皮间充质转化、骨髓来源的纤维细胞或循环祖细胞向成纤维细胞的转化,其中纤连蛋白(fibronectin, FN)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、重组人胶原蛋白-1(collagenⅠ)是成纤维细胞转化肌成纤维细胞过程中常见的标志物,在肺纤维化发生发展中发挥着重要作用[13]。
Wnt/β-联蛋白(Wnt/β-catenin)是一个在进化上高度保守的细胞信号系统,在胚胎发育、维持器官及组织稳态方面,发挥了至关重要的作用,并且与人类许多疾病的发病机制有关。目前,已有大量研究证实经典的Wnt/β-catenin通路在肺纤维化起到重要的作用。SONG等[14]研究发现,Wnt1处理人成纤维细胞能促进细胞增殖,使得α-SMA、波形蛋白和Ⅰ型胶原表达量显著增加。从博来霉素诱导的肺纤维化大鼠提取支气管肺泡灌洗液培养人成纤维细胞也能起到相同作用,而转染β-catenin shRNA序列可抑制这一过程。由此可知Wnt1/β-catenin信号通路可促进人成纤维细胞增殖,诱导人成纤维细胞转化为肌成纤维细胞,促进细胞外基质沉积。
黄芪甲苷(astragaloside-Ⅳ, AS-Ⅳ)是黄芪的有效活性成分之一,是我国药典检测黄芪质量的指标成分之一。目前,AS-Ⅳ的抗纤维化作用已得到研究证实。研究发现,AS-Ⅳ能够通过减少细胞外基质沉积、氧化应激和炎症反应,改善博来霉素诱导的大鼠肺纤维化[15-16],但其作用机制有待进一步探究。本实验研究以人成纤维细胞HFL-1细胞作为研究对象,探讨AS-Ⅳ通过调控Wnt/β-catenin信号通路对人成纤维细胞凋亡和肌成纤维细胞转化的作用。
1 材料
1.1" 细胞
人成纤维细胞HFL-1细胞(武汉普诺赛生命科技有限公司,货号:CL-0106)。
1.2" 药品与试剂
AS-Ⅳ(上海研域生物科技有限公司,批号:110781-200512);含L-丙氨酰-L-谷氨酰胺的完全培养基、胎牛血清、青链霉素混合液(武汉普诺赛生命科技有限公司,批号分别为PM150910、164210、PB180120);胰蛋白酶(美国Cytiva公司,批号:SH40003.01);细胞凋亡检测试剂盒(苏州四正柏生物公司,批号:20220718);TGF-β1抗体(美国Peprotech公司,批号:100-21-10uG);蛋白裂解液、BCA蛋白浓度测定试剂盒、蛋白酶抑制剂、磷酸酶抑制剂、山羊抗兔免疫球蛋白抗体、山羊抗鼠免疫球蛋白抗体(中国Abiowell公司,批号分别为AWB0136、AWB0104、AWH0645、AWH0650、AWS0002、AWS0
001);mRNA逆转录试剂盒、miRNA逆转录试剂盒(中国北京康为世纪生物科技有限公司,批号分别为CW2569、CW2141);总RNA抽提试剂盒(美国Thermo公司,批号:15596026);β-actin抗体、PCNA抗体、FN抗体、GAPDH抗体(美国proteintech公司,批号分别为66009-1-Ig、10205-2-AP、66042-1-Ig、10494-1-AP);β-catenin抗体(湖南艾方生物公司,批号:AF10715);半胱氨酸蛋白酶蛋白-3(Cleaved Caspase-3)抗体(美国CST公司,批号:9664T);抗荧光淬灭封片剂(美国South biotech公司,批号:0100-01);Tankyrase抑制剂XAV939(美国Target Molecule Corp公司,批号:225249)。
1.3" 仪器
HERAcell2401型CO2培养箱(美国Thermo Fisher公司);XDS-3型倒置生物显微镜(中国粤显光学仪器有限责任公司);Enspire 型多功能酶标仪(美国Perkinelmer公司);H1850R型台式冷冻离心机(中国湖南湘仪公司);BD FACSAria Ⅲ流式细胞仪(美国Becton Dickinson公司);TS-1型水平摇床(中国江苏其林贝尔公司);DYCP-31BN型电泳槽、DYCZ-40D型蛋白转印槽、DYCZ-24FN型高电流电泳仪(北京六一生物科技有限公司);ChemiScope 6000系列化学发光成像系统(中国勤翔公司);ViiATM 7型荧光定量PCR仪(美国Thermo公司);BioDrop ulite型核酸蛋白浓度测定仪(英国Biochrom公司);Eclipse CI型正置荧光显微镜、DS-u3型成像系统(日本尼康公司)。
2 方法
2.1" 细胞培养
人胚肺成纤维细胞HFL-1细胞用含1%青链霉素和10%胎牛血清的含L-丙氨酰-L-谷氨酰胺的完全培养基在37 ℃ 5%CO2条件下的恒温培养箱中培养,待细胞融合度达到80%时进行传代。
2.2" AS-Ⅳ药物溶液配制
AS-Ⅳ用二甲基亚砜溶解成高浓度(100 mmol/L)的储备液,分装后-20 ℃避光保存;临用时用含L-丙氨酰-L-谷氨酰胺的完全培养基稀释成5 μmol/L的干预浓度。
2.3" 细胞分组与干预
HFL-1细胞分为空白组、TGF-β1组、TGF-β1+AS-Ⅳ组、TGF-β1+XAV939组。其中,空白组给予含L-丙氨酰-L-谷氨酰胺的完全培养基培养24 h;TGF-β1组给予含10 ng/mL TGF-β1的培养基干预24 h,观察细胞形态,细胞从椭圆形变成长条形;TGF-β1+AS-Ⅳ组给予含10 ng/mL TGF-β1和5 μmol/L AS-Ⅳ培养基干预24 h;TGF-β1+XAV939组给予含10 ng/mL TGF-β1和5 μmol/L XAV939培养基干预24 h[17]。
2.4" 指标检测
2.4.1" 最佳浓度的选取" 取对数生长期HFL-1细胞胰蛋白酶消化后细胞计数,6孔板每孔加入HFL-1细胞悬液,培养过夜后,每孔加入100 μL基础培养基同步化24 h,分为6组。空白组不含细胞、只含等体积培养基;其余5组加入10 ng/mL TGF-β1,再分别加入0、5、10、20、40 μmol/L的AS-Ⅳ分别加入TGF-β1组、5 μmol/LAS-Ⅳ组、10 μmol/LAS-Ⅳ组、20 μmol/LAS-Ⅳ组、40 μmol/LAS-Ⅳ组。继续在培养箱中孵育72 h,随后采用RT-PCR检测FN的mRNA表达量。半抑制浓度(half maximal inhibitory concentration, IC50)=抑制率/抑制剂浓度-log(抑制率/抑制剂浓度),采用GraphPad Prism 9.0软件计算相应的IC50值。
2.4.2" 流式细胞术检测细胞凋亡率" 用细胞凋亡检测试剂盒进行流式细胞术测定,取对数生长期HFL-1细胞,用2.3所示干预浓度及分组处理,24 h后收集细胞上清液至离心管,用不含EDTA的胰蛋白酶消化贴壁细胞,将消化好的细胞与收集好的上清混合后离心,吸除上清液,用预冷PBS洗涤2次后加入100 μL 1×结合缓冲液重悬细胞,每管细胞分别加入5 μL的FITC-Annexin V和5 μL的PI工作液,放置室温避光孵育10 min,再加入400 μL的PBS混合后用流式细胞仪进行检测,结果用FlowJo软件分析。
2.4.3" RT-PCR法检测FN、collagenⅠ、Bax、Bcl-2、α-SMA mRNA的表达" 细胞按2.3的分组方法给药,用RNA提取液提取总RNA,采用mRNA逆转录试剂盒将RNA转录为cDNA,反应条件为50 ℃ 50 min,85 ℃ 5 min。引物由北京擎科生物科技有限公司合成,详见表1。以反转录后的cDNA为模板,GAPDH为内参,对各基因进行PCR扩增,扩增采用95 ℃变性15 s,60 ℃退火60 s,40个循环,65 ℃延伸1 min。使用2-ΔΔCt法计算mRNA的相对表达量。
2.4.4" 免疫荧光染色法检测α-SMA、E-Cadherin、collagenⅠ、FN、Cleaved Caspase-3、β-catenin蛋白表达" 细胞按2.3的分组方法给药后,用4%多聚甲醛固定15 min。加入100 μL破膜工作液,室温孵育10 min,3% BSA封闭30 min。分别加入α-SMA(1∶100)、E-Cadherin(1∶200)、collagenⅠ(1∶200)、FN(1∶200)、Cleaved Caspase-3(1∶200)、β-catenin(1∶200)一抗稀释液4 ℃孵育。PBS洗涤后加二抗稀释液室温孵育,孵育完成后PBS洗涤,再加DAPI染液室温避光染色,用抗荧光淬灭封片剂封片,于荧光显微镜下观察并采集图像,使用Image J软件分析平均荧光强度。
2.4.5" Western blot检测FN、β-catenin、Cleaved Caspase-3蛋白表达水平" 按2.3的分组方法给药后,使用RIPA裂解液提取总蛋白,用BCA法测定蛋白浓度。再进行聚丙烯酰胺凝胶电泳,然后将凝胶上的蛋白转移到PVDF膜上,用封闭液室温封闭2 h,加入β-actin(1∶5 000)、PCNA(1∶5 000)、FN(1∶5 000)、GAPDH(1∶5 000)、β-catenin(1∶1 000)、Cleaved Caspase-3(1∶1 000)一抗,4 ℃孵育过夜。膜用TBST洗3次,加入二抗(1∶5 000)室温下孵育2 h,TBST洗3次后显影成像,用Image J软件对结果进行分析。
2.5" 统计学分析
本实验数据由GraphPad Prism 9.0软件进行统计分析,实验数据符合正态分布用“x±s”表示,多组间比较使用单因素方差分析,多重比较使用Holm-Sidak检验。数据不符合正态性和(或)方差齐性用Kruskal-Wallis检验。
3 结果
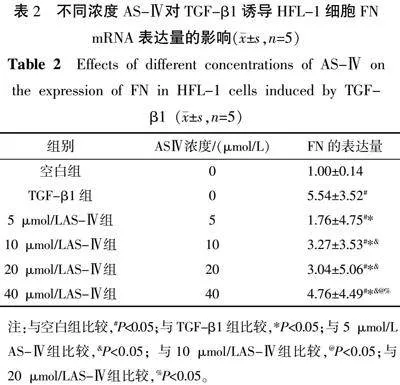
3.1" AS-Ⅳ最佳浓度的筛选
与空白组比较,其余各组细胞FN mRNA表达量上升(Plt;0.05);与TGF-β1组比较,AS-Ⅳ各浓度组细胞FN mRNA表达量均下降(Plt;0.05);与5 μmol/L AS-Ⅳ组比较,10 μmol/L AS-Ⅳ组、20 μmol/L AS-Ⅳ组、40 μmol/LAS-Ⅳ组细胞FN的mRNA表达量上升(Plt;0.05);与10、20 μmol/L AS-Ⅳ组比较,40 μmol/L AS-Ⅳ组细胞FN的mRNA表达量上升(Plt;0.05)。经计算IC50值,5 μmol/L AS-Ⅳ组、10 μmol/L
AS-Ⅳ组、20 μmol/L AS-Ⅳ组、40 μmol/L AS-Ⅳ组的IC50值分别为1.01、1.43、1.70、2.46,所以选择5 μmol/L的AS-Ⅳ组为后续实验组。详见表2。
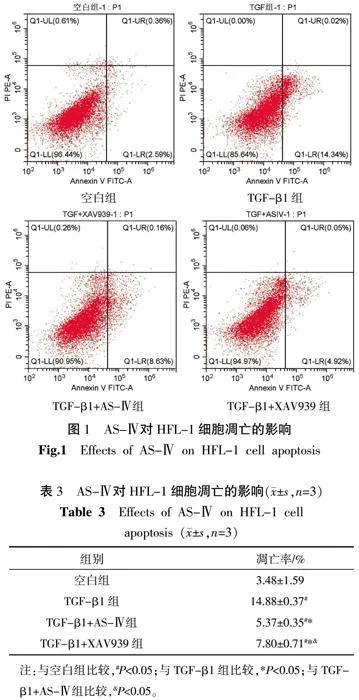
3.2" AS-Ⅳ对TGF-β1诱导下HFL-1细胞凋亡的影响
与空白组比较,其余各组细胞凋亡率升高(Plt;0.05);与TGF-β1组比较,TGF-β1+AS-Ⅳ组和TGF-β1+XAV939组细胞凋亡率降低(Plt;0.05);与TGF-β1+AS-Ⅳ组比较,TGF-β1+XAV939组细胞凋亡率升高(Plt;0.05)。详见图1、表3。
3.3" AS-Ⅳ对TGF-β1诱导下HFL-1细胞FN、collagenⅠ、Bax、Bcl-2、α-SMA mRNA的表达
与空白组比较,其余各组FN、collagenⅠ、Bcl-2和α-SMA mRNA表达量增加(Plt;0.05),Bax mRNA表达量降低(Plt;0.05)。与TGF-β1组比较,TGF-β1+AS-Ⅳ组和TGF-β1+XAV939组FN、collagenⅠ、Bcl-2、α-SMA mRNA表达量降低(Plt;0.05),Bax mRNA表达量增加(Plt;0.05)。与TGF-β1+AS-Ⅳ组比较,TGF-β1+XAV939组FN、collagenⅠ、Bcl-2、α-SMA mRNA表达量增加(Plt;0.05),Bax mRNA表达量降低(Plt;0.05)。详见表4。
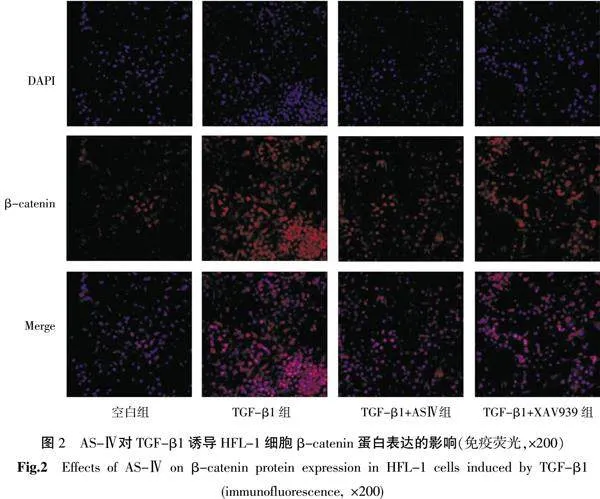
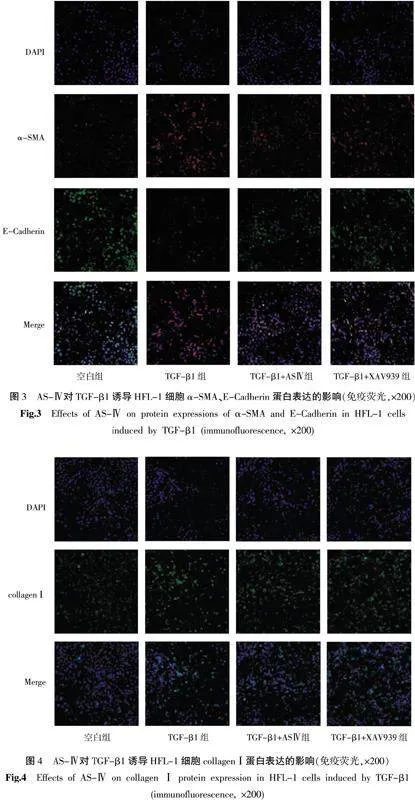
3.4" 免疫荧光染色法检测α-SMA、E-Cadherin、collagenⅠ、FN、Cleaved Caspase-3、β-catenin的蛋白表达
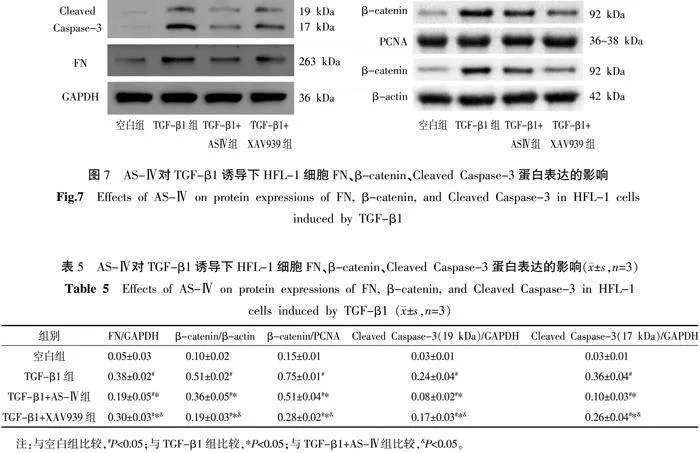
与空白组比较,其余各组α-SMA、collagenⅠ、FN、Cleaved Caspase-3、β-catenin蛋白表达量增加(Plt;0.05),E-Cadherin蛋白表达量减少(Plt;0.05)。与TGF-β1组比较,TGF-β1+AS-Ⅳ组和TGF-β1+XAV939组α-SMA、collagenⅠ、FN、Cleaved Caspase-3、β-catenin蛋白表达量减少(Plt;0.05),E-Cadherin蛋白表达量增加(Plt;0.05)。与TGF-β1+AS-Ⅳ组比较,FN、Cleaved Caspase-3蛋白表达量下降(Plt;0.05)。详见图2—6。
3.5" Western blot检测FN、β-catenin、Cleaved Caspase-3的蛋白表达
与空白组比较,其余各组的FN、β-catenin、Cleaved Caspase-3蛋白表达升高(Plt;0.05);与TGF-β1组比较,TGF-β1+AS-Ⅳ组和TGF-β1+XAV939组FN、β-catenin、Cleaved Caspase-3蛋白表达降低(Plt;0.05);与TGF-β1+AS-Ⅳ组比较,TGF-β1+XAV939组的FN、Cleaved Caspase-3蛋白表达升高(Plt;0.05),β-catenin的蛋白表达降低(Plt;0.05)。详见图7、表5。
4 讨论
IPF属于中医学“肺痿”“肺痹”范畴,发病原因复杂,基本病机为肺虚络瘀、本虚标实,本虚为肺、脾、肾三脏皆虚,标实为痰浊、瘀血痹阻于肺络[18-20],治疗上应补肺健脾益肾、祛痰活血通络[21]。黄芪具有补肺健脾、补气活血的功效。AS-Ⅳ为中药黄芪的药理成份,现代药理学研究发现,AS-Ⅳ可增强机体免疫力及抗病能力,改善肺功能,能延缓肺纤维化发展[22]。研究发现,AS-Ⅳ可以通过miR-21介导的途径激活肺泡细胞自噬,从而抑制IPF发生发展[23]。TONG等[24]使用博来霉素诱导小鼠IPF的发生,结果显示,黄芪甲苷治疗后可以减少羟脯氨酸的合成,延缓肺纤维化的发展。同样有研究表明,AS-Ⅳ还可通过能被转化生长因子激活的长链非编码RNA/微小RNA-200c/锌指转录因子1信号通路抑制上皮间充质转化和肺纤维变性[25]。
Wnt参与细胞增殖、分化与再生,其经典通路通过调控下游关键转录因子β-catenin以激活Wnt/β-catenin 信号通路,随后相关配体与受体结合形成蛋白复合体,调控肺组织血管新生,对损伤的气道内皮细胞进行修复,促使间质纤维细胞激活与重构,引起肺组织胶原沉积,参与IPF进程[26]。研究使用 Wnt/β-catenin信号通路抑制剂后发现,Wnt相关配体与LRP-5/6共受体,发生竞争性结合,减弱了信号之间的传导,从而逆转了肺成纤维细胞和肌成纤维细胞的增殖与分化,从而发挥改善IPF的作用。OKAZAKI等[27]使用新型Wnt/β-catenin/结合蛋白信号抑制剂 PRI-724,能通过调节肺中巨噬细胞的活性,从而改善博来霉素诱导的小鼠肺纤维化,因此,Wnt/β-catenin信号通路与肺纤维化的发生发展密切相关。中医药治疗肺纤维化源远流长,许多研究发现,某些中药单体的有效成分,尤其是苷类化合物可以通过调控Wnt/β-catenin信号通路从而抑制肺纤维化的发生发展[28]。有研究证实,用淫羊藿苷作用于肺成纤维细胞后,下调了氧化产物的浓度,同时提高了抗氧化物水平,从而抑制肺纤维化的产生,这与抑制Wnt/β-catenin信号传导相关[29]。WANG等[30]通过博来霉素诱导小鼠肺纤维化,使用五味子苷进行干预后检测相关指标发现相关炎症因子、Wnt及β-catenin等的表达受到抑制。
本研究流式细胞术检测结果显示,AS-Ⅳ能够抑制TGF-β1诱导下HFL-1细胞的凋亡。RT-PCR法检测结果显示,TGF-β1处理能够上调人成纤维细胞转化为肌成纤维细胞过程中标志物α-SMA、FN、collagenⅠ、抗凋亡蛋白Bcl-2 mRNA的表达,下调促凋亡蛋白Bax mRNA的表达;而AS-Ⅳ能够下调α-SMA、FN、collagenⅠ、抗凋亡蛋白Bcl-2表达,上调促凋亡蛋白Bax表达。本实验通过Western blot法检测相关蛋白表达,结果提示TGF-β1诱导HFL-1细胞后,FN、β-catenin、Cleaved Caspase-3蛋白表达增加,AS-Ⅳ作用后蛋白表达下降,同样免疫荧光染色检测结果显示TGF-β1诱导HFL-1细胞后α-SMA、E-Cadherin、collagenⅠ、FN、β-catenin、Cleaved Caspase-3蛋白表达增加,AS-Ⅳ作用后蛋白表达下降。结果证明,AS-Ⅳ能够抑制TGF-β1所诱导的细胞凋亡,抑制肌成纤维细胞转化,其作用机制可能与Wnt/β-catenin信号通路密切相关。
综上,本研究发现AS-Ⅳ能够抑制TGF-β1诱导的HFL-1细胞凋亡和肌成纤维细胞转化,该作用可能与Wnt/β-catenin信号通路有关,为AS-Ⅳ治疗IPF的临床应用提供了理论依据。
参考文献
[1] 黄" 元, 管艳云, 蔡欣蕊, 等. 特发性肺纤维化发病机制的研究进展[J]. 中国医刊, 2024, 59(10): 1054-1059.
[2] 宋思雨, 丁" 露, 赵美茹, 等. 特发性肺纤维化中医病机及防治策略的研究进展[J]. 中华中医药杂志, 2024, 39(11): 6020-6025.
[3] 曹" 婷. 特发性肺纤维化患者预后相关指标的临床研究[D]. 郑州: 郑州大学, 2020.
[4] 欧阳小荔, 彭" 红. 特发性肺纤维化预后的影响因素[J]. 中国呼吸与危重监护杂志, 2021, 20(11): 824-830.
[5] 宋" 璐, 李红燕, 姚" 渊, 等. 吡非尼酮联合尼达尼布对特发性肺纤维化治疗的作用[J]. 深圳中西医结合杂志, 2022, 32(24): 105-108.
[6] 邓" 泽, 戢新平. 吡非尼酮联合尼达尼布治疗特发性肺纤维化患者的临床研究[J]. 中国临床药理学杂志, 2022, 38(11): 1174-1176, 1194.
[7] 唐会猛, 田燕歌, 杨曙光, 等. 基于数据挖掘和网络药理学探究中医药治疗特发性肺纤维化的用药规律及作用机制[J]. 中医研究, 2024, 37(6): 61-69.
[8] 邹恩国, 黄天宇, 王木兰, 等. 特发性肺纤维化的发病机制及中药调节作用研究进展[J]. 中国实验方剂学杂志, 2024, 30(10): 280-289.
[9] 韩晓静, 韩齐齐, 钱" 峰. 特发性肺纤维化的炎症机制与潜在药物靶标[J]. 中国药理学通报, 2024, 40(5): 828-832.
[10] 李斯宇, 庞立健, 吕晓东, 等. 特发性肺纤维化复杂网络发病机制与络病理论[J]. 中华中医药杂志, 2022, 37(2): 640-645.
[11] ZHANG J X, HUANG P J, WANG D P, et al. m6A modification regulates lung fibroblast-to-myofibroblast transition through modulating KCNH6 mRNA translation[J]. Molecular Therapy, 2021, 29(12): 3436-3448.
[12] 张映驰, 史新琛, 吴梦宇, 等. 转化生长因子β1及相关生物分子在肺纤维化中作用的研究进展[J]. 现代预防医学, 2021, 48(13): 2473-2478.
[13] BOROK Z. Role for alpha3 integrin in EMT and pulmonary fibrosis[J]. The Journal of Clinical Investigation, 2009, 119(1): 7-10.
[14] SONG P, ZHENG J X, LIU J Z, et al. Effect of the Wnt1/β-catenin signalling pathway on human embryonic pulmonary fibroblasts[J]. Molecular Medicine Reports, 2014, 10(2): 1030-1036.
[15] LI L C, XU L, HU Y, et al. Astragaloside Ⅳ improves bleomycin-induced pulmonary fibrosis in rats by attenuating extracellular matrix deposition[J]. Frontiers in Pharmacology, 2017, 8: 513.
[16] YU W N, SUN L F, YANG H. Inhibitory effects of astragaloside Ⅳ on bleomycin-induced pulmonary fibrosis in rats via attenuation of oxidative stress and inflammation[J]. Inflammation, 2016, 39(5): 1835-1841.
[17] 李" 妲, 沈" 枭, 吴趋荟, 等. 柴胡含药血清通过Smad3/Rheb轴调节HFL1细胞凋亡和肌成纤维细胞转化[J]. 中国实验方剂学杂志, 2023, 29(11): 89-96.
[18] 邹吉宇, 庞立健, 吕晓东, 等. “肺虚络瘀”病机观与“机械应力异常”在特发性肺纤维化发病过程中的相关性[J]. 中华中医药杂志, 2024, 39(2): 686-689.
[19] 王" 省, 李" 艳, 周" 璐, 等. 浅析特发性肺纤维化的病机及治法[J]. 中医学报, 2023, 38(5): 978-982.
[20] 于睿智, 庞立健, 王天娇, 等. 从虚、毒、痰、瘀辨治特发性肺纤维化[J]. 中华中医药杂志, 2022, 37(10): 5815-5818.
[21] 王彦君, 王雪林, 李欣泽, 等. 中医药治疗特发性肺纤维化研究[J]. 中国中医基础医学杂志, 2021, 27(6): 1033-1035.
[22] 叶" 敏, 何光亮, 刘" 磊, 等. 黄芪甲苷在肺部疾病防治中的作用和机制研究进展[J/OL]. 中华中医药学刊, 1-15[2024-04-03]. http://kns.cnki.net/kcms/detail/21.1546.r.20241121.1042.078.html.
[23] LI T H, GAO X J, JIA R, et al. Astragaloside Ⅳ inhibits idiopathic pulmonary fibrosis through activation of autophagy by miR-21-mediated PTEN/PI3K/AKT/mTOR pathway[J]. Cellular and Molecular Biology, 2024, 70(2): 128-136.
[24] TONG J H, WU Z S, WANG Y C, et al. Astragaloside Ⅳ synergizing with ferulic acid ameliorates pulmonary fibrosis by TGF-β1/Smad3 signaling[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021: 8845798.
[25] GUAN Y Y, ZHANG J, CAI X R, et al. Astragaloside Ⅳ inhibits epithelial-mesenchymal transition and pulmonary fibrosis via lncRNA-ATB/miR-200c/ZEB1 signaling pathway[J]. Gene, 2024, 897: 148040.
[26] 周云越, 陈星彤, 杨金彪, 等. 肺纤维化中Wnt/β-catenin和TGF-β1/Smad信号通路之间的串扰研究[J/OL]. 海南医学院学报, 1-10[2024-12-03]. https://doi.org/10.13210/j.cnki.jhmu.20241108.002.
[27] OKAZAKI H, SATO S, KOYAMA K, et al. The novel inhibitor PRI-724 for Wnt/β-catenin/CBP signaling ameliorates bleomycin-induced pulmonary fibrosis in mice[J]. Experimental Lung Research, 2019, 45(7): 188-199.
[28] 邓雅茹, 陈同生. 中药单体抗肺纤维化研究进展[J/OL]. 中医学报, 1-6[2024-04-03]. http://kns.cnki.net/kcms/detail/41.1411.R.20240729.1640.056.html.
[29] 王" 培. 淫羊藿苷通过Wnt/β-catenin信号通路对肺纤维化的作用机制研究及相关临床分析[D]. 济南: 山东中医药大学, 2018.
[30] WANG Y, DONG X M, ZHAO N, et al. Schisandrin B attenuates bleomycin-induced pulmonary fibrosis in mice through the wingless/integrase-1 signaling pathway[J]. Experimental Lung Research, 2020, 46(6): 185-194.
〔基金项目〕湖南省中医药科研计划项目(2021165)。
〔通信作者〕*游柏稳,男,博士,主任医师,硕士研究生导师,E-mail:1326493020@qq.com。
