利用植物病原真菌除草的研究进展
2024-12-11谢文李力

谢文,李力.利用植物病原真菌除草的研究进展[J].福建农业科技,2024,55(9):01-07.
优秀学者论坛
李力,1977年生,博士,福建师范大学生命科学学院教授、博士生导师,主要从事微生物天然产物的发现与基因组挖掘研究,近年来主要针对真菌或放线菌基因组的信息,通过基因激活技术和异源表达手段,挖掘出新颖、有活性的天然产物。主持完成国家重点研发计划合成生物学专项课题“先导化合物生物合成路径的解析及骨架相关元件库的构建”、国家自然科学基金面上项目“一种靶向AHAS的真菌天然除草化合物的发现及作用机制”以及福建省自然科学基金面上项目、福建省第五轮卫生教育联合攻关计划项目等,以第一作者或通讯作者在《Journal of Agricultural and Food Chemistry》《Journal of the American Chemical Society》等学术期刊发表论文40多篇,涵盖天然产物生物合成、真菌新颖化合物发现等领域。兼任中国微生物学会分子微生物学及生物工程专业委员会委员,中国菌物学会药用真菌专业委员会委员。
摘要:杂草对农业生产危害巨大,长期使用化学除草剂带来诸多问题,促使新型环保高效除草剂的开发需求迫切。植物病原真菌源除草剂是利用活体真菌或其代谢产物开发的生物除草剂,具有资源丰富、低毒性、环境污染小等优点,成为新型除草剂开发的重要资源。文章总结了具有除草活性的植物病原真菌及其代谢产物的种类,综述了利用植物病原真菌除草机理及应用现状,并对未来植物病原真菌源除草剂的发展进行了展望。
关键词:植物病原真菌;真菌次级代谢产物;除草活性
中图分类号:S476.7文献标志码:A文章编号:0253-2301(2024)09-0001-07
DOI:10.13651/j.cnki.fjnykj.2024.09.001
Research Progress on Weed Control by Using Plant Pathogenic Fungi
XIE Wen,LI Li*
(College of Life Sciences,Fujian Normal University,Fuzhou,Fujian 350007,China)
Abstract:Weeds are very harmful to agricultural production,and the long-term use of chemical herbicides has brought many problems,which has prompted the urgent need for the development of new environmentally friendly and efficient herbicides.The herbicides derived from plant pathogenic fungi are biological herbicides developed by usingthe living fungi or their metabolites,which have the advantages of abundant resources,low toxicity and low environmental pollution.They have become an important resource for the development of new type of herbicides.In this paper,the types of plant pathogenic fungi and their metabolites with herbicidal activity were summarized.The weed control mechanism and application status of plant pathogenic fungi were reviewed,and the development of herbicides derived from plant pathogenic fungi in the future was prospected.
Keywords:Plant pathogenic fungi;Fungal secondary metabolites;Herbicidal activity
中国是全球杂草危害最为严重的国家之一,杂草种类超过1400种,种类多,发生面积广,每年农田杂草的发生面积超过93000000 hm²,造成粮食减产超300万t[1。传统化学除草剂虽然在一定程度上有效控制了杂草,但其长期大量使用不仅导致了环境污染、土壤退化等生态问题,导致杂草产生了抗药性,使得杂草的治理变得更加复杂和困难2。因此,开发新型、环保且高效的除草剂已成为推动农业可持续发展的迫切需求。
植物病原真菌作为自然界中广泛分布的微生物资源,具有独特的侵染机制和丰富的生物活性代谢产物,为新型除草剂的研发提供了丰富的来源³植物病原真菌能够直接侵染杂草并导致其枯萎死亡,或通过其生长过程中产生的次级代谢产物抑制杂草的生长4]。这些真菌及其代谢产物作用机制独特,不易引发杂草抗药性,且具有易降解、低毒性、对环境污染小等优点,是新型生物除草剂极具潜力的候选资源s
近年来,随着分子生物学、代谢组学等技术的快速发展,对植物病原真菌及其代谢产物的研究不断深入,越来越多的具有除草活性的真菌及其代谢产物被发现和鉴定6。目前植物病原真菌除草剂的研究仍处于起步阶段,商业化应用面临诸多挑战,如生产设备要求高、货架期短、质量不稳定等问题有待解决7。因此,本文旨在通过总结植物病原真菌及其代谢产物的除草活性,探讨其除草机理,评价其在农作物和果园杂草治理中的应用潜力,为新型生物除草剂的研发和应用提供理论参考和技术支持。
1植物病原真菌除草剂类型
植物病原真菌除草制剂依据其除草活性成分划分为两大类:一是活体植物病原真菌及其制剂,这类除草剂的核心是利用能够感染并导致特定杂草病害的真菌孢子悬液及其制剂,来源于植物的感病组织、根际微生物群落以及特殊生态环境中的微生物资源8。二是植物病原真菌的次级代谢产物,这一类除草剂则依赖于真菌生长过程中产生的具有除草活性的次级代谢产物,主要包括聚酮类、萜类等化合物[9
1.1活体植物病原真菌
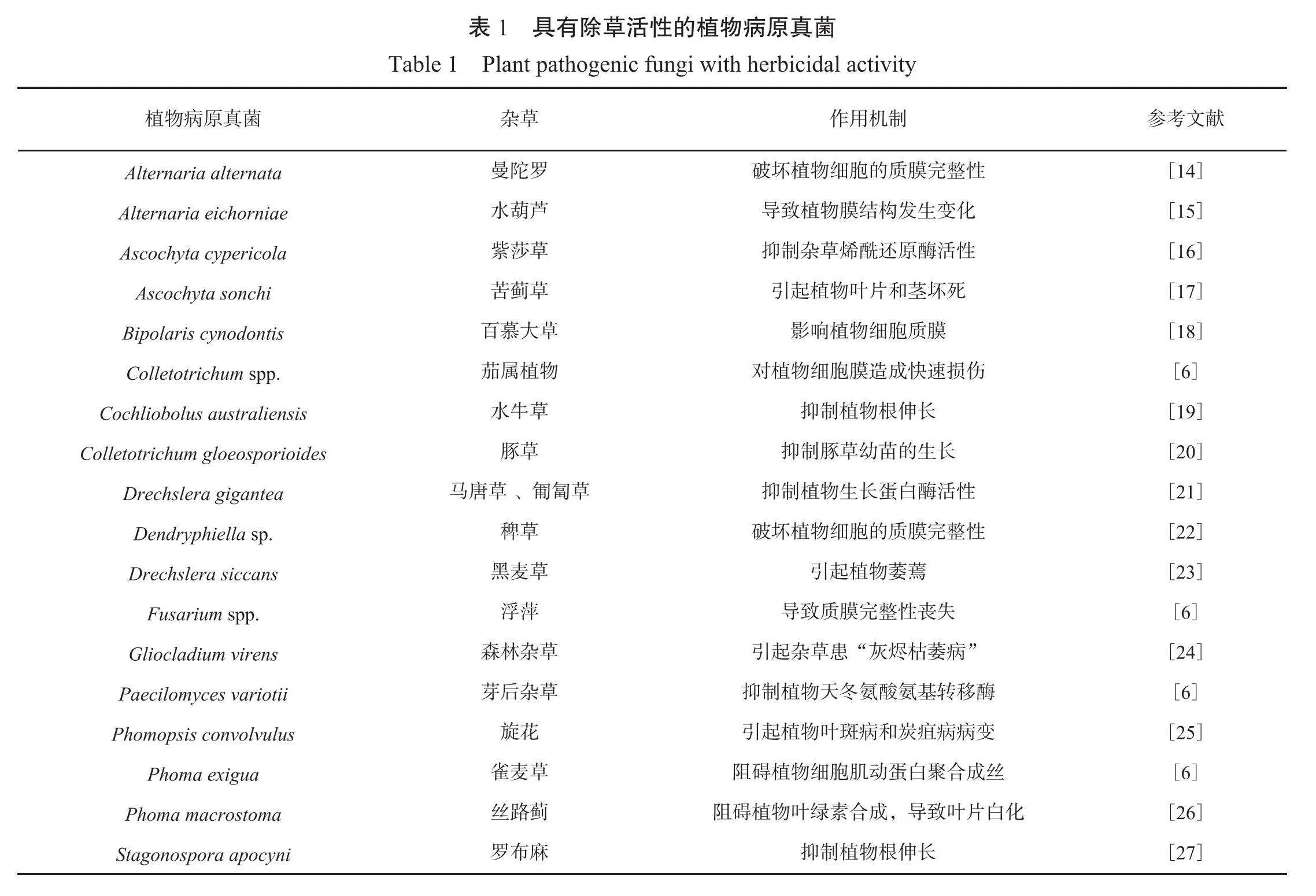
植物病原真菌是指寄生于植物并引起植物病害的一类真菌,但对于杂草而言,它们可以诱导杂草病害致死,成为合成天然除草剂的重要来源101。目前为止,已经被报道的具有除草活性的植物病原真菌见表1。
植物病原真菌的孢子是其繁殖和传播的主要方式之一。孢子悬浮液是将真菌孢子分散在水或其他介质中形成的混合物,具有高度的感染性和传播性,能够侵染杂草的根部、茎部或叶片等组织1。为了增强孢子的稳定性和感染性,通常会将其加工成各种制剂,如可湿性粉剂、乳油等。这些制剂在施用后能够迅速在杂草表面形成一层有效的覆盖层,从而提高真菌对杂草的侵染能力[12]。近年来越来越多的研究发现,从病害植物中分离出的致病真菌及其培养物有望开发为高效除草活性物质。Nestor等³首次报道了菜豆壳球孢菌Macrophominaphaseolina对田间杂草的致病性,从表现出病害症状的田间旋花叶子中分离出两株具有致病性真菌,分别为菜豆壳球孢菌Macrophomina phaseoli和链格孢菌Alternaria alternata,生长试验结果显示2株真菌对田间旋花幼苗干重的抑制率可达48%,致病率达到67%,并且在鹰嘴豆、菜豆、高粱、玉米或番茄植株上未观察到抑制作用。
1.2植物病原真菌代谢产物
植物病原真菌在生长和代谢过程中能够产生多种具有除草活性的次级代谢产物。这些活性代谢物的化学结构复杂多样,作为合成绿色除草剂的先导化合物或作用于杂草特定的分子靶标28]。截至目前,已经被报道的具有除草活性的真菌代谢化合物至少有545种,其中60%以上属于聚酮类化合物和萜类化合物9]。
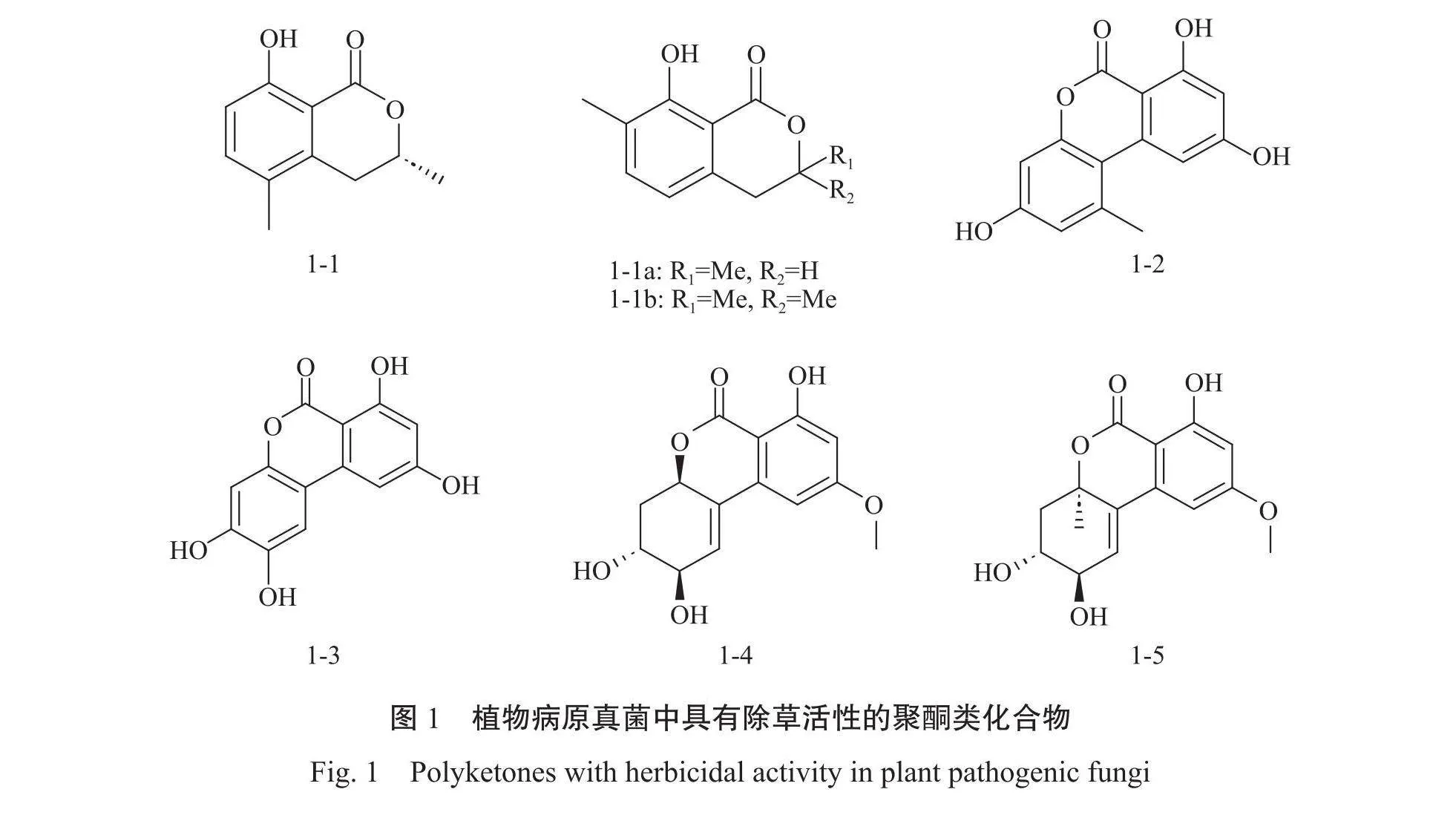
1.2.1聚酮类化合物具有除草活性的真菌次级代谢产物中有近一半属于芳香族聚酮类化合物,它们均由多酶复合体-聚酮合酶(PKS)催化合成,具有高度的结构多样性和生物活性9。Meepagala等²从植物病原真菌间座壳菌属Diaportheeres的液体发酵物中分离出5-methylmellein(图1-1),5-methylmellein对莴苣Lactuca sativa和翦股颖Agrostis stolonifera均表现出显著的除草活性,进一步挖掘5-methylmellein的生物活性潜力,对5-methylmellein的部分活性位点进行修饰,获得6个5-methylmellein的衍生聚酮化合物,其中衍生
物1(图1-1a)和衍生物2(图1-1b)在针对莴苣的毒性评估中表现尤为突出,其IC₅o值分别达到了41μmol-L¹和37μL¹,显著高于原始化合物5-methylmellein的毒性。Tang等30从苍耳Xanthium italicum的病原体真菌链格孢属Alternaria sp.中分离链格孢醇alternariol(图2-2)及其类似物alternuisol(图1-3),这2种化合物对狼尾草Pennisetum alopecuroides和苜蓿Medicago sativa的芽和根生长产生了显著的抑制作用。Huang等31研究进一步扩展了链格孢属真菌的除草活性谱,他们从同一属的不同菌株中分离出altenuene(图1-4)和isoaltenuene(图1-5)。这2种化合物对苋菜Amaranthus retroflexus L.和生菜的根、下胚轴伸长有抑制作用。
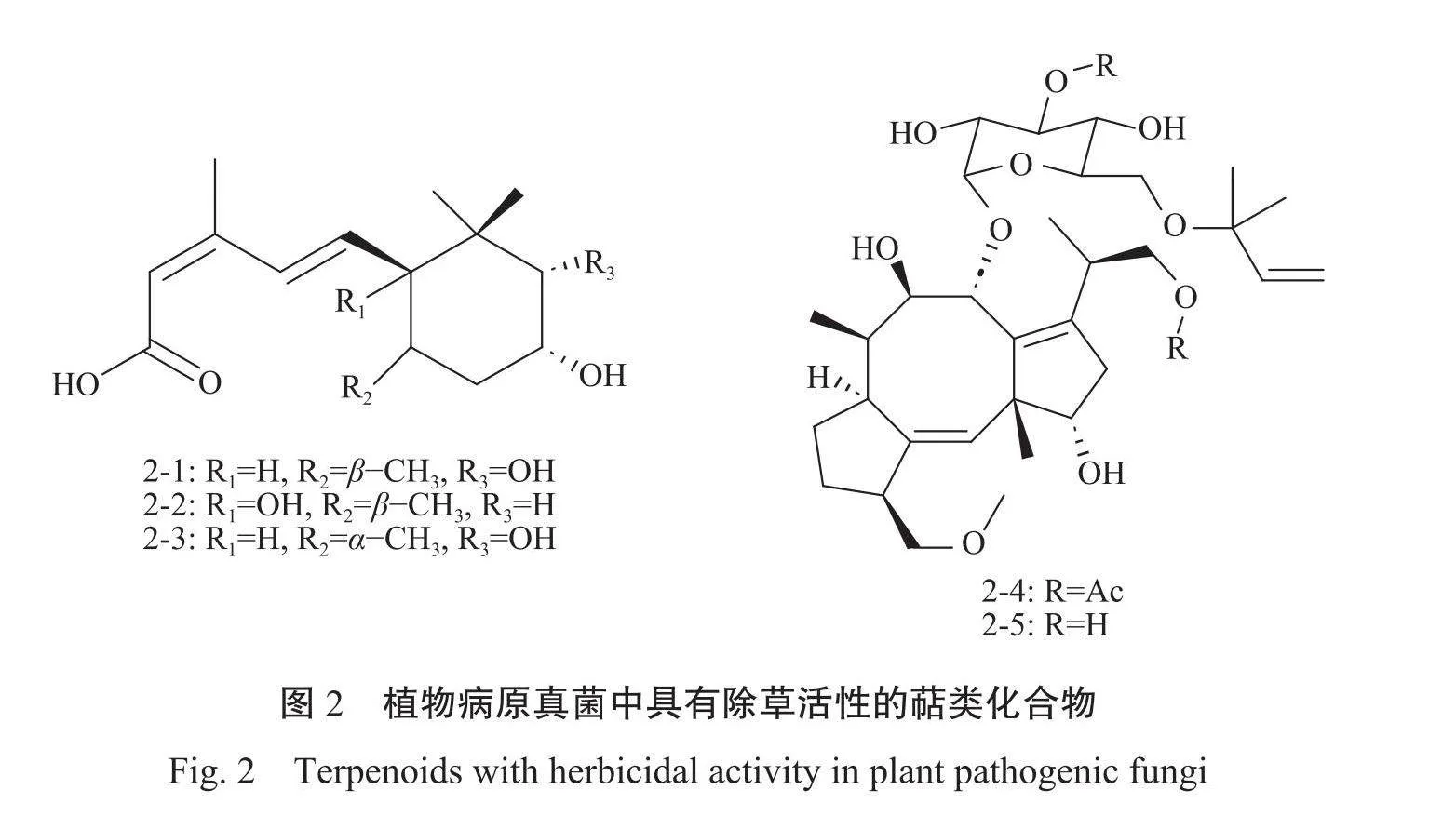
1.2.2萜类化合物萜类化合物是以异戊二烯单元为基本结构单元的化合物及其衍生物,在除草方面展现出了显著的活性和潜力9。Pyrenophorasemeniperda是一种存在于鸡麦草Bromus tectorum种子的病原菌,自然情况下可抑制种子萌发。2014年,Marco等[32从Pyrenophorasemeniperda的小麦培养物中分离得到倍半萜类化合物pyreno-phoric acid(图2-1),其结构与脱落酸相似,具有潜在除草活性。在对该菌的进一步分析中分离纯化出2个pyrenophoric acid的衍生物,命名为pyreno-phoricacidB(图2-2)和pyrenophoricacidC(图2-3),其结构变化分别为C-7位氧化成羟基和C-1与C-2差向异构。这3种化合物均能抑制金针幼草的胚芽伸长,其中C-7位氧化成羟基的化合物pyrenophoric acid B对金针幼草胚芽伸长的抑制效果最为显著。在机制研究上发现,pyrenophoric acid B作用于宿主短链醇脱氢酶(ABA2)水平,并激活脱落酸(ABA)生物合成途径,诱导宿主产生大量脱落酸抑制种子萌发,导致杂草死亡[33。
Fusicoccn A(图2-4)和dideacetylfusicoccin A(图2-5)是Fernandez-Aparicio等[3从植物病原真菌(Phomopsis amygdali)分离出2种具有独特O-异戊二烯化葡萄糖结构的二萜糖苷类化合物,它们能特异性地抑制寄生杂草列当属(Orobanche)的生长。这两种化合物在特定浓度范围内展现出对寄生杂草列当属(Orobanche)种子发芽的显著抑制效果,特别是在10-⁷M浓度时抑制率达到55%。进一步的机制研究表明,fusicoccn A通过与植物14-3-3蛋白的疏水空腔结合,稳定质膜H-ATPase C端磷酸化结构域的相互作用,进而促进气孔开放,最终导致植物死亡35]。这一发现为开发针对Orobanche物种的高效生物除草剂提供了重要的科学依据。
2除草机理
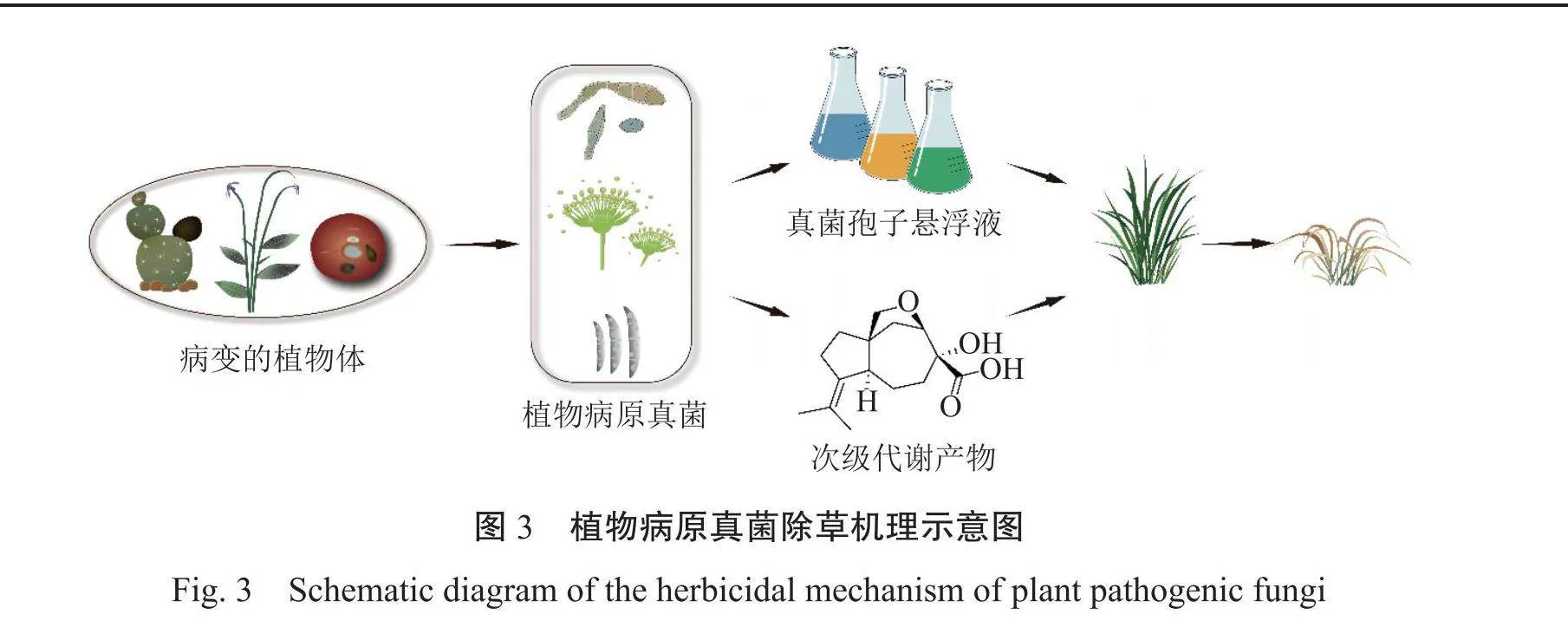
植物病原真菌除草机理示意图见图3。植物病原真菌通过活体孢子直接侵染杂草宿主使其枯萎致死,其有活性的代谢产物通过作用于植物细胞生长繁殖的多个关键位点,影响杂草的正常生理功能36。
2.1利用活体植物病原真菌除草
活体植物病原真菌利用孢子或菌丝体直接穿透植物表皮的屏障,进而侵入植物体内来实现其致病过程。一日进入植物体内,这些真菌会分泌一系列具有特定酶活性的分子,如纤维素酶、肽酶以及蛋白酶等。这些酶通过降解宿主细胞的细胞壁结构,以及破坏或调控宿主生长代谢途径中的关键蛋白质等,从而有效抑制植物的正常生长与发育,最终导致植物病害的发生与蔓延[377。镰刀菌属真菌通过菌丝侵染和分泌细胞壁降解酶来使杂草致病。例如,串珠镰刀菌Fusarium moniliforme能够潜入稗草的根系,通过分泌多种细胞壁降解酶直接破坏细胞壁的完整性,促进真菌菌丝在植物体内的蔓延。同时,串珠镰刀菌合成的镰刀菌酸等毒素,能够干扰杂草的代谢途径,特别是抑制呼吸链中的关键酶,导致能量供应中断,最终使杂草枯萎而死。
2.2利用真菌次级代谢产物靶标除草
真菌的次级代谢产物靶向作用于杂草生长代谢过程中的关键酶、受体或其他蛋白来抑制杂草生长,具有专一性强、活性高、低毒性等优点28。从土曲霉Aspergillus terreus中分离的aspterric acid能够靶向抑制二羟酸脱水酶(DHAD)的活性,从而阻断支链氨基酸的合成途径,达到抑制杂草生长的效果[39。此外,利用自抗性基因共定位策略是挖掘真菌除草活性产物的有效策略[40]。以合成支链氨基酸的关键酶乙酰乳酸合酶(ALS)为探针,在亮白曲霉(Aspergillus candidus)中发现了合成氯黄酮的生物合成基因簇。氯黄酮具有抑制拟南芥种子萌发的活性,具有开发为除草剂的潜力417
3利用植物病原真菌除草应用现状
3.1在农作物杂草治理上的应用
天然来源的植物病原真菌除草剂具有低毒性、易降解、对环境污染小等优点Is]。目前,已经有一些利用植物病原真菌开发的除草剂在农作物杂草治理中得到了应用。1987年,在美国登记的Dr.Biosedge除草剂,它是采用纵沟柄锈菌Pucciniacanaliculata制备的孢子制剂,有粉剂和颗粒型,可用来防治稻田里的油莎草,它通过侵染杂草的茎叶或根系,破坏其组织结构,导致杂草死亡。适量与苯达松、苄嘧磺隆等化学除草剂配合使用可以防治稗草、千金子等多种杂草42;我国第一个应用于杂草防治的植物病原真菌除草剂—“鲁保一号”,它是从病害菟丝子中分离出的一种胶孢炭疽菌Colletotrichum gloeosporioides,其通过孢子吸附、侵染杂草,并分泌大量毒素,破坏细胞,使其死亡,现已广泛应用于大豆菟丝子的防治,防治效果高达100%[43]。它有效解决了菟丝子对大豆产量的严重影响,特别是在中国主要大豆产区,这一杂草的广泛分布和严重危害得到了有效控制。
3.2在果园杂草治理上的应用
植物病原真菌及其次级代谢产物在果园杂草控制领域的应用研究,近年来引起了广泛的关注[44]。这些天然产物不仅为传统化学除草剂提供了潜在的替代选择,还因其独特的作用机制和更低的毒性、更短的残留期而备受青睐。从链格孢属Alternaria分离出的代谢产物AAL-毒素通过抑制龙葵和曼陀罗等果园常见杂草的神经酰胺合酶活性,破坏细胞膜结构和功能,最终导致植物枯亡[3。绿粘帚霉Gliocladium virens产生的代谢产物viridiol被发现对苹果园中的杂草藜具有显著的毒害作用,从而表现出除草剂的特性45。Devine是1981年在美国登记的首个生物除草剂,它采用了棕榈疫霉Phyto-phthorapalmivora的厚垣孢子制备成悬浮剂,主要用于柑橘园进行土壤处理以防治莫伦藤Morrenia odorata,防效可达96%,且持续期长达2年29。
4展望
植物病原真菌及其代谢产物在杂草控制方面显示出巨大的潜力,相较于化学除草剂具有来源广泛、易降解污染小、安全性高、不易产生抗性杂草等特点。然而,真菌源除草剂实现商业化生产,需要从技术上攻克生产设备要求高、货架期短、质量不稳定等困难。针对目前利用植物病原真菌除草在生产应用上遇到的问题,提出以下几种有效的改善策略。
(1)选择合适的发酵方式和培养基,优化培养条件。目前真菌扩大发酵最常用采用深层液体发酵,由于在发酵罐中形成菌丝体团块和颗粒而限制黏了传质,增加了培养基粘度,减少了氧传递,并导致混合困难,通常不适合高度分支的真菌菌丝体。为了克服这些不便,细胞固定化方法已被用来管理细胞形态并在几种丝状真菌发酵中实现更高的细胞密度和生产率。另外,OSMAC(One Strain Many Compounds)策略是一种通过修改培养参数,如培养基成分、培养温度、pH值、光照条件、添加诱导物等,来激发真菌合成不同的次级代谢产物。
(2)应用分子生物学技术改造真菌,获得稳定高产菌株。首先,利用高通量筛选手段,快速、大规模地从众多植物病原真菌中筛选出具有高效除草活性的菌株及代谢产物。通过优化筛选流程和指标体系,提高筛选的准确性和效率,为新型除草制剂的开发提供丰富的资源库。其次,借助分子生物学技术,深入解析植物病原真菌的除草作用机制及关键靶点。利用基因工程手段对真菌进行改造,增强其除草活性、稳定性和环境适应性。同时,通过研究真菌与杂草的相互作用分子机制,为开发针对性更强的除草策略提供理论支持。最后,探索合成生物学在植物病原真菌除草领域的应用,利用合成生物学技术构建高效的真菌代谢途径,实现特定除草活性物质的大规模合成。通过设计和优化合成生物系统,提高活性物质的产量和纯度,降低生产成本,推动真菌除草制剂的商业化进程。
总之,通过技术创新、应用拓展和安全性研究,利用植物病原真菌除草有望为农业和生态环境领域提供一种高效、环保、可持续的杂草治理解决方案。
参考文献:
[1]李香菊.近年我国农田杂草防控中的突出问题与治理对策[J].植物保护,2018,44(5):77-84.
[2]潘浪,刘敏,刘伟堂,等.我国杂草科学学科发展现状与展望[J].植物保护,2023,49(5):295-302,389.
[3]郭田,夏汉祥,刘美,等.利用植物病原真菌除草的研究进展[J].世界农药,2012,34(2):9-13.
[4]曾秘,张亚,彭争科,等.微生物除草剂的研究现状[J].江西农业学报,2013,25(2):40-43,46.
[5]黄春艳.利用植物病原真菌防除杂草研究进展[J].黑龙江农业科学,2000(3):43-44.
[6]VURRO M,BOARI A,CASELLAF,etal.Fungal Phytotoxins in Sustainable Weed Management[J].Current Medicinal Chemistry 2018,25(2):268-286.
[7]SINGHK A,PANDEY A K.Exploitation of Fungal Phytotoxin asNatural Herbicide for Ecofriendly Weed Management:ProblemsandProspects[J].International journal of plant and environment,2020,6(3):211-214.
[8]李丽,汤丽cd529eaf29aa755d175734d1daf0dd33d896eeda531d4ec504316ea1dd4dacc7影,生物除草剂的应用与发展探讨[J].产业与科技论坛,2020,19(10):54-55.
[9]XU D,XUE M Y,SHEN Z,etal.Phytotoxic Secondary Metabolites from Fungi[J].Toxins.,2021,13(4):261-261.
[10]朱赫,纪明山.具有除草活性植物病原真菌毒素的作用模式[J].杂草科学,2014,32(4):1-7.
[11]朱桓吾,邓炜,邓金奇,等.微生物除草剂的研究进展[J].农业研究与应用,2024,37(1):75-81.
[12]耿锐梅.稻田微生物除草剂孢子生产和制剂加工技术的研究[D].北京:中国农业科学院,2008.
[13]SOTELO-CEON ND,MALDONADO-MENDOZA L E,LEYVA-MADRIGAL KY,etal.Isolation,selection,and identification of phytopathogenic fungi with bioherbicide potential for the control of field bindweed(Convolvulus arvensis L.)[J].Weed BiologyandManagement,2023,23(3-4):99-109.
[14]ABBAS H K,VESONDER R F,BOYETTE C D,et al Phytotoxicity of AAL-toxin and other compounds produced by Alternaria alternata to jimsonweed(Datura stramonium)[J].Canadian journal of botany,1993,71(1):155-160.
[15]KHEDER A A,AKAGIY,TAKAO K,etal.Fungal growth and in planta distribution of host-specific AAL-toxin in tomato plants infected with the tomato pathotype of Alternaria alternata[J]Mycotoxins,2012,62(1):7-13.
[16]POMELLA A WV,BARRETO R C S.Leaf scorch of purple nutsedge(Cyperus rotumdus)caused by Ascochyta cyperiphthorasp.nov.[J].Mycotaxon,1997,65:459-468.
[17]STIERLE A A,UPADHYAYR K,STROBRL G A.Cyperine,a phytotoxin produced by Ascochyta cypericola,a fungal pathogen of Cyperus rotundus[J].Phytochemistry,1991,30(7):2191-2192.
[18]SUGAWARA F,STROBEL GA,FISHER L,etal.Bipolaroxin,a selective phytotoxin produced by Bipolariscynodontis[J].Proceedings of the National Academy of Sciences ofthe United Statesof America,1985,82(24):8291-8294.
[19]MASI M,MEYER S E,CLEMENT S,etal.Cochliotoxin,a Dihydropyranopyran-4,5-dione,and Its Analogues Produced by Cochliobolusaustraliensis Display Phytotoxic Activity againstBuffelgrass(Cenchrus ciliaris)[J].Journal of Natural Products,2017,80(5):1241-1247.
[20]OHRA J,MORITA K,TSUJINO Y,etal.Production of the Phytotoxic Metabolite,Ferricrocin,by the FungusColletotrichumgloeosporioides[J].Bioscience,Biotechnology,andBiochemistry,1995,59(1):113-114.
[21]EVIDENTE A,ANDOLFI A,CIMMINO A,etal.Herbicidal Potential of Ophiobolins Produced by Drechslera gigantea[J]Journal of Agricultural and Food Chemistry,2006,54(5):1779-1783.
[22]TANAKA M,OHRA J,TSUJTNO Y,etal.DendryolA,B,C,andD,Four New Compounds Producedby a Weed Pathogenic Fungus Dendryphiella sp.[J].Zeitschrift fur Naturforschung C,1995,50(11-12):751-756.
[23]EVIDENTE A,ANDOLFI A,VURRO M,etal.Drazepinone,atrisubstitutedtetrahydronaphthofuroazepinone with herbicidal activity produced by Drechslerasiccans[J].Phytochemistry,2005,66(6):715-721.
[24]EVIDENTEA.Specialized Metabolites Produced by Phytotopatogen Fungi to Control Weeds and Parasite Plants[J].Microorganisms,2023,11,(4):843.
[25]TSANTRIZOS YS,OGILVIE KK,WATSON AK.ChemInformAbstract:Phytotoxic Metabolites of Phomopsis convolvulus,a Host-Specific Pathogen of Field Bindweed[J].ChemInform,1993,24(13):2276-2284.
[26]GRAUPNER P R.,CARR A W,CLANCY E,etal.TheMacrocidins:Novel Cyclic Tetramic Acids withHerbicidal Activity Produced by Phomamacrostoma[J].Journal of Natural Products,2003,66(12):1558-1561.
[27]VENKATASUBBAIAH P,BAUDOIN A,CHILTON W S.LeafSpot of Hemp Dogbane Caused by Stagonosporaapocyni,anditsPhytotoxins[J].Journal of Phytopathology,1992,135(4):309-316.
[28]李冰,彭博文,李东华,等.植物病原真菌抑制杂草的活性筛选及高粱靶斑病菌的活性代谢产物[J].农药,2023,62(7):542-546.
[29]MEEPAGALAKM,BRISCOE WE,TECHENN,etal.Isolationofa phytotoxic isocoumarin from Diaportheeres-infected Hedera helix(English ivy)and synthesis of its phytotoxic analogs[J].Pest Management Science,2017,74(1):37-45.
[30]TANG JS,HUANG L,LIU Y,etal.Two Phytotoxins Isolated from the Pathogenic Fungus of the Invasive Weed Xanthium italicum[J].Chemistry&Biodiversity,2020,17(4):1-25.
[31]HUANGRH,GUOJY,ZHAO DL,etal.Phytotoxicity and anti-phytopathogenic activities of marine-derived fungi and theirsecondarymeabolites[J].RSC Advances,2018,8(66):37573-37580.
[32]MASI M,MEYER SE,CIMMINO A,etal.Pyrenophoric Acids B and C,Two New Phytotoxic Sesquiterpenoids Produced byPyrenophorasemeniperda[J].Journal of Agricultural and FoodChemistry,2014,62(42):10304-10311.
[33]LOZANO-JUSTE J,MASI M,CIMMINO A,etal.The fungal sesquiterpenoid pyrenophoric acid B uses the plant ABA biosynthetic pathway to inhibit seed germination[J].Journal of Experimental Botany,2019,70(19):5487-5494.
[34]SHIMADA A,KUSANO M,TAKEUCHI S,etal.Aspterric Acid and 6-Hydroxymellein,Inhibitors of Pollen Development inArabidopsisthaliana,Produced by Aspergillus terreus[J]Zeitschrif fir Naturforschung C,2002,57(5-6):459-464.
[35]张静,梁好,赵丹丹,等.生物除草剂研究进展[J].现代农业研究,2024,30(5):58-61.
[36]张红梅,陈玉湘,徐士超,等.生物源除草活性物质开发及应用研究进展[J].农药学学报,2021,23(6):1031-1045.
[37]方玮.杂草致病真菌的除草活性筛选及菌株SSQB01的次级代谢产物[D].合肥:安徽农业大学,2022.
[38]王世伟,王卿惠,李小鹏,等.镰刀菌分子鉴定与重要应用的研究进展[J].微生物学通报,2018,45(4):907-919.
[39]TSUDA Y,KANEDA M,TADA A,etal.Aspterricacid,anewsesquiterpenoidof the carotanegroup,a metabolite from Aspergillusterreus IFO-6123[J].X-Ray crystal and molecular structure of its p-bromobenzoate.Journal of the Chemical Society,1978(4):160-161.
[40]YAN Y,LIU Q K,ZANG X,etal.Resistance-gene-directed discovery of a natural-product herbicide with a new mode of action[J].Nature,2018,559(7714):415-418.
[41]ZHANG W,ZHANGX,FENG DD,etal.Discovery of a UniqueFlavonoid Biosynthesis Mechanism in Fungi by GenomeMining[J].AngewandteChemie International Edition,2023,62(12):0-9.
[42]刘璐,朱哲远,李颖曦,等.微生物除草剂的研究进展[J].生物技术通报,2024,40(9):161-171.
[43]李健,高兴祥,李美,等.“鲁保一号”菌株的鉴定和生防增效助剂筛选[J].山东农业科学,2021,53(2):102-105.
[44]张苗苗.果园生草对杂草及土壤微生物的影响[D].海口:海南大学,2020.
[45]刘富平,朱天辉.绿粘帚霉(Gliocladium virens)厚垣孢子的诱导[J].植物病理学报,2005(6):555-556.
(责任编辑:柯文辉)