硝普钠诱导下川西獐牙菜的LC-MS非靶向代谢组分析
2024-12-09王文静王易张亚美杨璞刘文英何舒萍向蓓蓓




〔摘要〕 目的 研究基于非靶向代谢组学技术的川西獐牙菜在硝普钠处理后的代谢响应,为相关研究提供参考。方法 以1.0 mmol/L硝普钠处理的川西獐牙菜为实验组,蒸馏水处理的川西獐牙菜为对照组,对实验组和对照组的川西獐牙菜中差异代谢物进行主成分分析(principal component analysis, PCA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)以及KEGG富集分析。结果 从实验组和对照组处理的川西獐牙菜中共检测到523种代谢物,通过OPLS-DA模型的数据分析,根据VIP>1和P<0.05 条件共筛选出104 种差异显著代谢物,其中有36 种代谢物上调、68 种代谢物下调,这些差异代谢物包括黄酮类、生物碱类、有机酸、氨基酸、糖类、维生素、香豆素类化合物及其他化合物。KEGG富集结果显示,对照组与实验组差异代谢物富集到121条途径中。结论 推测川西獐牙菜的差异代谢物显著富集的12条代谢途径主要与抗氧化有关。
〔关键词〕 川西獐牙菜;硝普钠;非靶向代谢组学;次生代谢;差异代谢物;抗氧化
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.019
LC-MS based non-targeted metabolomics analysis of Swertia mussotii Franch induced by sodium nitroprusside
WANG Wenjing, WANG Yi, ZHANG Yamei, YANG Pu, LIU Wenying, HE Shuping, XIANG Beibei*
Tianjin University of Chinese Medicine, Tianjin 301617, China
〔Abstract〕 Objective To study the metabolic response of Swertia mussotii Franch after sodium nitroprusside treatment based on non-targeted metabolomics technology, and to provide reference for related research. Methods The experimental group consisted of Swertia mussotii Franch treated with 1.0 mmol/L sodium nitroprusside, while the control group consisted of Swertia mussotii Franch treated with distilled water. Principal component analysis (PCA), orthogonal partial least squares discriminant analysis (OPLS-DA) and KEGG enrichment analysis were performed on the differential metabolites in the experimental group and the control group. Results A total of 523 metabolites were measured in Swertia mussotii Franch from the experimental group and the control group. Through the data analysis of the OPLS-DA model, 104 significantly different metabolites were screened according to VIP>1 and P<0.05 conditions. Among them, 36 metabolites were up-regulated and 68 metabolites were down-regulated. These differential metabolites include flavonoids, alkaloids, organic acids, amino acids, sugars, vitamins, coumarins compounds and other compounds. The results of KEGG enrichment analysis showed that the differential metabolites between the control group and the experimental group were enriched into 121 pathways. Conclusion It is speculated that 12 metabolic pathways of significantly enriched differential metabolites of Swertia mussotii Franch is mainly related to anti-oxidation.
〔Keywords〕 Swertia mussotii Franch; sodium nitroprusside; non-targeted metabolomics; secondary metabolism; differential metabolites; anti-oxidation
川西獐牙菜(Swertia mussotii Franch)是龙胆科(Gentianaceae)獐牙菜属(Swertia)的一年生草本,为传统的八珍藏药之一,也是藏茵陈的基原植物之一[1]。川西獐牙菜主要分布于我国西藏、云南(德钦)、青海西南部、四川西北部等。《晶珠本草》记载川西獐牙菜具有清肝、利尿、通筋骨、止血的作用,临床上用于治疗肝胆疾病,通常以干燥全草入药,具有巨大的经济和药用价值。
硝普钠(sodium nitroprusside, SNP)是一种外源一氧化氮(nitric oxide,NO)供体,NO是一种小型气体生物活性信号分子,在介导植物生理过程和非生物胁迫的反应中发挥着重要作用[2],如干旱、强光、盐碱、寒热和病原感染等[3]。适宜浓度的NO可以促进植物的生长发育和提高植物的抗逆性[4]。通过SNP提供给植物的外源NO也可以提高植物对环境胁迫的耐受性[5],同时对植物次生代谢产物生物合成途径产生影响[6]。外源施加SNP到植物体,能够刺激植物次生代谢产物的生物合成,引起多种植物次生代谢产物的迅速积累。外源SNP可以显著增加青钱柳中总多酚和多糖的含量[7];SNP处理可以提高天仙子毛状根中的东莨菪碱含量[8]。本研究应用非靶向代谢组学技术分析SNP处理和蒸馏水处理川西獐牙菜的代谢物变化情况,为进一步研究SNP胁迫响应的代谢机制奠定基础。
1 材料和方法
1.1 植物材料
川西獐牙菜种子来自青海师范大学,将种子置于灭菌的培养土中,在恒温培养室培养架上进行培养,光照16 h,黑暗8 h,温度25 ℃。选取长势相近的3月龄的土培苗,分为实验组和对照组。实验组用1.0 mmol/L SNP溶液隔天进行喷洒20 mL、浇灌30 mL处理;以等量蒸馏水代替SNP溶液进行喷洒、浇灌处理的川西獐牙菜植株作为对照组,实验组和对照组没有相互影响。每个处理设置6个重复,川西獐牙菜植株培养处理10 d后收集全株新鲜样品用于非靶向代谢组分析。
1.2 主要仪器
冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1850-R);混匀仪(海门市其林贝尔仪器制造有限公司,型号:BE-96);组织研磨器(浙江美壁仪器有限公司,型号:MB-96);超声波清洗器(昆山市超声仪器有限公司,型号:KW-100TDV);滤膜(天津市津腾实验设备有限公司,型号:0.22 μm PTFE);玻璃珠(美国西格玛奥德里奇公司,型号:G8772-500G);液相色谱仪、质谱仪(美国赛默飞世尔科技公司,型号Vanquish、Q Exactive)。
1.3 主要试剂
乙腈、甲醇(美国赛默飞世尔科技公司,批号: 75-05-8、67-56-1);甲酸(东京化成工业株式会社,批号:64-18-6);甲酸铵(美国西格玛奥德里奇公司,批号:540-69-2);2-氯-L-苯丙氨酸(内标标准物质)(阿拉丁生化科技股份有限公司,批号:103616-89-3);硝普钠(北京索莱宝科技有限公司,批号:13755-38-9)。
1.4 检测样本制备
将样本精确称取200 mg置于2 mL离心管中,加入600 μL含有2-氯-L-苯丙氨酸(4 ppm)的甲醇溶液,并进行涡旋振荡30 s。加入100 mg玻璃珠,并使用组织研磨器进行60 Hz研磨90 s。在室温下使用超声波处理15 min。最后在13 400 ×g下,4 ℃离心10 min,取上清液并通过0.22 μm 滤膜过滤。过滤后的液体被收集到检测瓶中,用于LC-MS检测。质量控制(quality control, QC)样本是从提取好的待测样本中取部分混合成的。
1.5 色谱和质谱采集条件
液相色谱相关参数为色谱柱:ACQUITY UPLC®HSS T3(2.1 mm×150 mm,1.8 μm);流速:0.25 mL/min;柱温:40 ℃;上样体积:2 μL。正离子模式流动相为0.1%甲酸乙腈和0.1%甲酸水;负离子模式流动相为乙腈和 5 mmol/L甲酸铵水。从色谱柱上洗脱的小分子通过高分辨率串联质谱进行分析。质谱条件:Thermo Q Exactive质谱检测器,电喷雾离子源(ESI)。正离子喷雾电压3.50 kV,负离子喷雾电压2.50 kV,鞘气30 arb,辅助气10 arb,毛细管温度325 ℃,一级离子扫描范围m/z 81~1 000(分辨率70 000),二级裂解碰撞电压30%(分辨率17 500)。
1.6 通路分析
采用MetaboAnalyst软件包对筛选差异代谢分子进行功能通路富集和拓扑学分析。富集得到的通路采用KEGG Mapper可视化工具进行差异代谢物与通路图的浏览。
1.7 数据处理
采用RXCMS软件包进行峰检测、峰过滤、峰对齐处理。采用公共数据库HMDB、massbank、LipidMaps、mzcloud、KEGG及自建物质库进行物质的鉴定,参数设置为ppm<30。基于QC样本的LOESS信号校正方法实现数据矫正,消除系统误差。数据质控中过滤掉QC样本中RSD>30%的物质。
采用R软件包Ropls分别对样本数据进行主成分分析(principal component analysis, PCA)、偏最小二乘判别分析(partial least squares-discriiminate analysis, PLS-DA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)降维分析。当P<0.05和VIP>1时,认为代谢物分子具有统计学意义。
2 结果与分析
2.1 LC-MS图谱
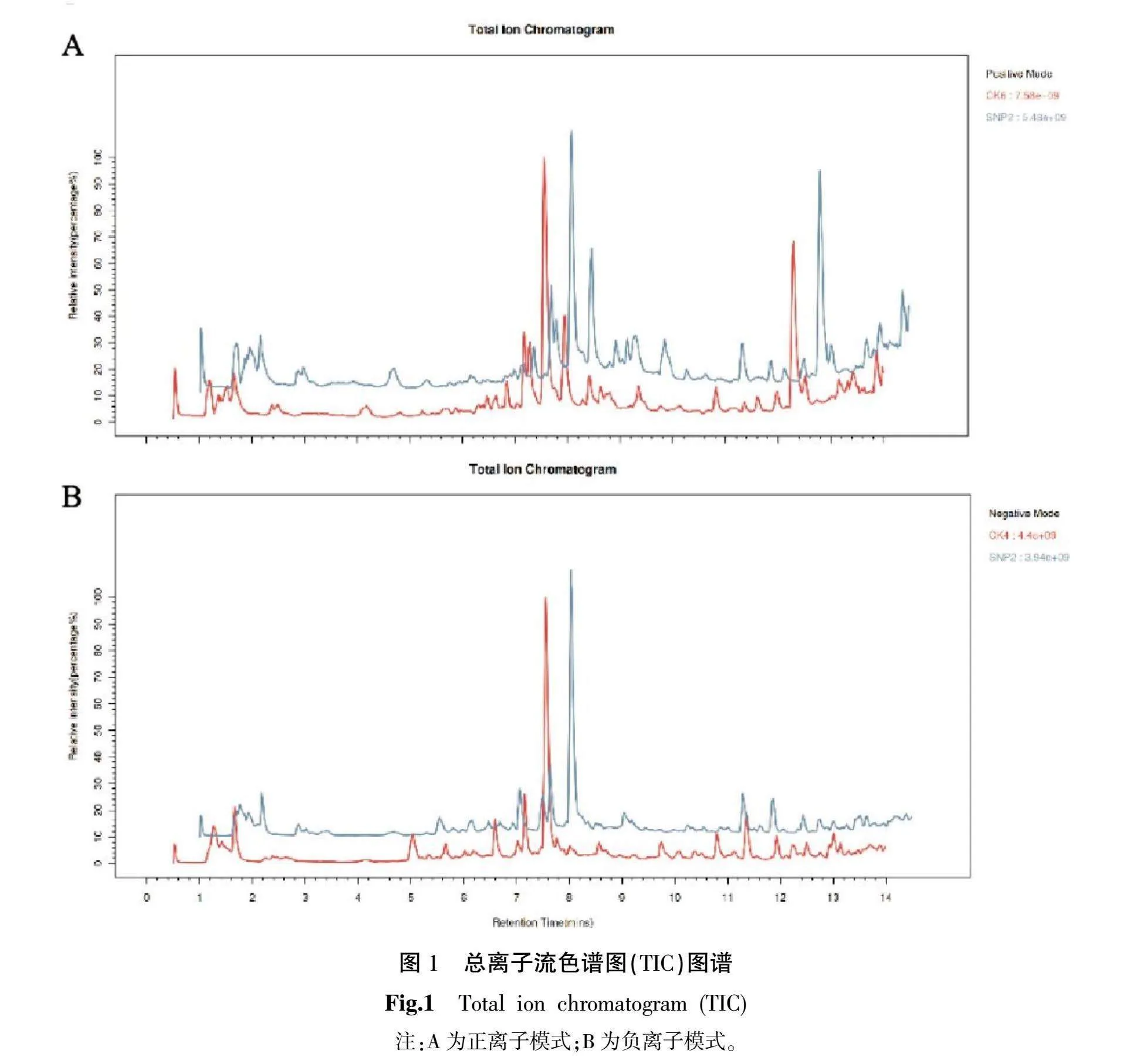
对SNP处理和蒸馏水处理的川西獐牙菜进行LC-MS非靶向代谢组学分析,结果显示总离子流色谱图(total ion chromatogram, TIC)图谱趋势相似,证明重复性好,结果可靠。详见图1。
2.2 代谢组数据质控分析
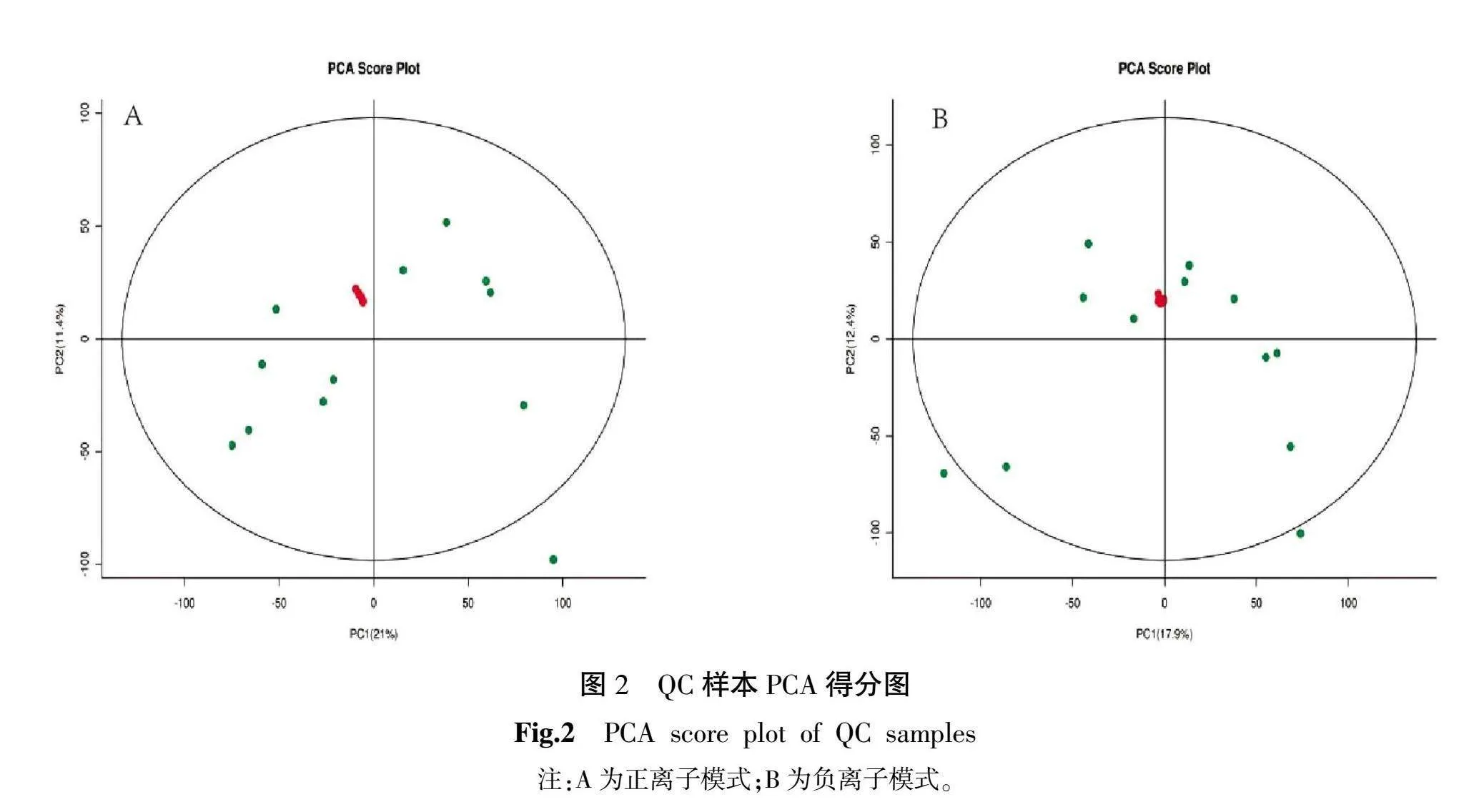
在样品进行检测前用QC评价质谱系统的稳定性,正负离子模式下QC样本PCA得分图详见图2,结果表明质谱系统稳定。为发现生物标志物,潜在的特征峰的相对标准偏差不能超过30%,不符合要求的特征峰应予以删除。在QC的基础上,通常会进行质量保证(quality assurance,QA)来删除QC样本中重复性差的特征峰。QA结果详见图3。
2.3 多元统计分析
使用R语言ropls包对数据进行分析,得到正负离子模式下的OPLS-DA模型和PLS-DA模型,详见图4。结果显示对照组与实验组分别在正负离子模式下独立聚类,进一步说明SNP胁迫使川西獐牙菜的代谢物产生了显著变化,模型建立成功。
建立的OPLS-DA和PLS-DA模型均在正离子模式和负离模式下具有较高的验证参数,R2Y分别为0.999和0.996。这表明该模型能够很好地解释样本数据的变异,并与真实情况拟合度高。同时,Q2值也较高,正离子模式Q2值分别为0.821和0.725,负离子模式Q2值分别为0.91和0.864,表明该模型具有良好的稳定性和预测能力。详见图5。
2.4 差异代谢物鉴定与分析
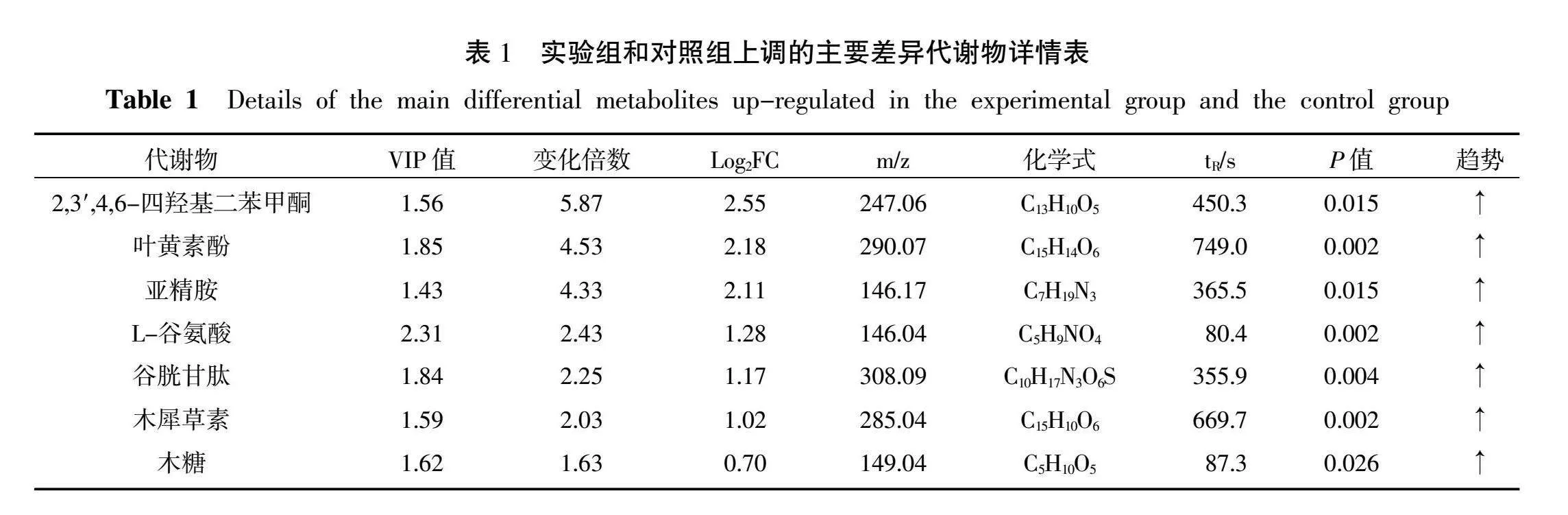
用1.0 mmol/L SNP处理川西獐牙菜10 d后,收获对照组和实验组的川西獐牙菜进行LC-MS非靶向代谢组学分析。非靶向代谢组学的数据表明,在川西獐牙菜中检测出大约523种代谢物,通过OPLS-DA模型的数据分析,根据VIP>1和P<0.05条件共筛选出104种差异显著代谢物,其中有36种代谢物上维生素及其衍生物、糖类、香豆素类化合物和其他化合物。主要的上调差异代谢物相关信息见表1。
2.5 差异代谢物KEGG富集分析
利用KEGG通路富集分析SNP处理后川西獐牙菜代谢途径的变化情况,根据图6所示,对照组和实验组差异代谢物富集到121条途径中,其中P<0.05的代谢途径有12条:分别是苯丙烷生物合成、亚油酸代谢、ABC转运、氨基苯甲酸降解、谷胱甘肽代谢、生物素代谢、色氨酸代谢、磷脂酶D信号通路、β-丙氨酸代谢、维生素的消化和吸收通路。在对照组和实验组的川西獐牙菜代谢组中,检测实验组的川西獐牙菜中,L-谷氨酸、谷胱甘肽和亚精胺显著富集到谷胱甘肽代谢途径中,三者均为氨基酸及其衍生物,与对照组相比分别上调2.43倍、2.25倍和4.33倍。亚精胺和谷胱甘肽也参与了ABC转运蛋白途径。此外,L-谷氨酸和木糖显著富集到ABC转运蛋白途径,木糖与对照组相比上调1.63倍。
3 讨论
NO是调节植物生长发育的重要分子,为探究SNP处理后川西獐牙菜中的代谢物变化,对蒸馏水处理和SNP处理的川西獐牙菜进行LC-MS非靶向代谢组分析,共检测出104种差异显著代谢物,其中有36种代谢物上调、68种代谢物下调,显著差异代谢通路有12条。
SNP处理川西獐牙菜能够影响谷胱甘肽的生物合成,谷胱甘肽生物合成的标准途径是谷胱甘肽的主要来源之一[9],在谷胱甘肽生物合成途径中,筛选到谷胱甘肽合成的关键中间代谢产物L-谷氨酸及谷胱甘肽含量显著上调。SNP处理可能通过影响谷胱甘肽生物合成标准途径影响谷胱甘肽的合成。有研究表明,SNP处理小麦幼苗[10]和苜蓿幼苗[1]谷胱甘肽还原酶基因上调。谷胱甘肽作为细胞内最丰富的抗氧化剂,能够保护DNA、蛋白质以及其他大分子物质抵抗氧化损伤,清除过量的活性氧,维持细胞内的稳态[12]。SNP处理川西獐牙菜后,可能通过谷胱甘肽生物合成标准途径促进谷胱甘肽生成,该结果与SNP处理香榧[13]谷胱甘肽含量升高的结果一致。
本研究在代谢组中发现亚精胺显著上调,它同时参与了苯丙烷途径、谷胱甘肽途径、ABC转运蛋白途径和β-丙氨酸代谢途径。亚精胺在植物中具有刺激生长、抗氧化、抗肿瘤等作用[14]。据报道,亚精胺可能在非生物胁迫中发挥重要作用[15],外源亚精胺可以提高苜蓿的抗氧化能力,维持细胞渗透平衡,从而缓解干旱对苜蓿幼苗的伤害[16]。SNP处理川西獐牙菜后亚精胺显著上调,表明川西獐牙菜应对外源胁迫的能力增加。
同时,SNP处理也影响ABC转运蛋白通路,ABC转运蛋白可以转运多肽、糖类、生物碱和谷胱甘肽等多种物质,具有抵抗生物和非生物胁迫、信号转导及病毒防御等多种功能[17]。ABC转运蛋白通路在植物生长发育、逆境胁迫等方面发挥着重要作用。有研究表明,部分ABC转运蛋白参与了巨大侧耳对镉离子胁迫的反应[18];野生大豆ABC转运蛋白基因响应干旱胁迫[19]。SNP处理川西獐牙菜后ABC转运蛋白出现响应表明SNP处理后川西獐牙菜的抗逆性增强,提高了川西獐牙菜对环境胁迫的耐受性,有研究表明SNP处理后,NO可以调节代谢物的表达保护植物免受胁迫[20-21]。
人们普遍认为,植物为了应对外源胁迫做出的防御反应之一就是积累更多的次生代谢产物[22]。类黄酮化合物是天然存在的代谢产物,具有多种生物活性[23],类黄酮化合物具有抗炎、抗癌、抗病毒、抗氧化和抗糖尿病等多种药理活性[24]。SNP处理川西獐牙菜代谢组学数据表明,在类黄酮生物合成途径中叶黄素酚和木犀草素含量明显增加。研究表明[25],类黄酮物质的积累可能是由于SNP处理川西獐牙菜后使内源性一氧化氮含量升高,继而刺激Ca2+和ROS信号来诱导参与类黄酮化合物基因的表达;这与SNP处理茶树[26]后,使内源性一氧化氮含量呈剂量依赖性增加,继而使茶树中类黄酮物质积累观点一致。呫吨酮类化合物构成了川西獐牙菜抗肿瘤的药效物质基础[27],但是其在川西獐牙菜中含量低且分离提取困难。SNP处理后,呫吨酮合成途径中关键的中间代谢产物2,3',4,6-四羟基二苯甲酮含量升高了5.87倍。SNP处理后川西獐牙菜中类黄酮化合物的积累是川西獐牙菜应对SNP处理的结果,这与前人的研究相符[28],这也为我们提高川西獐牙菜中的中药药用成分提供了思路。
本研究通过测定1.0 mmol/L SNP处理下川西獐牙菜的代谢物变化情况,发现主要的差异代谢物主要集中在抗氧化系统上,类黄酮化合物也呈现了不同程度的上调,这让我们了解了SNP处理川西獐牙菜的代谢响应,并且为川西獐牙菜的其他研究提供参考。
参考文献
[1] 马 徐, 刘 越, 冯晓晓, 等. 藏茵陈川西獐牙菜的生物学研究进展[J]. 中华中医药杂志, 2016, 31(3): 948-950.
[2] MOSTOFA M G, RAHMAN M, ANSARY M U, et al. Interactive effects of salicylic acid and nitric oxide in enhancing rice tolerance to cadmium Stress[J]. International Journal of Molecular Sciences, 2019, 20(22): 5798.
[3] 陈星辉, 陈虹廷, 孙浩轩, 等. 外源NO调节对植物生长过程中非生物胁迫的影响[J]. 园艺与种苗, 2024, 44(3):103-105.
[4] 孙扬扬, 罗曼莉, 纪淑娟. 外源硝普钠处理缓解冷藏南果梨果皮褐变的作用机理[J]. 食品科学, 2024, 45(16): 223-231.
[5] SHAO R X, ZHENG H F, JIA S J, et al. Nitric oxide enhancing resistance to peg-induced water deficiency is associated with the primary photosynthesis reaction in triticum aestivum L[J]. International Journal of Molecular Sciences, 2018, 19(9): 2819.
[6] LI S W, LENG Y, SHI R F. Transcriptome characterization of gene profiling during early stage of nitric oxide-induced adventitious rooting in mung bean seedlings[J]. Journal of Plant Growth Regulation, 2020, 39(1): 430-455.
[7] 陈淑慧, 杭紫莹, 张昊宸, 等.外源硝普钠对青钱柳叶片内活性物质含量和体外抗氧化能力的影响[J]. 山东林业科技, 2024, 54(2): 1-7.
[8] KHEZERLUO M, HOSSEINI B, AMIRI J. Sodium nitroprusside stimulated production of tropane alkaloids and antioxidant enzymes activity in hairy root culture of Hyoscyamus reticulatus L[J]. Biologia Futura, 2018, 69(4): 437-448.
[9] 王玮玮, 唐 亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展[J]. 中国生物工程杂志, 2014, 34(7): 89-95.
[10] IQBAL N, SEHAR Z, FATMA M, et al. Nitric oxide and abscisic acid mediate heat stress tolerance through regulation of osmolytes and antioxidants to protect photosynthesis and growth in wheat plants[J]. Antioxidants, 2022, 11(2): 372.
[11] RAHMAN M A, KABIR A H, SONG Y, et al. Nitric oxide prevents Fe deficiency-induced photosynthetic disturbance, and oxidative stress in alfalfa by regulating Fe acquisition and antioxidant defense[J]. Antioxidants, 2021, 10(10): 1556.
[12] AL-MADBOLY L A, KHEDR E G, ALI S M. Optimization of reduced glutathione production by a lactobacillus plantarum Isolate using plackett-burman and box-behnken designs[J]. Front Microbiol, 2017, 8:772.
[13] LIU Y, JIANG Z K, YE Y T, et al. Enhanced salt tolerance of torreya grandis genders is related to nitric oxide level and antioxidant capacity[J]. Frontiers in Plant Science, 2022, 13: 906071.
[14] 赵 硕, 幸岑璨, 王 艳, 等. 植物中亚精胺类物质的化学结构及生理活性研究进展[J]. 核农学报, 2018, 32(1): 123-130.
[15] CHANG S X, PU C, GUAN R Z, et al. Transcriptional and translational responses of rapeseed leaves to red and blue lights at the rosette stage[J]. Journal of Zhejiang University-SCIENCE B, 19(8): 581-595.
[16] 孙天国, 衣 兰, 谷新颖, 等. 外源亚精胺对苜蓿幼苗干旱缓解生理机制分析[J]. 草地学报, 2024, 32(7): 2099-2105.
[17] 孙洁婷, 敬雪皎, 赵丹妮, 等. 植物ABCG转运蛋白功能的研究进展[J]. 科学通报, 2024, 69(14): 1866-1880.
[18] 席寅生, 王 雪, 马金荣, 等. 巨大侧耳ABC转运蛋白家族的全基因组分析及其对镉离子胁迫的响应[J]. 菌物学报, 2024, 43(8): 57-72.
[19] 张小芳, 乔亚科, 王冰冰, 等. 干旱胁迫下野生大豆ABC转运蛋白转录组测序分析[J]. 核农学报, 2019, 33(8): 1474-1482.
[20] MA Y, YAO Y, WANG Q, et al. Mechanism of nitric oxide enhancing NaCl tolerance of barley seedlings based on physiol-biochemical Analysis and LC-MS metabolomics[J]. Environmental and Experimental Botany, 2021, 189: 104533.
[21] ZHU H H, AI H L, HU Z R, et al. Comparative transcriptome combined with metabolome analyses revealed key factors involved in nitric oxide (NO)-regulated cadmium stress adaptation in tall fescue[J]. BMC Genomics, 2020, 21(1): 601.
[22] GU L, ZHONG X, LIAN D H, et al. Triterpenoid biosynthesis and the transcriptional response elicited by nitric oxide in submerged fermenting Ganoderma lucidum[J]. Process Biochemistry, 2017, 60: 19-26.
[23] REMIGANTE A, SPINELLI S, BASILE N, et al. Oxidation stress as a mechanism of aging in human erythrocytes: Protective effect of quercetin[J]. International Journal of Molecular Sciences, 2022, 23(14): 7781.
[24] ZAKARYAN H, ARABYAN E, OO A, et al. Flavonoids: promising natural compounds against viral infections[J]. Archives of Virology, 2017, 162(9): 2539-2551.
[25] 胡 月. 硝普钠胁迫多根紫萍作用机制的研究及初探以青萍作为底盘细胞合成中药药用成分[D]. 天津: 天津中医药大学, 2022.
[26] LI X, ZHANG L, AHAMMED G J, et al. Nitric oxide mediates brassinosteroid -induced flavonoid biosynthesis in Camellia sinensis L[J]. Journal of Plant Physiology, 2017, 214: 145-151.
[27] 王海霞, 黄慧明, 苑 祥, 等. 川西獐牙菜不同部位对人胃癌细胞MGC-803增殖抑制作用和细胞周期的影响[J]. 药物评价研究, 2016, 39(5): 735-740.
[28] ZHANG Y M, JIA R, HUI T Y, et al. Transcriptomic and physiological analysis of the response of Spirodela polyrrhiza to sodium nitroprusside[J]. BMC Plant Biology, 2024, 24(1): 95.