响应面法优化圆苞车前子多酚与总黄酮超声提取工艺及其抗氧化活性分析
2024-12-09排合尔丁·穆太力甫木艾塔尔·努尔麦麦提艾尼娃尔·艾克木田树革








〔摘要〕 目的 本实验旨在优化圆苞车前子多酚和总黄酮提取工艺,探究圆苞车前子提取物抗氧化活性。方法 采用单因素实验结合响应面Box-Behnken设计对圆苞车前子中多酚和总黄酮进行超声辅助提取工艺研究,以多酚及黄酮提取率为指标,利用响应面法得出最佳提取工艺。且通过DPPH、ABTS+自由基的清除能力和总还原能力测定评价其抗氧化能力。结果 圆苞车前子多酚与总黄酮提取最佳工艺为:料液比1∶20,提取时间41 min,超声波功率420 W,乙醇体积分数88%。该条件下,多酚的提取量为4.79 mg/g,总黄酮的提取量为23.19 mg/g。抗氧化实验结果表明,圆苞车前子乙醇提取物在2.5~50 μg/mL范围内,对DPPH、ABTS+自由基有较好的清除作用,IC50值分别为26.62 μg/mL和9.40 μg/mL;其总还原能力随着浓度的增加而增强,且始终高于同浓度维生素C的还原能力。结论 该提取工艺稳定、可靠,可用于圆苞车前子多酚与总黄酮的提取,且圆苞车前子乙醇提取物具有较好的抗氧化活性。
〔关键词〕 圆苞车前子;超声波辅助提取;多酚;黄酮;响应面法;抗氧化
〔中图分类号〕R283.6;R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.012
Optimization of ultrasonic extraction process of polyphenols and total flavonoids from Plantago ovata Forssk by response surface methodology and its antioxidant activity analysis
iBfga4fJK59400jGk2s0hA==Paiheerding Mutailifu1,3, Muaitaer Nuermaimaiti1,3, Ainiwaer Aikemu1,3, TIAN Shuge2*
1. College of Xinjiang Hetian, Hetian, Xinjiang 848000, China; 2. College of Chinese Medicine, Xinjiang Medical University, Urumqi, Xinjiang 830017, China; 3. Xinjiang Key Laboratory of Hetian Characteristic Chinese Medicine Research, Hetian, Xinjiang 848000, China
〔Abstract〕 Objective To optimize the extraction process of polyphenols and total flavonoids from Plantago ovata Forssk, and explore the antioxidant activity of its extracts. Methods Single factor experiments combined with a response surface Box Behnken design were used to study the ultrasonic-assisted extraction process of polyphenols and total flavonoids from Plantago ovata Forssk. The optimal extraction process was determined using response surface methodology with the extraction rates of polyphenols and flavonoids serving as the main indicators. In addition, the antioxidant capacity of the extracts was evaluated by measuring the scavenging ability of DPPH and ABTS+ free radicals and the total reducing power. Results The optimal extraction process for polyphenols and total flavonoids from Plantago ovata Forssk were as follows: solid-liquid ratio of 1∶20, extraction time of 41 min, ultrasonic power of 420 W, and ethanol volume fraction of 88%. Under these conditions, the extraction amounts of polyphenols and total flavonoids were 4.79 mg/g and 23.19 mg/g, respectively. The antioxidant experiment results showed that the ethanol extract of Plantago ovata Forssk had good scavenging effects on DPPH and ABTS+ free radicals in the range of 2.5-50 μg/mL, with the IC50 values of 26.62 μg/mL and 9.40 μg/mL, respectively. The total reducing power increased with increasing concentration and remains higher than that of vitamin C at the same concentration. Conclusion The extraction process is stable and reliable, and can be used for the extraction of polyphenols and total flavonoids from Plantago ovata Forssk. The ethanol extract of Plantago ovata Forssk exhibits good antioxidant activity.
〔Keywords〕 Plantago ovata Forssk; ultrasonic-assisted extraction; polyphenol; flavonoid; response surface methodology; antioxidation
圆苞车前子为车前科车前属圆苞车前子(Plantago ovata Forssk)的干燥成熟种子,是亚洲、欧洲地中海地区和北非的特有植物[1-2]。圆苞车前子在印度和伊朗有广泛分布,并用于治疗痢疾、发热、感冒、咳嗽、胃肠道功能衰竭[3]。圆苞车前子为我国传统民族药记载于《回回药方》,具有止泻、降热、止痛、利尿、消肿利咽的功效[4],维吾尔医名称为“伊斯普古勒”(Ispaghul),过去由巴基斯坦、印度等国进口,现已引种栽培于我国新疆和田、喀什地区[5-6]。圆苞车前子因其溶胀和凝胶特异性,在治疗便秘、肥胖、糖尿病和高胆固醇血症方面得到广泛认可,作为食品补充剂用以防治糖尿病、高脂血症,已被列入我国新资源食品名录,在保健、食品和制药行业被广泛应用[7-8]。
现代研究表明,圆苞车前子具有护肝、降压、抑菌、降血清胆固醇水平、治疗腹泻和提高胰岛素敏感性等多种药理作用[9-10]。TALUKDER等[11-12]报道,圆苞车前子富含多种生物活性物质,如氨基酸、脂肪酸、黄酮和酚类化合物,具有抗氧化活性。目前,关于圆苞车前子的基础研究较薄弱,化学成分的研究集中在其主要成分糖类物质。对圆苞车前子中多酚和总黄酮以及提取工艺优化未见文献报道。超声波辅助提取法设备低廉、操作流程简易、提取时间短、多酚类和黄酮类提取率高[13]。本研究通过乙醇作为提取溶剂,应用超声波辅助提取方法,运用响应面Box-Behnken设计探讨最合适的提取工艺条件,并且研究其体外抗氧化能力,旨在为圆苞车前子的应用和挖掘提供基础理论依据。
1 材料
1.1 药材与试剂
圆苞车前子购自乌鲁木齐维医药材店,由新疆医科大学中医学院中药鉴定教研室徐海燕教授鉴定。
芦丁标准品(纯度99.4%,批号:100080-200707)购自中国药品生物制品鉴定所;没食子(纯度:99.2%)购自成都科龙化工试剂厂;ABTS试剂和1,1-二苯基-2-三硝基苯肼(DPPH,1,1-diphenyl-2-picryl-hydrazyl radical)购自上海阿拉丁试剂有限公司;娃哈哈纯净水;NaNO2、Al(NO3)3、NaOH等均为分析纯试剂。
1.2 主要仪器
800Y型粉碎机(浙江永康市铂欧五金制品有限公司);UV-2700型紫外分光光度计(日本岛津公司);JY99-IIDN型超声波破碎仪(宁波新芝公司);ME204E型分析天平(上海梅特勒公司);Multiskan FC型酶标仪[赛默飞世尔(上海)有限公司]。
2 方法
2.1 原材料的预处理与提取工艺
将圆苞车前子粉碎后过100目药筛备用。分别称取粉末1.0 g,在不同乙醇浓度、料液比、超声功率和超声时间等条件下进行总黄酮与多酚的提取工艺研究。
2.2 单因素实验
2.2.1 料液比对多酚和总黄酮提取率的影响 实验以70%乙醇设定为提取溶剂,固定超声辅助提取时间40 min和超声能量320 W,料液比分别选1∶15、1∶20、1∶25、1∶30及1∶35进行提取,计算圆苞车前子中多酚和总黄酮的提取量。
2.2.2 提取时间对多酚和总黄酮提取率的影响 实验以70%乙醇设定为提取溶剂,固定料液比1∶20和超声能量320 W,超声提取时间选10、20、30、40、50及60 min进行提取,计算圆苞车前子中多酚和总黄酮的提取量。
2.2.3 超声能量对多酚和总黄酮提取率的影响 实验以70%乙醇设定为提取溶剂,固定料液比1∶20 和超声提取时间40 min,超声能量分别选120、220、320、420及520 W进行提取,计算圆苞车前子中多酚和总黄酮的提取量。
2.2.4 乙醇体积分数对多酚和总黄酮提取率的影响 固定料液比1∶20、超声提取时间40 min和超声能量420 W,选用50%、60%、70%、80%、90%及100%乙醇进行提取,计算圆苞车前子中多酚和总黄酮的提取量。
2.3 响应面试验
以单因素实验分析结果作为依据,应用Design-Expert 8.0.6软件和Box-Behnken设计四因素三水平响应面设计,因素及水平设计见表1。
2.4 圆苞车前子总黄酮和多酚含量及提取率测定
2.4.1 总黄酮含量及提取率 总黄酮含量测定参照律梦伟等[14]方法,得到标准曲线为y=1.174 2x-0.002 4,R2=0.998 5。总黄酮提取率以每克圆苞车前子中含有相当于芦丁毫克数表示,单位为mg/g,如下计算:
W(%)=×100%
式中:W表示总黄酮得率,%,c代表供试样品的质量浓度,mg/mL;D为溶液稀释倍数;V为测试样品溶液的体积,mL;m为药材取样量,g。
2.4.2 多酚含量及提取率 多酚含量测定参照律梦伟[14]等方法,得到标准曲线为y=7.614 3x+0.328 4,R2=0.992 4。总黄酮提取率以每克样品中含有相当于没食子酸毫克数表示,单位为mg/g(按1.2.4.1公式1计算)。
2.5 圆苞车前子抗氧化能力测定
2.5.1 DPPH自由基清除能力的测定 参考清除DPPH自由基测定的方法[15]进行改良。以最佳提取条件下的提取液为原液,加乙醇稀释得质量浓度为2.5、5、10、20、30、40、50、100 μg/mL的样品溶液。用超纯水配成同浓度的维生素C(Vc)作为阳性对照。向96孔板中加各样品溶液(100 μL)和0.20 mmol/L DPPH试剂(100 μL),避光静置30 min,实验重复3次,517 nm处测吸光值,并计算DPPH自由基清除率。
DPPH自由基清除率(%)=(1-)×100%
式中A1表示样品溶液加DPPH的吸光值;A2表示不加DPPH样品溶液的吸光值;A0为DPPH试剂的吸光值。
2.5.2 ABTS+自由基清除率测定 参照GONG等的[16]方法进行改良,具体操作步骤如下:等体积的7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾混合,避光反应16 h,用无水乙醇稀释至734 nm处吸光值0.700±0.02准备ABTS工作溶液。向96孔板中加2.5~100.0 μg/mL浓度的样品溶液(20 μL)与ABTS工作溶液(200 μL),避光静置6 min,734 nm处测定吸光值,实验重复三次。同样浓度的抗坏血酸溶液作为阳性对照,并计算清除率。
ABTS+自由基清除率(%)=(1-)×100%
式中A1为样品加ABTS工作液的吸光值;A2为样品溶液吸光值;A0为ABTS工作液吸光值。
2.5.3 总还原能力测定 将提取液配制成不同质量浓度的待测液,参照LIU等[17]方法测定圆苞车前子乙醇提取液总还原能力。将1.0 mL不同浓度的样品溶液与1.0 mL 1%铁氰化钾水溶液混合,50 ℃孵育,再加1.0 mL 10%三氯乙酸,离心15 min(5 000 r/min,离心半径为7 cm),取其上清液2.5 mL与0.15 mL三氯化铁(0.1%)混合,700 nm处测吸光值。物吸光值的之间升高表明还原能力的提高。同浓度Vc作为阳性对照。
2.6 数据处理
试验均设计3次平行实验,用Origin 2021和Design-Expert等软件对数据进行处理及统计分析,以P<0.05为差异有统计学意义。
3 结果
3.1 单因素实验结果
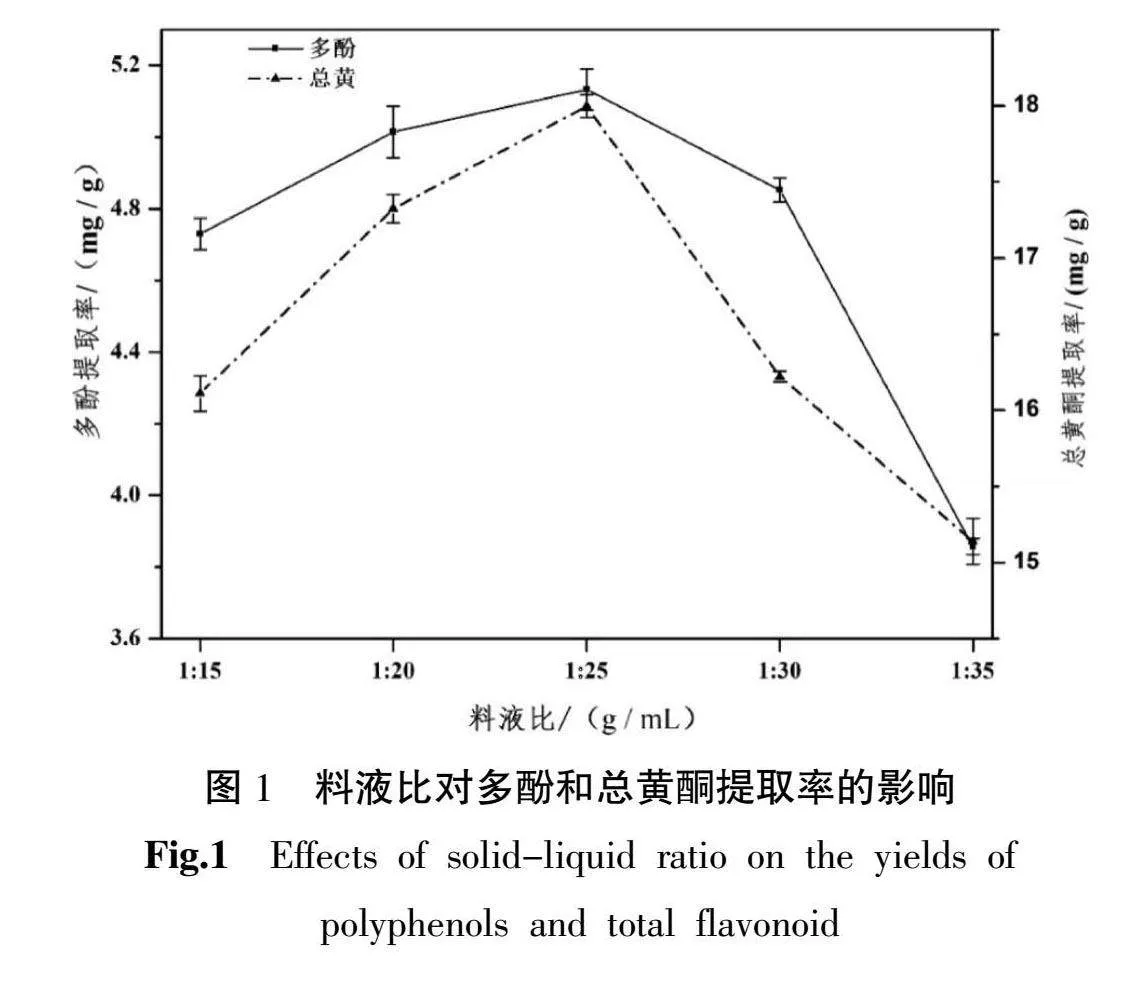
3.1.1 料液比对多酚和总黄酮提取率的影响 料液比较小时,随之料液比的增加,圆苞车前子的多酚和总黄酮提取率也增多,当料液比为1∶25时,多酚和总黄酮的提取率均为最高,可能是圆苞车前子中多酚和黄酮物质得到了充分溶解,但继续增加料液比,多酚和黄酮的提取率降下。同时考虑溶剂用量和能量消耗,选择料液比为1∶25最为适宜。详见图1。
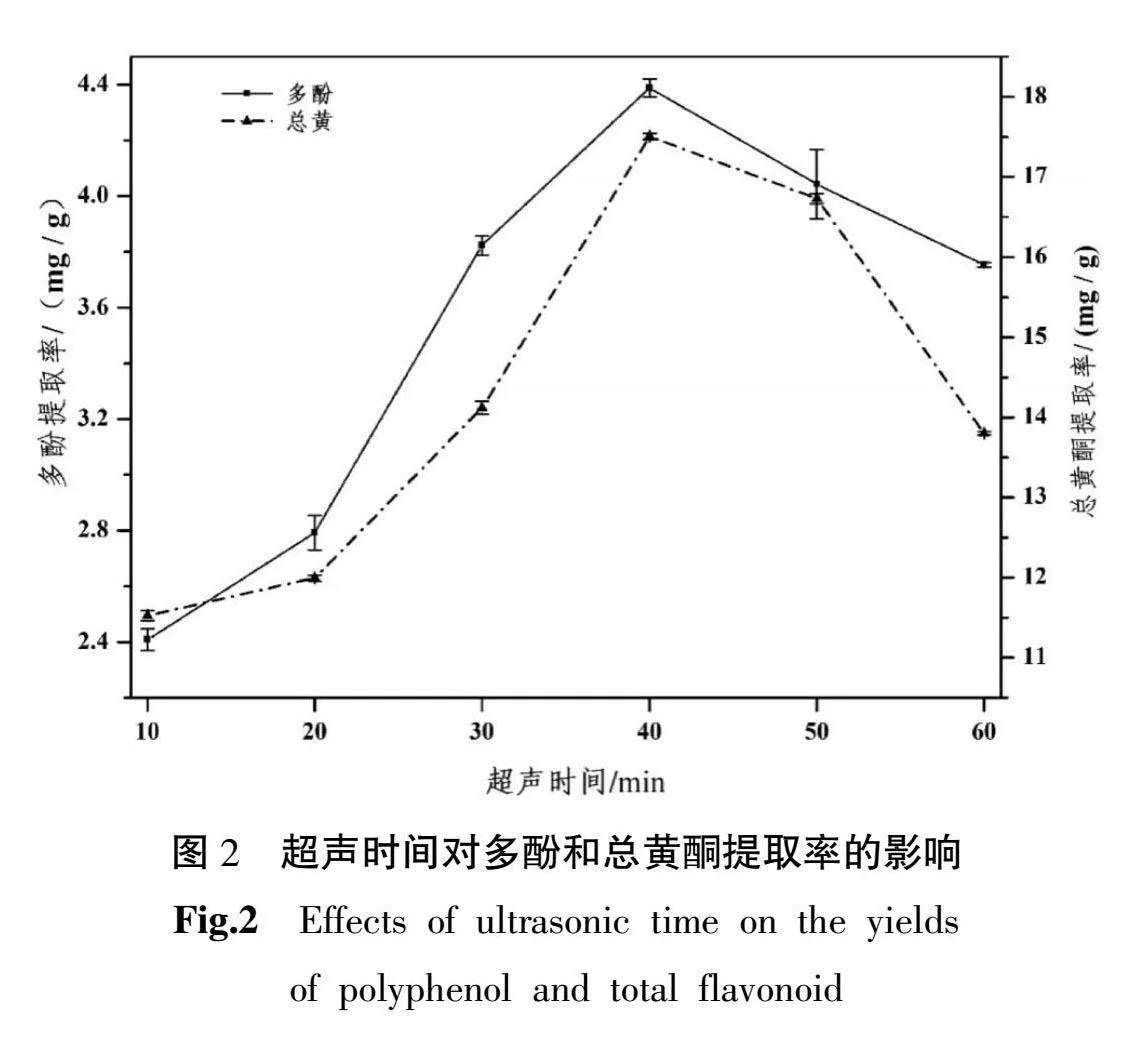
3.1.2 超声时间对多酚和总黄酮提取率的影响 10~40 min内,圆苞车前子中多酚和总黄酮提取量随着超声时间增加而提高,超声时间在40 min时提取率最高,在40~60 min时,多酚和总黄酮逐渐减少。详见图2。
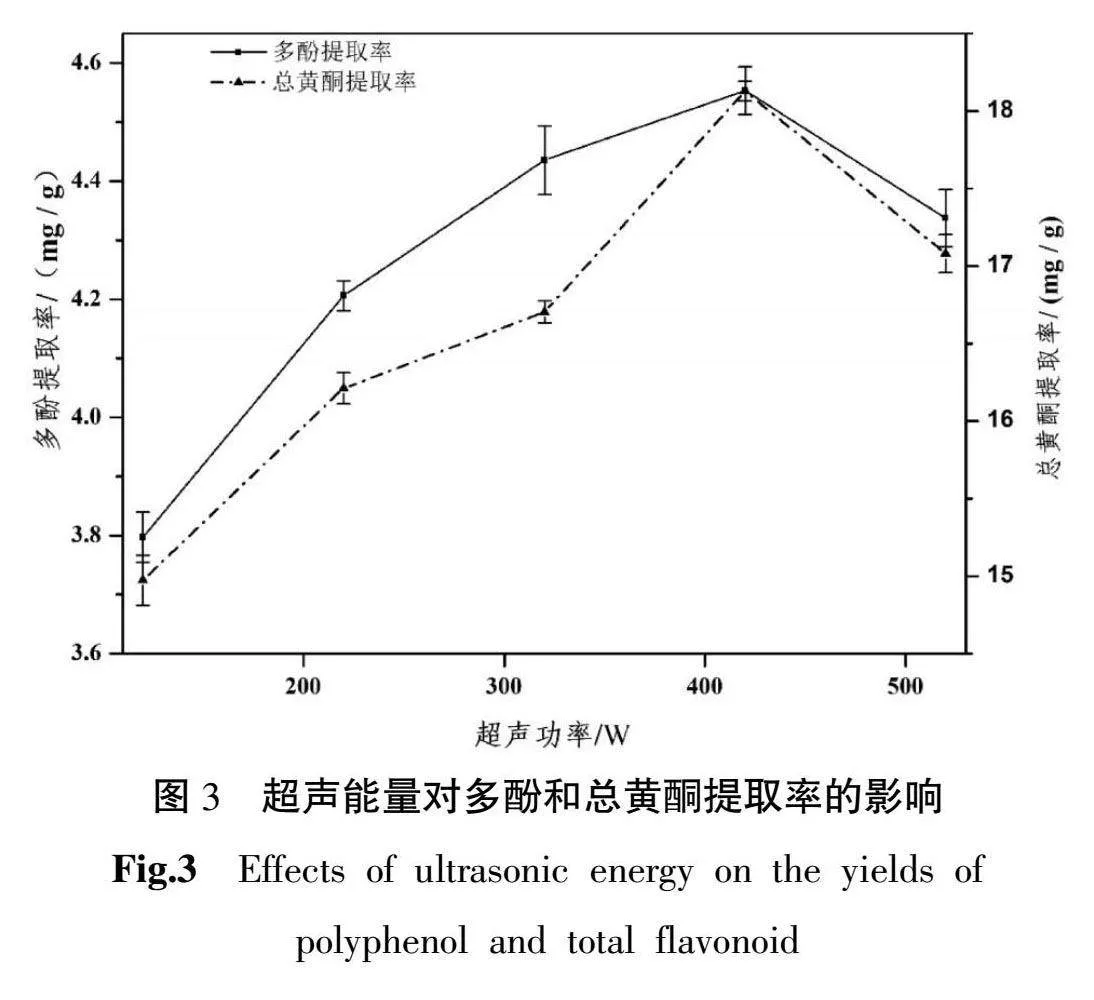
3.1.3 超声能量对多酚和总黄酮提取率的影响 多酚和总黄酮提取率随着超声能量增加而增加,在420 W时提取率最高。超声能量超过420 W时提取率减小。详见图3。
3.1.4 乙醇体积分数对圆苞车前子多酚与总黄酮提取率的影响 随着提取溶剂乙醇的体积分数增多,多酚与总黄酮提取率急剧提高,当乙醇体积分数达到90%时,圆苞车前子多酚与总黄酮的提取率也到达最高点,用无水乙醇提取时提取率反而直线下降。详见图4。
3.2 响应面实验结果与分析
3.2.1 Box-Behnken试验设计与结果 单因素实验结果基础上,用Design-Expert 8.0.6软件的Box-Behnken模型设计实验,响应面分析方案及结果如表2所示。
3.2.2 多酚回归方程方差分析及响应面试验结果 对多酚得率的结果进行拟合,圆苞车前子中多酚提取率对乙醇体积分数、超声能量、料液比和超声时间的二次多项式回归方程模型:Y=4.01-1.64A+ 0.081B-0.28C+0.15D-0.35AB-0.24AC-0.31AD+0.16 BC-0.57BD+0.089CD-1.16A2-0.20B2+0.13C2-0.12D2,对回归模型进行方差分析,结果见表3。
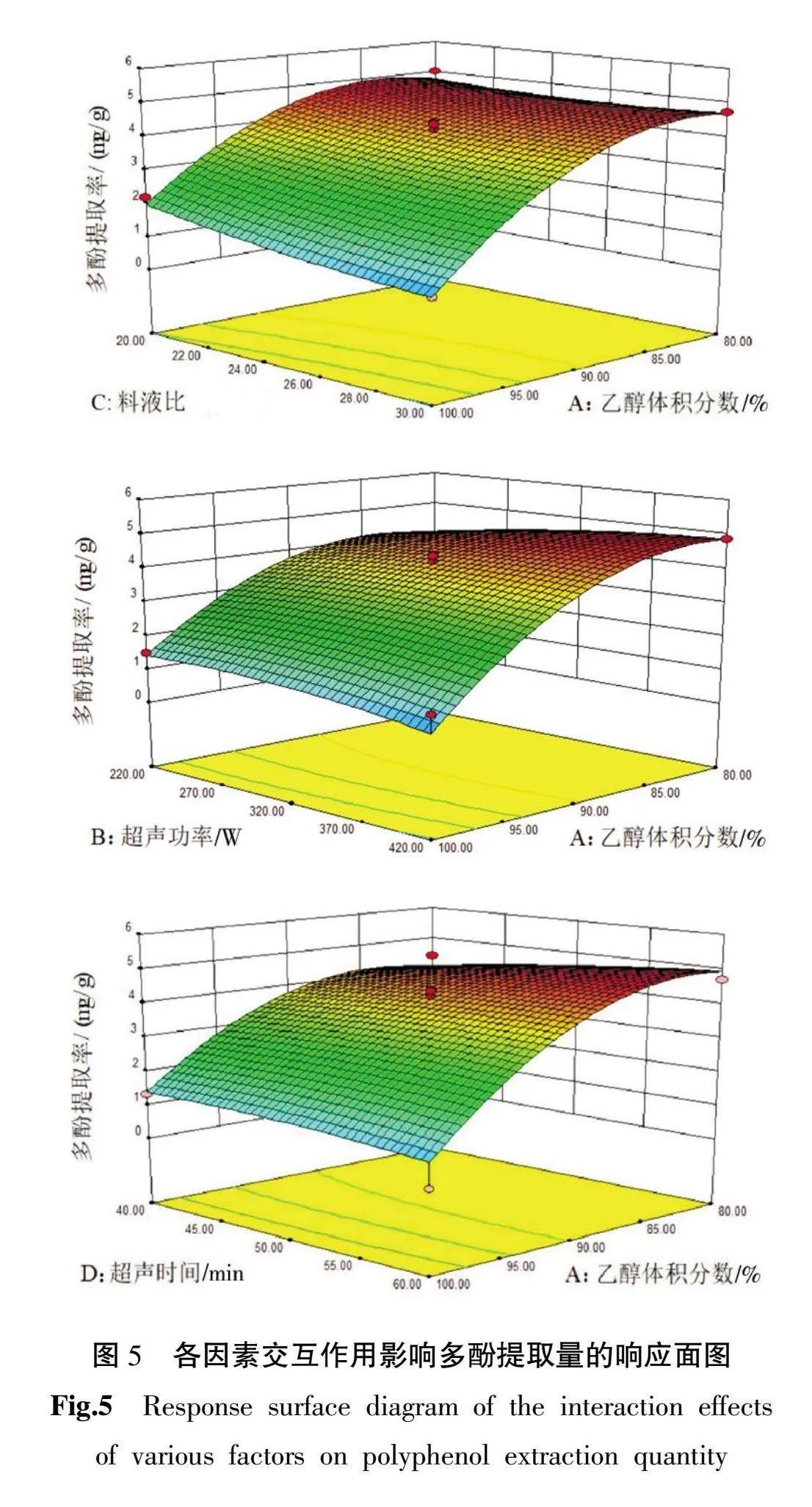
由表3可知:该模型的F=20.44,P<0.000 1,表明所得模型极显著,失拟项为P值为0.213>0.05,不显著,表明方程式成立,方法可靠,并模型与数据拟合程度良好。模型的复合相关系数R2=0.9534,表明相关性较强;可以用该模型优化圆苞车前子中多酚的提取工艺。根据F值可知所考察的因素对响应值影响力的大小顺序为乙醇体积分数(A)>料液比(C)>超声时间(D)>超声功率(B),其中A和A2对圆苞车前子多酚化合物的分离提取有极显著差异(P<0.01),C和BD对圆苞车前子多酚的提取影响亦显著(P<0.05)。
各因素交互作用对多酚提取量影响的响应曲面如图5所示。由图5可知,乙醇体积分数对多酚提取率的影响大于料液比、超声时间和超声能量的影响,这结果与方差分析所得结论一致。
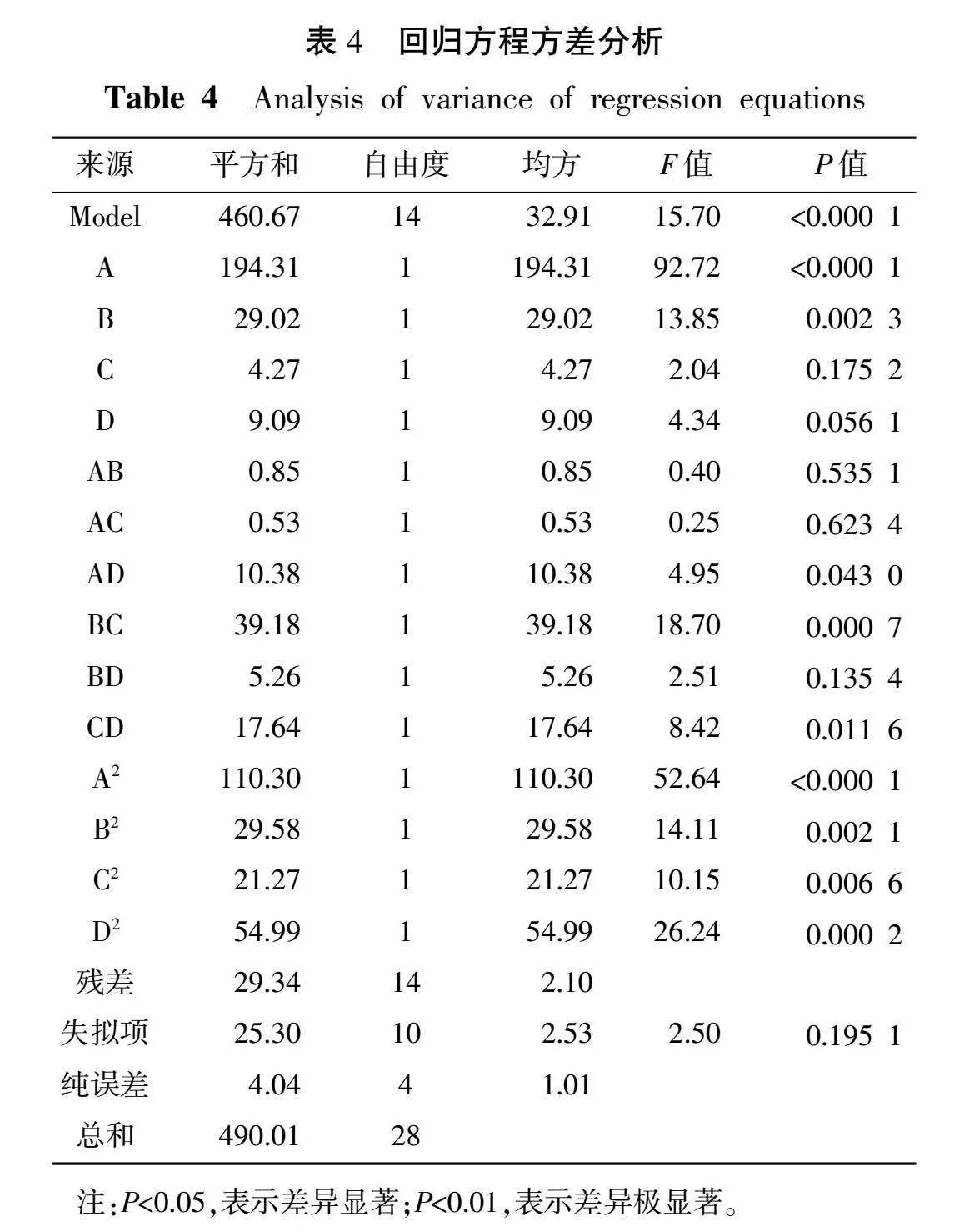
3.2.3 总黄酮回归方程方差分析及响应面试验结果 以总黄酮提取量作为响应值,建立二次回归多元方程如下:Y=22.2+4.02A+1.56B+0.6C-0.87D-0.46AB-0.36AC+1.61AD-3.13BC-1.15BD+2.1CD-4.12A2-2.14B2+1.81C2-2.91D2,对回归模型进行方差分析,结果见表4。
由表4可知,该模型的F=15.70,P<0.000 1,表明所得模型极显著,失拟项为P值为0.195>0.05,不显著,表明方程式成立,方法可靠,并模型与数据拟合程度良好。模型的复合相关系数R2=0.940 1,表明相关性较强;可以用该模型优化圆苞车前子中黄酮类成分的提取工艺。根据F值可知所考察的因素对响应值影响力的大小顺序为乙醇体积分数(A)>超声功率(B)>提取时间(D)>料液比(C),其中模型一次项A和B对结果均有极显著影响(P<0.01);交叉项BC具有极显著差异(P<0.01),交叉项AD和CD具有显著差异(P<0.05);二次项中A2、B2、C2和D2对结果均有极显著影响(P<0.01)。
各因素相互作用对黄酮提取率影响的响应曲面如图6所示。其中乙醇体积分数与超声功率,乙醇体积分数与料液比以及乙醇体积分数与超声时间的互相作用均较强,其次料液比与超声时间的相互作用最弱。
采用Design-Expert 8.0.6软件Optimization的Numerical功能,得到多酚和总黄酮响应面模型优化的最优提取工艺为乙醇体积分数88.57%,超声功率420.0 W,料液比1∶20,超声时间41.09 min。预测此条件下,最大多酚提取量4.81 mg/g,最大黄酮提取量23.26 mg/g。为便于工业生产及实际操作的可行性,确定最终工艺为乙醇体积分数88%,超声功率420 W,提取时间41 min,料液比1∶20,在此工艺条件下,进行三次平行实验,多酚得率的均值为4.79 mg/g(RSD=0.44%),黄酮得率均值为23.19 mg/g(RSD=0.19%),与预测值接近,表明经优化的提取工艺可行且稳定,可用于圆苞车前子中多酚和总黄酮的提取。
3.3 圆苞车前子提取物抗氧化活性评价
3.3.1 清除DPPH自由基的能力 如图7所示,在多酚浓度2.5~50 μg/mL范围内,随着圆苞车前子乙醇提取物和Vc浓度的升高,DPPH自由基清除能力均逐渐提高呈现量效关系,但在测试浓度范围内提取物对DPPH自由基的清除能力弱于同浓度Vc。当多酚浓度大于50.00 μg/mL时,随着浓度继续增大,清除率趋于平缓,总提取物的清除率与Vc接近,在多酚浓度为100.00 μg/mL时,Vc的清除率为87.84%,圆苞车前子提取物的清除率为84.31%。经计算得Vc和提取物的IC50值分别为14.38 μg/mL和26.62 μg/mL,可见,提取物表现出较好DPPH自由基清除能力,但与Vc相比,提取物对DPPH自由基清除率略弱。
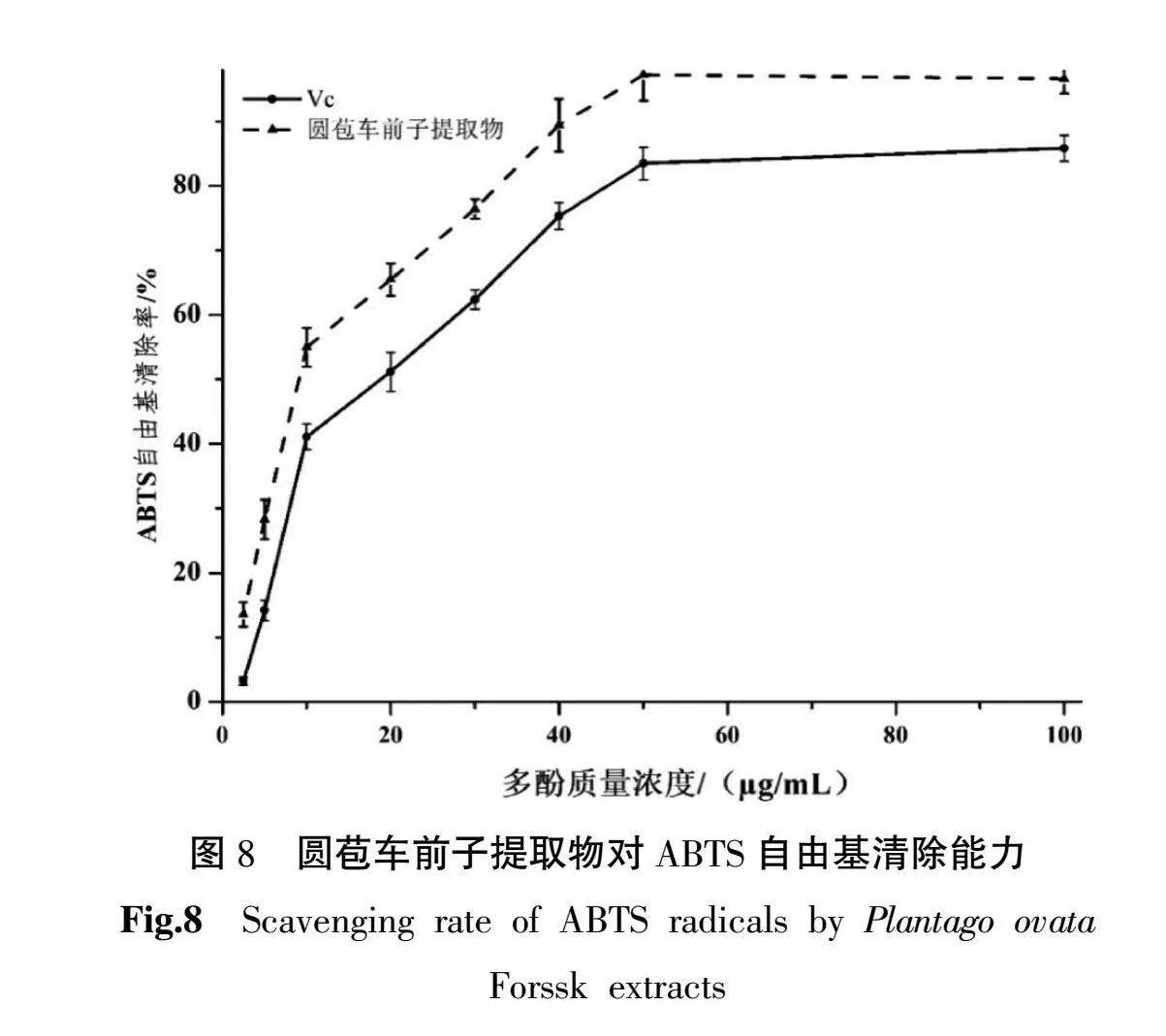
3.3.2 清除ABTS+自由基能力 如图8所示,多酚浓度2.5~50 μg/mL时,随着圆苞车前子乙醇提取物和Vc浓度的升高,ABTS+自由基清除能力均逐渐提高呈剂量效应关系,之后其清除ABTS+自由基的能力趋于平缓,且圆苞车前子提取物溶液总抗氧化能力始终比同等浓度抗坏血酸溶液高。当Vc浓度100 μg/mL时,清除率达到最大(85.48%),IC50值为19.49 μg/mL;而圆苞车前子提取物在多酚浓度为50.00 μg/mL时,清除率达到最大(97.21%),IC50值为9.40 μg/mL;说明圆苞车前子多酚具有良好的总抗氧化能力。
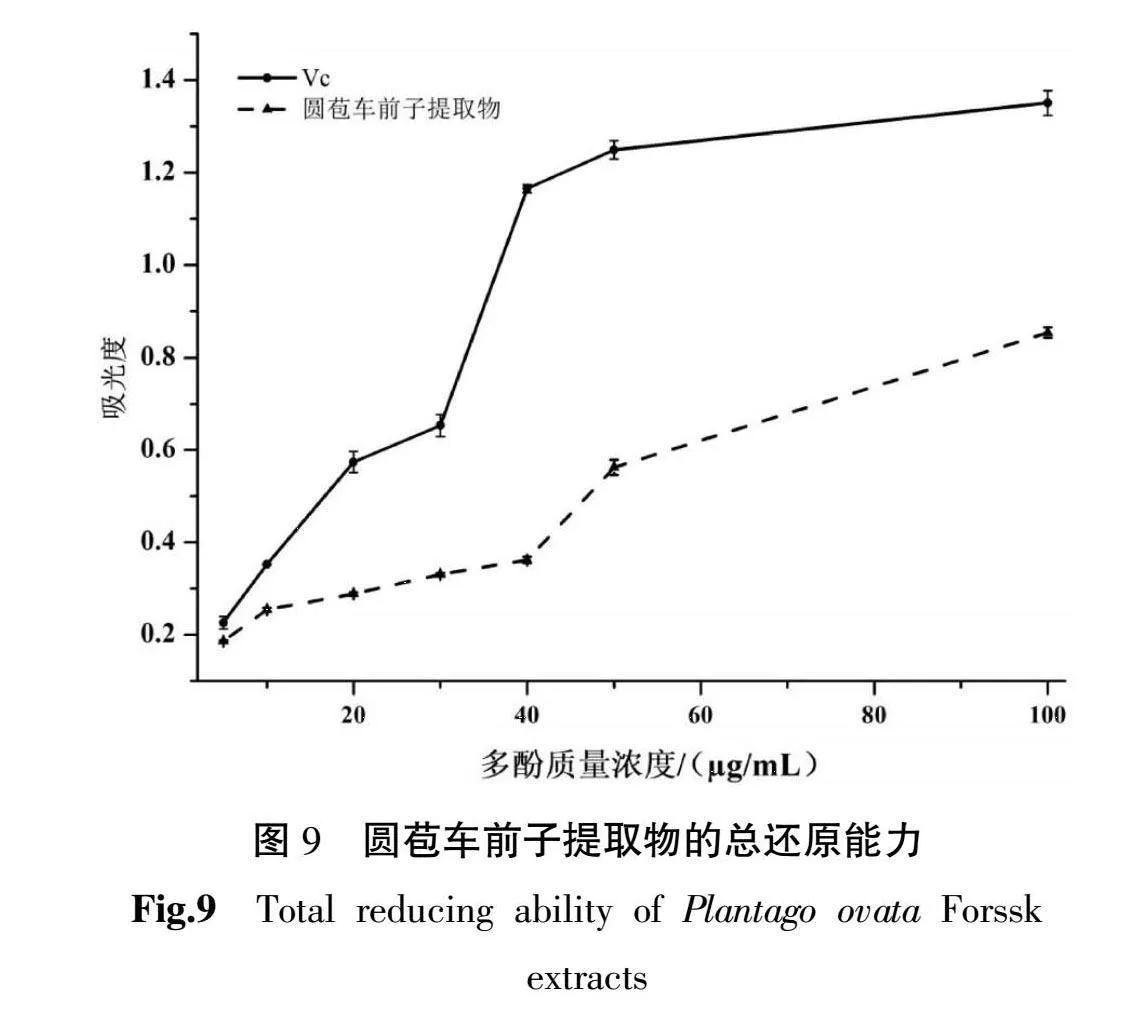
3.3.3 总还原能力 由图9可知,在5~100 μg/mL的浓度范围内,相同浓度圆苞车前子多酚还原能力比Vc低,但提取物的还原能力与其多酚质量浓度之间呈线性增加。当圆苞车前子多酚质量浓度为50 μg/mL时,其还原能力与浓度为20 μg/mL的Vc接近,表明圆苞车前子多酚具有较强的还原能力。
4 讨论
由单因素实验结果可见,当料液比为1∶25时提取率达到最高值。可能原因是,提取溶剂体积较小时,提取溶剂与药材的接触面积较小,得到多酚和总黄酮较少,而后当料液比大于1∶25时,超声波的部分能量被较多的溶剂消耗,作用于圆苞车前子的超声波能量减弱,降低了多酚和黄酮类成分从细胞中溶出的能力,导致提取率的下降,使得多酚与总黄酮提取率下降[18]。提取时间选为40 min,提取时间过短时,样品中的黄酮类成分没有被完全溶出,但随着提取时间的增加,其他杂质逐渐被溶出,或由于长时间超声波振荡的影响,一些不稳定成分被破坏,导致多酚和总黄酮的得率下降[18]。此外,提取率也与超声能量相关,一般情况下细胞内有效成分通过细胞膜及细胞壁依靠浓度差异进行渗透释放,当提供足够大的超声能量时,会加速细胞壁裂缝产生和发展,促使细胞膨胀至破裂,细胞内成分直接暴露进入溶剂中,提高溶出率及溶出速率[13]。结果表明,各因素中乙醇体积对提取率的影响较大,可能是乙醇浓度继续增大后,因溶剂极性变小使醇溶性、脂溶性或其他低级性杂质也被提取[18],从而导致多酚和总黄酮得率下降。文献报道不同药材使用乙醇提取时,获得最高提取率的乙醇体积分数存在一定差异[19-21],这些差异可能是与药材结构细胞致密度相关[13]。响应面图坡度的陡峭程度直观地反映了各因素对响应值的影响,响应面越陡峭的一方,对多酚提取率的影响越大[22]。
通过观察响应面图,可判断乙醇体积分数与超声功率,乙醇体积分数与料液比以及乙醇体积分数与超声时间的互相作用均较强。它们所对应的响应曲面均为较陡峭;料液比与超声时间的相互作用最弱,因此,其响应曲面较为平缓。直观分析结果与方差分析结果一致。本研究基于单因素试验结果,通过Box-Behnken模型优化圆苞车前子中多酚和总黄酮的超声辅助提取工艺,确定乙醇体积分数88%,超声功率420 W,提取时间41 min,料液比1∶20为最理想的提取工艺条件。此条件下,圆苞车前子多酚和总黄酮的实际提取量为分别为4.79 mg/g和23.19 mg/g,与预测值拟合效果好,表明建立的模型可靠,该提取工艺稳定合理,是提取圆苞车前子多酚和总黄酮的可行方法。
圆苞车前子乙醇提取物对DPPH自由基和ABTS+自由基的IC50分别为26.62 μg/mL和9.40 μg/mL,而Vc的IC50分别为14.38 μg/mL和19.49 μg/mL。可见,提取物表现出较好的DPPH自由基清除能力,但与Vc相比,其对DPPH自由基清除率略弱。此外,与Vc比较,该提取物具有较强的总还原能力。以上研究为圆苞车前子多酚和黄酮的生产以及圆苞车前子抗氧化活性成分应用于功能性食品开发提供理论依据。
参考文献
[1] FREZZA C, SCIUBBA F, TOMAI P, et al. Phytochemical analysis on the seeds of a new Iranian Plantago ovata Forssk. population specimen[J]. Natural Product Research, 2022, 36(14): 3761-3764.
[2] 李振宇, 张永田, 依布拉音·艾尔西丁. 中国车前属植物一新记录[J]. 植物分类学报, 2002, 40(5): 470-472.
[3] SHAHRIARI Z, HEIDARI B, DADKHODAIE A, et al. Analysis of karyotype, chromosome characteristics, variation in mucilage content and grain yield traits in Plantago ovata and P. psyllium species[J]. Industrial Crops and Products, 2018, 123: 676-686.
[4] 王祥山, 张睦焓, 王林元,等. 新外来中药圆苞车前子壳的中药药性探讨[J]. 环球中医药, 2022, 15(8): 1308-1314.
[5] 敏 德, 迪力努尔·沙比托夫, 伊布拉音·艾尔西丁, 等. 圆苞车前子脂肪油化学成分的研究[J]. 中国民族民间医药杂志, 2003, 12(6): 349-350.
[6] 沈晓丽, 沙拉麦提·艾力. HPLC法同时测定民族药材蚤状车前子中京尼平苷酸和毛蕊花糖苷的含量[J]. 中国药师, 2020, 23(8): 1628-1630.
[7] ZHOU P Y, EID M, XIONG W F, et al. Comparative study between cold and hot water extracted polysaccharides from Plantago ovata seed husk by using rheological methods[J]. Food Hydrocolloids, 2020, 101: 105465.
[8] FRANCO E A N, SANCHES-SILVA A, RIBEIRO-SANTOS R, et al. Psyllium (Plantago ovata Forsk): From evidence of health benefits to its food application[J]. Trends in Food Science & Technology, 2020, 96: 166-175.
[9] 迪丽努尔·莎比托夫, 敏 德, 依布拉音, 等. 圆苞车前子乙醇提取物毒性及药理实验研究[J]. 中成药, 2004, 26(11): 954-955.
[10] NUERXIATI R, MUTAILIFU P, LU C F, et al. Optimization of alkali extraction, structure, and antioxidant activity of protein-bound polysaccharide from seeds of Plantago ovata Forssk[J]. Industrial Crops and Products, 2022, 183: 114920.
[11] TALUKDER P, TALAPATRA S, GHOSHAL N, et al. Antioxidant activity and high-performance liquid chromatographic analysis of phenolic compounds during in vitro callus culture of Plantago ovata Forsk. and effect of exogenous additives on accumulation of phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 232-244.
[12] PATEL M K, TANNA B, GUPTA H, et al. Physicochemical, scavenging and anti-proliferative analyses of polysaccharides extracted from psyllium (Plantago ovata Forssk) husk and seeds[J]. International Journal of Biological Macromolecules, 2019, 133: 190-201.
[13] 龚受基, 覃 媚, 戴梓茹, 等. 响应面法优化相思藤黄酮提取工艺及其体外抗氧化活性分析[J]. 食品工业科技, 2024, 45(6): 178-185.
[14] 律梦伟, 刘鑫榕, 兰 卫, 等. 响应面法优化毛菊苣总黄酮和总多酚的超声提取工艺[J]. 化学与生物工程, 2023, 40(8): 20-25.
[15] 郑 沛, 文 敏, 刘秋叶, 等.半枝莲总黄酮提取工艺优化及抗氧化、抗肿瘤活性评价[J]. 食品工业科技, 2023, 44(23): 194-202.
[16] GONG J Y, HUANG J, XIAO G N, et al. Antioxidant capacities of fractions of bamboo shaving extract and their antioxidant components[J]. Molecules, 2016, 21(8): 996-1010.
[17] LIU Y, DU Y Q, WANG J H, et al. Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J]. International Journal of Biological Macromolecules, 2014, 64: 63-68.
[18] 杨 菁, 刘顶鼎, 陈 滕, 等. 粉条儿菜总黄酮提取工艺优化及抗氧化、抗炎活性分析[J]. 食品工业科技, 2024, 45(2): 192-200.
[19] 夏雨弘, 刘 颖, 周 茗, 等. 小二仙草总黄酮提取工艺的优化及其抗氧化活性分析[J]. 食品工业科技, 2023, 44(18): 244-250.
[20] SALEH M A, CLARK S, WOODARD B, et al. Antioxidant and free radical scavenging activities of essential oils[J]. Ethnicity & Disease, 2010, 20(S1): S78-S82.
[21] 张锦华, 徐 蔓, 白宝清, 等. 响应面法优化提取无花果干果中多酚和总黄酮物质及其抗氧化活性[J]. 食品工业科技, 2018, 39(16): 183-190, 212.
[22] 孙立权, 滕茂浩, 丛 勇, 等. 响应面法优化柴胡药渣中柴胡皂苷提取工艺[J]. 北京理工大学学报, 2023, 43(5): 540-548.