柴胡皂苷D通过NLRP3介导细胞焦亡抑制未分化甲状腺癌细胞增殖的机制研究
2024-12-09高芳李君郭艳霞李红




〔摘要〕 目的 研究柴胡皂苷D通过NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)介导细胞焦亡,抑制未分化甲状腺癌细胞增殖的作用及机制。方法 培养未分化甲状腺癌细胞株HTh83和KMH2,不同浓度柴胡皂苷D(1、4、7、10、13、16、19、22、25、28、31、34、37 μmol/L)作用48 h后检测细胞存活率,计算半数抑制浓度(50% inhibition concentration,IC50);细胞分为对照组(0 μmol/L柴胡皂苷D)、低浓度组(2.2 μmol/L柴胡皂苷D)、中浓度组(11 μmol/L柴胡皂苷D)、高浓度组(22 μmol/L柴胡皂苷D)、si-NC组(转染NC siRNA)、高浓度+si-NC组(22 μmol/L柴胡皂苷D联合转染NC siRNA)、高浓度+si-NLRP3组(22 μmol/L柴胡皂苷D联合转染NLRP3 siRNA),处理48 h后检测克隆形成数目,NLRP3、裂解型Caspase-1、GSDMD氨基末端片段(GSDMD N terminal fragment, GSDMD-N)的表达水平及培养基中白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-18(interleukin-18, IL-18)的水平。结果 柴胡皂苷D以浓度依赖的方式降低HTh83细胞和KMH2细胞的存活率(P<0.05);低浓度组、中浓度组、高浓度组的细胞克隆数目低于对照组(P<0.05),NLRP3、裂解型Caspase-1、GSDMD-N的表达水平及培养基中IL-1β、IL-18的水平高于对照组(P<0.05);高浓度+si-NLRP3组细胞的存活率及克隆数目高于高浓度+si-NC组(P<0.05),NLRP3、裂解型Caspase-1、GSDMD-N的表达水平及培养基中IL-1β、IL-18的水平低于高浓度+si-NC组(P<0.05)。结论 柴胡皂苷D能显著抑制未分化甲状腺癌细胞增殖,其作用机制可能与激活NLRP3,介导细胞焦亡有关。
〔关键词〕 未分化甲状腺癌;柴胡皂苷D;增殖;NOD样受体蛋白3;焦亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.011
Mechanism of saikosaponin D in inhibiting the proliferation of anaplastic thyroid cancer cells via NLRP3-mediated pyroptosis
GAO Fang1, LI Jun1, GUO Yanxia2, LI Hong3*
1. Department of Pharmacy, Tangshan Fengnan District Hospital of Chinese Medicine, Tangshan, Hebei 063300, China;
2. Department of Pharmacy Preparation, Tangshan Fengnan District Hospital of Chinese Medicine, Tangshan, Hebei 063300, China; 3. Department of Pharmacy, Tangshan Hospital of Chinese Medicine, Tangshan, Hebei 063300, China.
〔Abstract〕 Objective To study the effects and mechanism of saikosaponin D in inhibiting the proliferation of anaplastic thyroid cancer cells via NOD-like receptor protein 3 (NLRP3)-mediated pyroptosis. Methods Anaplastic thyroid cancer cell lines HTh83 and KMH2 were cultured and treated with various concentrations of saikosaponin D (1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37 μmol/L) for 48 h. Cell survival rate was subsequently measured and half-maximal inhibitory concentration (IC50) was calculated. The cells were divided into control group (0 μmol/L saikosaponin D), low concentration group (2.2 μmol/L saikosaponin D), medium concentration group (11 μmol/L saikosaponin D), high concentration group (22 μmol/L saikosaponin D) and si-NC group (transfected with NC) siRNA), high concentration+si-NC group (22 μmol/L saikosaponin D co-transfected with NC siRNA), and high concentration+si-NLRP3 group (22 μmol/L saikosaponin D co-transfected with NLRP3 siRNA). After 48 h of treatment, the colony formation was quantified, the expression levels of NLRP3, cleaved caspase-1, and GSDMD N terminal fragment (GSDMD-N) as well as the levels of interleukin-1β (IL-1β) and interleukin-18 (IL-18) in the medium were measured. Results Saikosaponin D reduced the survival rate of HTh83 cells and KMH2 cells in a concentration-dependent manner. The number of cell clones in low-, medium-, and high-concentration groups was lower than that in the control group (P<0.05), while the expression levels of NLRP3, cleaved caspase-1, and GSDMD-N, and the levels of IL-1β and IL-18 in the medium were higher than those in the control group (P<0.05). The survival rate and clone number in high concentration +si-NC group were higher than those in high concentration+si-NC group, while the expression levels of NLRP3, cleaved caspase-1, and GSDMD-N, and the levels of IL-1β and IL-18 in the medium were lower than those in high concentration+si-NC group (P<0.05). Conclusion Saikosaponin D significantly inhibits the proliferation of anaplastic thyroid cancer cells, and its mechanism is probably related to the activation of NLRP3 and the mediation of pyroptosis.
〔Keywords〕 anaplastic thyroid cancer; saikosaponin D; proliferation; Nod-like receptor protein 3; pyroptosis
未分化甲状腺癌是一种具有极高恶性程度的甲状腺恶性肿瘤,患者的临床预后差、生存期往往不超过半年[1-2]。虽然未分化甲状腺癌的分子机制尚不完全明确,但相关研究资料认为,细胞焦亡是调控未分化甲状腺癌细胞恶性生物学行为的重要靶点[3]。细胞焦亡过程中伴随着大量炎症物质的释放,因而该过程又称炎症性死亡。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)是调控焦亡的重要受体蛋白,NLRP3通过介导Gasdermin D(GSDMD)氨基末端的切割、形成GSDMD氨基末端片段(GSDMD N terminal,GSDMD-N)的方式执行细胞焦亡[4-6]。
中医学理论认为,甲状腺癌属“石瘿”范畴。柴胡疏肝散合二陈汤具有活血止痛、行气解郁的功效,临床研究证实该方剂对甲状腺癌术后复发具有抑制作用[7]。柴胡疏肝散合二陈汤中柴胡的活性成分柴胡皂苷D具有抗癌活性,可通过激活NLRP3/GSDMD-N介导的细胞焦亡抑制非小细胞肺癌细胞增殖[8],但柴胡皂苷D对未分化甲状腺癌细胞增殖及焦亡的调控作用尚不明确。基于此,本研究通过细胞实验对柴胡皂苷D通过NRLP3介导细胞焦亡,抑制未分化甲状腺癌细胞增殖的机制展开探索。
1 材料与方法
1.1 材料
未分化甲状腺癌细胞株HTh83和KMH2、CCK-8细胞增殖检测试剂盒(批号:CL-0806、CL-0623、P-CA-001,武汉普诺赛生命科技有限公司);柴胡皂苷D(批号:B20150,上海源叶生物科技有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO)、结晶紫(批号:D2650、Y0000418,美国Sigma公司);NLRP3一抗、裂解型Caspase-1一抗、GSDMD-N一抗(批号:ab263899、ab286125、ab210070,美国Abcam公司);辣根过氧化物酶标记的山羊抗兔抗体(批号:PK20001,武汉三鹰生物技术有限公司)。
细胞培养箱(Galaxy 170S型,Eppendorf公司);全波长酶标仪(ReadMax 1500型,上海闪谱生物科技有限公司);倒置显微镜(ECLIPSE Ts2型,日本Nikon公司);凝胶成像系统(1600R型,上海天能生命科学有限公司)。
1.2 方法
1.2.1 药物配制 用DMSO溶解柴胡皂苷D,制备成浓度为1 mmol/L的药物母液,放置在-20 ℃避光保存。进行细胞分组处理时,用培养基稀释至终浓度。
1.2.2 细胞培养 HTh83和KMH2细胞均在含有10%胎牛血清的高糖DMEM培养液中培养,培养条件为37 ℃及5%CO2。
1.2.3 CCK-8实验检测细胞增殖 消化收集对数生长期的HTh83和KMH2细胞,按照2 000个/孔接种在96孔培养板内,贴壁培养24 h后更换为含有不同浓度柴胡皂苷D(1、4、7、10、13、16、19、22、25、28、31、34、37 μmol/L[9])的培养基,设置对照组,并于每个浓度重复5次。培养48 h后加入CCK-8检测液,继续培养1 h后在酶标仪中检测450 nm波长处的吸光值(A)。细胞存活率=(A处理组-A空白组)/(A对照组-A空白组)×100%。根据细胞存活率计算柴胡皂苷D的半数抑制浓度(50% inhibition concentration,IC50)。
1.2.4 平板克隆实验检测细胞克隆数目 消化收集对数生长期的HTh83和KMH2细胞,按照1 000个/孔接种在6孔培养板内,贴壁培养24 h后按照对照组(0 μmol/L柴胡皂苷D)、低浓度组(2.2 μmol/L柴胡皂苷D)、中浓度组(11 μmol/L 柴胡皂苷D)、高浓度组(22 μmol/L 柴胡皂苷D)、si-NC组(转染NC siRNA)、高浓度+si-NC组(22 μmol/L柴胡皂苷D联合转染NC siRNA)、高浓度+si-NLRP3组(22 μmol/L柴胡皂苷D联合转染NLRP3 siRNA)处理。每2天更换1次培养液,第14天时弃培养基,磷酸盐缓冲液清洗3次后用4%多聚甲醛固定20 min,再次清洗后用0.1%结晶紫室温染色20 min,洗净结晶紫并拍照,计算克隆数目。
1.2.5 Western blot检测蛋白表达水平 消化收集对数生长期的HTh83和KMH2细胞,按照5×105个/孔接种在12孔培养板内,贴壁培养24 h后按照对照组(0 μmol/L柴胡皂苷D)、低浓度组(2.2 μmol/L柴胡皂苷D)、中浓度组(11 μmol/L柴胡皂苷D)、高浓度组(22 μmol/L柴胡皂苷D)、si-NC组(转染NC siRNA)、高浓度+si-NC组(22 μmol/L柴胡皂苷D联合转染NC siRNA)、高浓度+si-NLRP3组(22 μmol/L柴胡皂苷D联合转染NLRP3 siRNA)作用48 h。弃培养基,采用蛋白裂解液提取细胞蛋白,按照Western blot流程进行实验,以β-actin为内参,检测NLRP3、裂解型Caspase-1、GSDMD-N的蛋白表达水平。
1.2.6 ELISA检测培养基中IL-1β、IL-18水平 按照“1.2.5”的方法接种细胞和分组处理,收集处理后的细胞培养基,采用ELISA试剂盒检测培养基中白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-18(interleukin-18, IL-18)的水平。
1.3 统计学处理
采用GraphPad Prism 6.0软件进行数据的统计学处理及制图。实验数据均为计量资料,以“x±s”表示,进行单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
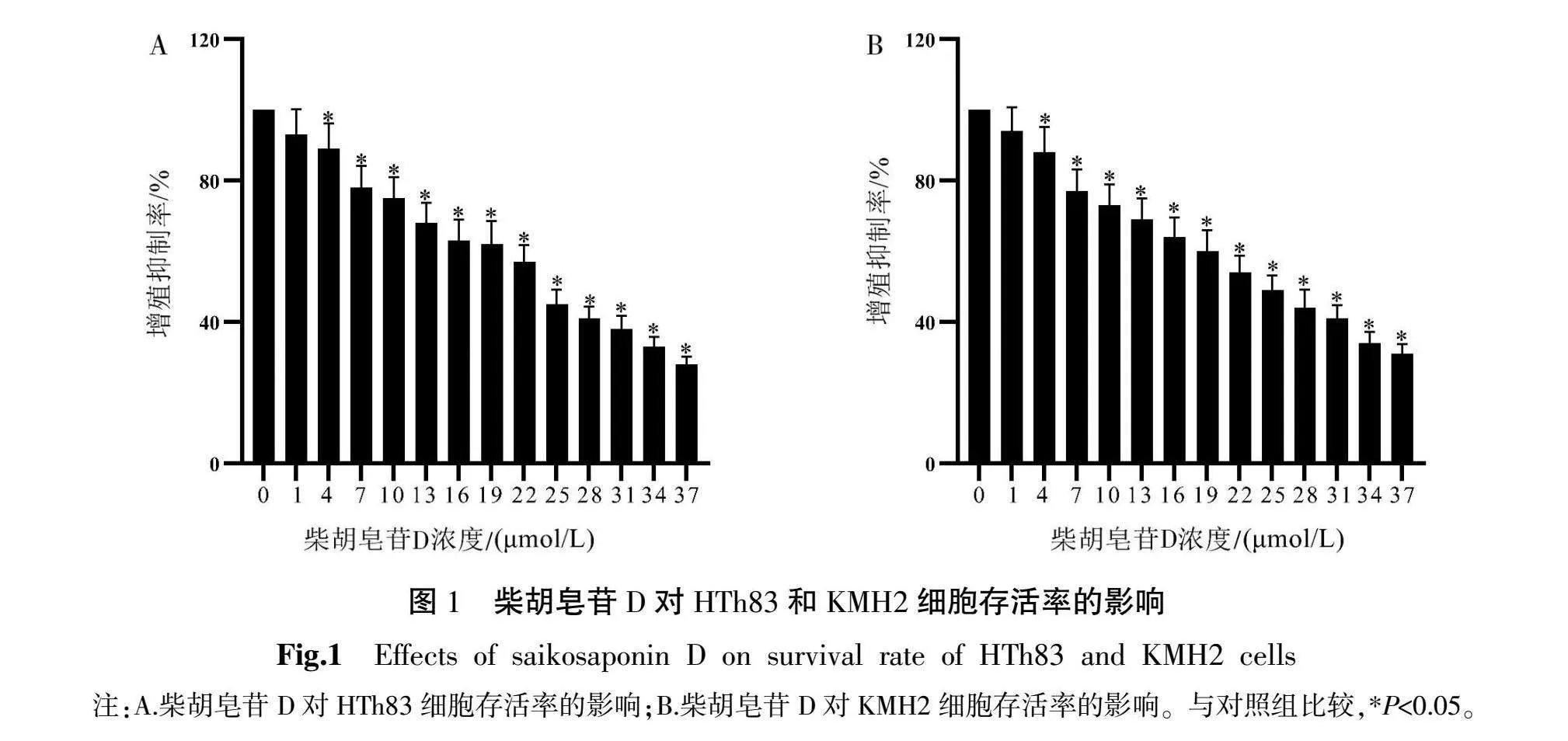
2.1 柴胡皂苷D对HTh83和KMH2细胞增殖的影响
与对照组比较,不同浓度柴胡皂苷D(1、4、7、10、13、16、19、22、25、28、31、34、37 μmol/L)作用HTh83和KMH2细胞48 h后细胞存活率均显著降低(P<0.05),HTh83细胞和KMH2细胞柴胡皂苷D作用48 h的IC50分别为22.20、22.90 μmol/L。详见图1。根据IC50的0.1倍、0.5倍和1.0倍选择低浓度(2.2 μmol/L)、中浓度(11 μmol/L)、高浓度(22 μmol/L)柴胡皂苷D作用48 h进行后续实验。
2.2 柴胡皂苷D对HTh83和KMH2细胞克隆形成的影响
柴胡皂苷D作用48 h时,低浓度组、中浓度组、高浓度组HTh83和KMH2细胞的克隆数目均低于对照组(P<0.05),且HTh83和KMH2细胞的克隆数目随柴胡皂苷D浓度升高而降低(P<0.05)。详见表1。
2.3 柴胡皂苷D对HTh83和KMH2细胞中NLRP3介导焦亡的影响
柴胡皂苷D作用48 h时,低浓度组、中浓度组、高浓度组HTh83和KMH2细胞的NLRP3、裂解型Caspase-1、GSDMD-N的表达水平以及培养基中IL-1β、IL-18的水平均高于对照组(P<0.05),且HTh83和KMH2细胞的NLRP3、裂解型Caspase-1、GSDMD-N的表达水平以及培养基中IL-1β、IL-18的水平随柴胡皂苷D浓度升高而增加(P<0.05)。详见图2、表2。
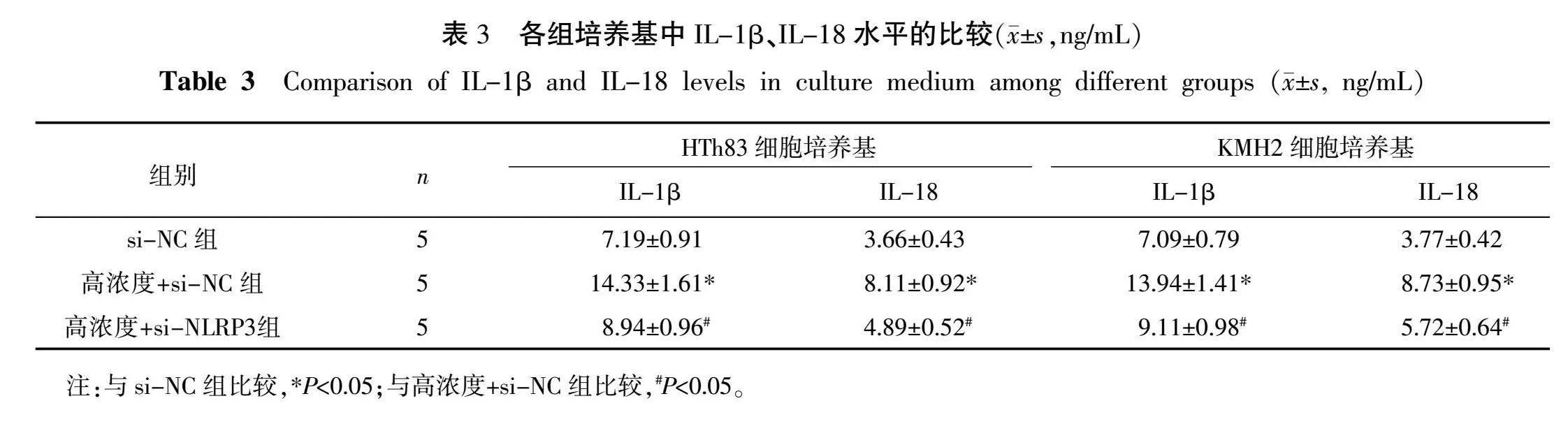
2.4 NLRP3 siRNA转染对柴胡皂苷D促进HTh83和KMH2细胞中NLRP3介导焦亡的影响
高浓度+si-NC组HTh83和KMH2细胞处理48 h时的NLRP3、裂解型Caspase-1、GSDMD-N表达水平以及培养基中IL-1β、IL-18的水平均高于si-NC组(P<0.05);高浓度+si-NLRP3组HTh83和KMH2细胞处理48 h时的NLRP3、裂解型Caspase-1、GSDMD-N表达水平以及培养基中IL-1β、IL-18的水平均低于高浓度+si-NC组(P<0.05)。详见图3、表3。
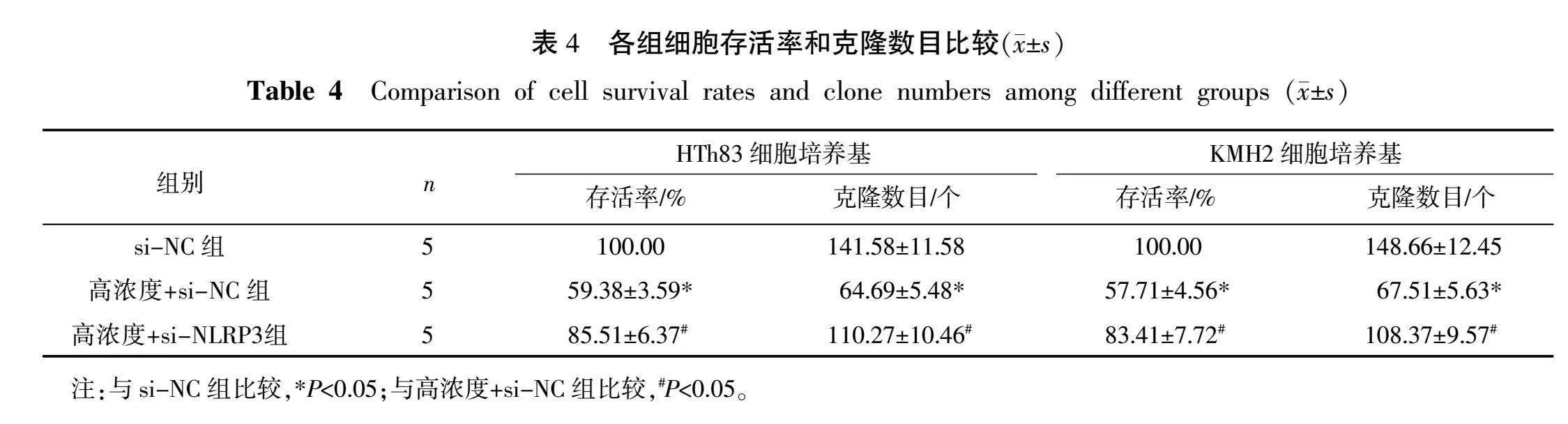
2.5 抑制NLRP3表达对柴胡皂苷D抑制HTh83和KMH2细胞增殖和克隆形成的影响
高浓度+si-NC组HTh83和KMH2细胞处理48 h时的细胞存活率及克隆数目均低于si-NC组(P<0.05);高浓度+si-NLRP3组HTh83和KMH2细胞处理48 h时的细胞存活率及克隆数目均高于高浓度+si-NC组(P<0.05)。详见表4。
3 讨论
未分化甲状腺癌是一种起源于甲状腺滤泡上皮细胞的高度恶性肿瘤,常规手术切除、放化疗的疗效均不理想,患者确诊后的平均生存期为6~8个月[1-2]。未分化甲状腺癌细胞表现出极强的增殖活性,与之相关的可能机制包括细胞凋亡、焦亡、铁死亡等生物学环节异常[10-11],但具体分子机制尚不完全清楚。因此,研究疾病的分子机制、发现新的治疗靶点和治疗手段对改善未分化甲状腺癌的治疗现状、延长患者的生存期具有重要意义。中药材及其活性成分是近些年抗癌研究的热点,本研究对中药柴胡的活性成分柴胡皂苷D抑制未分化甲状腺癌细胞增殖的作用及机制展开分析。
中医学认为甲状腺癌归属于“石瘿”范畴,其发病与肝郁气滞、痰湿凝聚有关,以柴胡为君药的柴胡疏肝散合二陈汤能够针对甲状腺癌的中医病机发挥活血止痛、行气解郁的功效[7]。研究资料显示,甲状腺癌术后应用柴胡疏肝散合二陈汤治疗能显著降低肿瘤复发率,提示该方剂具有抗甲状腺癌的功效[7]。柴胡疏肝散合二陈汤中柴胡的活性成分为柴胡皂苷D,多项基础研究证实,柴胡皂苷D对肺癌细胞、胰腺癌细胞、胶质瘤细胞、子宫内膜癌细胞、肺癌细胞的增殖具有抑制作用[8, 12-16]。本研究在两种未分化甲状腺癌细胞株HTh83和KMH2中探究柴胡皂苷D抑制增殖的作用。结果显示,柴胡皂苷D以浓度依赖性的方式抑制HTh83细胞和KMH2细胞增殖。平板克隆实验结果显示,不同浓度柴胡皂苷D能显著抑制HTh83细胞和KMH2细胞克隆形成。以上实验结果表明,柴胡皂苷D对未分化甲状腺癌细胞的增殖具有抑制效应。
焦亡作为一种新的程序性细胞死亡形式,其与未分化甲状腺癌发生发展的密切关系受到越来越多的关注。焦亡过程中伴随大量炎症物质释放,调控炎症反应的受体蛋白NLRP3是激活细胞焦亡的经典途径,NLRP3能够使细胞内裂解型Caspase-1生成增加,后者切割GSDMD形成的GSDMD-N是执行焦亡的蛋白[17-18]。GSDMD-N能定位于细胞膜并聚集成膜孔,使细胞中的炎症物质从膜孔释放并引起细胞发生炎症性死亡,即细胞焦亡[19-22]。非小细胞肺癌相关的研究证实,柴胡皂苷D通过激活NLRP3/GSDMD-N介导的焦亡抑制癌细胞增殖[8]。本研究对未分化甲状腺癌细胞中柴胡皂苷D调控细胞焦亡的作用进行分析。结果显示,不同浓度柴胡皂苷D显著增加HTh83细胞和KMH2细胞中NLRP3、裂解型Caspase-1及GSDMD-N的表达。这一结果与柴胡皂苷D在非小细胞肺癌中的实验结果一致[8],表明柴胡皂苷D对未分化甲状腺癌细胞的焦亡具有促进作用,进而提示柴胡皂苷D可能通过促进焦亡的方式抑制未分化甲状腺癌细胞增殖。
多项基础研究证实,抑制焦亡对未分化甲状腺癌细胞的增殖具有显著抑制作用[23-25]。本研究进一步设计转染siRNA的逆转实验,验证细胞焦亡在柴胡皂苷D抑制未分化甲状腺癌细胞增殖中的作用。通过转染NLRP3 siRNA的方式在柴胡皂苷D作用于细胞的过程中抑制NLRP3表达,进而阻碍NLRP3介导的细胞焦亡。细胞增殖及克隆形成的检测结果显示,柴胡皂苷D作用于细胞的同时,通过转染siRNA的方式抑制NLRP3表达后,柴胡皂苷D在HTh83细胞和KMH2细胞中抑制增殖和克隆形成、促进焦亡的作用均明显减弱,提示柴胡皂苷D对未分化甲状腺癌细胞增殖的抑制作用与促进NLRP3介导细胞焦亡的激活有关。
综上所述,柴胡皂苷D对未分化甲状腺癌细胞的增殖具有抑制作用,这一抑制作用与促进NLRP3介导细胞焦亡的激活有关。本研究结果为探索柴胡皂苷D在未分化甲状腺癌中的治疗价值及深入认识细胞焦亡在未分化甲状腺癌发生发展中的生物学价值提供了细胞实验证据。
参考文献
[1] TAO Y J, LI P, FENG C, et al. New insights into immune cells and immunotherapy for thyroid cancer[J]. Immunological Investigations, 2023, 52(8): 1039-1064.
[2] LI C, DONG X, YUAN Q, et al. Identification of novel characteristic biomarkers and immune infiltration profile for the anaplastic thyroid cancer via machine learning algorithms[J]. Journal of Endocrinological Investigation, 2023, 46(8): 1633-1650.
[3] ZHAO Q W, FENG H R, YANG Z Y, et al. The central role of a two-way positive feedback pathway in molecular targeted therapies-mediated pyroptosis in anaplastic thyroid cancer[J]. Clinical and Translational Medicine, 2022, 12(2): e727.
[4] ZHAO C Y, MU M C, LI X P, et al. USP50 regulates NLRP3 inflammasome activation in duodenogastric reflux-induced gastric tumorigenesis[J]. Frontiers in Immunology, 2024, 15: 1326137.
[5] ZENG Y, LI M X, WU S Q, et al. Carvedilol induces pyroptosis through NLRP3-caspase1-ASC inflammasome by nuclear migration of NF-κB in prostate cancer models[J]. Molecular Biology Reports, 2024, 51(1): 201.
[6] LI M, WU R R, WANG L, et al. Usenamine A triggers NLRP3/caspase-1/GSDMD-mediated pyroptosis in lung adenocarcinoma by targeting the DDX3X/SQSTM1 axis[J]. Aging, 2024, 16(2): 1663-1684.
[7] 贺小华. 甲状腺次全切除术后应用柴胡疏肝散合二陈汤对甲状腺癌患者的效果分析[J]. 天津药学, 2021, 33(1): 37-39.
[8] CHEN M Q, HU C Y, YANG L, et al. Saikosaponin-D induces the pyroptosis of lung cancer by increasing ROS and activating the NF-κB/NLRP3/caspase-1/GSDMD pathway[J]. Journal of Biochemical and Molecular Toxicology, 2023, 37(8): e23444.
[9] 关月宏, 刘桂梅, 刘雨思, 等. 柴胡皂苷D通过Akt/mTOR通路调控胰腺癌Panc-1细胞凋亡及自噬[J]. 中国中药杂志, 2023, 48(19): 5278-5284.
[10] GUO L, YUAN M, JIANG S H, et al. Expression of pyroptosis-associated genes and construction of prognostic model for thyroid cancer[J]. Translational Cancer Research, 2023, 12(12): 3360-3383.
[11] WU J J, LIANG J Y, LIU R Q, et al. Autophagic blockade potentiates anlotinib-mediated ferroptosis in anaplastic thyroid cancer[J]. Endocrine-Related Cancer, 2023, 30(9): e230036.
[12] XU X S, CUI L H, ZHANG L Q, et al. Saikosaponin d modulates the polarization of tumor-associated macrophages by deactivating the PI3K/AKT/mTOR pathway in murine models of pancreatic cancer[J]. International Immunopharmacology, 2023, 122: 110579.
[13] TANG T T, JIANG L, ZHONG Q, et al. Saikosaponin D exerts cytotoxicity on human endometrial cancer ishikawa cells by inducing apoptosis and inhibiting metastasis through MAPK pathways[J]. Food and Chemical Toxicology, 2023, 177: 113815.
[14] LIU G M, GUAN Y H, LIU Y X, et al. Saikosaponin D inducing apoptosis and autophagy through the activation of endoplasmic reticulum stress in glioblastoma[J]. BioMed Research International, 2022, 2022: 5489553.
[15] WU S, CHEN W, LIU K, et al. Saikosaponin D inhibits proliferation and induces apoptosis of non-small cell lung cancer cells by inhibiting the STAT3 pathway[J]. The Journal of International Medical Research, 2020, 48(9): 300060520937163.
[16] WANG B F, MIN W L, LIN S, et al. Saikosaponin-d increases radiation-induced apoptosis of hepatoma cells by promoting autophagy via inhibiting mTOR phosphorylation[J]. International Journal of Medical Sciences, 2021, 18(6): 1465-1473.
[17] FENG S H, ZHAO B, ZHAN X, et al. Quercetin-induced pyroptosis in colon cancer through NEK7-mediated NLRP3 inflammasome-GSDMD signaling pathway activation[J]. American Journal of Cancer Research, 2024, 14(3): 934-958.
[18] LI M, WU R R, WANG L, et al. Usenamine A triggers NLRP3/caspase-1/GSDMD-mediated pyroptosis in lung adenocarcinoma by targeting the DDX3X/SQSTM1 axis[J]. Aging, 2024, 16(2): 1663-1684.
[19] MIAO R, JIANG C, CHANG W Y, et al. Gasdermin D permeabilization of mitochondrial inner and outer membranes accelerates and enhances pyroptosis[J]. Immunity, 2023, 56(11): 2523-2541.
[20] BALASUBRAMANIAN A, HSU A Y, GHIMIRE L, et al. The palmitoylation of gasdermin D directs its membrane translocation and pore formation during pyroptosis[J]. Science Immunology, 2024, 9(94): 1452.
[21] XING Y Q, ZHANG F Y, JI P P, et al. Efficient delivery of GSDMD-N mRNA by engineered extracellular vesicles induces pyroptosis for enhanced immunotherapy[J]. Small, 2023, 19(20): e2204031.
[22] WU L G, WU X, LIU J J, et al. Expression and significance of effector proteins NLRP3 and gasdermin D N-terminal protein in the pyrolysis pathway in breast cancer[J]. Medicine, 2023, 102(40): e35440.
[23] GUO Y W, ZHU L, DUAN Y T, et al. Ruxolitinib induces apoptosis and pyroptosis of anaplastic thyroid cancer via the transcriptional inhibition of DRP1-mediated mitochondrial fission[J]. Cell Death & Disease, 2024, 15(2): 125.
[24] GUO H H, MA R S, ZHANG Y F, et al. Ibuprofen inhibits anaplastic thyroid cells in vivo and in vitro by triggering NLRP3-ASC-GSDMD-dependent pyroptosis[J]. Inflammopharmacology, 2024, 32(1): 733-745.
[25] GUO H H, MA R S, ZHANG Y F, et al. Alantolactone induces concurrent apoptosis and GSDME-dependent pyroptosis of anaplastic thyroid cancer through ROS mitochondria-dependent caspase pathway[J]. Phytomedicine, 2023, 108: 154528.