基于NLRP3/Caspase-1通路探讨银屑平丸含药血清对TNF-α诱导的人表皮角质形成细胞焦亡的影响
2024-12-09沈乐乐陈邦弟席建元

〔摘要〕 目的 探讨银屑平丸含药血清通过调控NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)/胱天蛋白酶-1(cysteine aspartate-specific proteinase-1,Caspase-1)信号通路改善肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的人表皮角质形成细胞焦亡的作用机制。方法 制备银屑平丸含药血清、阿维A含药血清及空白血清,采用CCK-8试剂检测空白血清对人表皮角质形成细胞存活率的影响;体外常规培养人表皮角质形成细胞,使用TNF-α诱导人表皮角质形成细胞建立体外银屑病损伤模型,设置正常组、模型组、空白血清组、银屑平丸含药血清组、阿维A含药血清组;ELISA 法检测各组细胞上清液中白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-18(interleukin-18,IL-18)水平;RT-PCR检测各组细胞NLRP3,功能蛋白D(gasdermin D,GSDMD)、Caspase-1 mRNA表达;Western blot 法检测各组细胞NLRP3、GSDMD、Caspase-1蛋白的表达。结果 与正常组比较,空白血清干预后细胞存活率无明显改变。与正常组比较,模型组和空白血清组细胞上清中IL-1β、IL-18水平显著升高(P<0.01),且NLRP3、GSDMD、Caspase-1蛋白及mRNA表达水平显著升高(P<0.05);与模型组比较,银屑平丸含药血清组及阿维A含药血清组细胞上清IL-1β、IL-18蛋白及mRNA水平明显下降(P<0.01),NLRP3、GSDMD、Caspase-1蛋白及mRNA表达显著下降(P<0.01)。结论 银屑平丸含药血清可下调TNF-α诱导的人表皮角质形成细胞NLRP3、GSDMD、Caspase-1蛋白及mRNA表达,降低炎症因子表达水平,其作用机制可能与调控 NLRP3/Caspase-1通路有关。
〔关键词〕 银屑病;银屑平丸含药血清;NLRP3/Caspase-1通路;人表皮角质形成细胞;细胞焦亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.010
Effects of serum containing Yinxieping Pill on TNF-α-induced pyroptosis of human epidermal keratinocytes based on the NLRP3/Caspase-1 pathway
SHEN Lele, Chen Bangdi, XI Jianyuan*
The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To investigate the mechanism of action of serum containing Yinxieping Pill (SCYXPP) in improving pyroptosis of human epidermal keratinocytes induced by tumor necrosis factor-α (TNF-α) through regulating the NOD-like receptor thermal protein domain associated protein 3 (NLRP3)/cysteine aspartate-specific proteinase-1 (Caspase-1) signaling pathway. Methods SCYXPP, serum containing Acitretin (SCA), and blank serum were prepared. CCK-8 reagent was used to detect the effect of blank serum on cell viability of the human epidermal keratinocytes. Human epidermal keratinocytes were cultured in vitro under conventional conditions and TNF-α was applied to them to establish an in vitro psoriasis injury model. Then normal, model, blank serum, SCYXPP, and SCA groups were set up. The levels of interleukin-1β (IL-1β) and interleukin-18 (IL-18) in the cell supernatant of each group were determined by ELISA, the mRNA expressions of NLRP3, gasdermin D (GSDMD), and Caspase-1 in the cells of each group were examined by RT-PCR, and the protein expressions of NLRP3, GSDMD, and Caspase-1 were checked by Western blot. Results Compared with the normal group, there was no significant change in cell viability in the blank serum group. Compared with the normal group, the levels of IL-1β and IL-18 in the cell supernatant of the model and blank serum groups were significantly elevated (P<0.01), and the mRNA and protein expressions of NLRP3, GSDMD, and Caspase-1 were significantly higher (P<0.05). Compared with the model group, the IL-1β and IL-18 levels in the cellular supernatant of SCYXPP and SCA groups significantly decreased (P<0.01), and the mRNA and protein expressions of NLRP3, GSDMD, and Caspase-1 were significantly reduced (P<0.01). Conclusion SCYXPP can down-regulate the mRNA and protein expressions of NLRP3, GSDMD, and Caspase-1 in human epidermal keratinocytes induced by TNF-α, and reduce the expression levels of inflammatory factors. Its mechanism of action may be related to the regulation of the NLRP3/Caspase-1 pathway.
〔Keywords〕 psoriasis; serum containing Yinxieping Pill; NLRP3/Caspase-1 pathway; human epidermal keratinocytes; pyroptosis
银屑病具有自身免疫性致病特征和高度免疫介导的遗传易感性,是一种炎症性皮肤病[1],主要表现为具有银白色鳞屑的红斑斑块,多位于头皮、肘部和膝关节。银屑病患病率在不同人群中差异很大,亚洲成人银屑病患病率约0.4%,美国成年人的银屑病患病率为3.2%[2],近年来发病率呈上升趋势[3]。目前认为,银屑病是由遗传和环境因素诱导的免疫异常[4],涉及角质形成细胞及各种免疫细胞,如T细胞、浆细胞样树突状细胞、髓系树突状细胞、中性粒细胞和巨噬细胞等,共同形成炎症回路,促进银屑病的发病和发展[5]。随着对银屑病发病机制的深入研究,越来越多的证据表明,细胞焦亡在银屑病的发生和发展中起着重要作用[6-7]。
细胞焦亡是一种新型的炎症依赖性程序性细胞死亡,包括经典的胱天蛋白酶-1(cysteine aspartate-specific proteinase-1,Caspase-1)通路和非经典的胱天蛋白酶-4/5/11(cysteine aspartate-specific proteinase-4/5/11,Caspase-4/5/11)通路[8-9]。焦亡作为一种重要的促炎机制,与癌症、感染性疾病、自身免疫性疾病和心血管疾病密切相关,已被广泛研究[10]。然而,细胞焦亡在银屑病发展中的作用尚未阐明。
银屑平丸是在国医大师指导下确立的有效治疗银屑病的自制药,以《医宗金鉴》犀角地黄汤为基础方化裁而成,由生地黄、白花蛇舌草、半枝莲、大青叶、赤芍、牡丹皮、丹参、紫草、女贞子、旱莲草、山药、白鲜皮和甘草组成。研究表明,银屑平丸含有的有效成分可通过抗炎、免疫调节、改善微循环、促进皮肤再生等机制共同发挥作用[11-13]。其中,生地黄、半枝莲、女贞子等药物的有效成分与细胞焦亡过程密切相关[14-15]。课题组前期研究表明,银屑平丸可提高寻常型银屑病疗效,复发率低,安全性高[16]。进一步的动物实验表明,银屑平丸可降低白细胞介素-18(interleukin-18,IL-18)[17]表达缓解咪喹莫特诱导的小鼠银屑病样皮损。细胞实验证实,银屑平丸含药血清可抑制肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)诱导的人表皮角质形成细胞增殖,降低TNF-α、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)及人表皮角质形成细胞相关蛋白表达[18],但其对人表皮角质形成细胞焦亡的影响尚不清楚。本研究采用细胞培养的方法,建立TNF-α诱导的银屑病细胞损伤模型,从NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)Caspase-1信号通路细胞焦亡角度探讨银屑平丸含药血清对人表皮角质形成细胞白细胞介素-1β(interleukin-1β,IL-1β)、IL-18水平及NLRP3、功能蛋白D(gasdermin D,GSDMD)、Caspase-1蛋白和mRNA的影响,探讨银屑平丸治疗银屑病的作用机制。
1 材料
1.1 实验动物
SPF级SD 雄性大鼠30只,体质量(200±10) g,8周龄,购自湖南省斯莱克景达实验动物有限公司,动物质量合格证号:430727221101231185,动物生产许可证号:SYXK(湘)2019-0004,实验动物使用许可证号:SYXK(湘)2019-0009。饲养于19~24 ℃,40%~70%湿度的环境,自由饮水及进食。本实验通过湖南中医药大学实验动物中心伦理审查,动物实验伦理合格批号:LLBH-202204190005。
1.2 细胞
人表皮角质形成细胞细胞系,货号:BNCC340593,购自长沙市益湘生物科技有限公司。
1.3 主要药物
银屑平丸:湖南中医药大学第一附属医院研制,生产批号:20191129;组成:生地黄、赤芍、淮山药、女贞子、旱莲草、紫草、丹参、白花蛇舌草、半枝莲、大青叶、甘草。60 g/瓶。
阿维A胶囊:购自湖南中医药大学第一附属医院,生产批号:H20010126,重庆华邦制药有限公司生产。
1.4 主要试剂
MEM液体培养基(BL307A,兰杰柯科技有限公司);胎牛血清(FSP025,依科赛生物科技有限公司);胰蛋白酶-EDTA消化液(0.25%)含酚红(PB180226,武汉普诺赛生命科技有限公司);TNF-α因子(C008,苏州近岸蛋白质科技股份有限公司);IL-1β、IL-18 ELISA试剂盒(2208H040,2208H042,江苏菲亚生物科技有限公司);mRNA逆转录试剂盒(CW2569,江苏康为世纪生物科技股份有限公司);核酸染料(PB11141,北京普利莱基因技术有限公司);Caspase-1、NLRP3、β-actin抗体(货号分别为22915-1-AP、19771-1-AP、66009-1-Ig,武汉三鹰生物技术有限公司);GSDMD(ab219800,美国Abcam公司);Goat anti-Rabbit IgG (H+L) Secondary Antibody, HRP(AWS0002,长沙艾碧维生物科技有限公司)。
2 方法
2.1 含药血清制备
30只SD大鼠,随机分为空白组、银屑平丸组、阿维A组,每组10只,适应性喂养7 d。按照70 kg人与200 g大鼠体表面积[19]进行换算,银屑平丸组按照3.82 g/(kg·d)灌胃给药,阿维A组按照2.54 mg/(kg·d)灌胃给药,空白组予以等剂量的生理盐水,每日1次,连续灌胃7 d。末次灌胃1 h后,以2%戊巴比妥钠2.5 mL/kg腹腔注射麻醉,腹主动脉采血,收集于真空采血管,室温静置2 h,3 000 r/min(离心半径8 cm)离心10 min,分离血清,56 ℃水浴灭活30 min,0.22 μm滤膜过滤除菌,-80 ℃冰箱冻存备用。
2.2 空白血清毒性检测
制备细胞悬液,在96孔板中接种人表皮角质形成细胞,密度为5 000个/孔,移至培养箱过夜使细胞贴壁,分别给予5%、10%、20%浓度的空白血清,于24 h后每孔加入10 μL CCK-8溶液于培养箱避光孵育1 h,酶标仪检测450 nm波长处每孔的吸光度。细胞存活率(%)=[(A实验组-A空白组)/(A对照组-A空白组)]×100%。
2.3 细胞培养及分组
取人表皮角质形成细胞,弃上清液,PBS清洗,加入2 mL 0.25%胰酶消化,于镜下观察,待变圆刚有脱落时留约0.5 mL胰酶移至培养箱消化,约3.5 min取出,用完全培养基(MEM+10%FBS+1%青-链霉素)终止消化,重悬细胞,将细胞悬液按比例分配至T25培养瓶中,置于37 ℃、5% CO2、饱和湿度的培养箱中培养。设置正常组(培养液含10%FBS+1%双抗)、空白血清组(培养液含20%空白血清+1%双抗)、模型组(培养液含10 ng/mL TNF-α+20%空白血清+1%双抗)、银屑平丸含药血清组(培养液含10 ng/mL TNF-α+20%银屑平丸含药血清+1%双抗)、阿维A含药血清组(培养液含10 ng/mL TNF-α+20%阿维A含药血清+1%双抗)。每组设置3个复孔,实验重复3次。
2.4 ELISA法检测细胞上清液中IL-1β及IL-18 水平
将各组细胞培养24 h后,收集细胞上清液,按照试剂盒步骤检测各组IL-1β及IL-18水平。
2.5 RT-PCR法检测NLRP3、GSDMD、Caspase-1 mRNA表达
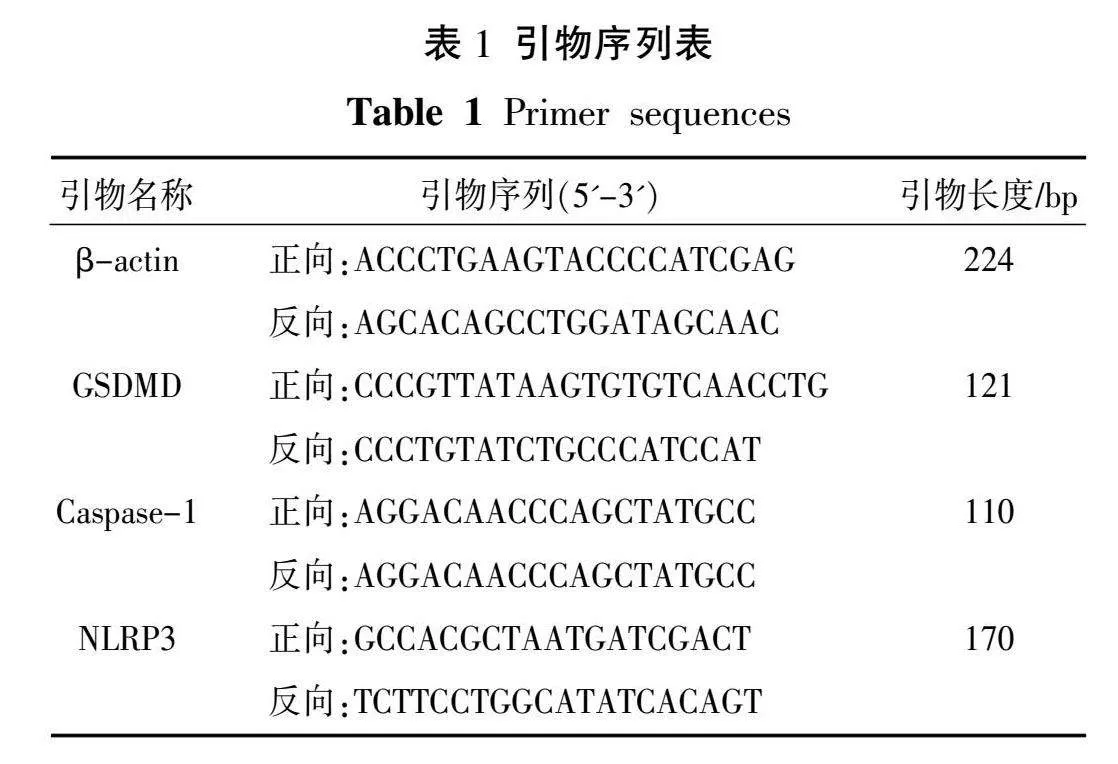
将各组细胞培养24 h后,弃细胞上清液,按试剂盒说明书提取细胞总RNA以组织总mRNA为模板,进行逆转录,扩增。PCR引物序列见表1,引物由北京擎科生物科技股份有限公司合成。
2.6 Western blot法检测NLRP3、GSDMD、Caspase-1蛋白的表达
取人表皮角质形成细胞,提取总蛋白,BCA测定蛋白浓度,取120 uL蛋白上清,加入30 μL 5×loading buffer混匀,沸水煮5 min,放入冰盒中速冷备用。10%SDS-PAGE电泳分离蛋白质,PVDF转膜,5%脱脂奶粉封闭,一抗(GSDMD、Caspase-1、NLRP3、β-actin稀释比例分别为1∶1 000、1∶1 000、1∶1 000、1∶10 000)孵育,4 ℃过夜,HRP标记的二抗室温孵育90 min,凝胶成像系统成像。
2.7 统计学分析
采用SPSS 24.0和GraphPad Prism 8.0进行统计分析,实验数据用“x±s”表示。实验数据符合正态分布及方差齐性,两组之间采用独立样本t检验,多组间采用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
3 结果
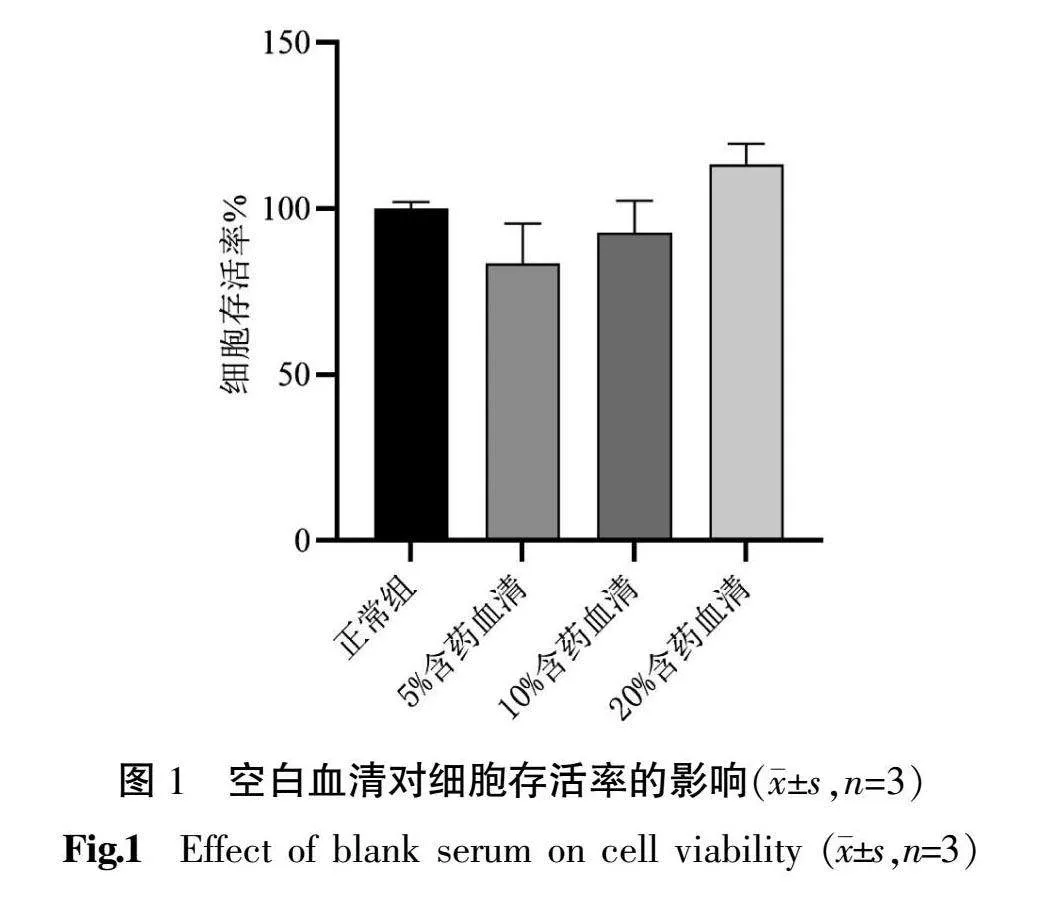
3.1 ; 空白血清对TNF-α诱导的人表皮角质形成细胞存活率的影响
与正常组比较,5%、10%、20%浓度空白血清干预后细胞存活率均无明显改变。根据本研究及前期结果[18]得出,银屑平丸含药血清、阿维A含药血清及空白血清浓度均选用20%进行后续研究。详见图1。
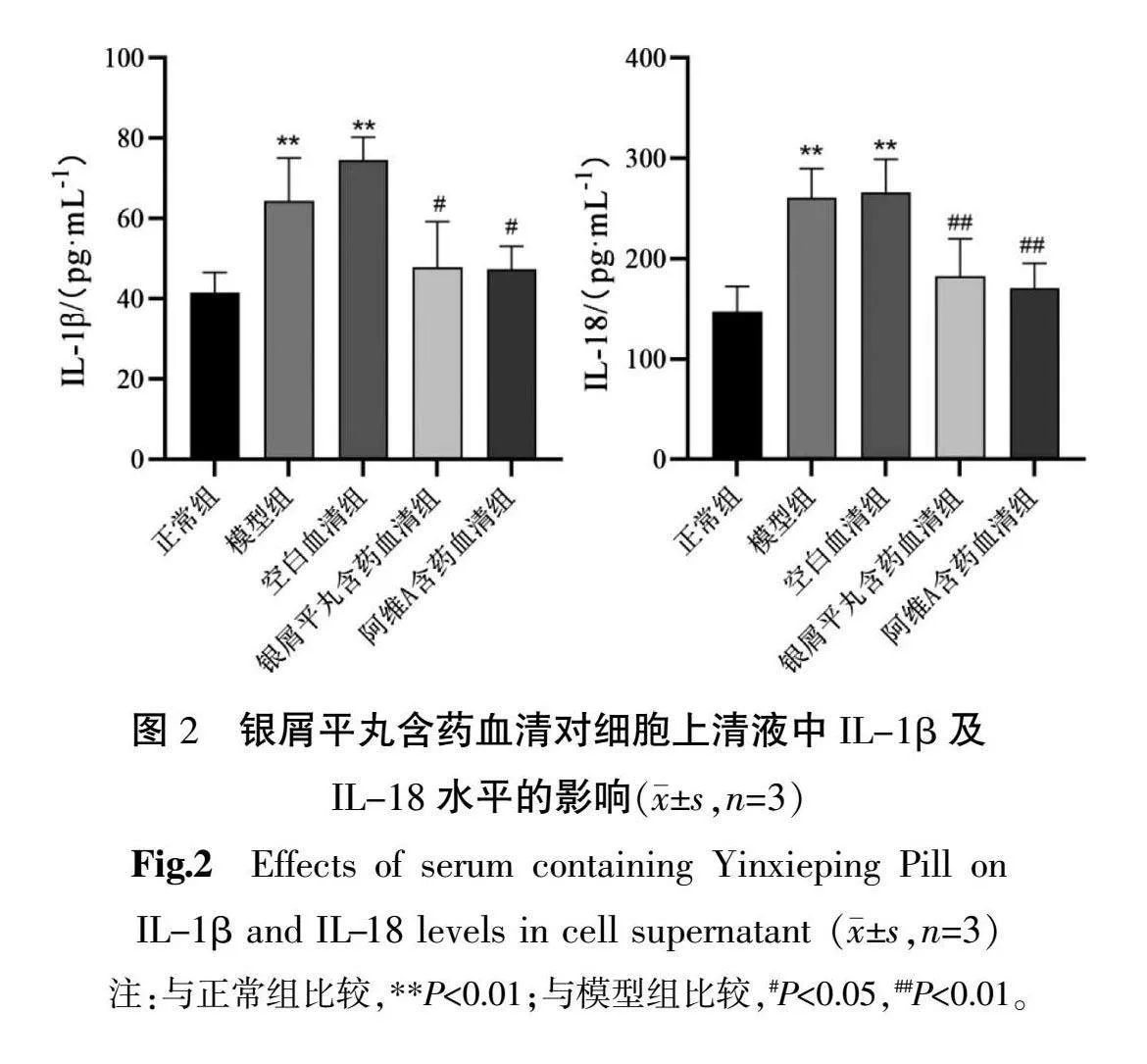
3.2 银屑平丸含药血清对细胞上清液中IL-1β及IL-18水平的影响
与正常组比较,模型组和空白血清组细胞上清IL-1β 及 IL-18 水平明显升高(P<0.01);与模型组比较,银屑平丸含药血清组、阿维A含药血清组IL-1β水平降低(P<0.05),IL-18水平显著降低(P<0.01)。详见图2。
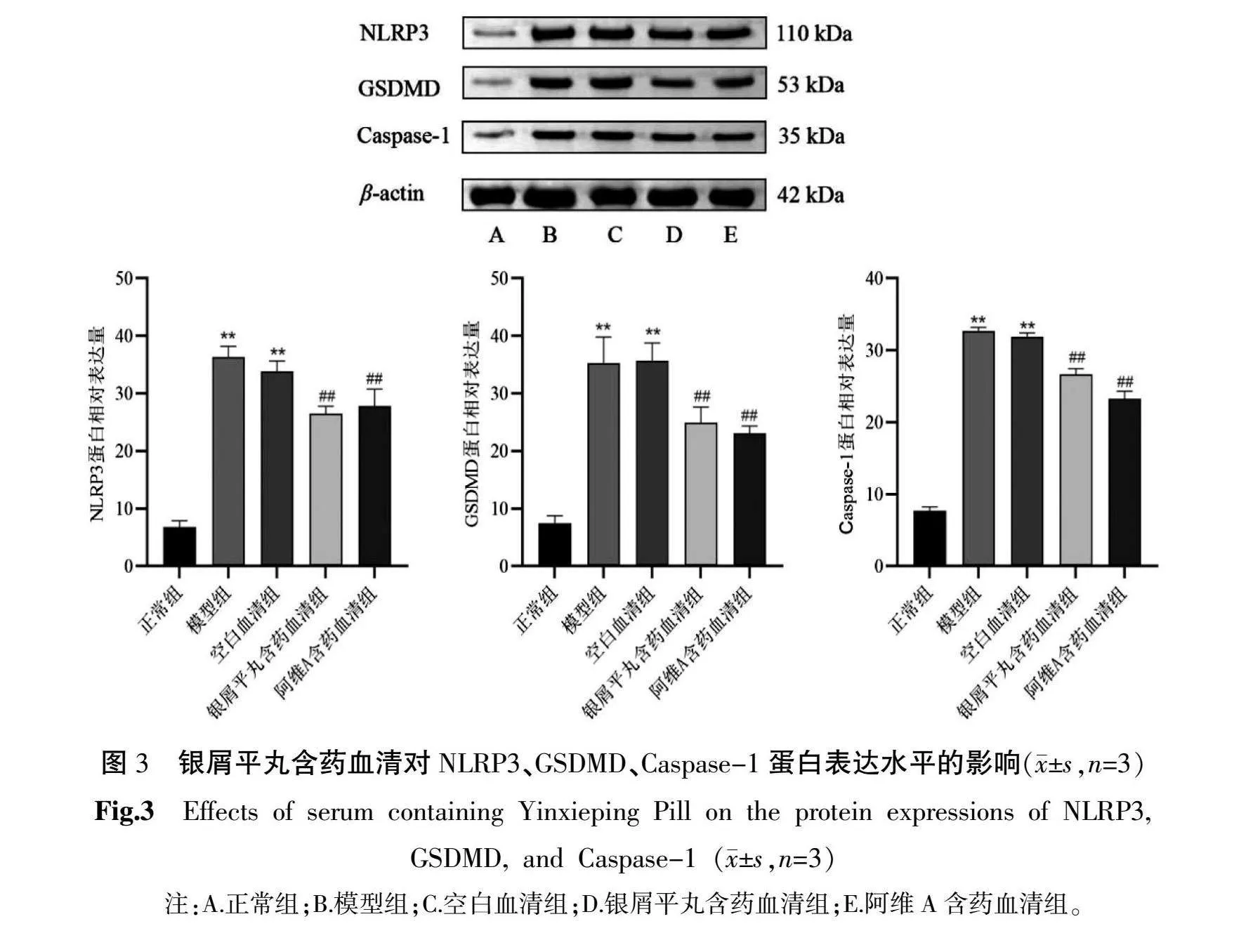
3.3 银屑平丸含药血清对NLRP3、GSDMD、Caspase-1蛋白表达的影响
与正常组比较,模型组和空白血清组NLRP3,GSDMD、Caspase-1蛋白表达显著升高(P<0.01);与模型组比较,药物干预后NLRP3、GSDMD、Caspase-1蛋白表达水平均明显下调(P<0.01)。详见图3。
3.4 银屑平丸含药血清对NLRP3、GSDMD、Caspase-1 mRNA表达的影响
与正常组比较,模型组和空白血清组NLRP3,GSDMD、Caspase-1 mRNA表达量明显升高(P<0.01);与模型组比较,银屑平丸含药血清组、阿维A含药血清组NLRP3、GSDMD、Caspase-1 mRNA表达水平均明显下调(P<0.01)。详见图4。
4 讨论
银屑病是一种慢性炎症性疾病,反复的皮肤炎症可导致表皮红斑和增生等特征性改变。银屑病发病的炎症级联反应最初由角质形成细胞、树突状细胞和巨噬细胞触发。角质形成细胞是皮肤表皮机械屏障的主要组成细胞,在皮肤免疫反应的启动、维持和调节中发挥关键作用[20]。研究表明[21],角质形成细胞死亡会引发皮肤炎症,而细胞焦亡被认为是最具炎症性的细胞死亡途径。经典的细胞焦亡途径依赖炎症小体的激活。炎症小体是多蛋白复合物,是炎症的主要介质。炎症小体激活导致炎性细胞因子的释放并诱导炎症细胞死亡[22]。在所有炎症小体亚型中,NLRP3与多种炎症和自身免疫性皮肤病的关系最为密切[23-24]。研究表明,NLRP3基因多态性可能是银屑病发病的致病或有价值的遗传标记因素,提示NLRP3可能是银屑病治疗的潜在靶点[25]。激活后的NLRP3引起细胞因子IL-1β、IL-18成熟,并加工GSDMD来介导细胞因子的释放[26]。GSDMD是Gasdermin蛋白家族的成员,作用于Caspase-1蛋白的下游,被切割后导致N-末端片段的释放,N-末端片段在膜中形成孔隙,响应细胞炎症调控[27-28]。
为了探究寻常型银屑病的分子机制是否与人表皮角质形成细胞焦亡相关,本研究使用TNF-α诱导人表皮角质形成细胞建立体外银屑病损伤模型,利用银屑平丸含药血清进行干预,以明确银屑平丸是否通过抑制人表皮角质形成细胞焦亡治疗银屑病。TNF-α是一种关键的促炎细胞因子,TNF-α和胱天蛋白酶-8(cysteine aspartate-specific proteinase-8,Caspase-8)特异性切割功能蛋白C(gasdermin C,GSDMC),产生GSDMC-N末端结构域,在细胞膜上形成孔并诱导细胞焦亡[29]。本研究使用TNF-α造模,其机制主要是TNF-α可通过caspase-1/GSDMD通路激活诱导人表皮角质细胞焦亡[30]。本研究结果表明,TNF-α可能是GSDMD介导的细胞焦亡的激活剂,导致NLRP3被激活,Caspase-1释放,GSDMD发生裂解,IL-1β、IL-18表达水平升高。通过银屑平丸含药血清干预后,NLRP3、GSDMD、Caspase-1表达水平显著降低,IL-1β、IL-18释放减少,提示银屑平丸含药血清可能通过抑制人表皮角质形成细胞焦亡途径降低炎症介质产生。
银屑病的中医病机可用“热、虚、瘀”来概括,血热日久,耗津伤血,又可导致血瘀、血虚等病因的出现,使营血亏虚、肌肤失养而发病。西医治疗常予以阿维A胶囊口服。阿维A是一种口服维甲酸,通过调节细胞增殖和分化,减少炎症反应,从而改善银屑病患者的皮肤病变,已被证实对银屑病有明显的疗效[31]。因此,本研究制备阿维A含药血清作为阳性对照组。然而,阿维A具有较多毒副作用,如致畸性、皮肤损害、胃肠道反应、血脂异常、肝损害等。银屑平丸针对银屑病“热、虚、瘀”的中医病机,以“清热凉血、活血养阴”为治疗大法。方中重用生地黄清热凉血、养阴生津为君药;白花蛇舌草、半枝莲、大青叶清热解毒,赤芍、牡丹皮、丹参、紫草清热凉血、活血化斑,与君药同用,清热凉血解毒之力大增,且凉血不留瘀,散瘀不伤血,共为臣药;女贞子、旱莲草、山药养阴生津润燥,为佐药;白鲜皮清热祛风止痒,引经达于肌表,甘草清热解毒兼调和诸药,共为使药。本方清热之中兼以养阴,凉血与活血配伍并用,使热清血宁而无耗血动血之虑,凉血止血又无冰伏留瘀之弊。在课题组前期研究的基础上,我们发现银屑平丸通过多环节、多靶点的整体调节作用,治疗银屑病安全高效,且当含药血清浓度为20%时,抑制细胞增殖效果最明显[18,32-33]。本研究通过TNF-α诱导人表皮角质形成细胞建立体外银屑病损伤模型,证实了20%银屑平丸含药血清对IL-1β、IL-18表达水平及NLRP3、GSDMD、Caspase-1 mRNA和蛋白表达具有抑制作用,与阿维A含药血清组效果相当。
综上所述,银屑平丸含药血清可能通过降低炎症小体活性,抑制Caspase导致的GSDMD裂解,IL-1β、IL-18炎症因子释放水平降低,改善人表皮角质形成细胞炎症状态,抑制表皮的过度增殖,从而起到防治银屑病的作用。
参考文献
[1] RENDON A, SCH?魧KEL K. Psoriasis pathogenesis and treatment[J]. International Journal of Molecular Sciences, 2019, 20(6): 1475.
[2] ARMSTRONG A W, MEHTA M D, SCHUPP C W, et al. Psoriasis prevalence in adults in the United States[J]. JAMA Dermatology, 2021, 157(8): 940-946.
[3] TAKESHITA J, GREWAL S, LANGAN S M, et al. Psoriasis and comorbid diseases: Epidemiology[J]. Journal of the American Ac?鄄ademy of Dermatology, 2017, 76(3): 377-390.
[4] GRIFFITHS C E M, ARMSTRONG A W, GUDJONSSON J E, et al. Psoriasis[J]. Lancet, 2021, 397(10281): 1301-1315.
[5] WU M J, DAI C, ZENG F F. Cellular mechanisms of psoriasis pathogenesis: A systemic review[J]. Clinical, Cosmetic and Investigational Dermatology, 2023, 16: 2503-2515.
[6] KENEALY S, MANILS J, RAVERDEAU M, et al. Caspase-11-mediated cell death contributes to the pathogenesis of imiquimod-induced psoriasis[J]. The Journal of Investigative Dermatology, 2019, 139(11): 2389-2393.e3.
[7] LIAN N, CHEN Y J, CHEN S H, et al. Gasdermin D-mediated keratinocyte pyroptosis as a key step in psoriasis pathogenesis[J]. Cell Death & Disease, 2023, 14(9): 595.
[8] SONG W, REN J, XIANG R S, et al. Identification of pyroptosis-related subtypes, the development of a prognosis model, and characterization of tumor microenvironment infiltration in colorectal cancer[J]. Oncoimmunology, 2021, 10(1): 1987636.
[9] ECKHART L, TSCHACHLER E. Control of cell death-associated danger signals during cornification prevents autoinflammation of the skin[J]. Experimental Dermatology, 2018, 27(8): 884-891.
[10] WEI X, XIE F, ZHOU X X, et al. Role of pyroptosis in inflammation and cancer[J]. Cellular & Molecular Immunology, 2022, 19: 971-992.
[11] 哈宗兰, 马丽娜, 马 琼, 等. 白花蛇舌草提取物通过AMPK/ATG5信号通路对急性胰腺炎大鼠肺损伤的保护作用机制研究[J]. 中国免疫学杂志, 2024, 40(2): 348-354.
[12] TIAN S, GUO L, SONG Y G, et al. Radix Salvia miltiorrhiza ameliorates burn injuries by reducing inflammation and promoting wound healing[J]. Journal of Inflammation Research, 2023, 16: 4251-4263.
[13] GAO L L, LI C, WANG Z M, et al. Ligustri lucidi fructus as a traditional Chinese medicine: A review of its phytochemistry and pharmacology[J]. Natural Product Research, 2015, 29(6): 493-510.
[14] 陈 慧, 杨洪涛, 许正锦, 等. 地黄梓醇对高糖介导足细胞焦亡的抑制作用及机制研究[J]. 中国中西医结合肾病杂志, 2023, 24(11): 953-956.
[15] 张 楠, 贾云柱, 田纪祥,等. 中医药调控糖尿病心肌病中细胞焦亡的研究进展[J]. 中国动脉硬化杂志, 2024, 32(9): 813-820.
[16] 李小鹏, 席建元, 谢汶芳, 等. 银屑平丸对寻常型银屑病患者外周血Th17相关细胞因子表达的影响[J]. 中国中西医结合皮肤性病学杂志, 2019. 18(6): 558-561.
[17] 彭 丹, 李小鹏, 席建元, 等. 银屑平丸对小鼠银屑病样模型血清白细胞介素-18和白细胞介素-22表达的影响[J]. 中国中西医结合皮肤性病学杂志, 2019, 18(3): 249-251.
[18] 沈乐乐, 李 淼, 彭子怡, 等. 基于Notch信号通路探讨银屑平丸含药血清对TNF-α诱导的人表皮角质形成细胞相关蛋白及炎症因子的影响[J]. 中药新药与临床药理, 2023, 34(9): 1171-1178.
[19] 魏 伟, 吴希美, 李元建. 药理实验方法学[M]. 北京: 人民卫生出版社, 2010: 71.
[20] BARKER J N, MITRA R S, GRIFFITHS C E, et al. Keratinocytes as initiators of inflammation[J]. Lancet, 1991, 337(8735): 211-214.
[21] NAKAMURA Y, MATSUZAKA T, TAHARA-HANAOKA S, et al. Elovl6 regulates mechanical damage-induced keratinocyte death and skin inflammation[J]. Cell Death Disease, 2018, 9(12): 1181-1185.
[22] SCHRODER K, TSCHOPP J. The inflammasomes[J]. Cell, 2010, 140(6): 821-832.
[23] XIAO Y C, XU W N, SU W R. NLRP3 inflammasome: A likely target for the treatment of allergic diseases[J]. Clinical and Experimental Allergy, 2018, 48(9): 1080-1091.
[24] WANG D, DUNCAN B, LI X Z, et al. The role of NLRP3 inflammasome in infection-related, immune-mediated and autoimmune skin diseases[J]. Journal of Dermatological Science, 2020, 98(3): 146-151.
[25] YU P, HAO S Y, ZHENG H W, et al. Association of NLRP1 and NLRP3 polymorphisms with psoriasis Vulgaris risk in the Chinese Han population[J]. BioMed Research International, 2018, 2018: 4714836.
[26] WALTER A, SCH?FER M, CECCONI V, et al. Aldara activates TLR7-independent immune defence[J]. Nature Communications, 2013, 4: 1560.
[27] KOVACS S B, MIAO E A. Gasdermins: Effectors of pyroptosis[J]. Trends in Cell Biology, 2017, 27(9): 673-684.
[28] ZOU J, ZHENG Y X, HUANG Y, et al. The versatile gasdermin family: Their function and roles in diseases[J]. Frontiers in Immunology, 2021, 12: 751533.
[29] HOU J W, ZHAO R C, XIA W Y, et al. PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis[J]. Nature Cell Biology, 2020, 22: 1264-1275.
[30] LI Y F, HE Y, YANG F Y, et al. Gasdermin E-mediated keratinocyte pyroptosis participates in the pathogenesis of psoriasis by promoting skin inflammation[J]. The British Journal of Dermatology, 2024, 191(3): 385-396.
[31] HEATH M S, SAHNI D R, CURRY Z A, et al. Pharmacokinetics of tazarotene and acitretin in psoriasis[J]. Expert Opinion on Drug Metabolism & Toxicology, 2018, 14(9): 919-927.
[32] 沈乐乐, 席建元, 孙立新, 等. 基于网络药理学及分子对接技术分析“半边莲-白花蛇舌草”药对治疗银屑病的作用机制[J]. 天然产物研究与开发, 2021, 33(12): 2136-2145.
[33] 蒋宁兰, 席建元, 李小鹏, 等. 银屑平丸联合卡泊三醇软膏治疗寻常型银屑病静止期的临床观察[J]. 湖南中医药大学学报, 2016, 36(7): 55-57.