慢性心力衰竭气虚血瘀证模型大鼠肠道菌群诱发心肌炎症的特征变化
2024-12-09吕李飞朱婷婷丁帆路迎冬崔向宁



〔摘要〕 目的 探究慢性心力衰竭气虚血瘀证模型大鼠肠道菌群失调诱发心肌炎症的特征变化。方法 采用皮下多点注射异丙肾上腺素复合力竭及控食方法制备慢性心力衰竭模型大鼠。造模成功后,基于心力衰竭模型大鼠的病证结合研究方法验证证型。从造模成功的18只大鼠中随机选取7只作为模型组,另设空白组7只。经胸心脏超声检测心功能变化;根据旷场实验评价大鼠行为学变化;通过HE染色观察心肌组织病理变化;采用ELISA检测脑钠素(brain natriuretic peptide, BNP)和脂多糖(lipopolysaccharide, LPS)水平;全自动生化分析仪检测肌酸激酶(creatine kinase, CK)、乳酸脱氢酶(lactate dehy drogenase, LDH)和肌酸激酶同工酶(MB isoenzyme of creatine kinase, CK-MB)含量;采用血液流变仪测定全血黏度的低、高切值;RT-qPCR及Western blot检测心肌NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)、凋亡相关斑点样蛋白(apoptosis related spot like protein, ASC)、胱天蛋白酶-1(cysteine aspartic acid specific protease-1, Caspase-1)和白细胞介素-1β(interleukin-1β, IL-1β)的mRNA和蛋白表达;同时Western blot检测结肠紧密连接蛋白(zonula occluden-1, ZO-1)、闭合蛋白(Occludin)和密封蛋白5(Claudin5)的表达;收集两组大鼠新鲜粪便,利用16S rDNA高通量测序技术测定大鼠肠道微生物群的差异。结果 与空白组比较,模型组大鼠左室射血分数(left ventricular ejection fraction, LVEF)和左室短轴缩短率(left ventricular fraction shortening, LVFS)显著降低(P<0.01);在旷场的运动速度和总路程降低(P<0.05,P<0.01);血清BNP和LPS水平显著增加(P<0.01),CK、LDH和CK-MB含量显著升高(P<0.01),表现出心功能减退的“心气虚”症状;心肌组织可见大量纤维水肿,细胞质疏松,组织边缘可见心肌纤维溶解,伴有少量炎症细胞浸润;全血黏度的低、高切值显著升高(P<0.01),表现出“血瘀”症状;NLRP3、ASC、Caspase-1、IL-1β的mRNA和蛋白表达均升高(P<0.05,P<0.01),ZO-1、Occludin、Claudin5表达均明显降低(P<0.01)。肠道菌群测定结果证实:与空白组比较,模型组大鼠肠道菌群物种发生改变,菌群的ɑ和β多样性也存在明显差异,物种差异在门水平上,拟杆菌门(Bacteroidota)和螺旋菌门(Spirochaetota)的丰度上调,厚壁菌门(Bacillota)的丰度下调;种水平上,普雷沃氏菌属(Segatella copri)和琥珀酸密螺旋体菌(Treponema succinifaciens)的丰度上调,Kineothrix alysoides(P<0.05)、伶俐瘤胃球菌(Ruminococcus callidus)和普雷沃氏菌(Prevotellamassilia timonensis)的丰度下调。结论 慢性心力衰竭气虚血瘀证模型大鼠存在肠道菌群紊乱和心肌炎症反应,并且伴随心功能和微循环障碍,这可能由肠道共生菌Kineothrix alysoides的丰度下调后LPS上调所介导。
〔关键词〕 慢性心力衰竭;气虚血瘀证;肠道菌群;心肌炎症;Kineothrix alysoides
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.008
Characteristic changes of gut microbiota-induced myocarditis in a rat model of chronic heart failure with qi deficiency and blood stasis pattern
LYU Lifei, ZHU Tingting, DING Fan, LU Yingdong, CUI Xiangning*
Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
〔Abstract〕 Objective To explore the characteristic changes of gut microbiota dysbiosis-induced myocardial inflammation in a rat model of chronic heart failure (CHF) with qi deficiency and blood stasis pattern. Methods CHF model rats were prepared by subcutaneous multi-point injection of isoprenaline combined with exhaustive exercise and controlled feeding. After the successful modeling, the pattern of qi deficiency and blood stasis in the rats was verified based on the combined research method of disease and pattern in heart failure model rats. Seven rats were randomly selected from the 18 successfully modeled rats to form the model group, and a blank group of 7 rats was set up additionally. Changes in cardiac function were checked by transthoracic echocardiography; behavioral changes in rats were evaluated through the open-field test; pathological changes in myocardial tissue were observed by HE staining; brain natriuretic peptide (BNP) and lipopolysaccharide (LPS) levels were checked by ELISA; content of creatine kinase (CK), lactate dehydrogenase (LDH) and MB isoenzyme of creatine kinase (CK-MB) was determined by automatic biochemical analyzers. Whole blood viscosity at low and high shear rates was measured using a hemorheometer. RT-qPCR and Western blot were used to examine the mRNA and protein expressions of myocardial NOD-like receptor protein 3 (NLRP3), apoptosis related spot like protein (ASC), cysteine aspartic acid specific protease-1 (Caspase-1), and interleukin-1β (IL-1β); Western blot was also used to check the expressions of colonic tight junction proteins such as ZO-1, Occludin, and Claudin-5. Fresh feces were collected from the two groups of rats, and the differences in gut microbiota between the two groups were analyzed by 16S rDNA high-throughput sequencing. Results Compared with the blank group, rats in the model group showed significantly decreased left ventricular ejection fraction (LVEF) and left ventricular fraction shortening (LVFS) (P<0.01), significantly reduced movement speed and total distance in the open field test (P<0.05, P<0.01), significantly elevated serum BNP and LPS levels (P<0.01), and significantly increased content of CK, LDH, and CK-MB (P<0.01), which were the manifestations of cardiac hypofunction, indicating "heart qi deficiency". In addition, the myocardial tissue of the model group exhibited extensive fibrous edema with loose cytoplasm, and dissolved myocardial fibers observed at the tissue edges, accompanied by a mild inflammatory cell infiltration; the whole blood viscosity at low and high shear rates significantly increased (P<0.01), indicating symptoms of "blood stasis". The mRNA and protein expressions of NLRP3, ASC, Caspase-1, and IL-1β in the model group were significantly higher (P<0.05, P<0.01), while the expressions of ZO-1, Occludin, and Claudin-5 were significantly lower (P<0.01). The gut microbiota analysis revealed that the gut microbiota species of rats in the model group had been altered compared with those of the blank group, with significant differences in both ?琢 and β diversity of the microbiota. At the phylum level, the abundances of Bacteroidota and Spirochaetota were up-regulated while the abundance of Bacillota was down-regulated; at the species level, the abundances of Segatella copri and Treponema succinifaciens were up-regulated while the abundances of Kineothrix alysoides (P<0.05), Ruminococcus callidus, and Prevotellamassilia timonensis were down-regulated. Conclusion Rats with CHF of qi deficiency and blood stasis pattern exhibit gut microbiota dysbiosis and myocardial inflammation, accompanied by cardiac dysfunction and microcirculation disturbance, which may be mediated by the upregulation of LPS following the downregulation of the abundance of the intestinal symbiotic Kineothrix alysoides.
〔Keywords〕 chronic heart failure; qi deficiency and blood stasis pattern; gut microbiota; myocardial inflammation; Kineothrix alysoides
慢性心力衰竭(chronic heart failure,CHF)是各种心血管疾病(cardiovascular disease,CVD)发展的终末期表现,是一组由心脏结构或功能异常引起的心室充盈或射血能力受损的复杂临床综合征,随着CHF患者发病率、死亡率和再入院率的持续上升,CHF已成为最严重的CVD疾病之一,始终威胁人类健康[1]。因此,为CHF寻求潜在的生物标志物和治疗靶点是临床预防CHF的重要方法。最近研究表明,肠道微生物组(gut microbiome,GM)可通过多种机制和途径影响宿主的器官和细胞功能,微生物-宿主串扰与CHF的发病机制密切相关,主要涉及炎症和代谢途径等[2]。肠-心轴相关研究已成为CHF治疗策略研发的重要方向[3]。
中医学将CHF归属于“心衰”范畴,并认为气虚血瘀是其形成的关键原因,气虚日久伴有阳虚,阳少则内寒生,内寒又容易招致外寒使病情恶化。目前国内专家拟定中西医联合干预的共识,将治疗CHF的中药逐步纳入治疗指南[4-5]。因此,将心衰病-证结合于同一模型动物,是中西医结合研究CHF的重要基础,也是现阶段中医药现代化的关键进程。
“肠漏”是指肠道菌群的长期失调会产生内源性有毒产物,经受损的肠道屏障吸收后再循环入血,主要归因于肠道灌注受损导致肠道屏障功能障碍,而肠道屏障由肠道微生物群的稳态维持。肠漏致使内毒素、微生物组分和微生物代谢产物移位到宿主体循环中,这一过程容易导致促炎状态,继而诱导促炎因子的释放,激活NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)。因此,基于菌群和炎症的精准调控能更好地保护和改善心肌功能,为CHF的潜在治疗提供新的靶点和策略[6]。如三甲胺-N-氧化物(trimethylamine N-oxide,TMAO)能诱导心肌细胞肥大,进而加速心肌纤维化并导致心脏舒张功能障碍,TMAO浓度升高也会破坏心肌线粒体丙酮酸和脂肪酸的氧化,导致能量代谢紊乱,进一步加重CHF[7-9]。可见肠道微生态的调节失衡会产生一些敏感性的疾病标志物,这些物质的代谢水平与疾病的发生、发展密切相关。
因此,本研究以CHF气虚血瘀证模型大鼠为研究对象,通过16S rDNA技术初步评估CHF大鼠肠道菌群失调后的特征变化,旨在从微生物区系角度阐明“菌群紊乱-心肌炎症”的初步诱发机制及CHF的发病机制,也希望从微生态理论对CHF气虚血瘀证的本质提出新见解,同时潜在辅助CHF的中医药治疗。
1 材料与方法
1.1 动物
30只SPF级雄性SD大鼠,6周龄,体质量(200±20) g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号SCXK(京)2021-0011。动物饲养于中国中医科学院中医基础理论研究所SPF级屏障动物房,使用许可证号SYXK(京)2021-0017,室温23~25 ℃,相对湿度55%~70%,循环光照/黑暗12 h,自由进食、饮水。适应性饲养1周后,开始实验。本研究经中国中医科学院广安门医院伦理委员会审批(审批号:IACUC-GAMH-2024-019)。
1.2 主要实验药物、试剂与仪器
盐酸异丙肾上腺素(批号:S31064,上海源叶生物科技有限公司);HE染液(批号:G1076)、NLRP3抗体(批号:GB114320)、胱天蛋白酶-1(cysteine aspartic acid specific protease-1, Caspase-1)抗体(批号:GB11383)均购自武汉赛维尔生物科技有限公司;大鼠脑钠素(brain natriuretic peptide, BNP)ELISA测定试剂盒(批号:SEKR-0058)、白细胞介素-1β(interleukin-1β, IL-1β)抗体(批号:K009661P)均购自北京索莱宝科技有限公司;凋亡相关斑点样蛋白(apoptosis related spot like protein, ASC)抗体(批号:abs155599,上海爱必信生物科技有限公司);紧密连接蛋白(zonula occluden-1, ZO-1)抗体(批号:21773-1-AP)、闭合蛋白(Occludin)抗体(批号:13409-1-AP)、密封蛋白5(Claudin5)抗体(批号:29767-1-AP)均购自武汉三鹰生物技术有限公司;大鼠脂多糖(lipopolysaccharide, LPS)ELISA试剂盒(批号:MM-0647R2,江苏酶免实业有限公司)。
80 cm×80 cm×40 cm大鼠旷场箱,自制;Vevo2100型超高分辨率小动物超声成像系统(加拿大Visual Sonics公司);R500IE型小动物麻醉机(深圳瑞沃德生命科技有限公司);CKX53型荧光显微镜(日本Olympus公司);H1650-W型台式微量高速离心机(湖南湘仪实验室仪器开发有限公司);ZIQ7003T0C 型Milli-Q纯水仪(美国Millpore公司);EG1150型包埋机、SM2010R型病理切片机(德国Leica公司);Chemray 800型全自动生化分析仪(深圳雷杜生命科学股份有限公司);SA-6600型全自动血液流变测试仪(北京赛科希德科技股份有限公司);Thermomixer C型恒温混匀仪(德国Eppendorf公司);HiSeq 2500型测序仪(美国Illumina公司);Agilent2100型生物分析仪(美国Agilent公司);TopScanTM3.0型动物行为分析软件(美国CleverSys Inc公司)。
1.3 造模及分组
30只大鼠按随机数字表法分为空白组(n=7)、实验组(n=23)。实验组先采用异丙肾上腺素(isoproterenol,ISO)皮下注射,诱导CHF模型[10],大鼠予以ISO(85 mg/kg)连续2 d皮下注射,间隔24 h,1次/d。再采用游泳力竭+限制饮食制备气虚血瘀证模型[11-12],ISO注射第3天开始力竭性游泳,将大鼠置于400 mm×500 mm×700 mm水槽内,室温24~25 ℃,水温22~24 ℃,水深约40 cm,保证大鼠在水中漂浮而不触及底部,当大鼠被动游泳至全身力竭时(以大鼠头面没入水中5~10 s为准),及时捞出,擦干鼠身,持续21 d。造模全程限制饮食,每天摄食量为正常食量的1/2。造模结束后(第27天)对存活的模型大鼠行脱毛备皮,禁食不禁水12 h,次日完成模型大鼠超声心动图检测。参考文献[10]标准判断,左室射血分数(left ventricular ejection fraction,LVEF)<45%表明CHF模型制作成功。空白组注射等量生理盐水。造模期间观察并记录大鼠一般情况。
基于“劳则耗气”“饥则损气”理论[12-13]及心衰动物模型分析[14]验证模型大鼠的毛色、精神及活动情况等,综合一般情况指标评价模型大鼠是否符合气虚血瘀证动物模型标准。剔除死亡及未造模成功的5只大鼠,从18只模型大鼠中随机选取7只作为模型组。
1.4 观察指标
1.4.1 一般情况 实验过程中观察大鼠毛色、精神及饮食情况。
1.4.2 心脏超声检查 大鼠左胸部备皮后,3%异氟烷麻醉,通过高分辨率小动物超声成像系统对大鼠进行超声心动图检查。通过乳头中部区域的胸骨旁长、短轴视野拍摄二维图像(M型超声),然后分别测量LVEF、左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左室舒张末期内径(left ventricular end diastolic diameter,LEVDD),连续测量3个心动周期,取平均值,计算左室短轴缩短率(left ventricular fraction shortening,LVFS)。LVFS(%)=(LEVDD-LVESD)/LEVDD×100%。
1.4.3 旷场实验 大鼠提前置于测试室中心适应1 h。于自制旷场箱(80 cm×80 cm×40 cm)中心点放入大鼠并观察5 min。采用动物行为软件TopScanTM3.0定义中心区,分析大鼠运动路程和运动时间,计算平均速度。测试完毕,用75%乙醇擦拭干净箱底,以避免不同大鼠间的气味、粪便及尿液相互影响。平均速度(mm/s)=运动路程(mm)/运动时间(s)。
1.4.4 血清及生化指标检测 超声检测后,所有大鼠禁食不禁水24 h。20%乌来糖腹腔注射(0.8 mL/100 g)麻醉大鼠,仰卧位固定于手术台上。腹主动脉采血,常温静置2 h,4 ℃、4 000 r/min(离心半径10 cm)离心10 min取血清。按ELISA试剂盒说明书操作步骤检测BNP和LPS水平。采用全自动生化分析仪测定大鼠血清中肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehy drogenase,LDH)和肌酸激酶同工酶(MB isoenzyme of creatine kinase, CK-MB)含量。
1.4.5 血液流变学指标检测 采用抗凝试管于大鼠腹主动脉采全血5 mL,测试前将试管颠倒混匀再置于血液流变检测仪中,按设定程序测定大鼠全血黏度的低、高切值。
1.4.6 HE染色 取大鼠心肌组织,生理盐水冲洗,置于4%多聚甲醛溶液中固定。组织修剪后乙醇梯度脱水,石蜡包埋,切片,行HE染色,封片。显微镜下观察心肌组织病理改变,采图并分析。
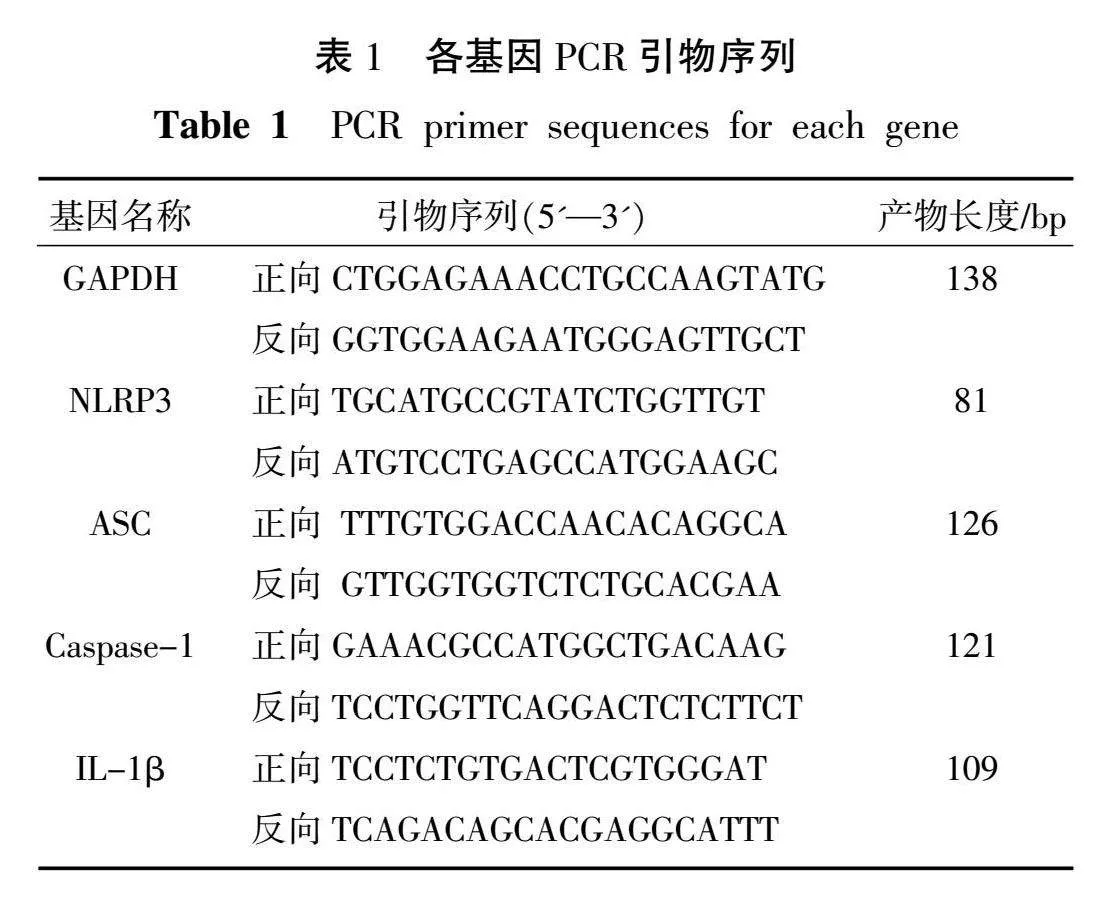
1.4.7 RT-qPCR检测 取心肌组织0.1 g,充分剪碎后置于匀浆管中,加入Trizol试剂,研磨仪充分研磨。16 000×g离心10 min,吸取上清液,加入250 μL三氯甲烷。颠倒混匀后,常温静置3 min,4 ℃、16 000×g离心10 min,吸取400 μL上清液置于新EP管中,加入0.8倍体积异丙醇混匀。-20 ℃静置15 min,4 ℃、16 000×g离心10 min。用75%乙醇洗涤沉淀,4 ℃、16 000×g离心5 min,弃去上清液。沉淀干燥后,加入无酶水15 μL,60 ℃孵育10 min。采用NanoDrop2000超微量分光光度计测定RNA浓度及纯度。根据Servicebio®RT Enzyme Mix试剂盒说明书将RNA进行反转录,合成cDNA,按2×SYBR Green qPCR Master Mix试剂盒说明书配制反应体系。反应条件:95 ℃预变性30 s,然后95 ℃变性15 s, 60 ℃退火和延伸持续30 s,共40个循环。2-ΔΔCt法计算目标基因mRNA相对表达量。引物由北京擎科生物科技股份有限公司设计合成,引物序列见表1。
1.4.8 Western blot 检测 取各组大鼠心肌及结肠组织,加入强RIPA裂解液,用研磨仪研磨成匀浆,冰上裂解30 min。4 ℃、16 000×g离心15 min,取上清液,分装后置于-80 ℃冰箱保存备用,BCA试剂盒测定蛋白浓度。用SDS-PAGE制胶试剂盒分离蛋白样品,并转移到PVDF膜上。5%脱脂奶粉封闭2 h,加入相应一抗[NLRP3(1∶1 000)、ASC(1∶1 000)、Caspase-1(1∶1 000)、IL-1β(1∶1000)、ZO-1(1∶3 000)、Occludin(1∶3 000)、Claudin5(1∶3 000)],4 ℃孵育过夜。TBST洗膜10 min×3次后,二抗(1∶5 000)室温孵育2 h,TBST再洗膜5 min×3次,然后用ECL试剂盒显色。用Image J软件定量分析,并以GAPDH和Tubulin蛋白标准化。
1.5 16S rDNA扩增子测序分析
无菌镊钳夹取大鼠新鲜粪便放入冻存管,液氮速冻后置于-80 ℃冰箱保存。采用MagPure Stool DNA试剂盒从6只空白组大鼠和5只CHF大鼠的冷冻粪便样本中提取微生物群落基因组。样本的总DNA提取操作步骤严格依据DNA抽提试剂盒说明书进行。采用Qubit和琼脂糖凝胶电泳对DNA的浓度及纯度进行质检。使用细菌16S rDNA(V3-V4)可变区域引物,前引物为341F-5'ACTCCTACGGGAGG?鄄CAGCAG-3',后引物为806R-5'GGACTACHVGGGTW?鄄TCTAAT-3',进行PCR纯化和扩增。纯化后的产物采用华大基因平台提供的HiSeq测序仪完成测序。滤除低质量的reads后,分析剩余高质量的Clean data,包括Tags拼接、OTU聚类和物种注释。?琢多样性应用于物种多样性的复杂性分析,利用R(3.2.1)软件计算Shannon和Simpson指数,将所得数值进行Wilcox检验和差异性比对。加权的UniFrac是在未加权的UniFrac基础上纳入分析序列的丰度信息,两者均可评估肠道微生物群的差异分组。β多样性主要针对因环境而造成的物种异质性。本研究基于加权或未加权的UniFrac,采用R(3.2.1)软件进行两组大鼠偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)及盒型图的可视化分析。
1.6 统计学分析
采用SPSS 19.0统计软件进行分析。符合正态分布的实验数据以“x±s”表示,组间比较采用独立样本t检验,方差不齐者采用校正t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 中医证型评价
模型组大鼠扎堆活动减少,体质量减轻,食少,毛发凌乱、稀疏枯槁、萎黄易掉;胞睑下垂、无神呆滞;舌面绛紫,鼻青唇黯;行超声备皮前可见胸部皮色晦滞;反应迟缓,蜷缩嗜睡,应激反应减弱,甚则倦怠萎靡;爪色青紫,抓捕时见甲掉出血。参照“1.3”中造模及中医证型评价标准,判断本研究模型大鼠与气虚血瘀证相符。
2.2 心脏超声结果
与空白组比较,模型组大鼠LVEF、LVFS显著降低(P<0.01),符合CHF大鼠造模评价标准。详见表2、图1。
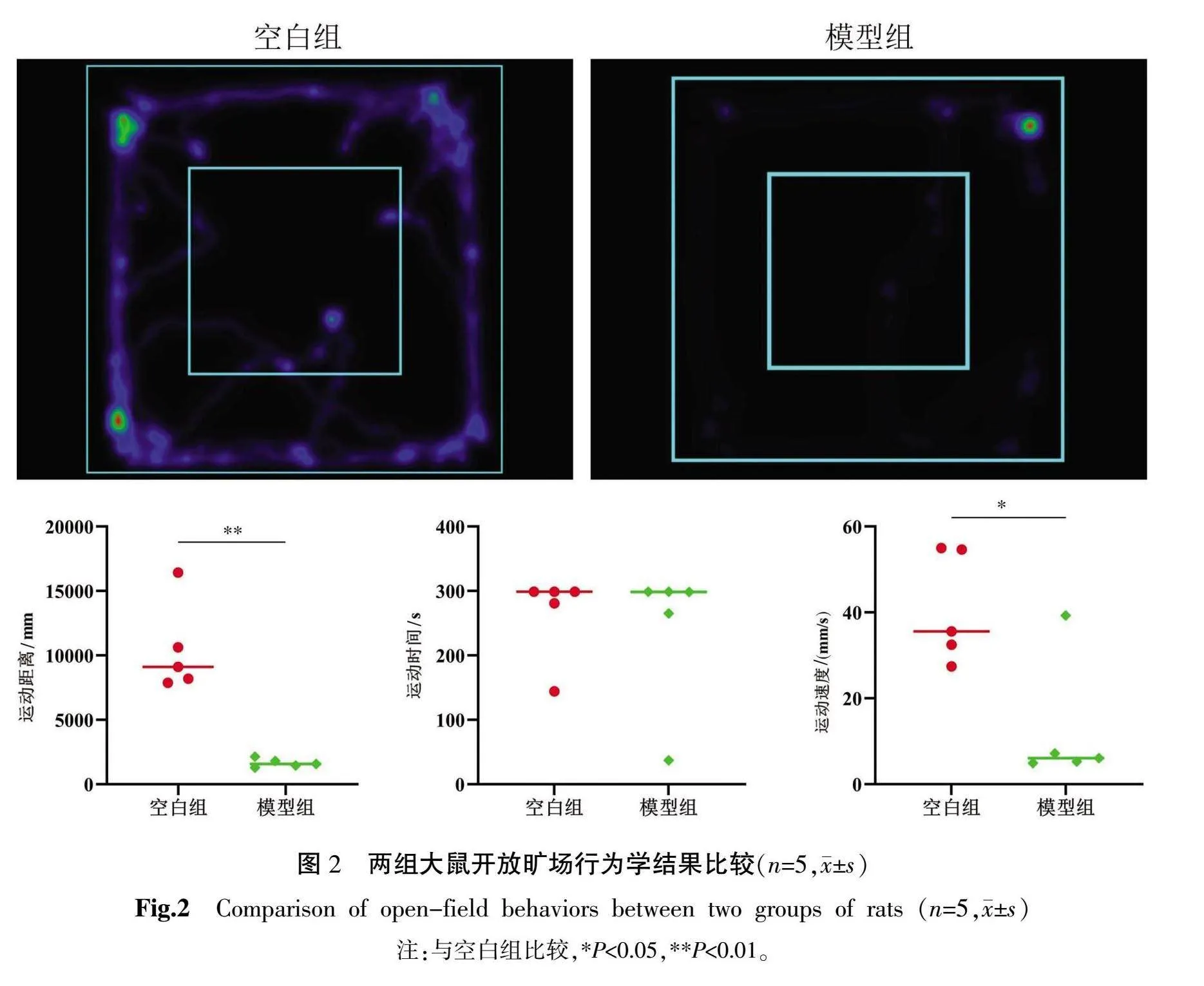
2.3 旷场行为学结果
与空白组比较,模型组大鼠活动时间差异无统计学意义(P>0.05),而运动速度和运动路程降低(P<0.05,P<0.01),提示模型大鼠出现行为学异常,符合气虚证表现。详见图2。
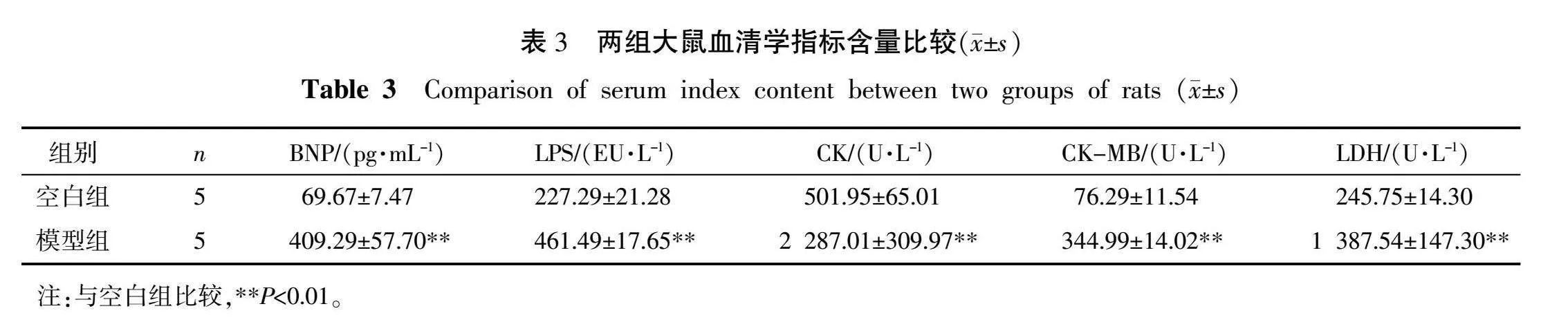
2.4 血清学指标检测结果
与空白组比较,模型组大鼠血清BNP、LPS、CK、CK-MB及LDH含量均显著增加(P<0.01)。详见表3。
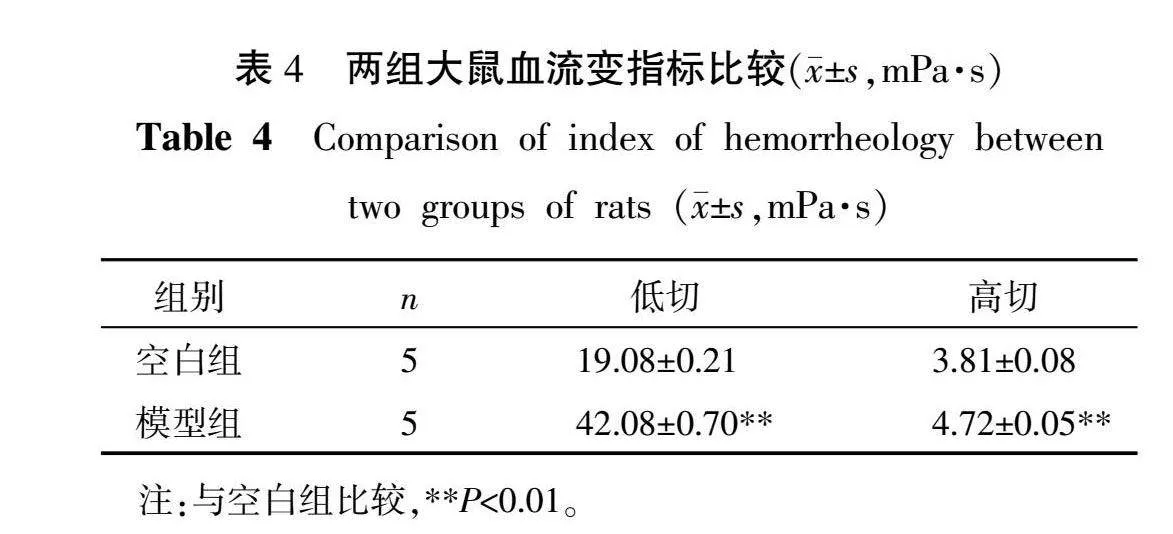
2.5 全血黏度指标检测结果
与空白组比较,模型组大鼠在低切和高切下的全血黏度明显升高(P<0.01),提示微循环功能异常。详见表4。
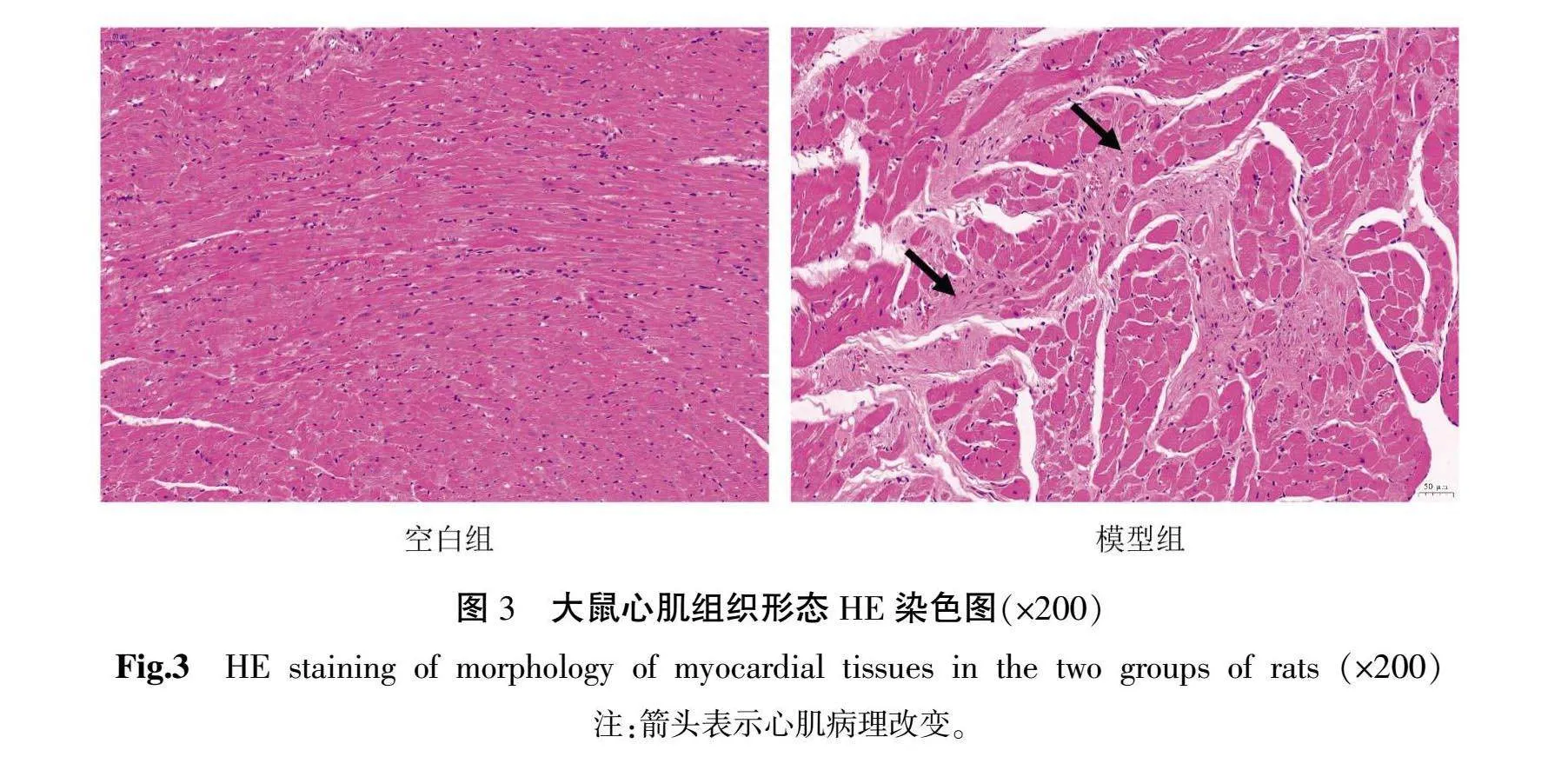
2.6 HE染色结果
空白组大鼠心肌组织结构清晰、排列整齐,心肌细胞间隙正常,未见水肿,间质间隙无炎症浸润。模型组大鼠心肌呈波浪状,心肌纤维水肿,细胞质疏松,细胞质中可见圆形空泡变性;局部组织可见较多心肌纤维溶解,被增生的结缔组织取代,伴有炎症细胞点状浸润。详见图3。
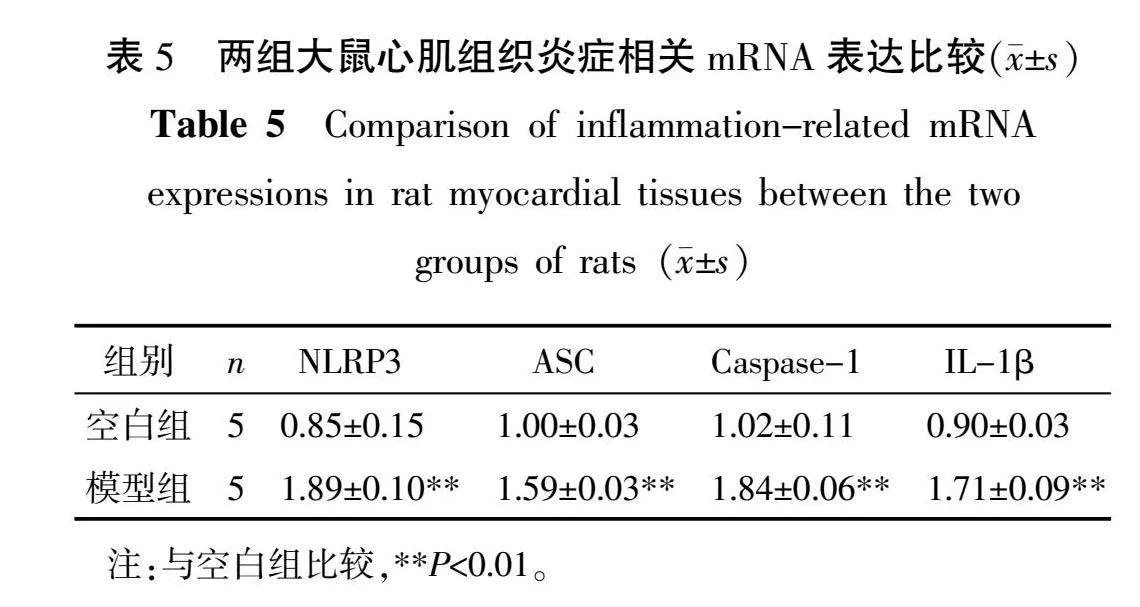
2.7 心肌炎症相关mRNA表达结果
与空白组比较,模型组心肌NLRP3、ASC、Caspase-1、IL-1β mRNA表达均明显升高(P<0.01)。详见表5。
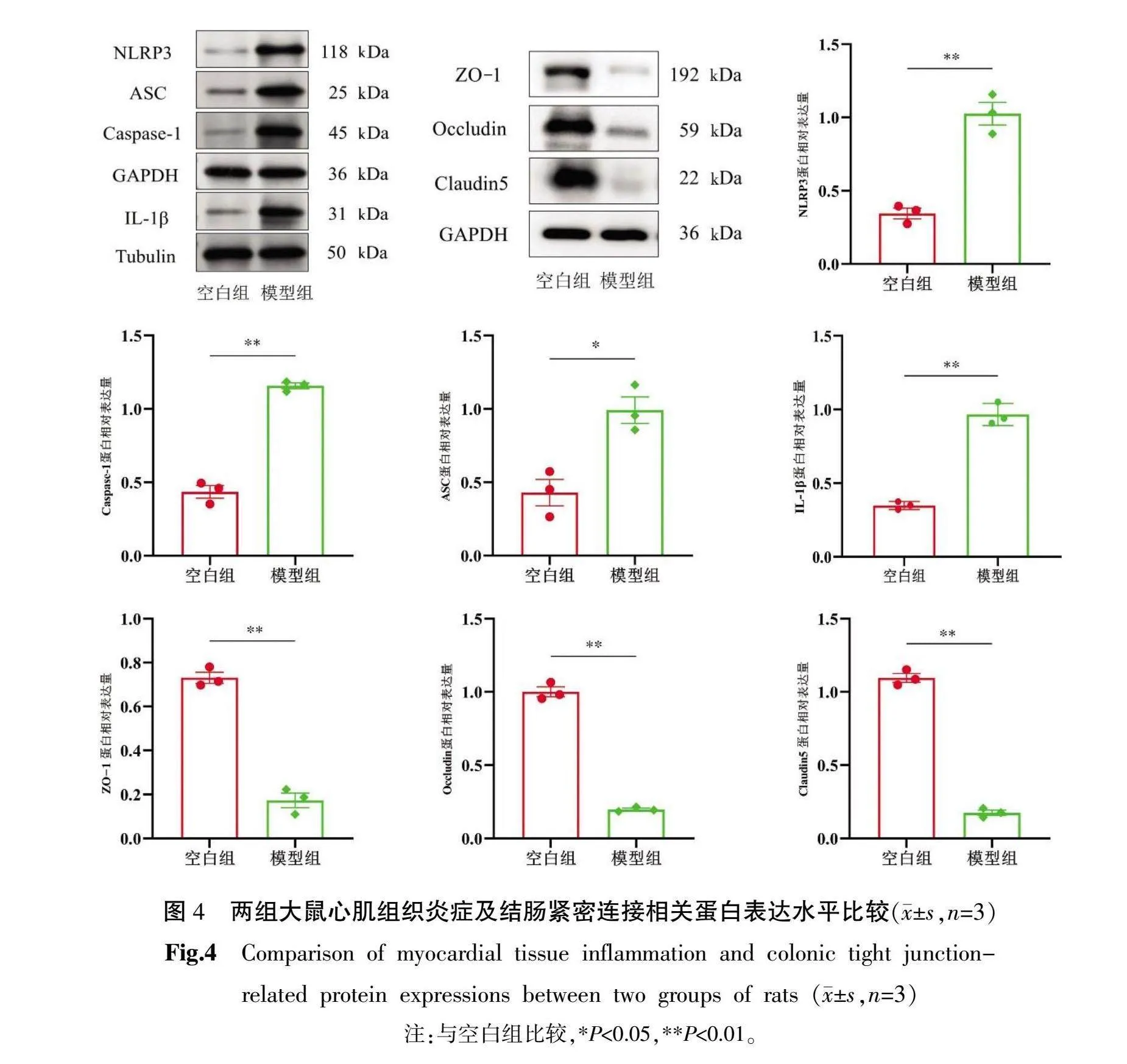
2.8 心肌炎症及肠道紧密连接相关蛋白表达结果
与空白组比较,模型组心肌NLRP3、ASC、Caspase-1、IL-1β蛋白表达均升高(P<0.05,P<0.01);而结肠ZO-1、Occludin、Claudin5蛋白表达均明显降低(P<0.01)。详见图4。
2.9 肠道菌群分析结果
为了更清楚地展示CHF大鼠肠道菌群的变化,通过分析ISO造模后对微生物菌群的影响,得出两组大鼠肠道微生物群物种的组成已经发生变化。在门水平(图5A),厚壁菌门(Bacillota)、拟杆菌门(Bacteroidota)和螺旋菌门(Spirochaetota)是3个占有优势的类群;在属水平(图5B),Segatella属、乳酸菌属(Lactobacillus)和密螺旋体属(Treponema)等是模型组较为丰富的微生物群。此外,Shannon和Simpson等指数能评估GM的α多样性,其中Shannon(P=0.017 3)和Simpson(P=0.017 3)指数均有差异(P<0.05),表明两组大鼠肠道微生物的群落多样性有明显改变(图5C)。PLS-DA得分结果显示,两组差异有显著分离趋势。表明基于metaX软件建立的PLS-DA模型,可用于CHF气虚血瘀证模型的肠道菌群差异物的筛选。β多样性组间差异盒型图的统计值P=0.022 6(P<0.05)。综合PLS-DA及盒型图所得结果,可知两组大鼠的肠道微生物群落间存在差异(图5D)。
在关键物种差异比较方面,与空白组相比,模型组肠道菌群在门水平上,Bacteroidota菌和Spirochaetota菌的丰度上调,Bacillota菌的丰度下调;在种水平上,Segatella copri菌和Treponema succinifaciens菌的丰度上调,Kineothrix alysoides菌、Ruminococcus callidus菌和Prevotellamassilia timonensis菌的丰度下调。选取丰度前10的物种,用R软件展示种水平核心微生物组的平均相对丰度以及差异检验的显著性(图5E)。得出CHF大鼠肠道菌群中Bacillota/Bacteroidota比值下调;与肠道共生的Kineothrix alysoides菌群丰度也下调(P<0.05),而与炎症相关的Treponema succinifaciens菌的丰度上调。
3 讨论
ISO是一种合成的儿茶酚胺和β-肾上腺素能激动剂,研究证实其在实验动物的心脏组织中能有效模拟人类心肌梗死(myocardial infarction,MI)所观察到的缺血、缺氧等病变过程,也涉及炎症反应[15-16]。
肠道菌群的紊乱主要影响MI后衰竭心脏的修复过程,包括心肌炎症因子的表达、炎症因子的释放和炎症微环境的形成[17-19]。CHF也常伴随炎症反应和肠道菌群的双重功能紊乱,同时也伴有NLRP3的激活。因此,推测肠道菌群可能通过“肠道菌群-NLRP3-心肌炎症”这一关键的通路与CHF相联系,靶向抑制NLRP3的激活能调节炎症相关的代谢失衡和肠道菌群紊乱,进而防治CHF[20-22]。
本研究Bacillota/Bacteroidota的比率在暴露ISO后下调,这可能是肠道微生物生态失调的典型特征。但目前研究表明,其暂不能作为肠道菌群失调的标志物[23]。Segatella copri菌能通过胰岛素介导葡萄糖的代谢,并导致胰岛素抵抗,与肠道菌群失调和肠道屏障破坏相关[24];Treponema succinifaciens菌的丰度与促炎因子(IL-1β和TNF-α)的水平呈正相关[25]。本研究结果显示,这两种菌群在CHF大鼠菌群中的丰度均上调,这可能与肠道微生物介导的炎症反应有关。Ruminococcus callidus菌与DNA的复制和修复密切相关,可降低免疫治疗不良反应的严重程度[26];Prevotellamassilia timonensis属于普雷沃氏菌属,被视为“益生菌”的代表,能接受益生元3-岩藻糖基乳糖的激发而在肠道定殖富集[27-28]。本研究结果显示,此两者在CHF大鼠菌群中的丰度下调,但肠道和菌落的具体作用机制有待进一步研究。
Kineothrix alysoides已被鉴定为一种能产丁酸的菌群,是本研究筛选出的关键差异菌群,由于其兼备抗炎和免疫调节双重特性,因此对肠道屏障和肠道健康的维持具有重要意义。然而,本研究Kineothrix
alysoides在CHF大鼠肠道呈现耗竭趋势。研究结果表明,辅助Kineothrix alysoides饮食治疗能有效增加颤螺菌科(Oscillospiraceae)的表达,Oscillospiraceae也是本研究空白组大鼠的优势肠道菌群,这与既往研究结果相似[29-30]。而且该菌属以产短链脂肪酸(short
chain fatty acid,SCFA),尤其以高产丁酸被广泛关注和研究。丁酸盐是一种微生物来源的SCFA,可减轻炎症和心肌肥大等病症,改善MI后的心功能,其含量在心力衰竭(heart failure,HF)患者中降低[29-30]。MI后,HF会显著影响心脏的代谢,在HF期间,ATP产生的途径由脂肪酸氧化转变为糖酵解和酮体代谢,使循环酮水平升高,酮体主要在肝脏中产生,也可在禁食cb1508d09147c8728b41fea84b9657a6期间或在受伤心脏中产生[29],与中医学“饥则损气”含义相似;另一方面,肠道菌群紊乱导致Th17/Treg的失衡[31],炎症和线粒体反应等诱导大量活性氧产生,继而激活NLRP3,并导致炎症损伤[6]。此外,研究表明,疲劳宿主产丁酸盐核心菌群处于缺乏状态[31],与中医学“劳则耗气”相契合。肠道屏障 “渗漏”的特征在于ZO-1、Occludin和Claudin5等紧密连接蛋白的损伤,从而导致有害代谢物的增加,如LPS,能引发煽动性的全身炎症,进而加剧MI后心肌的损伤[32-33]。本研究结果表明,MI后心脏炎症和肠道紧密连接蛋白的共同变化趋势与肠-心轴有关,心脏和肠道菌群之间存在一定的调节关系,这可能与Kineothrix alysoides菌群的丰度下调,导致 LPS进入循环,最后促进心肌炎症的蛋白表达有关。
综上所述,CHF气虚血瘀证的发病机制复杂,涉及炎症反应和信号通路,是综合性功能障碍相互作用的结果。Kineothrix alysoides菌可作为调控CHF气虚血瘀证的潜在靶点,“肠道菌群-NLRP3-心肌炎症”在CHF的发生发展中起着枢纽调控的作用,针对肠道菌群的紊乱和炎症的干预能缓解CHF进程。尽管本研究对肠道菌群失调和心肌炎症反应之间的潜在机制尚未完全阐明,但为CHF气虚血瘀证提供了微生物学的可靠依据。肠-心轴可能为探索CHF的药物干预机制提供一个新的视角,并有助于研究者更好地基于中医辨证思维理解肠-心轴在CHF中的特异性。
参考文献
[1] MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. European Heart Journal, 2021, 42(36): 3599-3726.
[2] CUI X L, SU Y Y, HUANG X T, et al. Combined analysis of plasma metabolome and intestinal microbiome sequencing to explore Jiashen prescription and its potential role in changing intestine-heart axis and effect on chronic heart failure[J]. Frontiers in Cardiovascular Medicine, 2023, 10: 1147438.
[3] DU Z Y, WANG J L, LU Y Y, et al. The cardiac protection of Baoy?鄄
uan Decoction via gut-heart axis metabolic pathway[J]. Phytom?鄄edicine, 2020, 79: 153322.
[4] 陈可冀, 吴宗贵, 朱明军, 等. 慢性心力衰竭中西医结合诊疗专家共识[J]. 中国中西医结合杂志, 2016, 36(2): 133-141.
[5] 中华中医药学会慢性心力衰竭中医诊疗指南项目组. 慢性心力衰竭中医诊疗指南(2022年)[J]. 中医杂志, 2023, 64(7): 743-756.
[6] WANG S C, ZHANG J Q, WANG Y L, et al. NLRP3 inflammasome as a novel therapeutic target for heart failure[J]. Anatolian Journal of Cardiology, 2022, 26(1): 15-22.
[7] LU X F, LIU J J, ZHOU B, et al. Microbial metabolites and heart failure: Friends or enemies?[J]. Frontiers in Microbiology, 2022, 13: 956516.
[8] PETRUZZIELLO C, SAVIANO A, MANETTI L L, et al. The role of gut microbiota and the potential effects of probiotics in heart failure[J]. Medicina, 2024, 60(2): 271.
[9] FAN C L, TANG X Y, YE M N, et al. Qi-Li-Qiang-Xin alleviates isoproterenol-induced myocardial injury by inhibiting excessive autophagy via activating AKT/mTOR pathway[J]. Frontiers in Pharmacology, 2019, 10: 1329.
[10] FENG W W, LI W M. The study of ISO induced heart failure rat model[J]. Experimental and Molecular Pathology, 2010, 88(2): 299-304.
[11] 王瑾茜, 喻 嵘, 李 薇, 等. 基于“心脾同治”理论探讨益气活血方调控冠心病气虚血瘀证大鼠炎症反应的机制[J]. 中国实验动物学报, 2022, 30(7): 935-941.
[12] 陈善达, 汪顺伟, 欧 颖, 等. 益气活血方对冠心病气虚血瘀证大鼠TLR4/MyD88/NF-κB信号通路的影响[J]. 中国中医基础医学杂志, 2024, 30(2): 226-231.
[13] 陈进成, 刘建勋, 林成仁, 等. 基于“劳则气耗”理论研究气虚证动物模型的建立方法[J]. 中国中药杂志, 2018, 43(11): 2177-2183.
[14] 张 瑾, 李秀敏, 苗明三. 基于中西医临床病症特点的心力衰竭动物模型分析[J]. 中国中药杂志, 2021, 46(4): 786-791.
[15] ZHENG A C, YI H, LI F, et al. Changes in gut microbiome structure and function of rats with isoproterenol-induced heart failure[J]. International Heart Journal, 2019, 60(5): 1176-1183.
[16] LIAO M R, XIE Q, ZHAO Y Q, et al. Main active components of Si-Miao-Yong-An Decoction (SMYAD) attenuate autophagy and apoptosis via the PDE5A-AKT and TLR4-NOX4 pathways in isoproterenol (ISO)-induced heart failure models[J]. Pharmacological Research, 2022, 176: 106077.
[17] ZHAO J X, ZHANG Q, CHENG W, et al. Heart-gut microbiota communication determines the severity of cardiac injury after myocardial ischaemia/reperfusion[J]. Cardiovascular Research, 2023, 119(6): 1390-1402.
[18] YAN G M, ZHANG L N, WU D Q, et al. Paeonol attenuates nonalcoholic steatohepatitis by regulating intestinal flora and AhR/NLRP3/Caspase-1 metabolic pathway[J]. Journal of Ethnopharmacology, 2024, 329: 118147.
[19] ZHENG Y, REN X Y, QI X D, et al. Bao Yuan Decoction alleviates fatigue by restraining inflammation and oxidative stress via the AMPK/CRY2/PER1 signaling pathway[J]. Journal of Ethnopharmacology, 2024, 328: 118058.
[20] WANG J Y, CHEN P W, CAO Q Y, et al. Traditional Chinese medicine ginseng Dingzhi Decoction ameliorates myocardial fibrosis and high glucose-induced cardiomyocyte injury by regulating intestinal flora and mitochondrial dysfunction[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 9205908.
[21] WU Y X, YANG X Y, HAN B S, et al. Naringenin regulates gut microbiota and SIRT1/PGC-1?琢 signaling pathway in rats with letrozole-induced polycystic ovary syndrome[J]. Biomedecine & Pharmacotherapie, 2022, 153: 113286.
[22] KHALIL M I, AHMMED I, AHMED R, et al. Amelioration of isoproterenol-induced oxidative damage in rat myocardium by Withania somnifera leaf extract[J]. BioMed Research International, 2015, 2015: 624159.
[23] MAGNE F, GOTTELAND M, GAUTHIER L, et al. The firmicutes/bacteroidetes ratio: A relevant marker of gut dysbiosis in obese patients?[J]. Nutrients, 2020, 12(5): 1474.
[24] NIE Q X, SUN Y G, HU W B, et al. Glucomannan promotes Bacteroides ovatus to improve intestinal barrier function and ameliorate insulin resistance[J]. iMeta, 2024, 3(1): e163.
[25] 徐雁云. 基于宏基因组学探讨高脂高胆固醇饮食诱导西藏小型猪动脉粥样硬化形成的机制[D]. 杭州: 浙江中医药大学, 2022.
[26] MAO J Z, WANG D X, LONG J Y, et al. Gut microbiome is associated with the clinical response to anti-PD-1 based immunotherapy in hepatobiliary cancers[J]. Journal for Immunotherapy of Cancer, 2021, 9(12): e003334.
[27] PITT J, BOND J, ROPER J, et al. A 21-day safety evaluation of biotechnologically produced 3-fucosyllactose (3-FL) in neonatal farm piglets to support use in infant formulas[J]. Food and Chemical Toxicology, 2024, 187: 114592.
[28] 李楠楠. 口服益生菌对慢性轻度应激致小鼠类焦虑、抑郁行为的干预作用及肠-炎症-脑轴影响的研究[D]. 沈阳: 中国医科大学, 2019.
[29] CHEN H C, LIU Y W, CHANG K C, et al. Gut butyrate-producers confer post-infarction cardiac protection[J]. Nature Communications, 2023, 14(1): 7249.
[30] CHOI K J, YOON M Y, KIM J E, et al. Gut commensal Kineothrix alysoides mitigates liver dysfunction by restoring lipid metabolism and gut microbial balance[J]. Scientific Reports, 2023, 13(1): 14668.
[31] GUO C, CHE X Y, BRIESE T, et al. Deficient butyrate-producing capacity in the gut microbiome is associated with bacterial network disturbances and fatigue symptoms in ME/CFS[J]. Cell Host & Microbe, 2023, 31(2): 288-304.
[32] 刘雅清, 徐航宇, 王敦方, 等. 黄芩汤对溃疡性结肠炎小鼠肠道菌群的影响及肠黏膜屏障的保护作用机制[J]. 中国实验方剂学杂志, 2023, 29(7): 11-19.
[33] ZHONG X Q, ZHAO Y C, HUANG L, et al. Remodeling of the gut microbiome by Lactobacillus johnsonii alleviates the development of acute myocardial infarction[J]. Frontiers in Microbiology, 2023, 14: 1140498.