接种丛枝菌根和不同施肥对桑树多酚及 黄酮含量的影响
2024-11-12熊承轩



摘 要:为了研究接种丛枝菌根和不同施肥对桑树根、枝和叶的多酚及黄酮含量的影响,本试验以大10为供试桑树品种,接种摩西斗管囊霉和施加不同肥料,测定桑树根、枝、叶中多酚和黄酮含量的变化情况。结果发现,各处理组根部多酚和黄酮含量均相对对照组降低,其中同时施加生物有机肥及化肥组的桑根多酚和黄酮含量与对照组差别最显著,分别相差39.33%和63.51%;枝部多酚含量变化情况不显著,黄酮含量除仅施加化肥组均高于对照组;叶部多酚含量变化情况不显著,黄酮含量则均低于对照组,其中仅有施加化肥组呈显著性差异,相对降低24.07%;桑树根、枝和叶的黄酮含量受影响程度均显著大于同部位的多酚含量。本试验可以为后续植物与土壤相互作用研究提供参考。
关键词:桑;多酚;黄酮;丛枝菌根;施肥
中图分类号:S888.2" 文献标识码:A" 文章编号:0488-5368(2024)10-0020-06
收稿日期:2024-03-30 修回日期:2024-05-07
作者简介:熊承轩(2004-),男,本科,主要从事活性物质高附加值产品开发工作。
Effects of Inoculation with Arbuscular Mycorrhizal Fungi and Different "Fertilizations" on Polyphenol and Flavonoid Content in Mulberry Trees
XIONG Chengxuan
(College of Life Sciences, Shanxi University, Taiyuan, Shanxi" 030031, China)
Abstract: This study investigates the effects of arbuscular mycorrhizal fungi and different fertilizers on the content of polyphenols and flavonoids in the roots, branches, and leaves of mulberry trees.Using Da 10 as the experimental variety, inoculation with %Morchella esculenta %and the application of different fertilizers were performed, and the changes in polyphenol and flavonoid content in the roots, branches, and leaves of the mulberry trees were measured.The results showed that the content of polyphenols and flavonoids in the roots of each treatment group was relatively lower than that of the control group. Among them, the group treated with both bioorganic fertilizer and chemical fertilizer had the most significant differences in the content of polyphenols and flavonoids compared to the control group, with differences of 39.33% and 63.51%, respectively. The changes in the polyphenol content in the branches were not significant. The flavonoid content was higher than the control group, except for the group treated only with chemical fertilizer. The changes in the leaf polyphenol content were not significant, while the flavonoid content was lower than the control group. Among them, only the group treated with chemical fertilizer showed significant differences, with a relative decrease of 24.07%. Overall, flavonoid content in mulberry trees is significantly more affected than that of polyphenol content. This study provides a reference for further research into the interactions between plants and soil.
Key words: Mulberry, Polyphenols; Flavonoids; Arbuscular mycorrhizal; Fertilization
引 言
桑(%Morus alba% L.)具有丰富营养组分及多种活性成分,其原料及产品已被广泛用于饲蚕、食品和医药等多个领域[1]。在桑树活性成分中,多酚通常具有一个至少连接一个羟基的苯环及其衍生物,根据官能团可分类为黄酮类、花色素类和香豆素类等化合物,具有缓解植物营养缺乏,抵抗逆境胁迫及作为信息交流物质等作用[2~3]。目前研究表明,可通过改变土壤环境[4]、改良品种[5]、施加激素[6]和不同种植模式[7]等途径改变桑树活性成分含量,其中联合施用生物有机肥及氮肥、磷肥和钾肥可以改善其栽种土壤的理化性状及微生物的功能多样性,从而有效提高桑叶及桑果的产量与品质[8,9]。
植物与土壤之间相互作用被视为最具挑战的前沿领域。截至目前,植物地上部之间的通讯机制研究已经取得重要进展,但是关于根际对话的认识较为有限[10]。典型的根际对话(如菌根、根瘤等)是植物的根可与土壤微生物建立共生关系,促进植物生长和作物品质。其中,菌根(mycorrhiza)是指根在土壤中与真菌形成的共生结构,主要包括外生菌根和内生菌根两种类型[11]。桑科植物根系发达,主要形成内生菌根中的丛枝菌根真菌(arbuscular mycorrhiza fungi, AMF)。杜丽建[12]发现对“特优2号”桑树幼接种套近明球囊霉、摩西斗管囊霉和根内根孢囊霉可提高桑叶中类胡萝卜素和黄酮类化合物的含量。目前,有关接种AMF对桑树多酚及黄酮含量变化影响的研究较少。因此,本研究拟对大10桑树品种进行接种AMF和不同施肥处理,探究其对桑树根、枝、叶的多酚及黄酮含量的影响,为改进桑树栽培技术及其产业应用提供参考借鉴。
1 材料与方法
1.1 材料
实验桑园位于陕西省周至县马召镇曹家滩村(北纬34.16°,东经108.22°)。供试品种为大10,2019年11月种植,树龄5 a。丛枝菌根供试菌种选用摩西斗管囊霉(%Funneliformis mosseae, %Fm),购自长江大学根系生物学研究所。供试桑园土壤含有机质22.36" g/kg,全氮1.1 g/kg,有效磷35.2" mg/kg,速效钾178 mg/kg,pH值6.9。生物有机肥含有机质380 g/kg,全氮25 g/kg,P-2O-5 21 g/kg,K-2O 51 g/kg,pH值8.4,由鸡粪发酵制成,购自咸阳佳源肥业有限公司。化肥包括尿素、磷肥和钾肥,其中尿素含N量≥46.4%,购自江苏晋煤恒盛化工股份有限公司;磷肥含P量≥70%,购自湖北丰乐生态肥业有限公司;钾肥含K量≥60%,购自中华化肥有限公司。
1.2 试验设计
设置包括对照组在内的7个处理组,分别为CK组(不接种Fm且不施肥)、C组(仅接种Fm)、Y组(仅施加生物有机肥)、H组(仅施加化肥)、CY组(接种Fm且施加生物有机肥)、CH组(接种Fm且施加化肥)、YH组(施加生物有机肥及化肥)。分别在2023年4月8日与7月15日进行试验处理。每个处理组3个重复,每个重复3株。具体分组处理情况见表1和表2。
1.3 样品采集与处理
2023年10月15日按组别采集靠近主干15~20 cm的根,主干顶端粗细与长短相近的枝以及枝上生长的叶。各组样品干燥后,经粉碎机粉碎,过80目筛,精密称取2 g过筛样品,加入30 mL 70%乙醇浸提3 h,之后按60 ℃、100 W的参数超声辅助提取45 min,过滤除去残渣,并使用70%乙醇10倍稀释后得样品溶液。
1.4 指标测定
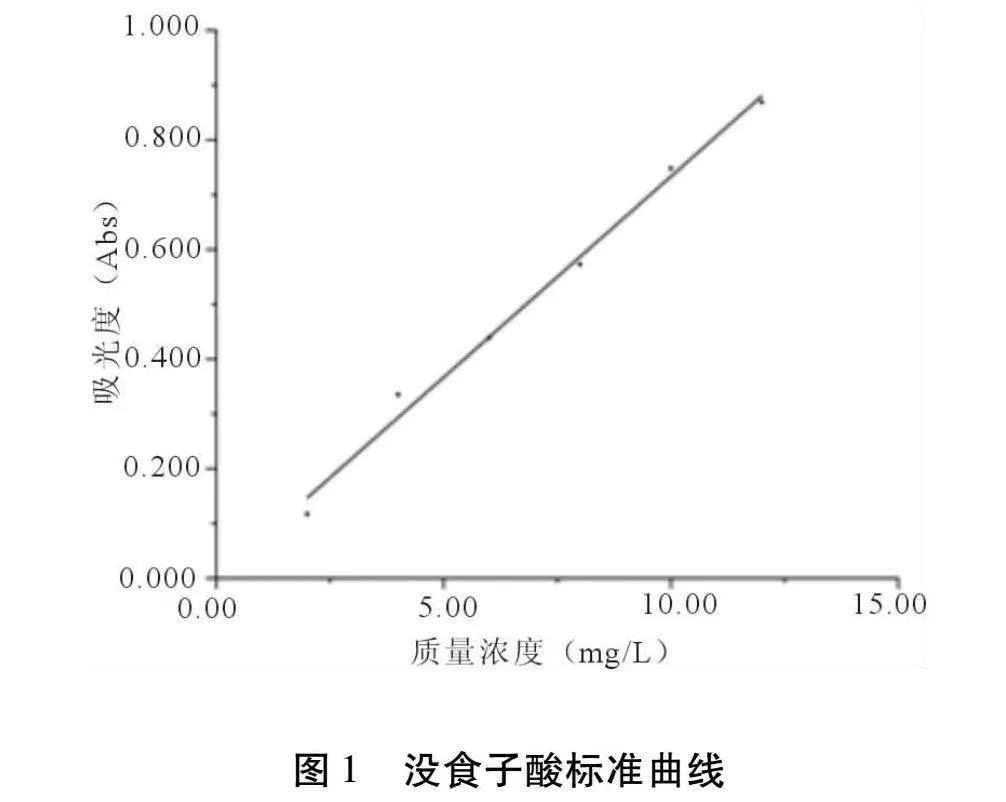
1.4.1 多酚含量的测定 参考占鹏飞等[13]的方法,采用福林酚比色法测定多酚含量。准确称取没食子酸标准品25 mg,用去离子水溶解并定容至50 mL,从中精确量取5 mL于50 mL容量瓶中并用去离子水定容,得没食子酸标准溶液。分别准确量取没食子酸标准溶液0.2 mL、0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL于10 mL容量瓶中,各加入福林酚试剂0.4 mL,10.8%无水碳酸钠溶液4.8 mL,用去离子水定容至10 mL,摇匀并放置30 min,在760 nm波长处测定吸光度值。以没食子酸标准溶液质量浓度(mg/L)为横坐标,吸光度为纵坐标,绘制没食子酸标准曲线(图1),得到回归方程y = 73.329x + 0.0002(R2 = 0.9917)。
精确量取样品溶液0.8 mL于15 mL离心管中,各加入福林酚试剂0.4 mL、10.8%无水碳酸钠溶液4.8 mL和去离子水4.0 mL,摇匀并放置30 min,按5 000 rpm的参数离心5 min,取上清液,在760 nm波长处测定吸光度值,根据回归方程计算样品中多酚含量。计算公式为:多酚含量(mg/g)=测定液质量浓度×10×10×15/170.12。
1.4.2 黄酮含量的测定
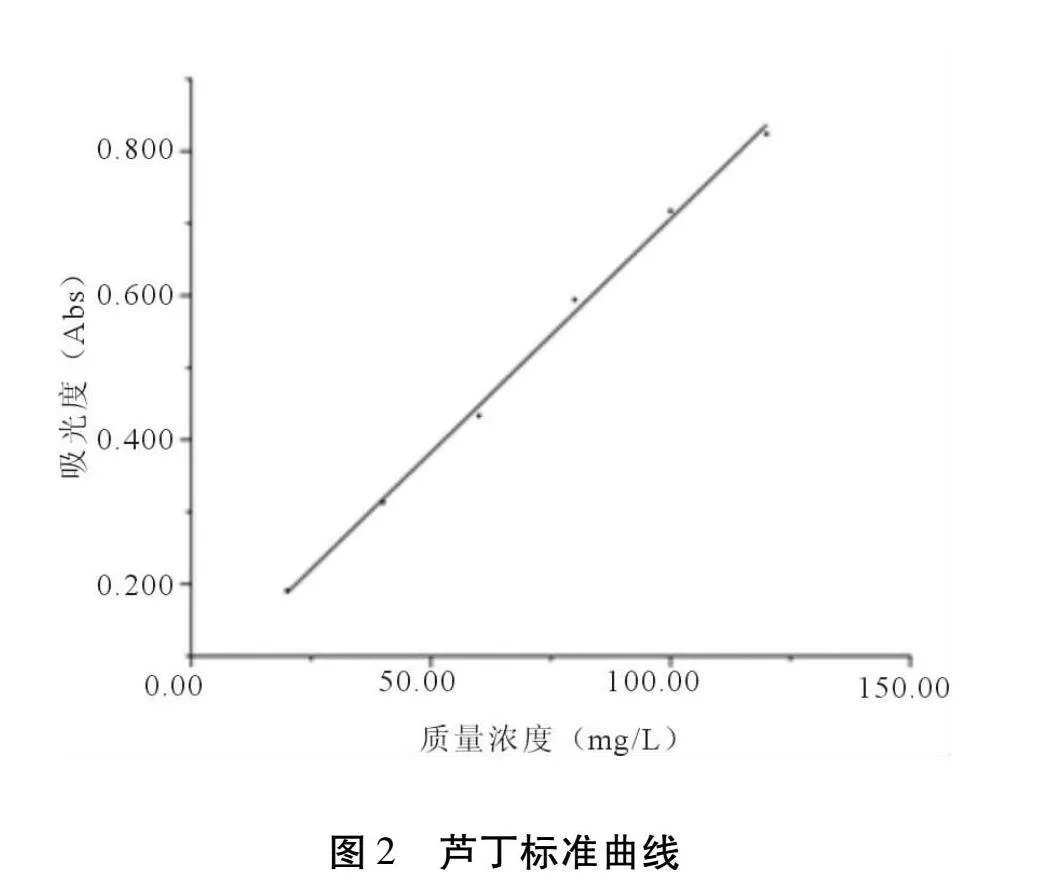
参考江念等[14]的方法,采用亚硝酸钠-硝酸铝法测定黄酮含量。精密称取芦丁标准品20 mg,用70%乙醇溶液溶解并定容至50 mL,得芦丁标准溶液。分别准确量取芦丁标准溶液0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL于10 mL容量瓶中,加入5%亚硝酸钠溶液0.5 mL,摇匀并放置5 min。加入5%的硝酸铝溶液0.5 mL,摇匀并放置5 min。加入4%氢氧化钠溶液4 mL,用去离子水定容至10 mL,摇匀并放置15 min,在510 nm波长处测定吸光度值。以芦丁标准溶液质量浓度(mg/L)为横坐标,吸光度为纵坐标,绘制芦丁标准曲线(图2),得到回归方程y = 6.4829x + 0.0582(R2= 0.9973)。
准确量取样品溶液1 mL,参照上述步骤获得吸光度,根据回归方程计算样品中黄酮含量。计算公式为:黄酮含量(mg/g)=测定液质量浓度×10×10×15/610.52。
1.5 数据处理
使用Microsoft Office Excel 2021和SPSS 26分析数据,通过SPSS 26进行单因素ANOVA方差分析和显著性水平检验,数据以\"平均值±标准差\"表示,通过皮尔逊法分析多酚含量与黄酮含量的相关性,%P%<0.05认为具有统计学意义。使用Origin Pro 2021绘制图像。
2 结果与分析
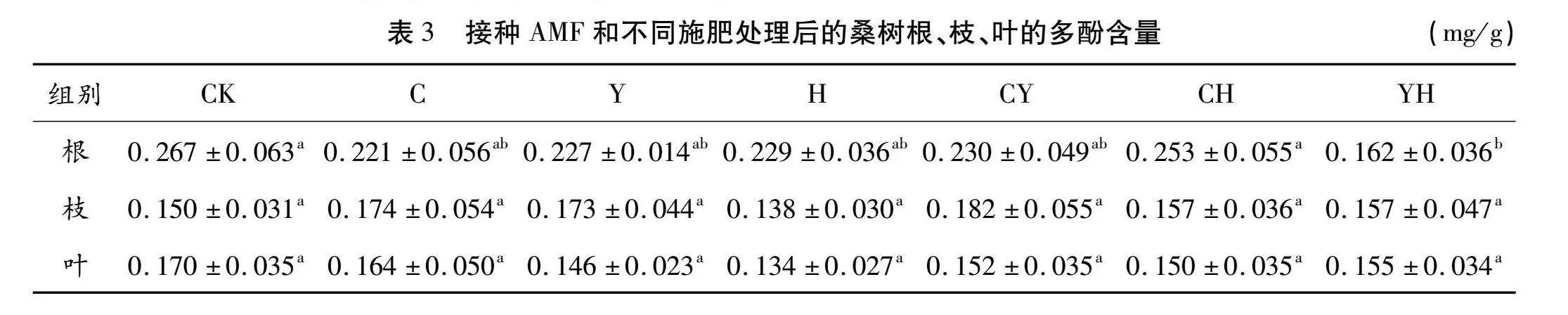
2.1 接种AMF和不同施肥处理后桑树根、枝、叶的多酚含量
桑树根、枝、叶的多酚含量如表3所示。桑根多酚含量仅在少数组别之间存在显著差异。CK组含量最高,为0.267 mg/g,YH组含量最低,为0.162 mg/g。显著性差异仅存在于YH组与CK组及CH组之间,YH组分别较CK组和CH组减低39.33%和35.97%。其余各实验组之间无显著差异。该系列数据表明,对桑树同时施加生物有机肥及化肥会显著减少桑根多酚的含量。
桑枝多酚各组之间不存在显著差异。仅H组多酚含量低于CK组,其余各处理组均高于CK组。桑叶多酚各组之间不存在显著差异。各处理组多酚含量均低于CK组,其中H组多酚含量相对最低。该系列数据说明,对桑树施加化肥会显著降低桑树枝、叶的多酚含量,而接种AMF及其他施肥对桑树枝、叶中多酚含量无显著影响。
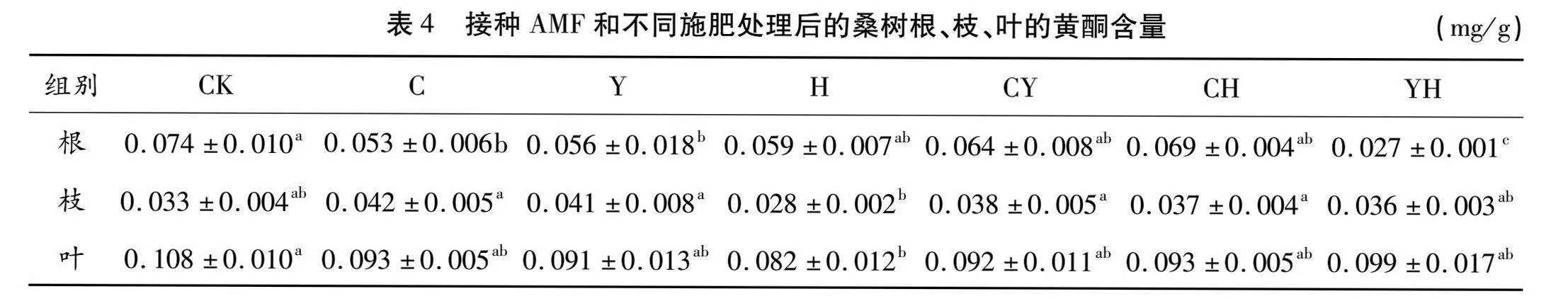
2.2 接种AMF和不同施肥处理后桑树根、枝、叶的黄酮含量
桑树根、枝、叶的黄酮含量如表4所示。桑根黄酮含量在多个实验组之间存在显著差异。CK组黄酮含量最高,为0.074 mg/g,YH组黄酮含量最低,为0.027 mg/g。C组、Y组和YH组黄酮含量均与CK组有显著差异,分别较CK组减少28.38%、24.32%和63.51%。H组、CY组和CH组仅与YH组有显著差异,与其他实验组无显著差异。该系列数据表明对桑树接种AMF和不同施肥均可降低桑根黄酮含量,特别是同时施加生物有机肥及化肥会显著减少桑根黄酮含量,且接种AMF及不同施肥对桑根黄酮含量的影响显著于对桑树根部多酚含量的影响。
桑枝黄酮含量仅在少数实验组之间存在显著差异。C组黄酮含量最高,为0.042 mg/g,H组黄酮含量最低,为0.028 mg/g,二者相差33.33%。CK组与各处理组均无显著差异,C组、Y组、CY组和CH组黄酮含量分别较CK组增加27.27%、24.24%、15.15%和12.12%,且该水平只与H组有显著差异。该系列数据表明,对桑树施加化肥会显著降低桑枝黄酮含量,而接种AMF及其他施肥对桑枝黄酮含量无显著影响。
桑叶黄酮含量仅在少数实验组之间存在显著差异。CK组黄酮含量最高,为0.108 mg/g,H组黄酮含量最低,为0.082 mg/g。CK组只与H组存在显著差异,与其他处理组无显著差异,H组黄酮含量较CK组减少24.07%。C组、Y组、CY组、CH组和YH组均属同一显著水平,与CK组和H组无显著差异。该系列数据表明,对桑树施加化肥会显著降低桑叶黄酮含量,而接种AMF和及其他施肥对桑叶黄酮含量无显著影响。
2.3 桑树根、枝、叶的多酚含量与黄酮含量的相关性分析
桑树根、枝、叶中多酚及黄酮含量的相关系数如表5所示。桑根多酚与桑枝多酚,桑根多酚与桑叶多酚,桑枝多酚与桑叶多酚之间均具有极显著正相关性。桑根黄酮与桑根多酚之间具有显著正相关性,桑叶黄酮与桑枝多酚之间具有显著负相关性,而桑树根、枝、叶的黄酮含量之间无显著相关性,说明接种AMF和不同施肥对桑树根、枝、叶的黄酮含量的差异性影响显著于对多酚含量的影响,而对桑树多酚含量与黄酮含量之间的关联性仅在根部有显著正相关性。
3 讨论与结论
3.1 不同施肥对桑树根、枝、叶中多酚和黄酮含量的影响
参考相关文献[15,16],当植物感应根际N、P含量降低时,其根系会分泌黄酮类化合物。这可能解释本次试验在已有土壤肥力上,继续施加生物有机肥及尿素、磷肥、钾肥,会随着CK组、H组、Y组、YH组中N、P含量的增加,反向降低桑树根部多酚和黄酮的含量,尤其对于降低黄酮含量具有显著影响。相关研究[17,18]指出,过量施肥特别是过量施用化肥会造成植物减少合成次生代谢产物,而适量施加生物有机肥则能显著促进植物总黄酮的积累。这可能解释本次试验中仅施加化肥组相对其他处理组会显著降低桑树枝、叶中多酚及黄酮的含量。
3.2 接种AMF和不同施肥对桑树根、枝、叶中多酚和黄酮含量的影响
根系是植物直接与土壤接触和交换营养的主要器官,根系的生命活动基于长期进化,能够适应并改变其所接触的土壤环境[11]。在植物根系与土壤环境的交互作用中,特别是微生物侵染植物及植物自身防护的相互作用中,植物占据主导地位,可通过次生代谢分泌多酚化合物,有效抵御土壤中的真菌、细菌等土壤微生物[19]。土壤微生物是土壤的重要环境因子,会对植物的营养吸收和次生代谢产生正向或负向的影响[20,21]。有研究表明,AMF共生可能是植物适应低P环境而演化出的获取P营养的一种策略[22]。AMF能在植物根部皮层形成与植物交换营养的丛枝结构,其细胞膜上有P和N转运蛋白,其他微量营养元素也能被AMF富集并传递给植物[23,24]。在本次试验中,CK组、CH组、CY组和C组桑根多酚及桑根黄酮含量依次减少,这种变化趋势可能与土壤中营养含量有关,当土壤养分含量较低时,AMF会与桑树形成寄生或竞争关系,此时桑树因摄取养分不足而无法合成多酚等活性成分[25];当土壤养分含量充分时,AMF可与桑树形成互惠共生关系,桑树可从土壤中摄取更多的养分而减少合成多酚及黄酮[19]。CY组、C组、CH组的桑树枝、叶中多酚和黄酮的含量均高于CK组,但是各实验组之间并无显著差异,相关具体机理尚不明确,有待进一步探究。
参考文献:
[1] 姜玥,刘洋洋,田海涛,等.桑属植物中异戊烯基黄酮类化合物及其药理活性研究进展[J].中草药,2022,53(21):6 948-6 958.
[2] 徐国前,张振文,郭安鹊,等.植物多酚抗逆生态作用研究进展[J].西北植物学报,2011,31(2):423-430.
[3] 贺水花,杨玲.新疆特色植物药桑多酚的研究进展[J].食品研究与开发,2021,42(20):167-172.
[4] 邓真华,杜贤明,王军文,等.果桑专用有机活性肥对粤椹大10产量和品质的影响[J].广西蚕业,2021,58(4):25-28.
[5] 宋志姣,甘春雁,李德焕,等.保山地区12个桑树品种(系)的综合评价[J].经济林研究,2022,40(1):169-177.
[6] 王然,徐章逸,李佳玥,等.桑树桑黄抗氧化菌株筛选及植物激素对胞内黄酮的影响[J].食用菌学报,2020,27(3):61-67.
[7] Jiaying L ,Yawei W ,Haitao D , %et al.%Effects of Intercropping between Morus alba and Nitrogen Fixing Species on Soil Microbial Community Structure and Diversity[J].Forests,2022,13(9):1 345.
[8] 赵珮,黄传书,唐小平,等.不同施肥方案对果叶兼用桑树生长及桑果品质的影响[J].蚕学通讯,2020,40(4):1-6.
[9] 董朝霞,于翠,莫荣利,等.不同施肥和树形处理对设施果桑果实品质及土壤微生物功能多样性的影响[J].北方蚕业,2021,42(4):8-14.
[10] Hongmiao W ,Changxun F ,Antonino M , %et al.%Editorial: Rhizosphere conversation among the plant-plant microbiome-soil under consecutive monoculture regimes[J].Frontiers in Microbiology,2022,13,1061427.
[11] 周云龙,刘全儒.植物生物学(第4版)[M].北京:高等教育出版社,2016:67-69.
[12] 杜丽建. 接种3种丛枝菌根真菌对桑树‘特优2号’生长发育的影响[D].南充:西华师范大学,2023.
[13] 占鹏飞,赵辉,霍进喜,等.桑叶多酚的提取方法优化及应用研究[J].蚕桑通报,2023,54(1):10-17.
[14] 江念,万佐玺,陈根洪,等.正交试验法优化3种乌蔹莓属植物中黄酮和多糖的水提醇沉工艺[J].中成药,2016,38(10):2 281-2 284.
[15] Cesco S ,Mimmo T ,Tonon G , %et al.%Plant-borne flavonoids released into the rhizosphere: impact on soil bio-activities related to plant nutrition. A review[J].Biology and fertility of soils:2012,48(2):123-149.
[16] Kumar A G ,Kumar S ,Bhardwaj R , %et al.%Recent advancements in multifaceted roles of flavonoids in plant-rhizomicrobiome interactions[J].Frontiers in Plant Science,2024,14,1297706.
[17] 冯玉喜,白彦霞,丁耀录,等.不同类型肥料对当归产量和品质的影响[J].甘肃农业大学学报,2023,58(6):66-74.
[18] 郭兰萍,王铁霖,杨婉珍,等.生态农业--中药农业的必由之路[J].中国中药杂志,2017,42(2):231-238.
[19] B.B.布坎南,W.格鲁伊森姆,R.L.琼斯.植物生物化学与分子生物学(第二版)[M].瞿礼嘉,等译.北京:科学出版社,2021:1 124-1 129.
[20] 方荣祥.植物与生物相互作用总论[M].北京:科学出版社,2023:460-464,471-475.
[21] Chenghong X ,Chunyun X ,Jinqiang Z , %et al.%Soil Microbial Communities Affect the Growth and Secondary Metabolite Accumulation in Bletilla striata (Thunb.) Rchb. f.[J].Frontiers in Microbiology,2022,13,916418.
[22] Jincai S ,Boyu Z ,Shuang Z, %et al.%A phosphate starvation response-centered network regulates mycorrhizal symbiosis.[J].Cell,2021,184(22):5527-5540.e18.
[23] Caxl R F,Emma W G ,Yugandhar B, %et al.%Carbon availability triggers fungal nitrogen uptake and transport in arbuscular mycorrhizal symbiosis[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(7):2 666-2 671.
[24] 薛英龙,李春越,王苁蓉,等.丛枝菌根真菌促进植物摄取土壤磷的作用机制[J].水土保持学报,2019,33(6):10-20.
[25] Jiang Y ,Wang W ,Xie Q , %et al.%Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi[J].Science,2017,356(6343):1 172-1 175.
