基于临床生物信息学的白藜芦醇对自闭症谱系障碍的潜在治疗意义
2024-11-11吕艳华钟小云王康龙赵宏霞于琦








Potential therapeutic significance of resveratrol for autism spectrum disorders based on clinical bioinformatics
LYU Yanhua, ZHONG Xiaoyun, WANG Kanglong, ZHAO Hongxia, YU Qi
School of Management, Shanxi Medical University, Shanxi 030600 China
*Corresponding Author LYU Yanhua, E⁃mail:lvyanhua01@163.com
Abstract Objective:To explore the potential therapeutic effect of resveratrol on autism spectrum disorders (ASD)based on clinical bioinformatics.Methods:Obtain whole genome expression profiles of resveratrol and ASD from GEO database;Perform differentially expressed gene analysis,Gene Ontology enrichment analysis,Kyoto Encyclopedia of Genes and Genomes pathway enrichment analysis,and protein-protein interaction network analysis on the whole genome expression profile data of resveratrol and ASD,and screen for core genes;Using domain knowledge scoring method to validate the effectiveness of core genes with important regulatory effects on resveratrol in Chinese and English databases.Results:294 and 256 differentially expressed genes(DEGs)were identified in the resveratrol group and ASD group,respectively;The genes enriched in the resveratrol group GO are mainly related to nervous system development,neurogenesis,synaptic tissue,etc. The KEGG pathway enrichment is mainly related to animal mitochondrial autophagy,cholesterol metabolism,thyroid hormone synthesis,etc;The enrichment of KEGG pathway in ASD group is mainly related to mitogen activated protein kinase signaling pathway,thyroid hormone synthesis,oxytocin signaling pathway,etc;A total of 11 core genes were identified in the PPI network of resveratrol group DEGs,mainly related to cell cycle,synaptogenesis and synaptic plasticity,inflammation,and immune response,etc.Conclusions:Resveratrol has functions such as inhibiting inflammatory response,promoting immune regulation,improving oxidative stress,regulating synaptogenesis and synaptogenesis processes,and regulating neurotransmitter release. It has potential therapeutic significance for ASD.
Keywordsresveratrol;autism spectrum disorders;differentially expressed gene analysis;enrichment analysis;protein-protein interaction network;domain knowledge score;clinical bioinformatics
摘要目的:基于临床生物信息学探讨白藜芦醇对自闭症谱系障碍(ASD)的潜在治疗作用。方法:从基因表达综合数据库(GEO)中获取白藜芦醇和ASD的全基因组表达谱数据;分别对白藜芦醇和ASD的全基因组表达谱数据进行差异基因分析、基因本体(GO)富集分析、京都基因与基因组百科全书(KEGG)通路富集分析和蛋白质相互作用网络(PPI)分析并筛选核心基因;采用领域知识得分法在中英文数据库中对白藜芦醇具有重要调控作用核心基因的有效性进行文本验证。结果:白藜芦醇组和ASD组分别筛选出294个和256个差异基因(DEGs);白藜芦醇组GO富集的基因主要与神经系统发育、神经发生、突触组织等有关,KEGG通路富集主要与动物线粒体自噬、胆固醇代谢、甲状腺激素合成等有关;ASD组KEGG通路富集主要与丝裂原活化蛋白激酶信号通路、甲状腺激素合成、缩宫素信号通路等有关;白藜芦醇组DEGs的PPI网络分析中共获得11个核心基因,主要与细胞周期、突触发生和突触可塑性、炎症、免疫反应等有关。结论:白藜芦醇具有抑制炎症反应、促进免疫调节、改善氧化应激、调节突触发生和突触生成过程、调节神经递质的释放等功能,对ASD具有潜在的治疗意义。
关键词白藜芦醇;自闭症谱系障碍;差异基因分析;富集分析;蛋白质相互作用网络;领域知识得分;临床生物信息学
doi:10.12102/j.issn.1009-6493.2024.21.002
自闭症谱系障碍(autism spectrum disorders,ASD)被归类为一种由于神经系统失调导致的发育障碍,是以社会交往障碍、沟通交流障碍、兴趣受限和行为重复刻板为典型特征的精神类疾病[1⁃2]。在药物治疗方面,目前对ASD通常是对症治疗,没有特效药物,会使用一些抗精神病药、抗抑郁药、促进脑细胞功能药、维生素和其他补充剂等缓解症状。本课题组运用语义挖掘技术抽取ASD相关文献中的三元组并构建自闭症药物实体知识图谱,采用3种语义路径开展ASD药物知识发现,筛选出27种ASD潜力药物,其中,白藜芦醇排在第12位。白藜芦醇(resveratrol,RSV)是一种多酚类化合物,多酚类化合物是日常膳食中的非营养素,具有一定的药物学特性,如抗氧化、抗感染、抗病毒、抗细菌、抗过敏、抗出血和增强免疫力等,非营养素是防治慢性病的重要组成成分[3]。白藜芦醇主要来源于葡萄、坚果、虎杖、浆果等,具有抗炎和抗氧化的特性,可调节内环境,它在慢性病特别是心脑血管疾病、糖尿病、肥胖、肿瘤等疾病的治疗中具有潜在的优势[3]。而自闭症也属于一种慢性病,同时,众多的临床试验研究显示,白藜芦醇具有一定的神经保护作用,对精神障碍疾病具有治疗作用,如重度抑郁症、双相情感障碍、阿尔茨海默病和自闭症等[4]。本研究利用临床生物信息学的研究方法,分析白藜芦醇作用于ASD的潜在机制,以期为ASD的治疗和白藜芦醇的临床应用及价值提供参考依据。
1 资料与方法
1.1 数据获取
分别以“resveratrol”和“autism”为检索词在基因表达综合数据库(Gene Expression Omnibus,GEO)中进行检索,设置条目类型为“series”,各得到135条和655条检索结果。筛选出符合条件的数据集GSE11291(GPL1261⁃56135)和GSE28521(GPL6883⁃11606)。其中,GSE11291数据集包含白藜芦醇作用于小家鼠心脏、大脑新皮质、腓肠肌的全基因组表达谱数据。GSE28521数据集源自从ASD病人和正常人个体死后的小脑、额叶皮层和颞叶皮层中提取的核糖核酸(RNA)样本。
1.2 实验设计
1.2.1 白藜芦醇
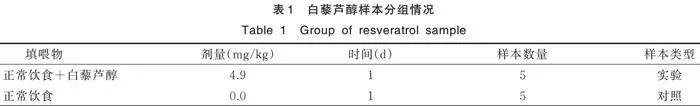
对数据集GSE11291中的数据进行整理,考虑ASD的病因,选择提取小家属组织为大脑新皮质的基因表达谱数据进行分析,根据填喂白藜芦醇和正常饮食的条件将筛选后的数据分为实验组和对照组。见表1。
1.2.2 ASD
对数据集GSE28521中的数据进行整理,根据组织来源为小脑、额叶皮层、颞叶皮层,将筛选后的数据分为3组实验组和对照组。见表2。
1.3 方法
1.3.1 数据处理及差异基因(DEGs)筛选
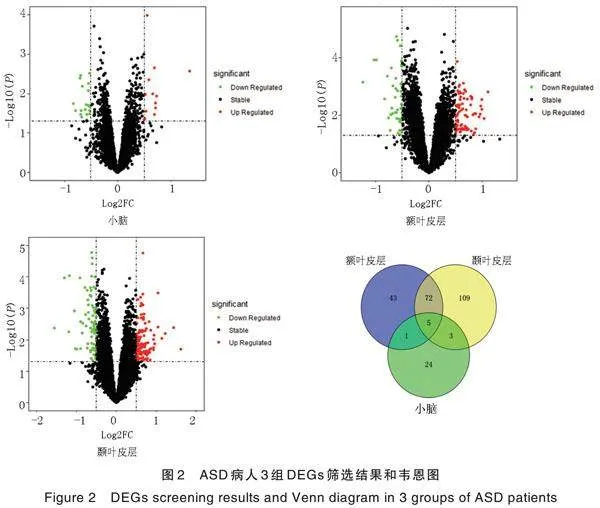
下载R语言程序包并安装RStudio软件,用于数据处理和DEGs筛选[5]。首先,利用平台文件对数据集中的探针名称进行基因注释,并分别使用Impute包、biomaRt包、limma包对数据进行缺失值填充、基因同源转化、差异表达分析,获得实验组和对照组样本之间的DEGs,并使用ggplot2包绘制火山图可视化差异分析结果,然后设定标准筛选可靠DEGs。使用Venny 2.1[6]和Excel工具,去除ASD组3组DEGs中调控作用相反的交集基因,并对3组调控作用相同的DEGs表达量取最大值,汇总差异分析结果。
1.3.2 构建蛋白互作网络(PPI)并计算核心基因
利用STRING v11.0数据库对上述筛选出的DEGs进行PPI网络分析[7]。运用CytoScape软件[8]绘制PPI网络图,并根据软件中CytoHubba插件[9]提供的12种蛋白质重要性评分算法对蛋白质在网络中的属性进行评分和排名,分别输出12种算法中排名前10位的蛋白质,并统计出现频次,将排名前10位的蛋白质作为核心基因。
1.3.3 基因富集分析
为分析白藜芦醇作用于ASD潜在的生物学功能,使用clusterProfiler包分别对白藜芦醇和ASD的DEGs进行基因本体(GO)[10]和京都基因与基因组百科全书(KEGG)[11]通路富集分析,并使用ggplot2包绘制条形图,对聚类结果进行可视化处理。
1.3.4 基于领域知识得分的文本验证
采用领域知识得分法,在中英文数据库中对白藜芦醇关键作用靶点的有效性进行文本验证,若文献中通过实验验证显示白藜芦醇关键靶点与ASD有关联,有1篇则计1分,重复文献不累计得分。具体操作:将CytoHubba插件计算出的核心基因作为关键靶点,以“(autism[Title/Abstract]) AND (key target[Title/Abstract])”为检索式,在英文数据库PubMed中进行检索,以“[(主题:自闭症)OR(主题:孤独症)]AND(主题:关键靶点)”为检索式,在中国知网和万方数据库中进行检索,记录相关检索结果并统计其累计得分。
2 结果
2.1 白藜芦醇组和ASD组的DEGs筛选
2.1.1 白藜芦醇
白藜芦醇组差异分析结果见图1。以“|Log2FC|>0.5,FDR<0.01”为阈值筛选出294个DEGs(46个上调和248个下调)。
2.1.2 ASD
ASD组差异分析结果见图2。以“|log2FC|>0.5,<0.05”为阈值得到3组DEGs,依次为小脑33个,额叶皮层121个,颞叶皮层189个。将3组差异结果汇总,得到256个DEGs(140个上调,116个下调)。
2.2 构建PPI网络并计算核心基因
将白藜芦醇DEGs导入STRING数据库中进行PPI网络分析,以置信度>0.4作为阈值进行筛选,共得到293个节点、679条相互关系,平均点度为4.63,蛋白质之间具有较强的相互关联性。在CytoScape软件中构建PPI网络图,部分结果见图3。
采用CytoHubba插件的12种拓扑分析方法对PPI网络结果进行分析,统计12种算法得出的排名前10位的蛋白质出现频次。最终统计结果中排名第10位、第11位的蛋白质频次相同,并列第10位,故选择前11位蛋白质作为具有重要调控作用的核心基因。这11个核心基因分别为AKT1、GRB2、HRAS、JUN、DLG4、HIF1A、KAT2A、HSPA5、FYN、MED1、VAMP2,是白藜芦醇关键作用靶点。
2.3 白藜芦醇和ASD的基因富集分析
2.3.1 白藜芦醇
对白藜芦醇的DEGs进行GO富集和KEGG通路富集分析(部分结果见图4)。以“<0.01,<0.05”为阈值对GO富集结果进行筛选,获得生物学过程(biological process,BP)136条、细胞组分(cellular components,CC)80条、分子功能(molecular function,MF)13条。在BP方面,富集的基因大多与膜电位、神经系统发育和神经元投射发育的调节以及神经元死亡等有关。在CC方面,富集的基因大多与神经元细胞体、远端轴突、突触后特化、神经元间突触等有关。在MF方面,富集的基因大多与DNA结合转录因子结合、RNA聚合酶Ⅱ⁃特异性DNA结合转录因子结合、蛋白质⁃大分子衔接器活性、转录共激活因子活性等有关。
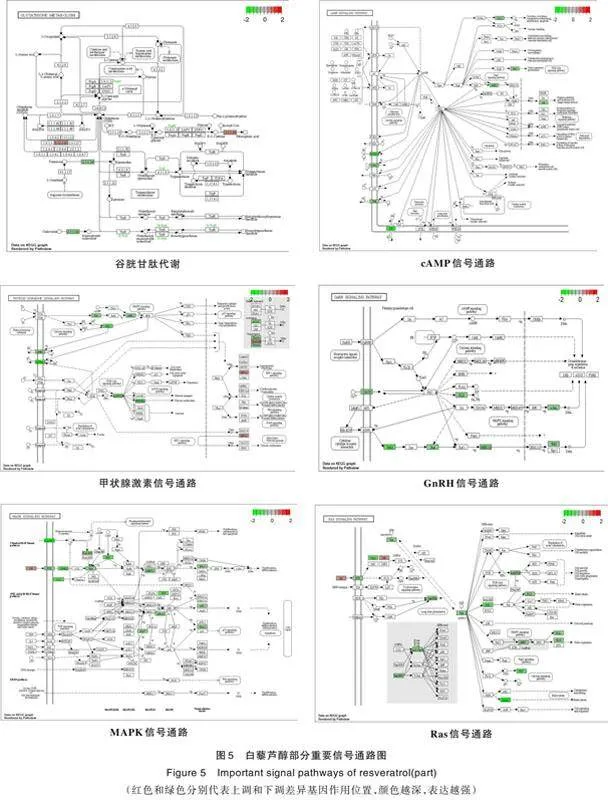
以“<0.10,<0.50”为阈值对KEGG通路富集结果进行筛选,获得上调基因所在通路13条、下调基因所在通路93条。排除一些疾病通路,结果显示,上调基因富集的通路主要参与动物线粒体自噬、蛋白质输出、谷胱甘肽代谢、甲状腺激素信号通路等相关功能或过程。下调基因富集的通路主要参与丝裂原活化蛋白激酶(mitogen⁃activated protein kinases,MAPK)信号通路、Ras蛋白(Ras proteins,Ras)信号通路、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号通路、促性腺激素释放激素(gonadotropin⁃releasing hormone,GnRH)信号通路、缩宫素信号通路等相关功能或过程。白藜芦醇部分重要信号通路见图5。
2.3.2 ASD
对ASD病人的DEGs进行KEGG通路富集分析(部分结果见图6)。以“<0.10,<0.50”为阈值对KEGG通路富集结果进行筛选,获得上调基因所在通路59条、下调基因所在通路50条。排除一些疾病通路,其中上调基因富集的通路主要参与MAPK信号通路、核因子Kappa B(nuclear factor⁃Kappa B,NF⁃Kappa B)信号通路、低氧诱导因子1(hypoxia⁃inducible factor 1,HIF⁃1)信号通路、缩宫素信号通路等相关功能或过程。下调基因富集的通路主要参与γ⁃氨基丁酸能突触、神经活性配体⁃受体相互作用、cAMP信号通路、钙信号通路等相关功能或过程。
2.4 白藜芦醇与ASD的生物信息学分析结果对比
2.4.1 基因对比
将白藜芦醇与ASD病人的DEGs进行对比,发现调控作用相反的基因有ALPL和JUN。白藜芦醇作用下小家鼠ALPL和JUN基因表达下调,而在ASD病人中,ALPL和JUN基因表达上调。ALPL基因在大脑、小脑、卵巢、结肠、皮肤等组织中普遍表达,JUN基因在大脑、小脑、卵巢、肝脏、甲状腺等组织中普遍表达。ALPL和JUN都在脑部和卵巢组织中表达。ASD与遗传因素、母体环境等有关,ASD病人使用白藜芦醇有望减轻症状,在母体中应用白藜芦醇有望起到预防作用。
2.4.2 通路对比
将白藜芦醇与ASD病人的DEGs分别富集到的KEGG通路进行对比,发现调控作用相反的基因所富集的共同通路有23条,排除一些疾病通路,包括HIF⁃1信号通路、Janus激酶⁃信号传导和转录激活因子(janus kinase⁃signal transducers and activators of transcription,JAK⁃STAT)信号通路、MAPK信号通路、缩宫素信号通路等。其中,在白藜芦醇和ASD中同时满足<0.05的通路有JAK⁃STAT信号通路、MAPK信号通路、缩宫素信号通路、甲状腺激素合成和癌症的胆碱代谢5条,白藜芦醇与ASD有共同的生物信息学基础。通路对比情况见图7。
从图7可以看出,在JAK⁃STAT信号通路中,白藜芦醇影响配体与膜受体结合过程;ASD影响JAK磷酸化STAT和启动转录过程。JAK⁃STAT信号通路是一种普遍表达的细胞内信号转导通路,参与细胞增殖、分化、凋亡和免疫调节等关键生物过程,该信号通路与许多免疫和炎症性疾病密切相关[12]。在MAPK信号通路中,白藜芦醇和ASD影响该通路的各个方面。MAPK信号通路参与调节细胞增殖、分化、凋亡、应激反应、免疫细胞的活化、炎症反应等细胞生理和病理过程,该信号通路在肿瘤、心血管疾病等疾病中扮演重要角色[13]。在甲状腺激素合成通路中,白藜芦醇和ASD影响的部分调控作用相反。甲状腺激素会影响海马体的神经发生,小脑中甲状腺激素的缺失可导致小脑形态发生变化,还可能导致突触数量减少、神经元和颗粒细胞迁移、神经胶质细胞分化和异常连接模式,妊娠期充足的甲状腺激素对胎儿中枢神经系统的发育至关重要[14⁃16]。在缩宫素信号通路中,白藜芦醇和ASD影响的部分调控作用相反。缩宫素是由下丘脑合成的一种神经肽,在人类社会行为和认知、焦虑、情绪以及恐惧学习和消退中起着核心作用[17]。因此,白藜芦醇可能通过调控这5条通路达到治疗ASD的目的。
2.5 基于领域知识得分的文本验证
为了验证PPI网络中筛选出的11个白藜芦醇关键作用靶点的有效性,分别在中英文数据库中检索与白藜芦醇关键靶点相关的ASD文献(见表3)并阅读。文献中的实验结果显示,其中9个靶点与ASD密切相关,这些靶点主要参与突触发生和突触可塑、炎症、细胞周期进程、感染、免疫反应等过程。
3 讨论
ASD病因复杂,综合国内外研究来看,ASD发病与遗传因素、非遗传因素及二者之间复杂相互作用相关,其中突触蛋白的基因突变、染色体变异、分子通路功能障碍、神经内分泌和神经递质以及脑部炎症反应等是导致ASD发生的主要影响因素[18]。挖掘ASD潜力药物从而找到较合适的治疗药物成为重中之重,基于课题组的前期研究,发现白藜芦醇有望预防或治疗ASD。本研究基于GEO数据库中白藜芦醇和ASD的基因表达谱数据,从GO功能和KEGG通路等方面分析白藜芦醇的作用机制,并从中英文数据库中检索关键靶点和ASD的密切联系,进行“药物⁃疾病”关联研究。
3.1 白藜芦醇作用机制
白藜芦醇和ASD的基因表达谱数据的生物信息学分析结果显示,白藜芦醇可通过对ASD多靶点、多通路调控发挥潜在治疗作用。
在GO富集结果中,白藜芦醇主要与各类神经组织和系统发育的调节、神经元细胞周期、氨基酸分解代谢、突触和多种膜的构成、多种转录因子和受体结合等有关。在KEGG通路富集结果中,白藜芦醇主要参与氧化应激、神经炎症、免疫反应、氨基酸合成分泌与代谢等相关功能或过程,并作用于MAPK信号通路、RAS信号通路、GnRH信号通路、谷胱甘肽代谢、缩宫素信号通路等通路。
SIRT1影响炎症、代谢、细胞凋亡等各种生物过程,参与神经保护,突触在认知功能中起着重要作用,突触素是参与突触形成的重要因素之一,白藜芦醇可通过激活SIRT1/PGC⁃1通路增加突触素,改善创伤性脑损伤后认知障碍[19]。有学者发现,白藜芦醇通过表达PGC⁃1α抑制小胶质细胞极化到促炎(M1)表型和促进小胶质细胞极化到抗炎(M2)表型达到治疗神经炎症的目的,而小胶质细胞也是中枢神经系统中发挥免疫功能的主要细胞[20]。有学者发现,白藜芦醇可诱导免疫细胞释放白介素2(IL⁃2)、白介素4(IL⁃4)和干扰素γ(IFN⁃γ),从而增强CD+和CD+T淋巴细胞以及自然杀伤细胞的增殖,调节免疫系统[21]。活性氧(ROS)产生增加或抗氧化机制减少会破坏氧化还原稳态,天然抗氧化物白藜芦醇具有清除ROS作用,且可增加抗氧化防御能力,抑制促氧化酶的释放[22]。线粒体自噬功能失调是神经系统疾病的致病因素之一,有效的线粒体功能在大脑的正常功能中起着重要作用,白藜芦醇可缓解β⁃淀粉样蛋白(Aβ)诱导的线粒体功能障碍和氧化损伤,促进线粒体自噬,起到神经保护的作用[23]。有学者发现,长期服用白藜芦醇可显著降低兴奋性神经递质谷氨酸(Glu)、天冬氨酸(Asp)和神经调节剂d⁃丝氨酸(d⁃Ser)的释放,并显著增加抑制性神经递质γ⁃氨基丁酸(GABA)、甘氨酸(Gly)和牛磺酸(Tau)水平[24]。
综上所述,白藜芦醇可通过作用于细胞增殖、分化、凋亡等生理和病理过程及调控炎症、免疫和氧化反应等相关通路抑制炎症反应、参与免疫调节、调节神经递质的释放、调节突触发生和突触生成过程及改善氧化应激治疗ASD。
3.2 文献验证
本研究通过构建白藜芦醇DEGs的PPI网络,发现白藜芦醇具有重要调控作用的11个关键靶点。分别在中英文数据库中检索这11个关键靶点与ASD的关联文献,文献中实验结果显示其中9个基因与ASD密切相关,分别为JUN、DLG4、FYN、AKT1、VAMP2、HRAS、HIF1A(HIF⁃1α)、KAT2A、HSPA5。JUN是一种转录因子,是神经元死亡和再生的主要调节因子,JUN的活性受磷酸化调节,磷酸化由c⁃Jun N末端激酶(JNK)家族介导,JNK基于其调节皮质神经元基底树突发育的功能与ASD的病理生理机制密切相关[25⁃27]。由DLG4编码的突触后密度蛋白⁃95(PSD⁃95)调节大脑中的兴奋性突触功能,DLG4变异的病人临床表现以早发性整体发育迟缓、智力障碍、自闭症谱系障碍和注意力缺陷多动障碍为主[28]。FYN与神经元信号转导有关,是Reelin信号通路的核心成分,Reelin参与神经元迁移、突触发生和突触可塑等功能,相关疾病有ASD、抑郁症、阿尔茨海默病等[29]。AKT1是AKT激酶中3种密切相关的丝氨酸/苏氨酸蛋白激酶之一,AKT在大脑中高度表达,参与细胞进程,可调节突触可塑性以及神经递质受体数量[30]。VAMP2是大脑神经元突触传递中的一种工具蛋白,促进神经递质的释放,该基因的变异会导致早发性轴向肌张力减退、智力障碍和ASD等神经发育特征[31]。有研究发现,ASD病人血清中HIF⁃1α水平较低,HIF⁃1α可能在母体产前缺氧引起的后代ASD样行为中发挥作用[32⁃33]。
4 小结
本研究基于白藜芦醇和ASD基因表达谱数据,利用临床生物信息学方法开展“药物⁃疾病”关联分析,结果显示,白藜芦醇可能通过抑制炎症反应、参与免疫调节、改善氧化应激、调节突触发生和突触生成过程、调节神经递质的释放等达到治疗ASD的目的。基于临床生物信息学的研究方法为新药发现、老药新用提供了新思路,为药物治疗疾病提供了理论依据,下一步将进行后续的实验对白藜芦醇的真实效果、作用时间和剂量等进行研究及验证。
参考文献:
[1] 唐娜娜,李燕,郭德剑.探究行为功能分析在自闭症谱系障碍儿童问题行为中的应用[J].内蒙古教育,2020(20):68-72.
TANG N N,LI Y,GUO D J.Exploring the application of behavioral function analysis in problem behavior of children with autism spectrum disorder[J].Inner Mongolia Education,2020(20):68-72.
[2] 熊淑萍,李文炜,王坚.自闭症儿童康复路径国内外研究现状[J].中国健康心理学杂志,2022,30(12):1902-1908.
XIONG S P,LI W W,WANG J.Review of domestic and foreign research on rehabilitation pathway of autistic children[J].China Journal of Health Psychology,2022,30(12):1902-1908.
[3] 韩世范,冯耀清,高文晴.非营养素防治慢性病的食疗理论模型[J].护理研究,2023,37(4):565-569.
HAN S F,FENG Y Q,GAO W Q.Theoretical model of non-nutrient diet therapy for prevention and treatment of chronic diseases[J].Chinese Nursing Research,2023,37(4):565-569.
[4] MENEGAS S,KELLER G S,POSSAMAI-DELLA T,.Potential mechanisms of action of resveratrol in prevention and therapy for mental disorders[J].The Journal of Nutritional Biochemistry,2023,121:109435.
[5] GENTLEMAN R C,CAREY V J,BATES D M,.Bioconductor:open software development for computational biology and bioinformatics[J].Genome Biology,2004,5(10):R80.
[6] OLIVEROS J C.An interactive tool for comparing lists with Venn's diagrams[EB/OL].[2023-10-12].https://bioinfogp.cnb.csic.es/tools/venny/index.html.
[7] SZKLARCZYK D,GABLE A L,LYON D,.STRING v11:protein-protein association networks with increased coverage,supporting functional discovery in genome-wide experimental datasets[J].Nucleic Acids Research,2019,47(D1):D607-D613.
[8] SHANNON P,MARKIEL A,OZIER O,.Cytoscape:a software environment for integrated models of biomolecular interaction networks[J].Genome Research,2003,13(11):2498-2504.
[9] CHIN C H,CHEN S H,WU H H,.CytoHubba:identifying hub objects and sub-networks from complex interactome[J].BMC Systems Biology,2014,8(Suppl 4):S11.
[10] ASHBURNER M,BALL C A,BLAKE J A,.Gene ontology:tool for the unification of biology.The gene ontology consortium[J].Nature Genetics,2000,25(1):25-29.
[11] OGATA H,GOTO S,SATO K,.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research,1999,27(1):29-34.
[12] XIN P,XU X Y,DENG C J,.The role of JAK/STAT signaling pathway and its inhibitors in diseases[J].International Immunopharmacology,2020,80:106210.
[13] ASL E R,AMINI M,NAJAFI S,.Interplay between MAPK/ERK signaling pathway and microRNAs:a crucial mechanism regulating cancer cell metabolism and tumor progression[J].Life Sciences,2021,278:119499.
[14] GIANNOCCO G,KIZYS M M L,MACIEL R M,.Thyroid hormone,gene expression,and central nervous system:where we are[J].Semin Cell Dev Biol,2021,114:47-56.
[15] MORREALE DE E G,OBREGON M J,ESCOBAR F.Role of thyroid hormone during early brain development[J].European Journal of EnMyJdFFLLpZ/0vaxDe7MXcypEHLFIDcEeJbdzhMtQGzo=docrinology,2004,151(Suppl 3):U25-U37.
[16] ARAUJO A P B,CARPI-SANTOS R,GOMES F C A.The role of astrocytes in the development of the cerebellum[J].Cerebellum,2019,18(6):1017-1035.
[17] YOON S,KIM Y K.The role of the oxytocin system in anxiety disorders[J].Advances in Experimental Medicine and Biology,2020,1191:103-120.
[18] 尚宇夫,王月华,杜冠华.自闭症发病机制及治疗药物研究进展[J].中国药学杂志,2023,58(11):949-953.
SHANG Y F,WANG Y H,DU G H.Research progress in the pathogenesis and therapeutic drugs of autism[J].Chinese Pharmaceutical Journal,2023,58(11):949-953.
[19] YU D,ZHAO X Y,MENG Q P,.Resveratrol activates the SIRT1/PGC-1 pathway in mice to improve synaptic-related cognitive impairment after TBI[J].Brain Research,2022,1796:148109.
[20] YANG X D,XU S Q,QIAN Y W,.Resveratrol regulates microglia M1/M2 polarization via PGC-1αin conditions of neuroinflammatory injury[J].Brain,Behavior,and Immunity,2017,64:162-172.
[21] FALCHETTI R,FUGGETTA M P,LANZILLI G,.Effects of resveratrol on human immune cell function[J].Life Sciences,2001,70(1):81-96.
[22] SAHOO D K,HEILMANN R M,PAITAL B,.Oxidative stress,hormones,and effects of natural antioxidants on intestinal inflammation in inflammatory bowel disease[J].Frontiers in Endocrinology,2023,14:1217165.
[23] WANG H,JIANG T,LI W,.Resveratrol attenuates oxidative damage through activating mitophagy in an in vitro model of Alzheimer's disease[J].Toxicol Lett,2018,282:100-108.
[24] LI C,YAN Z,YANG J,.Neuroprotective effects of resveratrol on ischemic injury mediated by modulating the release of neurotransmitter and neuromodulator in rats[J].Neurochem Int,2010,56(3):495-500.
[25] COFFEY E T,SMICIENE G,HONGISTO V,.C-Jun N-terminal protein kinase(JNK) 2/3 is specifically activated by stress,mediating c-Jun activation,in the presence of constitutive JNK1 activity in cerebellar neurons[J].The Journal of Neuroscience,2002,22(11):4335-4345.
[26] PETROV D,LUQUE M,PEDRÓS I,.Evaluation of the role of JNK1 in the hippocampus in an experimental model of familial Alzheimer's disease[J].Molecular Neurobiology,2016,53(9):6183-6193.
[27] DE ANDA F C,ROSARIO A L,DURAK O,.Autism spectrum disorder susceptibility gene TAOK2 affects basal dendrite formation in the neocortex[J].Nature Neuroscience,2012,15(7):1022-1031.
[28] RODRÍGUEZ-PALMERO A,BOERRIGTER M M,GÓMEZ-ANDRÉS D,.DLG4-related synaptopathy:a new rare brain disorder[J].Genetics in Medicine,2021,23(5):888-899.
[29] JOSSIN Y.Reelin functions,mechanisms of action and signaling pathways during brain development and maturation[J].Biomolecules,2020,10(6):964.
[30] WANG Q,LIU L,PEI L,.Control of synaptic strength,a novel function of Akt[J].Neuron,2003,38(6):915-928.
[31] BOGUE D,RYAN G,WASSMER E,.VAMP2 gene-related neurodevelopmental disorder:a differential diagnosis for rett/angelman-type spectrum of disorders[J].Molecular Syndromology,2023,14(5):449-456.
[32] ŞIMŞEK F,IŞIK Ü,AKTEPE E,.Comparison of serum VEGF,IGF-1,and HIF-1αlevels in children with autism spectrum disorder and healthy control[J].J Autism Dev Disord,2021,51(10):3564-3574.
[33] WANG W Y,TANG J H,ZHONG M,.HIF-1 αmay play a role in late pregnancy hypoxia-induced autism-like behaviors in offspring rats[J].Behavioural Brain Research,2021,411:113373.
(本文编辑崔晓芳)
基金项目国家社会科学基金一般项目,编号:20BTQ064
作者简介吕艳华,副教授,博士,E⁃mail:lvyanhua01@163.com
引用信息吕艳华,钟小云,王康龙,等.基于临床生物信息学的白藜芦醇对自闭症谱系障碍的潜在治疗意义[J].护理研究,2024,38(21):3768⁃3778.
