N-芳基氨基甲酸苄酯的合成及抗真菌活性研究
2024-11-11杨珊珊沙赟颖燕韦婷郭玮璐王洋莉张雨墨刘竺云



摘要:为发现更多抗真菌药物分子,设计合成16种N-芳基氨基甲酸苄酯类目标化合物,并进行结构鉴定;以醚菌酯为阳性对照,采用菌丝线性生长速率法,测定目标化合物对常见的10种植物病原真菌的体外抑制活性,以及5种高抗菌活性的目标化合物对苹果轮纹病原菌和番茄早疫病原菌的毒力。结果发现,所有目标化合物对10种供试真菌都有不同程度的抑制活性,其中,化合物B11抗菌活性最高,对9种供试真菌的抑制率均超过80%,对马铃薯干腐病原菌的抑制率为98.1%,对番茄早疫病原菌的EC50为7.6 μg/mL。构效关系研究表明,-F和-Me的引入有利于提高活性,是该类化合物的优势基团;-F和-Me的组合可大幅度提高活性,是优势基团叠加效应的结果。
关键词:N-芳基氨基甲酸苄酯;植物病原真菌;抗真菌活性;构效关系
中图分类号:S482.2 文献标识码:A 文章编号:1006-060X(2024)10-0070-05
Synthesis and Antifungal Activity of N-Arylaminomethyl Benzyl Ester
YANG Shan-shan1,2,SHA Yun-ying1,2,YAN Wei-ting2,GUO Wei-lu2,WANG Yang-li2,
ZHANG Yu-mo2,LIU Zhu-yun1,3
(1. Jiangsu Intelligent Pharmaceutical Industry-Education Integration Platform, Taizhou 225300, PRC; 2. Taizhou Polytechnic College, Taizhou 225300, PRC; 3. Nanjing Tech University, Nanjing 210000, PRC)
Abstract: To discover novel antifungal molecules, we designed and synthesized 16 target compounds of N-arylaminomethyl benzyl esters and identified their structures. With kresoxim-methyl as the positive control, the inhibitory effects of the target compounds on 10 common phytopathogenic fungi were determined by the mycelial growth rate method. Furthermore, the toxicity of 5 highly antifungal target compounds to Botryosphaeria dothidea and Alternaria solani was determined. The results showed that all the target compounds inhibited the growth of the 10 tested fungi. Among them, compound B11 had the highest antifungal activity, with the inhibition rates over 80% against 9 tested fungi. In addition, compound B11 demonstrated the inhibition rate of 98.1% against Fusarium sambucinum and the EC50 of 7.6 μg/mL against A. solani. The analysis of structure-activity relationship showed that -F and -Me increased the compound activity, being the dominant functional groups of such compounds. The combination of -F and -Me significantly enhanced the compound activity, which was attributed to the combined effect of dominant functional groups.
Key words: N-arylaminomethyl benzyl ester; phytopathogenic fungi; antifungal activity; structure-activity relationship
目前有超过19 000种植物病原真菌可以感染农作物和植物,导致农作物质量和产量下降,从而造成巨大的经济损失[1-2]。相比于其他微生物群体,植物病原真菌是造成全球农业损失的主要原因,每年导致的经济损失已超过2000亿美元[3]。除此之外,一些植物病原真菌也会引起食品安全问题,因为其代谢产生的真菌毒素可损伤人和动物的健康[4]。植物真菌病害已成为最具破坏性的因素之一,其对农业生产的影响不容忽视。迄今为止,控制植物病原真菌最有效的方法是化学杀菌剂,然而传统化学杀菌剂的长期使用不但会导致真菌耐药性的产生,也会引起环境污染和土壤退化等问题[5-6]。因此开发新型抗菌剂就显得十分必要。
氨基甲酸酯(Carbamate)及其衍生物具有较高的化学稳定性和较强的细胞膜渗透能力,在药物化学中占有重要的地位,广泛应用于农用化学品、药物前体和药物中间体[7-8]。在农业生产中,氨基甲酸酯可以用作杀菌剂、除草剂及杀虫剂[8]。目前已有多种氨基甲酸酯类化合物应用于实际生产中,例如苯菌灵(Benomyl)、氯炔灵(Chlorbufam)及速灭威(Metolcarb)等[9]。
目前关于N-芳基氨基甲酸苄酯对植物病原真菌抑制活性的报道较少。为筛选更多高活性抗真菌先导化合物,丰富氨基甲酸酯类化合物的活性研究,本试验通过合成16种N-芳基氨基甲酸苄酯类目标化合物,鉴定目标化合物结构和检测对10种常见植物病原真菌的抑制活性,并对其构效关系进行分析。
1 材料与方法
1.1 供试植物病原菌
10种供试植物病原真菌由西北农林科技大学无公害农药中心提供,分别为:苹果轮纹病原菌(Physalospora piricola)、烟草赤星病原菌(Alternaria alternata)、西瓜枯萎病原菌(Fusarium oxysporium f. sp. Niveum)、水稻稻瘟病原菌(Pyricularia oryza)、马铃薯干腐病原菌(Fusarium solani)、白菜黑斑病原菌(Alternaria brassicae)、小麦赤霉病原菌(Fusariumgraminearum)、苹果腐烂病原菌(Valsa mali)、番茄早疫病原菌(Alternaria solani)、玉米弯孢病原菌(Curvularia lunata)。
1.2 主要仪器与试剂
IKA C-MAG HS7磁力搅拌器、Bruker AVANCE NEO核磁共振仪、SW-CJ-1BC洁净操作台(苏净集团苏州安泰空气技术有限公司)、PRX-4500智能培养箱(宁波赛福实验仪器有限公司)。
合成16种目标化合物的主要试剂(表1),葡萄糖、琼脂、二甲基亚砜(DMSO)、醚菌酯(97%)、四氢呋喃、乙酸乙酯、石油醚、碳酸氢钠、无水硫酸钠,合成目标化合物所用的主要试剂为分析纯,其他试剂为化学纯。
1.3 试验方法
1.3.1 目标化合物的合成 参照Mdeni N L[10]的方法合成所有目标化合物,试剂用量一致。以A1为例,合成步骤如下:
将5 mmol苯胺溶于干燥四氢呋喃中,0 ℃搅拌下加入6 mmol碳酸氢钠,之后缓慢滴加6 mmol氯甲酸苄酯,滴加完毕后,将温度缓慢升至室温。待TLC检测反应完全,用乙酸乙酯萃取(3×30 mL),所得有机相经饱和食盐水洗涤和无水硫酸钠干燥后,减压蒸馏除去溶剂,残余物用硅胶(200~300目)柱层析进行分离纯化,洗脱剂为石油醚-乙酸乙酯(体积比为5∶1)混合液,即可得目标化合物。按公式(1)计算化合物产出率。
产出率=(实际产量/理论产量)×100% (1)
所有目标化合物的结构均通过核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)进行鉴定。
1.3.2 抗真菌活性测定 (1)抗真菌活性初筛 采用菌丝线性生长速率法[11],测试目标化合物对10种供试真菌的体外抑制活性,以市售抗菌药物醚菌酯作为阳性对照。检测方法如下:
将200 g去皮土豆切成1 cm3的小块,加入1 L蒸馏水煮沸20 min,过滤土豆块,保留滤液;将20 g葡萄糖与18 g琼脂加入滤液中,搅拌均匀即得PDA培养基。称取10.0 mg待测目标化合物溶于10 mL5% DMSO中,将配好的药液与190 mL灭菌后的PDA培养基混合均匀,即得带药培养基,浓度为50 μg/mL。之后将直径5 mm的菌饼放置于带药培养基上,置于28 ℃、湿度为80%的环境下黑暗培养约72 h,采用十字交叉法测量菌落直径,并按公式(2)计算菌丝生长抑制率。每种目标化合物及对照对应10种供试真菌,共170个处理,每处理3次重复。
抑制率=(dc-ds)/(dc-d0)×100% (2)
式中,dc—空白对照组菌落平均直径(mm);ds—样品组菌落平均直径(mm);d0—菌落直径(5 mm)。
(2)抗真菌毒力测定 在抗真菌活性初筛的基础上,选取5种对真菌高抑制活性的目标化合物,测定对苹果轮纹病原菌、番茄早疫病原菌的毒力。通过倍半稀释法配制药物浓度为80.00、40.00、20.00、10.00、5.00、2.50、1.25 μg/mL的系列培养基,并测定对应的菌丝生长抑制率,计算5种目标化合物抗真菌的EC50值和95% CI。
1.4 数据处理
采用Excel软件对抗真菌活性检测数据进行数据处理。
抗真菌毒力测定中,以药物浓度的对数值(lgC)为自变量x,该浓度下平均抑制率(0~1)的几率值为因变量y,采用Graphpad Prism 6.0 软件进行线性拟合,得出毒力回归方程y = kx + b,并算出半数有效浓度(EC50)及95%置信区间(95% CI)。
2 结果与分析
2.1 目标化合物合成的产出率、物理性状及核磁数据
合成16种目标化合物的名称、产出率、物理性质及核磁共振氢谱(1H NMR)数据见表2。
合成目标化合物的产出率在82%~99%之间。核磁数据中,由于苄基的存在,所有化合物都存在一个单峰δH ≈ 5.20 ppm(s,2H),为Ph-CH2-O;酰胺键O=C-NH为活泼氢,出现在δH = 6.50~6.80 ppm(s,1H)。
2.2 目标化合物的抗真菌活性
2.2.1 抗真菌活性初筛 由表3可知,所有目标化合物在50 μg/mL时对10种供试真菌均表现出不同程度的抑制作用;B11对9种供试真菌的抑制率均超过80%,对水稻稻瘟病、马铃薯干腐病、苹果腐烂病的病原菌抑制率分别达到了91.8%、98.1%、92.6%,活性优于阳性对照醚菌酯;B1对苹果轮纹病、马铃薯干腐病、小麦赤霉病、番茄早疫病的4种病原菌抑制率达80%以上,A1对苹果轮纹病、小麦赤霉病、番茄早疫病3种病原菌抑制率高于80%,B10对马铃薯干腐病、苹果腐烂病、番茄早疫病的3种病原菌抑制率高于80%。
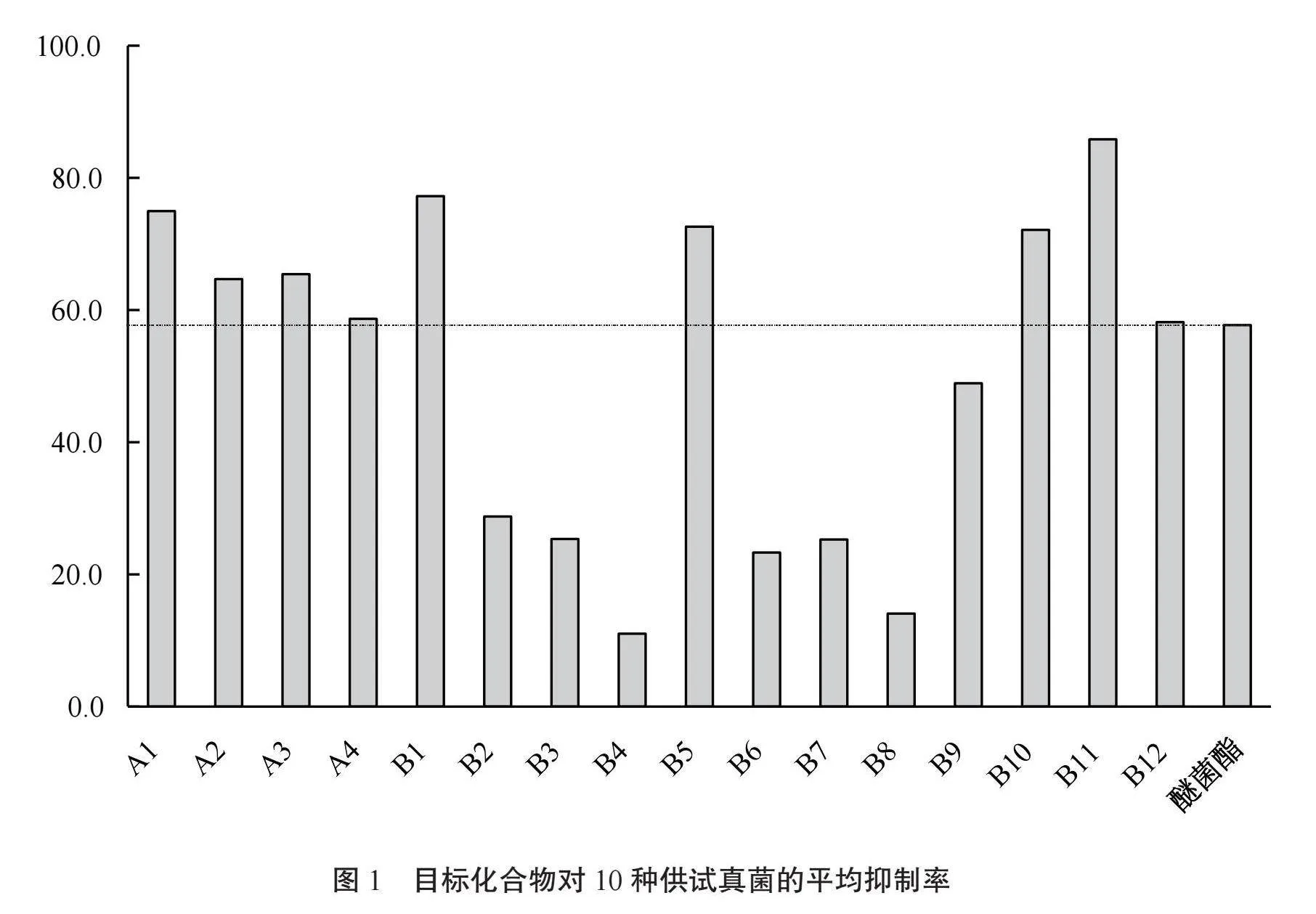
由图1可知,16个目标化合物中,9个化合物的平均抑制率为58.2%~85.8%,高于阳性对照醚菌酯(平均抑制率57.7%);B11表现出最高活性,平均抑制率达85.8%,是醚菌酯的1.5倍;A1、B1、B5和B10的平均抑制率超过了70%。
带有取代基的B系列化合物中,-F(氟原子)和-Me(甲基)的引入可提高化合物(B1、B5)的活性,而其他取代基的引入则会降低化合物(B2~B4、B6~B9)的活性。
10种供试真菌中,番茄早疫病原菌和苹果轮纹病原菌对应的高活性化合物数量较多,可认为是该类化合物的敏感菌株。而烟草赤星病、西瓜枯萎病、水稻稻瘟病、白菜黑斑病和玉米弯孢病5种供试真菌对应的高活性化合物数量较少,总体上敏感度较低。
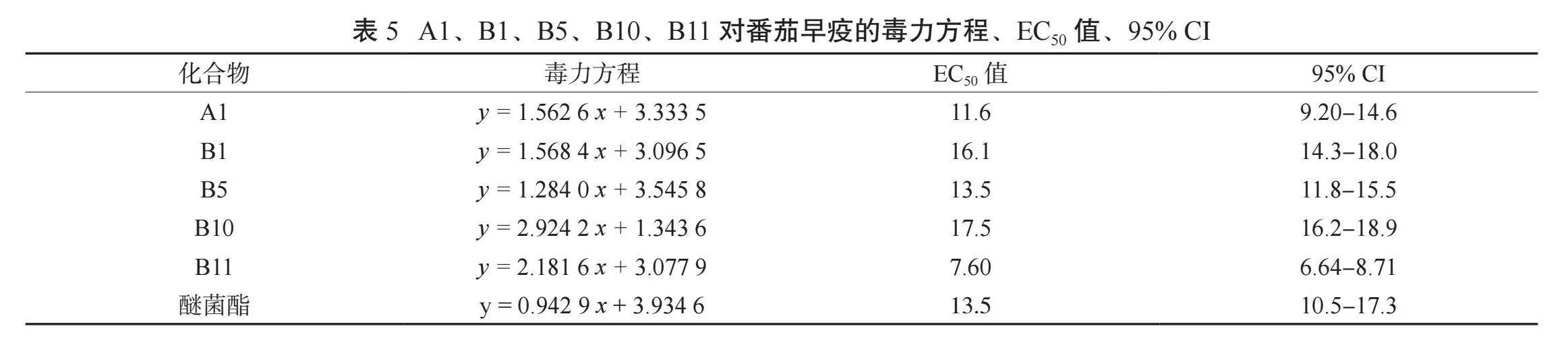
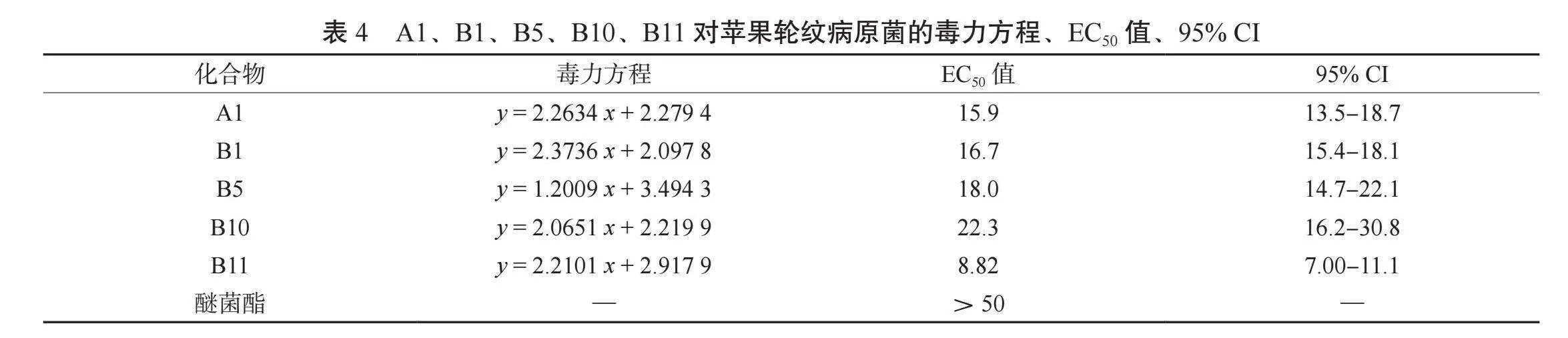
2.2.2 5种高抗菌活性目标化合物的抗真菌毒力 由表4、表5可知,高活性化合物A1、B1、B5、B10、B11对苹果轮纹病原菌的抑制活性均高于阳性对照,其EC50值在8.82~22.3 μg/mL范围内,均小于醚菌酯(EC50>50 μg/mL);B5对番茄早疫病原菌的EC50值与阳性对照相同,A1、B11低于阳性对照,B1、B10高于阳性对照。
3 结论
试验设计合成16种N-芳基氨基甲酸苄酯类化合物,并通过NMR验证了结构。体外抗真菌活性测定发现5种高活性化合物,N-(3,5-二氟苯基)氨基甲酸苄酯(B11)的活性最高,可作为抗真菌药物候选分子。活性数据分析得到如下结论:(1)酰胺键与苯环之间的桥链长度与化合物活性紧密相关。当酰胺键与苯环直接相连时,化合物的活性总体较高(A1 vs A2~A4);(2)取代基的引入影响化合物的结构。与其他取代基相比,-F和-Me的引入有利于提高活性,属于优势基团(A1 vs B1~B9);(3)-F和-Me的组合可大幅度提高活性,是优势基团叠加效应的结果(B10~B12)。以上研究结果可为氨基甲酸酯类抗真菌药物的研发提供参考。
参考文献:
[1] JAIN A,SARSAIYA S,WU Q,et al. A review of plant leaf fungal diseases and its environment speciation[J]. Bioengineered, 2019, 10(1):409-424.
[2] ZHOU Y,YANG C J,LUO X F, et al. Design, synthesis,and biological evaluation of novel Berberine derivatives against phytopathogenic fungi[J]. Pest Management Science,2022,78(10):4361-4376.
[3] YIN X D,MA K Y,WANG Y L,et al. Design,synthesis,and antifungal evaluation of 8-Hydroxyquinoline metal complexes against phytopathogenic fungi[J]. Journal of Agricultural and Food Chemistry,2020,68(40):11096-11104.
[4] YANG S S,LV Q Y,FU J,et al. New 7-Chloro-9-methyl-2-phenyl-3,4-dihydro-β-carbolin-2-iums as promising fungicide candidates: design,synthesis,and bioactivity[J]. Journal of Agricultural and Food Chemistry, 2022,70(14):4256-4266.
[5] CHEN Y J,MA K Y,DU S S,et al. Antifungal exploration of quinoline derivatives against phytopathogenic fungi inspired by quinine alkaloids[J]. Journal of Agricultural and Food Chemistry,2021,69(41):12156-12170.
[6] YANG C J,LI H X,WANG J R,et al. Design,synthesis and biological evaluation of novel evodiamine and rutaecarpine derivatives against phytopathogenic fungi[J]. European Journal of Medicinal Chemistry,2022, 227:113937.
[7] 张晓鹏,梁冰洁,裴莹莹,等. 氨基甲酸酯类化合物的合成进
展[J]. 化学通报,2010,73(10):886-891.
[8] 张福豪. 含氨基甲酸酯/羧酸酯基的取代嘧啶甲酰胺的合成及杀菌活性研究[D].山东: 山东农业大学,2022.
[9] MALHOTRA H,KAUR S,PHALE P S. Conserved metabolic and evolutionary themes in microbial degradation of carbamate pesticides[J]. Frontiers in Microbiology, 2021,12: 648868.
[10] MDENI N L,ADENIJI A O,OKOH A I,et al. Analytical evaluation of carbamate and organophosphate pesticides in human and environmental matrices: a review[J]. Molecules (Basel, Switzerland),2022,27(3):618.
[11] TRAN V H,KIM H K. CaI2-Catalyzed direct transformation of N-Alloc-,N-Troc-,and N-Cbz-protected amines to asymmetrical ureas[J]. New Journal of Chemistry,2019,43(35):14093-14101.
[12] ZHANG Y H,YANG S S,ZHANG Q,et al. Discovery of N-phenylpropiolamide as a novel succinate dehydrogenase inhibitor scaffold with broad-spectrum antifungal activity on phytopathogenic fungi[J]. Journal of Agricultural and Food Chemistry,2023,71(8):3681-3693.
(责任编辑:谢培庚)
