托珠单抗治疗急性淋巴细胞白血病化疗后白细胞介素-6增高介导的门冬酰胺酶相关重症急性胰腺炎1例
2024-11-11杜振兰王娅陈鹏陈伟司英健窦凌松邢国胜


【摘要】目的 探讨托珠单抗(TCZ)治疗急性淋巴细胞白血病(ALL)化疗后白细胞介素-6(IL-6)增高介导的门冬酰胺酶相关重症急性胰腺炎(SAP)的安全性与有效性。方法 分析1例16岁男性ALL患者化疗后白细胞介素-6(IL-6)增高介导的SAP诊疗过程,患者临床表现为剧烈腹痛、高热、多浆膜腔积液(胸腔、腹腔、心包),淀粉酶、尿淀粉酶和IL-6水平明显增高,影像学检查可见胰头水肿、胰体增大、胰尾处大量渗出,按常规重症胰腺炎治疗联合TCZ治疗,并观察患者预后情况。结果 患者SAP后出现全身炎症反应综合征(SIRS)致多脏器损伤。按常规重症胰腺炎治疗联合TCZ治疗,患者IL-6水平快速下降,体温正常,浆膜腔积液快速吸收,心、肺压迫症状明显缓解,淀粉酶、尿淀粉酶水平明显下降,SIRS反应和其他脏器继发损伤程度减轻。结论 ALL治疗时使用培门冬酰胺酶是发生SAP的高危因素,化疗后粒细胞缺乏期感染增大SAP的危险性及治疗难度。TCZ可有效阻断IL-6介导的炎性反应、减轻脏器损害,改善患者预后、缩短病程,在ALL化疗后继发的SAP治疗中安全有效。
【关键词】托珠单抗;急性淋巴细胞白血病;门冬酰胺酶;重症急性胰腺炎
【中图分类号】R725.5 【文献标识码】A 【文章编号】2096-2665.2024.21.0121.04
DOI:10.3969/j.issn.2096-2665.2024.21.037
L-门冬酰胺酶(L-ASP)是一种大肠杆菌衍生的酶,能催化必需氨基酸天冬酰胺分解成天冬氨酸和氨。一项对白血病细胞内L-ASP活性的研究发现,其抗肿瘤作用是通过消耗肿瘤细胞的必需氨基酸天冬酰胺产生的,肿瘤细胞转录过程中因缺乏天冬酰胺合成酶而无法合成天冬酰胺,使DNA、 RNA和蛋白质合成受损,导致白血病细胞凋亡[1-2]。聚乙酰胺化形式的L-天冬酰胺酶(PEG-ASP)是左旋门冬酰胺酶与聚乙二醇(PEG)5 000的共轭聚合物,是一种新型的长效门冬酰胺酶类的抗肿瘤药,是儿童急性淋巴细胞白血病(acute lymphocytic leukemia , ALL)常用治疗方案[3-4]。相关研究表明,虽然增加PEG-ASP的ALL治疗方案可改善患者的预后,但会引发与PEG-ASP相关的独特不良反应,包括肝毒性、高胆红素血症、高甘油三脂血症、高血糖症、高血氨症、过敏反应、静脉血栓、凝血异常、胰腺炎等[5-6]。相关研究报道,儿童ALL中PEG-ASP相关性胰腺炎发生率为11%~18%,成人的发病率约14%[4,7-8]。急性淋巴细胞白血病的化疗过程损伤肿瘤组织的过程中也会损伤正常组织,激活免疫系统,进而促使免疫细胞分泌白细胞介素- 6(IL-6)等细胞因子;肿瘤组织的代谢产物或死亡裂解后释放的物质会促进IL-6水平的升高。过量的IL-6会导致胰腺细胞发生凋亡、坏死,增加血管的通透性,导致胰腺水肿、出血和坏死,其还可激活其他炎症细胞释放炎性介质(如肿瘤坏死因子-α、白细胞介素- 1、血小板活化因子),形成炎症级联反应,进一步加重胰腺损伤,进而导致患者发生门冬
酰胺酶相关重症急性胰腺炎(severe acute pancreatitis,SAP)。现报道中国人民解放军总医院第七医学中心1例使用PEG-ASP后发生SAP的患者,在治疗过程中发现患者IL-6水平明显增高,使用托珠单抗(TCZ)进行联合治疗后,有效缩短SAP疗程,效果较好。
1 资料与方法
1.1 病例资料 男性患者, 16岁,无既往病史,因双下肢剧烈疼痛于2020年9月在中国人民解放军总医院第七医学中心就诊,行双腿X线片检查,结果未见异常。经血常规、骨髓细胞形态学、免疫学、细胞遗传学、分子生物学分型检查明确诊断为ALL(B细胞型,高危)。头颅MRI及脑脊液免疫残留检查未见异常。予VDLD方案(柔红霉素+长春新碱+PEG-ASP+地塞米松)诱导化疗,疗程中共使用2次PEG-ASP(江苏恒瑞医药股份有限公司,国药准字H20090015,规格:5 mL∶3 750 IU),化疗过程中予低糖低脂饮食,并每周监测血常规及生化指标
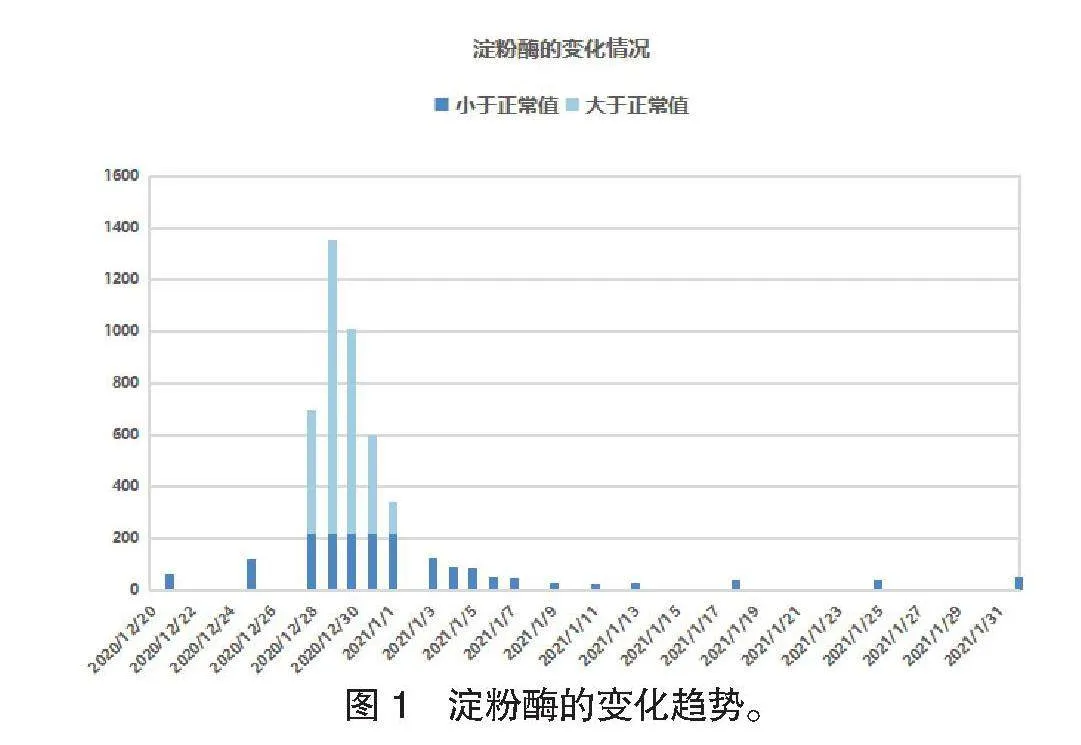
3次,结果均显示各脏器功能正常。患儿于化疗第29天出现左肾区疼痛,行肝胆胰脾超声、双肾输尿管超声检查未见异常,后自行缓解。第2天晨起再次主诉左侧腰部疼痛,肾区疼痛明显,伴有左肋下放射痛;腹部CT提示胰腺周边欠光滑可见少量渗出;生化指标检查结果:淀粉酶升至1 354 U/L(参考值25~125 U/L),提示起病时淀粉酶水平快速升高,且升高幅度明显,远大于参考值上限,见图1;超声检查结果:肝实质密度减低,不排除肝损伤,胃及腹部肠腔内容物多,胰腺后方、脾下方脂肪密度增高,伴条索影,考虑渗出性改变。结合临床症状及影像学、血液学检查结果,明确诊断为SAP。
1.2 诊断标准 SAP的诊断标准:符合以下特征指标中至少2项,且符合急性胰腺炎中重度的诊断标准。特征:⑴腹痛症状;⑵淀粉酶水平高出参考值上限3倍;⑶CT、核磁共振或腹部超声提示急性胰腺炎表现;⑷最后1次注射PEG-ASP后4周内发病[5]。急性胰腺炎严重程度:轻度为无器官衰竭及局部或全身并发症,通常1周可痊愈;中度为短暂的器官衰竭(<48 h)或存在局部或全身并发症;重度为器官衰竭持续时间>48 h,局部并发症包括胰周液积聚、胰腺和胰周坏死、假性囊肿和包裹性坏死[9]。
1.3 治疗方法 因患儿处于化疗后骨髓抑制期,确诊SAP当天血常规显示:白细胞0.46×109/L, 血红蛋白浓度86 g/L,血小板32×109/L。患者体温最高39.2 ℃。予亚胺培南、西司他汀、万古霉素、伏立康唑联合抗感染治疗后,患儿出现进行性呼吸困难、心率增快。胸腔超声示:双侧胸腔中见无回声区,右侧深约13.1 cm,距体表约1.8 cm;左侧深约9.8 cm,距体表约2.5 cm。行胸腔穿刺引流,引流量1 000~1 200 mL/d,为深褐色水样液体。体液检查示:体液白细胞248×106/L,体液单个核细胞25.8%,体液多个核细胞74.2%,李凡他试验(-),体液培养结果(-)。生化检查提示轻度肝功能异常及黄疸。血细胞因子检查结果: IL-6水平明显增高,最高
7 844.77 ng/L(参考值0.37~0.46 ng/L),考虑存在细胞因子释放综合征。为抑制剧烈炎症反应,予托珠单抗注射液阻断炎性链式反应, IL-6水平快速下降,见图2。转氨酶和总胆红素较治疗前下降,但谷丙转氨酶因药物因素再次上升,见图3;肌酐、尿素氮逐渐下降至正常,见
图4。按重症胰腺炎治疗,同时予以抗感染、促进造血干细胞功能恢复、抑制炎症反应联合对症治疗后患者腹痛明显缓解,浆膜腔积液吸收,脏器功能逐渐恢复。病情恢复后为患者行空肠管留置术进行肠内营养,避免刺激胰腺,经4个月空肠管肠内营养治疗后改为经口进食。现患者化疗结束2年,症状完全缓解。
2 讨论
本病例显示青少年ALL患者在使用PEG-ASP化疗后4周内出现重症胰腺炎,伴有多浆膜腔积液、骨髓抑制、多脏器功能损害等并发症。由此可见门冬酰胺酶类诱发的胰腺炎起病急、进展快,可能导致多脏器损伤,危及患者生命。
多项临床研究结果显示,儿童ALL治疗方案中使用PEG-ASP可提高ALL儿童的生存率[3-9]。但会增加相关并发症,且儿童与成人患者在使用PEG-ASP时并发症发生率存在差异[10-11]。不同的并发症需给予相应的治疗建议,
见表1。
目前, SAP的发病机制尚未明确。 1988年Rinderknecht提出的胰腺炎发病的“白细胞过度激活”学说和后来的“第二次打击”理论(即炎症因子的产生及其级联“瀑布”效应),认为急性胰腺炎是由多重因素导致的胰腺泡细胞损伤,损伤的细胞释放活性胰酶,激活单核巨噬细胞和中性粒细胞,释放大量细胞因子,肠道菌群易位导致内毒素血症,并再次激活巨噬细胞、中性粒细胞,再次释放大量炎性因子,导致全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[12-13]。SIRS是机体应对感染、创伤、烧伤、手术以及缺血-再灌注等感染性或非感染性因素的严重损伤所产生的全身性的非特异性炎症反应,最终导致机体对炎症反应失控所表现的一组临床症状。与这一病理过程密切相关,IL-6水平增高程度是胰腺炎严重程度和预后的重要指标。
IL-6主要由两类细胞产生,一类是免疫细胞,包括单核细胞、中性粒细胞及T、B、NK淋巴细胞;另一类是其他细胞,包括角质细胞、纤维细胞、内皮细胞及肌细胞等。IL-6增高程度是胰腺炎严重程度和预后的重要指标,其比快速C反应蛋白、降钙素原反应更灵敏,约在诱因出现3 h后开始升高[14-18]。一项选择27个研究进行Meta分析的报道(包括896例轻度急性胰腺炎、700例重度急性胰腺炎及312例健康对照)发现,IL-6水平可作为判断胰腺病变及炎症反应程度的有效指标,IL-6水平与胰腺炎的严重程度密切相关[19]。一项胰腺炎介导的急性肺损伤的小鼠模型试验中发现,与野生型急性胰腺炎小鼠相比,IL-6缺陷小鼠的死亡率较低,而注射IL-6的小鼠更有可能发展成急性肺损伤[20]。炎症相关的核因子κB能诱导髓细胞分泌IL-6,IL-6与可溶性IL-6受体进行络合,这个过程被称为反式信号转导。IL-6反转录信号刺激胰腺腺泡细胞中信号转导及转录激活因子3的磷酸化和中性粒细胞吸引物趋化因子配体1的产生,IL-6联合可溶性IL-6受体的表达是SAP和SAP介导的急性肺损伤的可靠预测因子[21-22]。由此可见IL-6水平升高会增加急性胰腺炎的发生风险,进而导致脏器发生损害。
TCE是竞争性抑制IL-6受体的单克隆抗体,可有效阻断由B、T细胞活化介导的炎症反应的信号转导通路受体,从而抑制炎性因子分泌[23]。因此,近年来,TCE作为IL-6抑制剂在自身免疫性疾病、炎症性疾病中的应用较为广泛[24]。现在有学者尝试使用托珠单抗治疗重症胰腺炎导致的全身炎症反应综合征。有研究报道了1例38岁男性胰腺炎患者因感染冠状病毒病致重症胰腺炎,后经使用托珠单抗后病情好转,冠状病毒病核酸转阴,随访3个月胸腔积液、腹腔积液完全消失[25]。有研究发现,2 mg/kg的TCE对重症胰腺炎小鼠血清学指标及组织学指标的改善最有效,给药后小鼠血清趋化因子配体1下调,胰腺核因子κB、信号转导因子和转录激活因子3失活,从而抑制胰腺炎介导的炎症反应,改善胰腺炎导致的其他脏器免疫损伤[26]。而另1项研究表明,在急性胰腺炎小鼠模型中,认为TCE是治疗胰腺炎的有效药物,且8 mg/kg比4 mg/kg组更利于急性胰腺炎的治疗[27]。
目前,临床对于TCE治疗急性重症胰腺炎的报道并不多见,部分基础研究发现TCE对于急性胰腺炎导致的
SIRS有改善作用,但TCE的副作用可能提高胰腺分泌功能。在本例病例中,使用TCE后患者治疗效果较好,并未见到明显的TCE相关不良反应,且患者快速度过脏器损伤期,白细胞水平快速恢复,未发生严重感染等继发不良反应,提示在部分IL-6明显增高的继发性胰腺炎中,TCE是有效的、安全的治疗药物。
参考文献
TAHIRA B, ESSAM A M, MUNA J, et al. A comprehensive review on L-asparaginase and its applications a comprehensive review on l-asparaginase and its applications[J]. Appl Biochem Biotechnol , 2016, 178(5): 900-923.
SUSAN L K, SUZANNE E D, DONNA E L, et al. Clinical course and outcome in children with acute lymphoblastic leukemia and asparaginase-associated pancreatitis[J]. Pediatr Blood Cancer, 2009, 53(2): 162–167.
CECILUE U R, BENJAMIN O W, KATHRINE G, et al. Asparaginase-associated pancreatitis in acute lymphoblastic leukemia: Results from the NOPHO all 2008 treatment of patients 1~45 years of age[J]. J Clin Oncol, 2020, 38(2): 145-154.
WENDY S, SELINA M L, ANIJALI S A , et al. A pediatric regimen for older adolescents and young adults with acute lymphoblastic leukemia: Results of CALGB 10403[J]. Blood, 2019, 133(14): 1548-1559.
KRISHNA R J, CHLOE S, RYAN D C. Asparaginase in the treatment of acute lymphoblastic leukemia in adults: Current evidence and place in therapy[J]. Blood Lymphat Cancer, 2022, 30(12): 55-79.
YOUNG A H, YAHIYA Y S, SUSAN J K. Pegaspargase: A review in acute lymphoblastic leukaemia[J]. Drugs, 2019, 79(7): 767-777.
WOLTHERS B O, FRANDSEN T L, ABRAHAMSSON J, et al. Asparaginase-associated pancreatitis: A study on phenotype and genotype in the NOPHO ALL 2008 protocol[J]. Leukemia, 2017, 31(2): 325-332.
LIU C, YANG W, DEVIDAS M, et al. Clinical and genetic risk factors for acute pancreatitis in patients with acute lymphoblastic leukemia[J]. J Clin Oncol, 2016, 34(18): 2133-2140.
李云,钟文,杨帆,等. 儿童门冬酰胺酶相关胰腺炎的临床特点及风险因素分析[J].实用临床医药杂志 ,2022,26(12):65-68.
TODD W M J, ASHLEY D F, MARK G, et al. Case report: Hyperosmolar hyperglycemic syndrome secondary to PEG-asparaginase-induced hypertriglyceridemia and pancreatitis[J]. Front Oncol, 2023, 19(12): 1094964.
KJELD S, ANDISHE A, SHLOMIT B, et al. Consensus definitions of 14 severe acute toxic effects for childhood lymphoblastic leukaemia treatment: A delphi consensus[J]. Lancet Oncol, 2016, 17(6): e231–e239.
626fd3beb62cd61abcbc02a809bd1289XU P, LOU X L, CHEN C. Apoptotic mechanisms of peroxisome proliferator-activated receptor-γ activation in acinar cells during acute pancreatitis[J]. Pancreas, 2016, 45(2): 179-186.
MATTHIAS S, FRANK U W, JANNINE G, et al. Cathepsin B-mediated activation of trypsinogen in endocytosing macrophages increases severity of pancreatitis in mice[J]. Gastroenterology, 2018, 154(3): 704-718, e10.
MARIOLA S M, GRZEGORZ M, ZYGMUNT G, et al. Relationship between somatostatin and interleukin-6: A cross-sectional study in patients with acute pancreatitis[J]. Pancreatology, 2018, 18(8): 885-891.
GARIPATI S, PRAMOD K G, HK P, et al. Elevated level of interleukin-6 predicts organ failure and severe disease in patients with acute pancreatitis[J]. J Gastroenterol Hepatol, 2007, 22(4): 550-554.
GOU N,YAN C J,ZHANG G C. Changes of serum procalcitonin (PCT), C-reactive protein (CRP), interleukin-17 (IL-17), interleukin-6 (IL-6), high mobility group protein-B1 (HMGB1) and D-dimer in patients with severe acute pancreatitis treated with continuous renal replacement therapy (CRRT) and its clinical significance[J]. Med Sci Monit, 2018, 24: 5881-5886.
GAO J W, ZHANG A Q, PAN W, et al. Association between IL-6-174G/C polymorphism and the risk of sepsis and mortality: A systematic review and meta-analysis[J]. PLoS One, 2015, 10(3): e0118843.
CHRISTOPHER A H, SIMON A J. IL-6 as a keystone cytokine in health and disease[J]. Nature Immunology, 2015, 16(5): 448–457.
LI N, WANG B M, CAI S, et al. The role of serum high mobility group box 1 and interleukin-6 levels in acute pancreatitis: a meta-analysis[J]. J Cell Biochem, 2018, 119(1): 616-624.
ZHANG H, PATRICK N, SONG L, et al. IL-6 trans-signaling promotes pancreatitis-associated lung injury and lethality[J]. J Clin Invest, 2013, 123(3): 1019-1031.
ZHOU Y G, FU B Q, ZHENG X H, et al. Aberrant pathogenic GM-CSF+T cells and inflammatory CD14+CD16+ monocytes in severe pulmonary syndrome patients of a new coronavirus[J]. BioRxiv, 2020, 20: 945576.
熊慧敏,许小凡,段丽芳,等.白细胞介素-6在胰腺炎症和肿瘤中的作用机制研究进展[J].新乡医学院学报, 2019, 36(12): 1191-1196.
SEBBA A. Tocilizumab: The first interleukin-6-receptor inhibitor[J]. Am J Health Syst Pharm, 2008, 65(15): 1413-1418.
ROBERT Q L, LO L, YUAN W T, et al. FDA approval summary: Tocilizumab for treatment of chimeric antigen receptor T cell-induced severe or life-threatening cytokine release syndrome[J]. Oncologist, 2018, 23(8): 943-947.
PIOTR Z, MAGDALENA K, MARIUSZ F, et al. Effective treatment of severe acute pancreatitis and COV44554e04d4ac5d1ba6f2cb4aaebd9c3af581c96dd93449ea178cff93f0fbb224ID-19 pneumonia with tocilizumab [J]. Prz Gastroenterol, 2020, 15(3): 267-272.
CHEN K L, LV Z Y, YANG H W, et al. Effects of tocilizumab on experimental severe acute pancreatitis and associated acute lung injury[J]. Crit Care Med, 2016, 44(8): e664-677.
YUSUF H, MUSTAFA K, ALPASLAN T, et al. Efficacy of tocilizumab treatment in cerulein-induced experimental acute pancreatitis model in rats[J]. Turk J Gastroenterol, 2017, 28(6): 485-491.
1基金项目:吴阶平基金会临床科研专项资助基金(编号:320.6750.20-11-30)
作者简介:杜振兰,博士研究生,副主任医师,研究方向:儿童血液病的诊疗及异基因造血干细胞移植。
通信作者:陈鹏,博士研究生,副主任医师,研究方向:良恶性血液病及异基因造血干细胞移植后病毒感染的诊疗。E-mail:chenp 1@163.com
