Caspase-3的调控因素及其对宰后肌肉嫩化影响的研究进展
2024-11-11吴佳琪熊欣罗永康

摘 要:细胞凋亡是细胞自我破坏的程序性死亡过程,是动物宰后早期肌肉细胞必须经历的过程。研究发现,凋亡与宰后肌肉嫩化或软化过程具有高度相关性,其关键执行蛋白酶Caspase-3通过线粒体凋亡途径在肉嫩化过程中起到重要作用。Caspase-3的激活导致关键蛋白质的降解,从而使肌肉纤维结构松散,增加肉的嫩度。因此,本文从2 个方面对Caspase-3与肉类品质存在的关联机制进行论述:一方面是Caspase-3的活性调控机理;另一方面是Caspase-3参与关键肌原纤维蛋白降解的过程。通过总结由线粒体凋亡途径激活的Caspase-3对肉类品质的影响,以期实现对肉类品质的精确控制。
关键词:Caspase-3;线粒体凋亡;宰后嫩化;调控因素;凋亡因子
Research Progress on the Regulatory Factors of Caspase-3 and Its Impact on Postmortem Muscle Tenderization
WU Jiaqi, XIONG Xin, LUO Yongkang*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract: Apoptosis, or programmed cell death, is the process of cellular self-destruction, which muscle cells must undergo early after animal slaughter. Studies have found that apoptosis is highly correlated with the process of muscle tenderization or softening postmortem. The key executioner protease, caspase-3, plays an important role in meat tenderization through the mitochondrial apoptosis pathway. Activation of caspase-3 leads to the degradation of key proteins, thereby loosening muscle fiber structure and increasing meat tenderness. This paper discusses the mechanisms of the association between caspase-3 and meat quality from two aspects: the regulatory mechanisms of caspase-3 activity, and the involvement of caspase-3 in the degradation process of myofibrillar proteins. It also summarizes the impact of activation of caspase-3 by the mitochondrial apoptosis pathway on meat quality, aiming to help achieve precise control over meat quality.
Keywords: caspase-3; mitochondrial apoptosis; postmortem tenderization; regulatory factors; apoptotic factors
DOI:10.7506/rlyj1001-8123-20240702-170
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2024)10-0059-07
引文格式:吴佳琪, 熊欣, 罗永康. Caspase-3的调控因素及其对宰后肌肉嫩化影响的研究进展[J]. 肉类研究, 2024, 38(10): 59-65. DOI:10.7506/rlyj1001-8123-20240702-170. http://www.rlyj.net.cn
WU Jiaqi, XIONG Xin, LUO Yongkang. Research progress on the regulatory factors of caspase-3 and its impact on postmortem muscle tenderization[J]. Meat Research, 2024, 38(10): 59-65. DOI:10.7506/rlyj1001-8123-20240702-170. http://www.rlyj.net.cn
我国肉类资源丰富、品种多样,是动物蛋白的重要来源,同时提供铁、硒、VA、VB12和叶酸等重要微量营养素[1]。
随着经济的快速发展,消费者对肉品品质的需求不断增加。在众多评价指标中,消费者对肉类(尤其是禽畜类产品)的嫩度、多汁性、风味和整体适口性最为关注。其中,嫩度被认为是最重要的,直接影响消费者的购买意愿[2]。
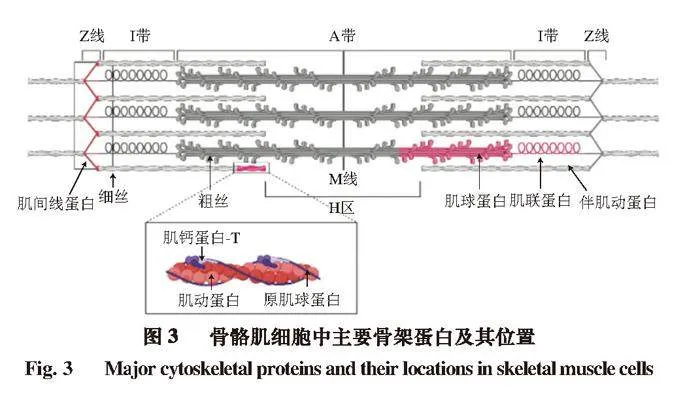
肉的嫩度与动物在宰后贮藏过程中关键细胞骨架蛋白如肌间线蛋白、肌钙蛋白-T、伴肌动蛋白和肌联蛋白的完整程度密切相关[3]。这些蛋白质在维持肌肉纤维结构和肌肉收缩功能中起着至关重要的作用,在宰后贮藏过程中,这些关键蛋白质部分降解,导致肌肉纤维松散,肉质变得嫩滑[4]。
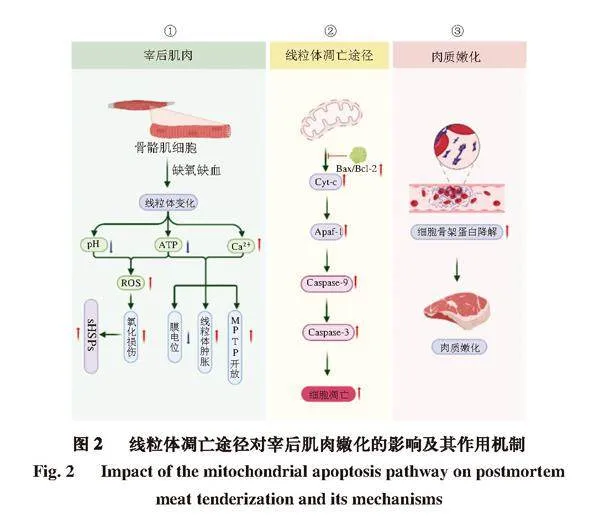
在肉类的贮藏过程中,蛋白质的完整程度主要涉及到复杂的多酶过程。研究人员认为与肉类嫩度相关的蛋白水解酶系统主要有4 种:钙蛋白酶、组织蛋白酶、蛋白酶体和Caspase[5]。Sentandreu等[6]提出Caspase可能在肉的嫩化过程中存在潜在贡献。细胞凋亡主要以内质网信号途径、线粒体凋亡途径和死亡受体途径这3 种途径发生[7]。由于宰后初期细胞处于缺血缺氧状态,细胞能量代谢受阻,乳酸堆积,导致细胞内环境酸化。酸化和钙离子内流增加引起线粒体功能受损,产生过量活性氧自由基(reactive oxygen species,ROS),进一步破坏细胞膜的完整性,这些变化共同作用,符合触发线粒体途径诱导肌肉细胞凋亡的条件[8]。因此在肉制品领域,线粒体凋亡途径对蛋白分解的作用被广泛关注。线粒体凋亡途径在宰后肌肉转化过程中发挥重要作用。凋亡途径激活Caspase-3,这种酶被认为是细胞凋亡的主要执行者,通过切割多种细胞骨架和结构蛋白,导致肌肉细胞的程序性死亡和分解[9]。
尽管Caspase-3在细胞凋亡中的作用已被广泛研究,但其在肉嫩化过程中的具体作用机制仍存在争议。一些研究[10]表明,Caspase-3通过切割肌间线蛋白、肌钙蛋白-T等关键蛋白质,导致肌肉纤维结构松散,从而增加肉的嫩度。然而有研究人员[11]认为,Caspase-3并不能直接作用于宰后肉类的肌原纤维蛋白。因此Caspase-3活性的具体调控机制及其在不同肉类中的作用差异尚需进一步探讨。本文阐述线粒体凋亡通路在宰后肉嫩化中的作用机理,综述并分析宰后肌肉中Caspase-3活性的影响因素及其对蛋白质的降解。通过蛋白质水解途径及影响肉嫩度相关机制的视角,总结Caspase-3在宰后肌肉中的重要作用,以更好地理解和控制肉品品质。
1 线粒体凋亡通路
细胞凋亡是组织程序化的细胞死亡,其特征是细胞收缩、线粒体去极化、细胞核形状改变、染色质凝聚、DNA片段化及细胞骨架蛋白的广泛降解[12]。与细胞坏死不同的是,质膜在凋亡过程中没有被完全破坏,可防止细胞成分放电,从而避免对邻近细胞造成损伤[13]。
在Caspase介导的细胞凋亡中,有3 个主要的激活途径:Caspase-12介导的内质网信号途径、细胞色素c(cytochrome c,Cyt-c)释放和Caspase-3激活相关的线粒体凋亡途径(内源性)及Caspase-8、Caspase-10介导的死亡受体途径(外源性)[14]。其中线粒体凋亡途径被认为是一种经典的凋亡途径,并且在死后骨骼肌细胞中最为常见[15]。
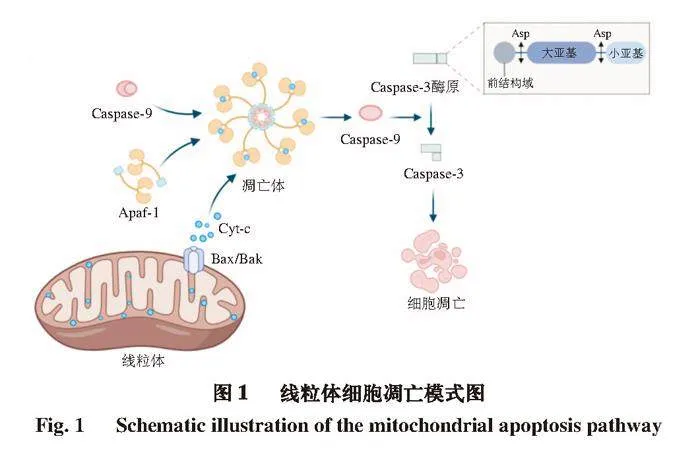
线粒体凋亡途径是一个协调、复杂且依赖于能量的过程(图1)。线粒体包括基质(内膜以内)和膜间隙(内膜与外膜之间)2 个区域,在线粒体凋亡途径中,线粒体受到内部凋亡信号的影响,改变了线粒体外膜的通透性,线粒体膜通透性过渡孔(mitochondrial permeability transition pore,MPTP)打开,释放处于膜间隙中的凋亡因子Cyt-c。当Cyt-c被释放到细胞质中就会与凋亡蛋白激活因子-1(apoptotic protease activating factor-1,Apaf-1)和dATP结合,诱导形成寡聚复合物,该复合物招募Caspase-9酶原,并切割活化。被激活的Caspase-9进一步激活下游的凋亡效应酶Caspase-3,启动凋亡级联反应[16]。
所有Caspase均具有高度保守的结构,其中Caspase-3酶原是线粒体凋亡途径中的关键酶原,具有1 个稳定的二聚体结构,它由1 个N端前结构域、1 个大亚基和1 个小亚基组成[17]。Caspase-3酶原必须通过启动Caspase裂解连接单元,分离其催化结构域的大亚基和小亚基,从而去除前结构域来激活[18]。Du Jie等[19]报道,在大鼠骨骼肌中,Caspase-3以其无活性的酶原(42 kDa)形式存在,激活后被切割成特征性的14 kDa活性片段参与蛋白水解。也有研究[20]报道称,在宰后牛最长肌中,35 kDa的Caspase-3酶原被切割成2 个活性片段(17~23 kDa)。猪骨骼肌中Caspasre-3酶原为32 kDa,激活后产生17~20 kDa和11 kDa的活性片段[21]。活性Caspase-3可通过水解特定底物蛋白在肉的嫩化中发挥作用。
2 调控Caspase-3的因素
2.1 细胞内环境因素
动物骨骼肌细胞中Caspase-3的激活依赖于细胞内环境的条件。动物死后呼吸和血液循环停止,供给肌肉的氧气中断,细胞内的有氧呼吸转化为厌氧糖酵解[22]。在缺氧条件的诱导下,糖酵解代谢开启,使葡萄糖和ATP水平下降,乳酸水平增加,导致pH值降低[23]。有研究[24]
表明,细胞质酸化是线粒体凋亡途径中调控Caspase-3活化的早期事件。李文东等[25]对牦牛背最长肌进行快速冷冻处理,发现牦牛肉pH值的下降速率减缓,导致Caspase-3在宰后前期的活力被抑制。Ma Jibing等[26]报道,死后公牛胸最长肌pH值的快速下降增强了Caspase-3的激活和线粒体细胞凋亡。因此,动物宰后肉中pH值的快速下降可能会导致线粒体的完整度下降,对Caspase-3的激活产生一定的影响。
由于死后肌肉细胞中ATP的供应减少和pH值的下降,正常的氧化还原系统被打破,抗氧化酶活性下降,导致ROS的产生和积累。线粒体既是细胞中ROS的主要来源,又是ROS的主要靶点。线粒体活性氧的过量积累会对线粒体凋亡产生影响[27]。同时ROS可以攻击线粒体膜上的多不饱和脂肪酸,产生丙二醛等脂质过氧化物,导致线粒体肿胀和破坏,受损的线粒体恶性循环,产生更多的ROS,进而介导线粒体凋亡途径的发生[15]。Ding Zhenjiang等[28]在H2O2处理的牛肌肉(胸最长肌)中检测到比未处理组更多的17 kDa Caspase-3活性片段,表明ROS诱导的氧化应激可以增加Caspase-3的活性。
虽然ROS不直接影响MPTP的形成,但ROS诱导的线粒体氧化应激反应诱导细胞质中的钙离子流入线粒体增加,钙水平升高可导致线粒体膨胀和钙离子超载,钙离子的超载也进一步促进ROS的产生,两者共同作用导致MPTP的开放和线粒体膜电位的去极化[29]。Huang Feng等[16]在用钙离子处理的牛骨骼肌中检测到Caspase-3酶原水平的显著下降和Cyt-c水平的显著上升,表明钙离子的增加促进了MPTP的开放,使Cyt-c被释放,激活Caspase凋亡级联反应。
2.2 凋亡因子
众多研究表明细胞内环境因素的改变(如ATP水平、pH值、ROS和钙离子等的变化)对MPTP的开放和线粒体膜电位去极化的调控产生影响,线粒体功能障碍是细胞凋亡的前兆。除了内环境的影响外,一些凋亡因子在细胞凋亡过程中发挥的重要作用也受到广泛关注。
普遍认为Cyt-c从线粒体释放到细胞质中的过程是启动Caspase级联反应的第1步,也是决定性步骤。Cyt-c进入细胞质后,和dATP、Apaf-1结合形成凋亡小体,可以激活Caspase-9酶原,随后启动Caspase凋亡级联反应。关于Cyt-c释放,目前普遍认为MPTP的打开、线粒体膜电位的去极化为Cyt-c的释放提供了优良的通道[30]。
Cyt-c的释放和线粒体膜电位由B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)家族蛋白控制,Bcl-2家族蛋白可以将凋亡刺激和线粒体膜通透性偶联,控制线粒体膜间隙中蛋白的释放,以启动Caspase级联反应[31]。Bcl-2家族是细胞凋亡的关键调节因子,由至少18 个成员组成,可分为3 部分:抗凋亡成员(Bcl-xl和Bcl-2等)、促凋亡成员(Bax和Bak等)和BH3亚家族蛋白(BIM和BID等),它们与其他蛋白共同作用,维持细胞死亡与存活之间的动态平衡[32]。Bcl-2家族蛋白的相互作用及其在细胞凋亡调节中相反的活性构成“变阻器”模型,如果促凋亡的Bax和Bak的数量超过抗凋亡的Bcl-2数量,就会使细胞发生凋亡[33]。Xiang Xiaomei等[34]研究发现,鸡胸肉中Bax的水平和Bax/Bcl-2比值随宰后时间的延长而显著增加。因此Bax/Bcl-2比值是评价Cyt-c释放到细胞质中的速率及细胞是否处于凋亡状态的主要指标。
2.3 小热休克蛋白(small heat shock proteins,sHSPs)
在遭受高温、缺氧、缺血、氧化、重金属盐等胁迫刺激后,生物体会快速产生具有高度保守性的一类非特异性细胞蛋白,即热休克蛋白(heat shock proteins,HSPs),Snoeckx等[35]根据氨基酸序列的同源性、分子质量和功能的不同将HSPs分为6 个主要家族,即HSP100、HSP90、HSP70、HSP60、HSP40和sHSPs家族(12~43 kD)。sHSPs属于HSPs家族中的第6类,主要包括HSP27、HSP20和αB-晶体蛋白。
可以引起细胞凋亡的应激刺激都会诱导sHSPs的表达。sHSPs是一种细胞凋亡负调节因子,可以在细胞凋亡过程中保护一些结构蛋白(如肌间线蛋白、肌联蛋白和肌钙蛋白-T)不被降解[36]。在检测到的sHSPs中,HSP27、HSP20和αB-晶体蛋白在骨骼肌中的表达量最高[37]。
并且Picard等[38]发现,在一些特殊牛品种中,HSP27和αB-晶体蛋白与牛肉的嫩度呈正相关。它们是肌原纤维蛋白降解和肉嫩度变化的关键标志物。
有许多研究证明,HSP27是最有可能参与肉嫩化的HSPs。例如,丁振江[39]研究表明,外源性HSP27可以抑制Caspase-3在体外降解肌原纤维蛋白。同样,在体内HSP27也能与Caspase-3相互作用,从而降低Caspase-3的活性[28]。这与Ma Danyi等[40]的观点一致,他们在宰后牛腰大肌中同时发现HSP27被较少降解和Caspase-3被较少切割活化,表明HSP27被修饰可能抑制Caspase-3的激活,从而影响细胞凋亡途径。此外,Balan等[41]报道,公牛腰部肉中肌间线蛋白和肌钙蛋白-T的降解程度与HSP27和HSP20降解程度之间存在高度相关性。与之研究结果一致,Li Zheng等[42]报道,在绵羊胸最长肌中添加磷酸酶抑制剂能够抑制HSP27的降解,对某些肌原纤维蛋白的降解和肉的嫩度产生负面影响。
αB-晶体蛋白是sHSPs家族的重要成员,可以保护细胞骨架蛋白免受各种应激因素的影响、防止蛋白质变性、抑制细胞凋亡、影响肉的嫩度[37]。在细胞凋亡过程中,αB-晶体蛋白可以抑制Caspase-3的激活,从而减少肌原纤维蛋白的水解[43]。在宰后45 min,Warner-Bratzler剪切力(Warner-Bratzler shear force,WBSF)较低的牛肉中αB-晶体蛋白的表达水平较低[44],这与目前的研究结果一致。其机制可能是αB-晶体蛋白和HSP27参与调节中间细丝与其他细胞蛋白的相互作用,并防止增加肉嫩度的蛋白质聚集[37]。
2.4 钙蛋白酶
钙蛋白酶已被广泛报道可以水解肌原纤维蛋白,最近的研究报道了肌原纤维蛋白中的肌间线蛋白、伴肌球蛋白和肌钙蛋白-T等蛋白质均是钙蛋白酶与肉嫩度高度相关的底物[45]。其中肉嫩度改善主要归因于钙蛋白酶系统中的钙蛋白酶-1。钙蛋白酶-1的钙激活阈值较低,在充足的钙离子存在条件下,钙蛋白酶-1被激活而迅速自溶,80 kDa亚基被自溶为更活跃的76 kDa形式,可引起肉嫩度约70%的差异[5]。即使钙蛋白酶对宰后肉嫩化的贡献很大,但也不能完全解释宰后细胞骨架蛋白降解的规律,肉的嫩化是多种酶作用的结果。
先前的报道显示钙蛋白酶与Caspase-3之间存在相互作用。通过细胞凋亡诱导剂及低频高强度超声提高鸡肉中Caspase-3的活性,导致钙蛋白酶的特异性抑制剂强度降低,进而上调钙蛋白酶的活性并在肉嫩化过程中起到促进作用[46]。Ma Yunhao等[47]证明钙蛋白酶可以通过激活促凋亡蛋白Bax增大线粒体膜通透性并触发Caspase凋亡级联反应。此外,Huang Feng等[48]指出,钙蛋白酶的直接切割会导致Caspase-3酶原产生无酶活性的降解片段,因此钙蛋白酶可能可以降低Caspase-3的活性。这些结果均表明在宰后肉嫩化的复杂机制中,钙蛋白酶和Caspase这2 个不同的蛋白水解系统之间存在相互作用。
线粒体凋亡途径对宰后肌肉嫩化的影响及其作用机制如图2所示。
3 Caspase-3对肉嫩化的作用
在宰后早期,肉嫩度的改善主要是由于肌原纤维蛋白断裂导致肌原纤维结构完整性的下降。肌原纤维蛋白由多种蛋白组成,其中肌间线蛋白、肌钙蛋白-T、伴肌动蛋白和肌联蛋白等关键性骨架蛋白的降解能够改变肌肉的内部结构[49](图3)。
后续不断有研究者发现在宰后早期,Caspase-3活性与肌原纤维蛋白水解程度和肉嫩度之间存在正相关性(表1)。Li Xue等[50]的研究发现,注射Caspase-3抑制剂N-乙酰天冬氨酰-谷氨酰-缬氨酰-天冬氨醛(N-acetyl-Asp-Glu-Val-Asp-aldehyde,AC-DEVD-CHO)的白斑狗鱼背部肉在贮藏过程中线粒体损伤受到明显抑制,其中肌间线蛋白、肌钙蛋白-T、肌联蛋白和伴肌动蛋白的降解程度显著低于未注射Caspase-3抑制剂的鱼肉,注射抑制剂组的肌原纤维小片化指数(myofibrillar fragmentation index,MFI)也显著偏低。Yang Yayuan等[51]发现,抑制Caspase-3的活性后,Caspase-8、Caspase-9也明显受到影响,进而表明Caspase-3在整个线粒体凋亡途径中发挥重要作用,是线粒体凋亡途径中重要的效应Caspase。尽管有众多实质性的证据证明了Caspase-3的活性与肉宰后肌原纤维蛋白水解之间的关系,但也有一些相悖的结论。Underwood等[11]
对宰后牛胸最长肌和胸骨下颌肌使用Caspase-3抗体进行免疫印迹分析,均未检测到Caspase-3的活性形式,这表明Caspase-3的活性与牛胸最长肌的WBSF无关,并且认为Caspase-3没有明显参与宰后牛肉中蛋白的水解。同样,He Jun等[52]的研究发现,Caspase-3的变化对鸭肉嫩度没有显著影响,可能在不同物种间,Caspase-3对宰后肌肉嫩度的影响不同。Zhang Jiaying等[20]的研究发现,猪腰大肌和背最长肌在宰后贮藏过程中线粒体功能被破坏的程度及各种凋亡因素的变化存在显著差异,腰大肌具有比背最长肌更高的Caspase-3活性、更快的线粒体凋亡启动速率,却含有比背最长肌更完整的肌间线蛋白和更少降解的肌钙蛋白-T。表明线粒体细胞凋亡介导的蛋白水解作用可能存在特异性,其中细胞凋亡的加速发生不一定会导致某种肌肉类型宰后蛋白水解作用的增加。因此Caspase-3对于肉嫩度的影响还有待进一步的研究和发现。
4 宰后处理
宰后肉的嫩度变化速率和程度因物种、年龄、贮藏条件及其他各种因素的不同而有所不同。由于Caspase-3在蛋白质水解和嫩化过程中的关键作用,通过调控Caspase-3的活性来改善肉的食用特性成为了一种有效方法。目前常用的物理方法包括超声波和冷藏等。Dang等[5]通过超声波处理牛肉,增加了ROS的产生量,诱导线粒体功能障碍,进而激活Caspase-3活性,增强蛋白水解,以提高肉的嫩度。此外,一些研究表明,宰后快速冷却对肉的嫩度有积极作用,Caspase-3的激活随着宰后贮藏期间肌肉冷却速率的增加而延迟[59]。另外,添加一些特定的化学物质也是提高肉嫩度的重要方式。王琳琳等[60]以茶多酚处理的牦牛背最长肌为研究对象,探究茶多酚对宰后肌肉成熟过程中细胞凋亡的影响,发现茶多酚通过保护线粒体结构和功能,抑制线粒体Cyt-c的释放及Caspase-3的激活,从而抑制线粒体介导的细胞凋亡级联反应,最终阻碍了肌肉嫩化过程。Wang Tongting等[61]研究表明,槲皮素可诱导细胞凋亡,激活Caspase-3并促进肌原纤维蛋白水解,从而改善肉的嫩度。肉类嫩化调控技术的发展可更加注重精准调控Caspase-3活性的方法、新型物理处理技术和生物化学调控手段协同作用,进一步提高肉的品质。
5 结 语
宰后肉的成熟和嫩化是一个复杂的生化过程,受到许多相互作用的酶系统影响。在Caspase系统中,Caspase-3起着至关重要的作用。宰后肉的贮藏过程中,由于细胞内环境因素和凋亡因子表达水平的变化,Caspase-3被激活。这种激活主要通过线粒体凋亡途径实现,导致一系列关键肌原纤维蛋白的降解,从而在肌肉向肉类转化的初始阶段显著影响肉的嫩化过程。
理解不同物种和条件下的肌肉生化反应和Caspase-3在宰后肉嫩化过程中的作用机制,对于改善肉类品质具有重要意义。通过调控Caspase-3的活性,可以在一定程度上控制肉的嫩化速率和程度,有助于开发更具针对性的嫩化策略,推动肉类加工业的技术进步和产品优化。从而提高肉类产品的市场竞争力。
参考文献:
[1] TROY D J, KERRY J P. Consumer perception and the role of science in the meat industry[J]. Meat Science, 2010, 86(1): 214-226. DOI:10.1016/j.meatsci.2010.05.009.
[2] YUN Y, LEE B, KWON K, et al. Comparison of beef palatability characteristics between longissimus thoracis and vastus lateralis muscles from different grades during postmortem aging[J]. Food Science of Animal Resources, 2020, 40(1): 34. DOI:10.5851/kosfa.2019.e78.
[3] RAJAGOPAL K, OOMMEN G T. Myofibril fragmentation index as an immediate postmortem predictor of buffalo meat tenderness[J]. Journal of Food Processing and Preservation, 2015, 39(6): 1166-1171. DOI:10.1111/jfpp.12331.
[4] 李雪. 细胞凋亡酶-3介导线粒体凋亡对白斑狗鱼蛋白降解的影响[D]. 石河子: 石河子大学, 2022. DOI:10.27332/d.cnki.gshzu.2022.000115.
[5] DANG D S, STAFFORD C D, TAYLOR M J, et al. Ultrasonication of beef improves calpain-1 autolysis and caspase-3 activity by elevating cytosolic calcium and inducing mitochondrial dysfunction[J]. Meat Science, 2022, 183: 108646. DOI:10.1016/j.meatsci.2021.108646.
[6] SENTANDREU M A, COULIS G, OUALI A. Role of muscle endopeptidases and their inhibitors in meat tenderness[J]. Trends in Food Science & Technology, 2002, 13(12): 400-421. DOI:10.1016/s0924-2244(02)00188-7.
[7] STRASSER A, O’CONNOR L, DIXIT V M. Apoptosis signaling[J]. Annual Review of Biochemistry, 2000, 69(1): 217-245. DOI:10.1146/annurev.biochem.69.1.217.
[8] 曹锦轩, 张玉林, 黄鸿兵, 等. 宰后骨骼肌内环境对Caspase-3活化的潜在影响因素综述[J]. 食品与发酵工业, 2013, 39(1): 155-160. DOI:10.13995/j.cnki.11-1802/ts.2013.01.047.
[9] LANA A, ZOLLA L. Apoptosis or autophagy, that is the question: two ways for muscle sacrifice towards meat[J]. Trends in Food Science & Technology, 2015, 46(2): 231-241. DOI:10.1016/j.tifs.2015.10.001.
[10] HUANG F, HUANG M, ZHOU G H, et al. In vitro proteolysis of myofibrillar proteins from beef skeletal muscle by caspase-3 and caspase-6[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17): 9658-9663. DOI:10.1021/jf202129r.
[11] UNDERWOOD K R, MEANS W J, DU M. caspase-3 is not likely involved in the postmortem tenderization of beef muscle[J]. Journal of Animal Science, 2008, 86(4): 960-966. DOI:10.2527/jas.2007-0549.
[12] PROKHOROVA E A, ZAMARAEV A V, KOPEINA G S, et al. Role of the nucleus in apoptosis: signaling and execution[J]. Cellular and Molecular Life Sciences, 2015, 72: 4593-4612. DOI:10.1007/s00018-015-2031-y.
[13] GALLUZZI L, KROEMER G. Necroptosis: a specialized pathway of programmed necrosis[J]. Cell, 2008, 135(7): 1161-1163. DOI:10.1016/j.cell.2008.12.004.
[14] NÖSSING C, RYAN K M. 50 years on and still very much alive: ‘apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics’[J]. British Journal of Cancer, 2023, 128(3): 426-431. DOI:10.1038/s41416-022-02020-0.
[15] WANG L L, MA G Y, ZHANG Y B, et al. Effect of mitochondrial cytochrome c release and its redox state on the mitochondrial-dependent apoptotic cascade reaction and tenderization of yak meat during postmortem aging[J]. Food Research International, 2018, 111: 488-497. DOI:10.1016/j.foodres.2018.05.049.
[16] HUANG F, HUANG M, ZHANG H, et al. Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J]. Food Chemistry, 2016, 190: 110-114. DOI:10.1016/j.foodchem.2015.05.056.
[17] 张杰, 杨玺, 李游山. 蛋白酶及其抑制剂关键活性位点研究进展[J]. 生物工程学报, 2021, 37(2): 561-579. DOI:10.13345/j.cjb.200579.
[18] ASADI M, TAGHIZADEH S, KAVIANI E, et al. Caspase-3: structure, function, and biotechnological aspects[J]. Biotechnology and Applied Biochemistry, 2022, 69(4): 1633-1645. DOI:10.1002/bab.2233.
[19] DU J, WANG X, MIERELES C, et al. Activation of caspase-3 is an initial step triggering accelerated muscle proteolysis in catabolic conditions[J]. The Journal of Clinical Investigation, 2004, 113(1): 115-123. DOI:10.1172/jci18330.
[20] ZHANG J Y, MA D Y, KIM Y H B. Mitochondrial apoptosis and proteolytic changes of myofibrillar proteins in two different pork muscles during aging[J]. Food Chemistry, 2020, 319: 126571. DOI:10.1016/j.foodchem.2020.126571.
[21] KEMP C M, PARR T, BARDSLEY R G, et al. Comparison of the relative expression of caspase isoforms in different porcine skeletal muscles[J]. Meat Science, 2006, 73(3): 426-431. DOI:10.1016/j.meatsci.2005.12.009.
[22] KE R, XU Q C, LI C, et al. Mechanisms of AMPK in the maintenance of ATP balance during energy metabolism[J]. Cell Biology International, 2018, 42(4): 384-392. DOI:10.1002/cbin.10915.
[23] WANG C C, MATARNEH S K, GERRARD D, et al. Contributions of energy pathways to ATP production and pH variations in postmortem muscles[J]. Meat Science, 2022, 189: 108828. DOI:10.1016/j.meatsci.2022.108828.
[24] SERGEEVA T F, SHIRMANOVA M V, ZLOBOVSKAYA O A, et al.
Relationship between intracellular pH, metabolic co-factors and caspase-3 activation in cancer cells during apoptosis[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2017, 1864(3): 604-611. DOI:10.1016/j.bbamcr.2016.12.022.
[25] 李文东, 韩玲, 宋仁德, 等. 快速冷却对宰后牦牛肉成熟过程中细胞凋亡酶活力与嫩度的影响[J]. 现代食品科技, 2019, 35(3): 73-79. DOI:10.13982/j.mfst.1673-9078.2019.3.012.
[26] MA J B, YU Q L, HAN L. The effect of postmortem pH decline rate on caspase-3 activation and tenderness of bovine skeletal muscle during aging[J]. Journal of Food Biochemistry, 2022, 46(9): e14215. DOI:10.1111/jfbc.14215.
[27] HEKIMI S, WANG Y, NOË A. Mitochondrial ROS and the effectors of the intrinsic apoptotic pathway in aging cells: the discerning killers![J]. Frontiers in Genetics, 2016, 7: 161. DOI:10.3389/fgene.2016.00161.
[28] DING Z J, WEI Q C, ZHANG C J, et al. Influence of oxidation on heat shock protein 27 translocation, caspase-3 and calpain activities and myofibrils degradation in postmortem beef muscles[J]. Food Chemistry, 2021, 340: 127914. DOI:10.1016/j.foodchem.2020.127914.
[29] MOON D O. Calcium’s role in orchestrating cancer apoptosis: mitochondrial-centric perspective[J]. International Journal of Molecular Sciences, 2023, 24(10): 8982. DOI:10.3390/ijms24108982.
[30] FU M L, SHI W H, LI Z L, et al. Activation of mPTP-dependent mitochondrial apoptosis pathway by a novel pan HDAC inhibitor resminostat in hepatocellular carcinoma cells[J]. Biochemical and Biophysical Research Communications, 2016, 477(4): 527-533. DOI:10.1016/j.bbrc.2016.04.147.
[31] PEÑA-BLANCO A, GARCÍA-SÁEZ A J. Bax, Bak and beyond-mitochondrial performance in apoptosis[J]. The FEBS Journal, 2018, 285(3): 416-431. DOI:10.1111/febs.14186.
[32] DOERFLINGER M, GLAB J A, PUTHALAKATH H. BH3-only proteins: a 20-year stock-take[J]. The FEBS Journal, 2015, 282(6): 1006-1016. DOI:10.1111/febs.13190.
[33] EDLICH F. BCL-2 proteins and apoptosis: recent insights and unknowns[J]. Biochemical and Biophysical Research Communications, 2018, 500(1): 26-34. DOI:10.1016/j.bbrc.2017.06.190.
[3f39deea8c052bb139b4f9df12c2334a34af4b54a6d6ca539388d1e93856bd1224] XIANG X M, YAN N, WANG Y Z, et al. Mitochondrial and endoplasmic reticulum stress pathways regulate tenderness of post-mortem chicken muscle[J]. Food Bioscience, 2024, 60: 104321. DOI:10.1016/j.fbio.2024.104321.
[35] SNOECKX L H, CORNELUSSEN R N, VAN NIEUWENHOVEN F A,
et al. Heat shock proteins and cardiovascular pathophysiology[J]. Physiological Reviews, 2001, 81(4): 1461-1497. DOI:10.1152/physrev.2001.81.4.1461.
[36] GOLENHOFEN N, DER PERNG M, QUINLAN R A, et al. Comparison of the small heat shock proteins αB-crystallin, MKBP, HSP25, HSP20, and cvHSP in heart and skeletal muscle[J]. Histochemistry and Cell Biology, 2000, 122: 415-425. DOI:10.1007/s00418-004-0711-z.
[37] LOMIWES D, FAROUK M M, WIKLUND E, et al. Small heat shock proteins and their role in meat tenderness: a review[J]. Meat Science, 2014, 96(1): 26-40. DOI:10.1016/j.meatsci.2013.06.008.
[38] PICARD B, GAGAOUA M, MICOL D, et al. Inverse relationships between biomarkers and beef tenderness according to contractile and metabolic properties of the muscle[J]. Journal of Agricultural and Food Chemistry, 2014, 62(40): 9808-9818. DOI:10.1021/jf501528s.
[39] 丁振江. 热休克蛋白27对宰后牛肉肌原纤维蛋白降解的调控机制研究[D]. 北京: 中国农业科学院, 2018.
[40] MA D Y, KIM Y H B. Proteolytic changes of myofibrillar and small heat shock proteins in different bovine muscles during aging: their relevance to tenderness and water-holding capacity[J]. Meat Science, 2020, 163: 108090. DOI:10.1016/j.meatsci.2020.108090.
[41] BALAN P, KIM Y H B, BLIJENBURG R. Small heat shock protein degradation could be an indicator of the extent of myofibrillar protein degradation[J]. Meat Science, 2014, 97(2): 220-222. DOI:10.1016/j.meatsci.2014.01.019.
[42] LI Z, LI M, DU M T, et al. Dephosphorylation enhances postmortem degradation of myofibrillar proteins[J]. Food Chemistry, 2018, 245: 233-239. DOI:10.1016/j.foodchem.2017.09.108.
[43] KAMRADT M C, CHEN F, SAM S, et al. The small heat shock protein αB-crystallin negatively regulates apoptosis during myogenic differentiation by inhibiting caspase-3 activation[J]. Journal of Biological Chemistry, 2002, 277(41): 38731-38736. DOI:10.1074/jbc.m201770200.
[44] OH E, LEE B, CHOI Y M. Associations of heat-shock protein expression with meat quality and sensory quality characteristics in highly marbled longissimus thoracis muscle from hanwoo steers categorized by Warner-Bratzler shear force value[J]. Foods, 2019, 8(12): 638. DOI:10.3390/foods8120638.
[45] ÁLVAREZ C, MORÁN L, KEENAN D F, et al. Mechanical and biochemical methods for rigor measurement: relationship with eating quality[J]. Journal of Food Quality, 2019, 2019: 1894543. DOI:10.1155/2019/1894543.
[46] 陈琳. Caspase-3在鸡肉成熟过程中的作用以及与calpain的交互关系研究[D]. 南京: 南京农业大学, 2012.
[47] MA Y H, WANG Y, WANG Z M, et al. New perspet3UOVhj0xLeNjnrqHnL/F11TgsVMdoKEhTwTDzaIFqs=ctive for calpain-mediated regulation of meat quality: unveiling the impact on mitochondrial pathway apoptosis in post-mortem[J]. Food Chemistry, 2024, 441: 138287. DOI:10.1016/j.foodchem.2023.138287.
[48] HUANG F, DING Z J, ZHANG C J, et al. Effects of calcium and zinc ions injection on caspase-3 activation and tenderness in post-mortem beef skeletal muscles[J]. International Journal of Food Science & Technology, 2018, 53(3): 582-589. DOI:10.1111/ijfs.13631.
[49] 李胜杰, 胡忠良, 郭向莹, 等. 细胞凋亡对肌肉宰后嫩化的贡献[J]. 食品工业科技, 2010, 31(4): 395-398. DOI:10.13386/j.issn1002-0306.2010.04.073.
[50] LI X, HU L, ZHU X R, et al. The effect of caspase-3 in mitochondrial apoptosis activation on degradation of structure proteins of esox lucius during postmortem storage[J]. Food Chemistry, 2022, 367: 130767. DOI:10.1016/j.foodchem.2021.130767.
[51] YANG Y Y, HAN L, YU Q L, et al. Effects of caspase activity of yak meat and internal environment changing during aging[J]. Journal of Food Science and Technology, 2022, 59(4): 1362-1371. DOI:10.1007/s13197-021-05145-x.
[52] HE J, DENG F, PAN D D, et al. Investigation of the relationships between different enzymes and postmortem duck muscle tenderization[J]. Poultry Science, 2019, 98(11): 6125-6130. DOI:10.3382/ps/pez301.
[53] DONG X F, HE B Y, JIANG D, et al. Proteome analysis reveals the important roles of protease during tenderization of sea cucumber Apostichopus japonicus using iTRAQ[J]. Food Research International, 2020, 131: 108632. DOI:10.1016/j.foodres.2019.108632.
[54] LEE B, KIM J Y, CHOI Y M. Associations of apoptotic and anti-apoptotic factors with beef quality, histochemical characteristics, and palatability of hanwoo longissimus thoracis muscle[J]. Animals, 2022, 12(4): 467. DOI:10.3390/ani12040467.
[55] KIM J Y, LEE B, KIM E J, et al. Eff974481dd38bcd858c75b304ce836e840ects of apoptotic factor levels on palatability variation during postmortem aging of Holstein longissimus thoracis muscles classified as Warner-Bratzler shear force change value[J]. Food Chemistry, 2023, 428: 136741. DOI:10.1016/j.foodchem.2023.136741.
[56] HUANG H, HE Y F, LI L H, et al. Effects of manipulation of proteases on myofibril protein degradation of tilapia muscle in vitro and in vivo[J]. Journal of Aquatic Food Product Technology, 2019, 28(6): 658-666. DOI:10.1080/10498850.2019.1628153.
[57] DU T Y, MA C, WANG Z X, et al. Distribution and degradation of pork filamin during postmortem aging[J]. Journal of Agricultural and Food Chemistry, 2023, 71(41): 15287-15295. DOI:10.1021/acs.jafc.3c04208.
[58] 韩金花, 张永胜, 陈敬敬, 等. 宰后LND处理对藏羊肉线粒体通路细胞凋亡与嫩度的影响[J]. 甘肃农业大学学报, 2023, 58(6): 210-216. DOI:10.13432/j.cnki.jgsau.2023.06.023.
[59] HUANG C Y, IJAZ M, CHEN L, et al. Effect of chilling rate on heat shock proteins abundance, myofibrils degradation and caspase-3 activity in postmortem muscles[J]. International Journal of Food Science & Technology, 2022, 57(10): 6492-6502. DOI:10.1111/ijfs.15985.
[60] 王琳琳, 陈炼红, 韩玲, 等. 茶多酚对宰后牦牛肉线粒体细胞凋亡和肌肉嫩度的影响[J]. 农业机械学报, 2019, 50(10): 352-359; 366. DOI:10.6041/j.issn.1000-1298.2019.10.041.
[61] WANG T T, FENG X C, LI L Z, et al. Effects of quercetin on tenderness, apoptotic and autophagy signalling in chickens during post-mortem ageing[J]. Food Chemistry, 2022, 383: 132409. DOI:10.1016/j.foodchem.2022.132409.
收稿日期:2024-07-02
基金项目:国家自然科学基金面上项目(32372397)
第一作者简介:吴佳琪(2001—)(ORCID: 0009-0007-9536-5369),女,硕士研究生,研究方向为水产品贮藏保鲜。E-mail: wujiaq7@163.com
*通信作者简介:罗永康(1964—)(ORCID: 0000-0002-5679-4933),男,教授,博士,研究方向为水产品加工及贮藏。E-mail: luoyongkang@cau.edu.cn
