高效液相色谱-串联质谱法检测鸡组织及鸡蛋中新型兽药氟雷拉纳残留
2024-11-11凌艺菡王潇萌武首薰周婷李星洁周荷蜓张舒文阴文娅王建萍王毅


摘 要:基于高效液相色谱-串联质谱法建立鸡组织(鸡肉、鸡肝、鸡皮和鸡肾)及鸡蛋中新型兽药氟雷拉纳残留的检测方法。将低(0.10 mg/kg)、中(0.25 mg/kg)、高(0.50 mg/kg)剂量氟雷拉纳分2 次灌胃(间隔7 d)白羽母鸡后获得阳性动物样品。样品经乙腈提取、PRiME HLB固相萃取小柱净化后,以甲醇和5 mmol/L甲酸铵溶液为流动相,Eclipse Plus C18色谱柱为分离柱进行梯度洗脱,电喷雾负离子模式电离,在多反应监测模式下检测,绘制基质匹配校准曲线,外标法定量。结果表明:氟雷拉纳在0~200 ng/mL质量浓度范围内具有良好的线性关系,相关系数(R2)>0.99,方法检出限为2.0 μg/kg,定量限为5.0 μg/kg;在5、15、50 μg/kg加标水平下,鸡组织(鸡肉、鸡肝、鸡皮、鸡肾)和鸡蛋中氟雷拉纳的平均加标回收率为81.2%~99.1%,相对标准偏差为1.29%~7.86%(n=6)。该方法成功应用于阳性动物样品中氟雷拉纳残留量的检测。综上,该方法简便、快速、灵敏,适用于鸡组织及鸡蛋中氟雷拉纳兽药残留的检测。
关键词:氟雷拉纳;高效液相色谱-串联质谱;兽药残留;固相萃取;鸡组织及鸡蛋
Determination of Residues of the Novel Veterinary Drug Fluralaner in Chicken Tissues and Eggs byHigh Performance Liquid Chromatography-Tandem Mass Spectrometry
LING Yihan1, WANG Xiaomeng1, WU Shouxun1, ZHOU Ting1, LI Xingjie1, ZHOU Heting1,
ZHANG Shuwen1, YIN Wenya1, WANG Jianping2, WANG Yi3,*
(1. West China School of Public Health/West China Fourth Hospital, Sichuan University, Chengdu 610041, China;
2. Animal Nutrition Institute, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Institute of Food Inspection, Chengdu 611731, China)
Abstract: This study established a methodfpnplvUbgZay6jxBXunjAA== for the determination of fluralaner residues in chicken tissues (meat, liver, skin and kidney) and eggs by high performance liquid chromatography-tandem mass spectrometry. Positive animal samples were obtained from white-feathered laying hens orally administered of low (0.10 mg/kg), medium (0.25 mg/kg) and high(0.50 mg/kg) doses of fluralaner (in two fractions, 7 d apart). Samples were extracted with acetonitrile and purified by solid phase extraction on a PRiME HLB column. The target analyte was separated on an Eclipse Plus C18 column with gradient elution using a mobile phase consisting of methanol and 5 mmol/L ammonium formate solution and analyzed using electrospray ionization in the negative ion mode with multiple reaction monitoring (MRM). A matrix-matched calibration curve was prepared and the external standard method was used for quantification under the optimal conditions. The calibration curve showed good linearity in the concentration range of 0–200 ng/mL with correlation coefficient (r2) greater than 0.99. The limit of detection (LOD) and the limit of quantification (LOQ) were 2.0 and 5.0 μg/kg, respectively. The recoveries of added fluralaner from chicken meat, eggs, liver, skin and kidney were 81.2%–99.1% with relative standard deviations (RSDs) of 1.29%–7.86% at spiked levels of 5, 15 and 50 μg/kg (n = 6). The method is simple, rapid, sensitive, and has been successfully applied for the determination of fluralaner residues in medicated chicken samples.
Keywords: fluralaner; high performance liquid chromatography-tandem mass spectrometry; veterinary drug residues; solid phase extraction; chicken tissues and eggs
DOI:10.7506/rlyj1001-8123-20240702-165
中图分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2024)10-0030-06
引文格式:
凌艺菡, 王潇萌, 武首薰, 等. 高效液相色谱-串联质谱法检测鸡组织及鸡蛋中新型兽药氟雷拉纳残留[J]. 肉类研究, 2024, 38(10): 30-35. DOI:10.7506/rlyj1001-8123-20240702-165. http://www.rlyj.net.cn
LING Yihan, WANG Xiaomeng, WU Shouxun, et al. Determination of residues of the novel veterinary drug fluralaner in chicken tissues and eggs by high performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2024, 38(10): 30-35. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240702-165. http://www.rlyj.net.cn
据联合国粮食及农业组织统计,2020年我国成为全球第一大鸡蛋生产国和全球第二大鸡肉生产国[1]。作为家禽养殖业中危害最严重的外寄生虫之一,鸡皮刺螨(Dermanyssus gallinae)又称家禽红螨,给禽养殖业带来巨大威胁[2-4]。调查显示,我国家禽鸡皮刺螨感染率达57.1%,且仍呈现上升趋势,给我国鸡肉和鸡蛋生产造成巨大的经济损失[5-7]。目前,为控制病虫害、提高食用动物产品质量[8],兽药被广泛应用,由此也带来了兽药过度使用和滥用等安全问题[9-10]。
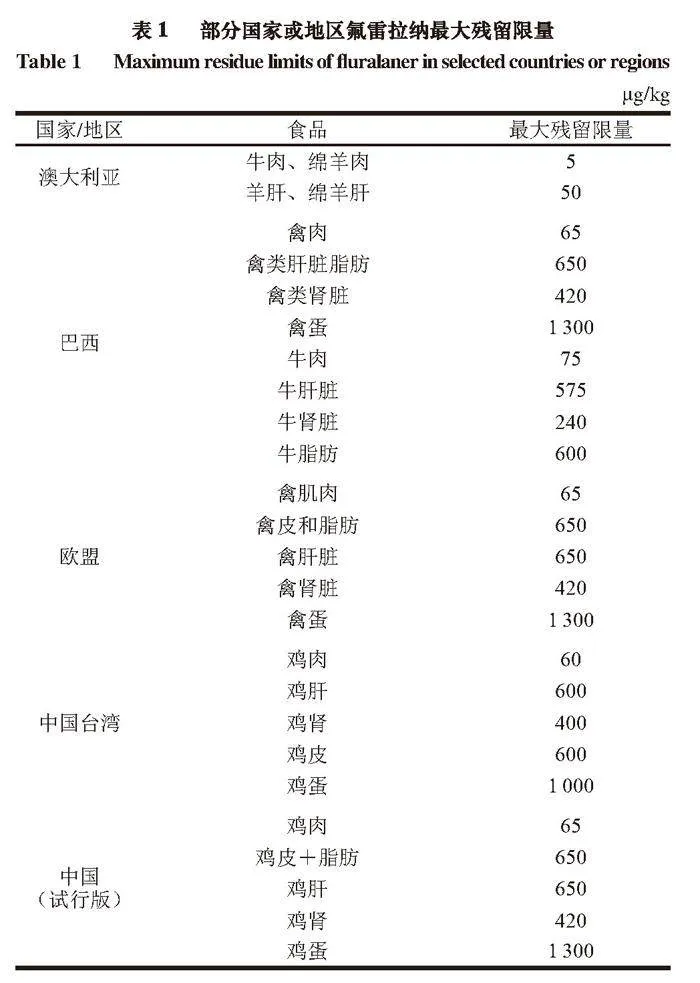
氟雷拉纳是一种新型的异噁唑啉类除螨剂,能够有效防治鸡皮刺螨病,主要通过抑制γ-氨基丁酸(γ-aminobutyric acid,GABA)和L-谷氨酸(L-glutamic acid,Glu)门控氯离子通道发挥作用,氯离子通道关闭后,虫体细胞过度兴奋,最终瘫痪甚至死亡[11-13]。其商品化试剂Exzolt®已经被欧盟批准用于治疗鸡的鸡皮刺螨病[14-15],由于其相对安全,在国外已被广泛应用[16]。氟雷拉纳在动物体内由肝脏代谢,具有清除率低、易蓄积、残留量高等缺点,长期超剂量使用可能导致哺乳动物出现神经失调[17]。因此,为规范氟雷拉纳的使用,降低残留药物对人体的潜在风险,欧盟、澳大利亚农兽药管理局、我国台湾省卫生福利部和巴西国家卫生监督局等陆续增订了其在各类动物组织中的最大残留限量要求[18],我国农业农村部于2023年也发布了试行版最大残留限量标准[19]。部分国家或地区氟雷拉纳最大残留限量见表1。
目前关于氟雷拉纳的研究多集中于其作用机制、代谢动力学评价及毒理学等方面[20-22],鲜少有对其检测方法的研究。检测方法的缺乏不仅增加了食品安全监管部门对违规使用兽药的监管难度,也使我国在动物源性食品的进出口贸易中处于不利地位。因此有必要建立鸡组织和鸡蛋中氟雷拉纳残留的检测方法,对保障动物源性食品安全具有重要意义。高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法兼具色谱技术的高效分离与质谱技术的良好定性优势,是迄今兽药残留分析领域较准确、高效的定性、定量方法,也是大多数实验室兽药残留检测的常用方法[23-24];固相萃取法净化样品可获得更低的检出限,满足低含量兽药残留检测要求[25]。综上,本研究拟基于固相萃取-HPLC-MS/MS法建立一种鸡组织及鸡蛋中的氟雷拉纳新型兽药残留定性及定量检测方法,以期为此类兽药检测方法研究及标准的建立提供参考。
1 材料与方法
1.1 材料与试剂
白羽母鸡 眉山温氏畜牧有限公司。
甲醇、乙腈(均为色谱纯) 成都市诺尔施科技责任有限公司;甲酸铵、乙酸铵(均为色谱纯) 美国Thermo Fisher Scientific公司;乙酸乙酯、正己烷(均为分析纯) 成都市科隆化学品有限公司;贝卫多(0.112 5 g氟雷拉纳/片) 默沙东动物保健品(上海)有限公司;100 μg/mL氟雷拉纳标准储备液(纯度>99.4%,CAS:864731-61-3) 天津阿尔塔科技有限公司;实验用水为超纯水。
1.2 仪器与设备
PRiME HLB固相萃取柱(150 mg/3 mL)、HLB固相萃取柱(60 mg/3 mL)、C18固相萃取柱(500 mg/3 mL) 沃特世科技(上海)有限公司;6460三重四极杆串联质谱仪(配有电喷雾电离(electronspray ionization,ESI)源)、1200高效液相色谱仪、ZORBAX Eclipse Plus C18色谱柱(100 mm×4.6 mm,3.5 μm) 美国Agilent公司;Milli-Q Academic超纯水仪 美国Millipore公司;H2050R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;TurboVap LV氮吹浓缩仪 瑞典Biotage公司;XS105DU电子天平 梅特勒-托利多科技(中国)有限公司;Reax Top涡旋振荡器 德国Heidolph公司。
1.3 方法
1.3.1 实验动物喂养
选取180 d左右日龄、体质量(2.0±0.2)kg、未使用任何兽药的健康白羽母鸡12 只。空白组(3 只)给予生理盐水,实验组(9 只,每组3 只)以溶液方式灌胃氟雷拉纳兽药贝卫多,分别按照低(0.10 mg/kg)、中(0.25 mg/kg)、高(0.50 mg/kg)剂量给药,其中高剂量组为推荐治疗剂量组。采用不含任何抗生素的基础日粮预饲3 d后进入实验期,实验期共计7 d,首次给药后间隔7 d,再次以溶液方式灌胃相同剂量。实验期自由饮水,均饲喂不含抗生素的基础日粮。所有动物程序均按照SICAU 2021-042《四川农业大学实验动物护理和使用指南》进行。所有动物在末次给药1 d后屠宰,采集鸡肉、鸡皮、鸡肝、鸡肾,-20 ℃保存。在此期间收集所有鸡蛋,4 ℃保存。
1.3.2 样品前处理
称取(2.0±0.02)g样品,置于50 mL具塞离心管(聚丙烯)中,加入10 mL乙腈,于涡旋振荡器中涡旋1 min,超声15 min,10 000 r/min离心5 min,重复上述操作1 次,合并2 次上清液,混匀后取5 mL过PRiME HLB固相萃取柱(150 mg/3 mL),准确量取4 mL流出液,40 ℃氮吹近干,加1 mL初始流动相(5 mmol/L甲酸铵溶液与甲醇体积比2∶8)复溶,过0.22 μm有机滤膜,供检测使用。
1.3.3 标准溶液配制
移取适量标准储备液,用乙腈稀释后配制成500 ng/mL氟雷拉纳标准中间液;经1.3.1节样品前处理制备空白基质溶液,用空白基质溶液逐级稀释标准中间液,配制成质量浓度分别为1、2、5、10、20、50、100、200 ng/mL的基质匹配标准工作液。所有溶液现配现用。
1.3.4 检测条件
HPLC条件:ZORBAX Eclipse Plus C18色谱柱(100 mm×4.6 mm,3.5 μm);柱温30 ℃;进样体积2 μL;流速0.5 mL/min;流动相A:5 mmol/L甲酸铵溶液,B:甲醇。梯度洗脱程序:0~2 min,20% A;2~6 min,20%~5% A;6~6.1 min,5%~0% A;6.1~10 min,0% A;10~10.1 min,0%~20% A;10.1~12 min,20% A。
MS条件:ESI负离子(ESI-)模式;多反应监测(multiple reaction monitoring,MRM)模式;毛细管电压3 500 V;干燥气:氮气(纯度>99.5%);雾化气压力310.275 kPa;干燥气温度350 ℃,干燥气流速6 L/min,鞘气温度300 ℃,鞘气流速11 L/min。其他MS参数见表2。
1.3.5 样品中氟雷拉纳残留量计算
样品中氟雷拉纳残留量按式(1)计算:
(1)
式中:ρ为由标准曲线得到的被测组分质量浓度/(ng/mL);V为样品处理后定容体积/mL;m为样品质量/g;f为稀释倍数。
1.3.6 基质效应(matrix effect,ME)计算
ME按式(2)计算:
(2)
式中:SMM为基质匹配校准曲线斜率;SRO为溶剂曲线斜率。
1.4 数据处理
在Angileng MassHunt2e1DJIvyAPY6jnljENV1aw==er LC-MS Acquisition工作站进行数据采集和分析,采用Excel 2021进行结果分析,采用Origin 2022绘图。
2 结果与分析
2.1 质谱条件优化
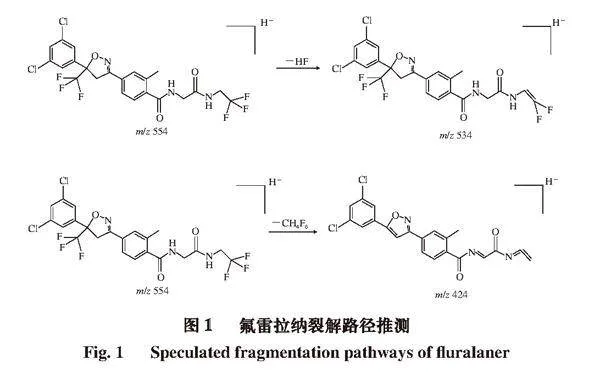
取200 ng/mL氟雷拉纳标准溶液,以自动进样方式在ESI+、ESI-模式下进行MS全扫描,结果表明,氟雷拉纳在ESI-模式下具有较好且稳定的电离效果,准分子离子([M-H]-)m/z 554,[M-H]-母离子再通过二级质谱扫描得到不同的碎片离子,主要碎片离子为m/z 534、424。对氟雷拉纳可能裂解路径进行解析,结果如图1所示。准分子离子[M-H]-丢失碎片HF后得到m/z 534的碎片离子,丢失碎片CH4F6后得到m/z 424的碎片离子。选择相应信号最高的碎片离子m/z 534为定量离子,相应信号次高的碎片离子m/z 424为定性离子。在MRM负离子模式下优化毛细管电压、雾化气压力、干燥气温度、干燥气流速、鞘气温度、鞘气流速等各MS参数,得到较佳MS条件(表2)。
2.2 色谱条件优化
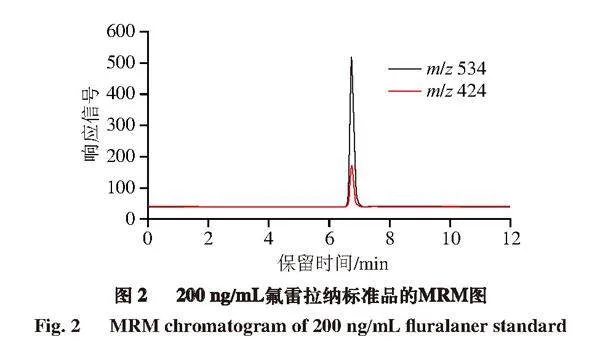
探究不同流动相体系对氟雷拉纳峰形和响应信号的影响,分别以甲醇和乙腈作为有机相,进样氟雷拉纳标准品(200 ng/mL)。结果表明,有机相为甲醇时的待测物响应信号明显高于乙腈,且峰形更好,因此将甲醇作为流动相中的有机相。由于氟雷拉纳MS检测采用负离子模式,在流动相水相中加入少量酸、碱、盐类可以增强化合物离子化效率,改善待测物峰形,提高检测灵敏度[26-27]。因此,分别采用0.1%甲酸水溶液、5 mmol/L甲酸铵溶液和5 mmol/L氨水溶液进行洗脱,考察水相对氟雷拉纳峰形和响应信号的影响。结果表明,0.1%甲酸水溶液对待测物的峰形并无明显改善作用;5 mmol/L氨水溶液导致待测物色谱峰出现拖尾且响应信号降低;5 mmol/L甲酸铵溶液则能明显提高待测化合物的响应信号,色谱峰峰形尖锐、对称。因此,本研究确定最终流动相体系以甲醇为有机相,以5 mmol/L甲酸铵溶液为水相,在此条件下获得氟雷拉纳标准品的MRM图(图2)。
2.3 提取和净化条件优化
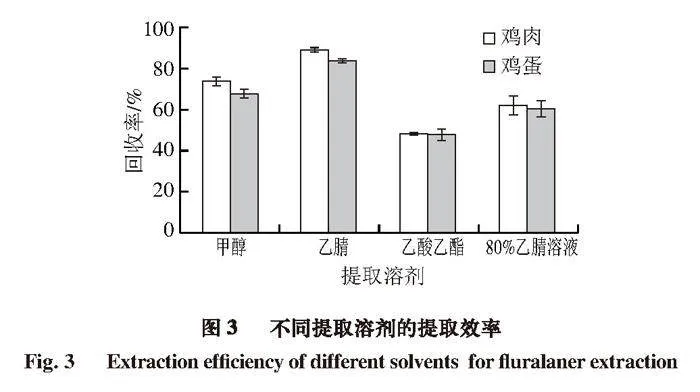
根据氟雷拉纳的溶解性,结合兽药残留检测前处理中常用于沉淀蛋白的提取溶剂,选择甲醇、乙腈、乙酸乙酯、80%乙腈溶液4 种溶剂对空白鸡肉和鸡蛋样品加标后的提取效果进行考察。由图3可知,乙腈提取效果明显优于其他3 种提取溶剂,且乙腈能够使蛋白质快速变性,从而减少蛋白质干扰[28],因此本研究选择乙腈为提取溶剂。
鸡蛋和鸡肉等动物源样品含有大量脂肪、蛋白质、不饱和脂肪酸等,基质复杂,选择合适的净化措施可减少基质对背景的干扰、提高检测准确性、延长仪器使用寿命[29]。本研究比较HLB(60 mg/3 mL)、C18(500 mg/3 mL)和PRiME HLB(150 mg/3 mL)3 种固相萃取小柱对回收率的影响。结果表明,当鸡蛋和鸡肉基质出现乳化现象时,较难通过HLB和C18固相萃取小柱净化,且回收率小于60%,净化效果较差;而使用PRiME HLB固相萃取小柱净化时,净化过程迅速,回收率可达91%。因此,本研究选择PRiME HLB固相萃取小柱进行净化。
2.4 ME分析
由于动物源性食品基质较为复杂,净化不完全会影响待测化合物在离子源中的电离,出现基质增强或抑制效应[30]。ME>0%,则为基质增强效应,ME<0%,则为基质抑制效应;ME的绝对值越大,基质干扰越强,0%<|ME|≤20%表明ME较小,可忽略不计;20%<|ME|≤50%表明存在中等强度ME,|ME|>50%表明存在强ME[31]。由图4可知,除鸡蛋外,其余4 种鸡组织样品均存在中等强度的基质增强效应。与其他样品相比,鸡蛋蛋白含量更高、酶活性物质更丰富,即使在前处理中尽量减少可能和预期的干扰,仍可能产生基质抑制效应[32]。为克服样品ME对定量结果的影响,本方法采用基质匹配校准曲线进行定量分析。
2.5 方法线性范围、检出限与定量限
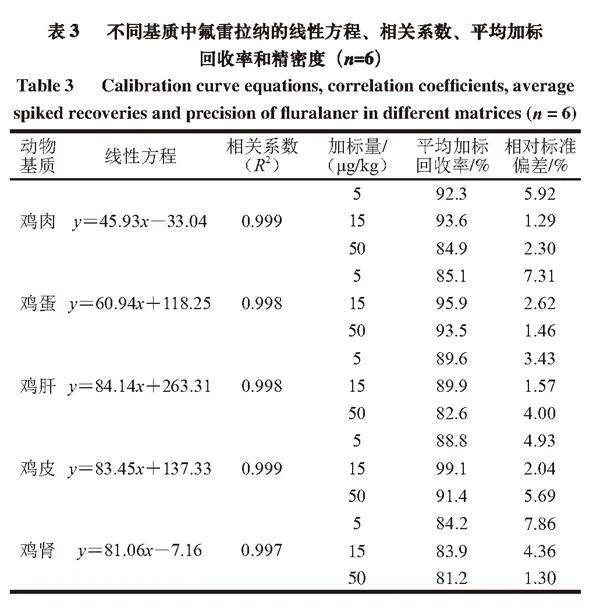
以基质匹配标准工作液中的氟雷拉纳质量浓度为横坐标,相应峰面积为纵坐标,绘制标准曲线。由表3可知,在5 种基质中,氟雷拉纳在0~200 ng/mL质量浓度范围内线性关系良好,相关系数(R2)为0.997~0.999。在空白基质中添加一定质量浓度的氟雷拉纳标准工作液,经提取净化后上机测定离子对信号与基线噪音信号比值,以信噪比(RSN)>3对应的最低含量为检出限(limit of detection,LOD),RSN>10对应的最低含量为定量限(limit of quantification,LOQ),得到氟雷拉纳在5 种基质中的LOD为2.0 μg/kg,LOQ为5.0 μg/kg。
2.6 回收率和精密度
本研究对5 种空白基质进行5、15、50 μg/kg 3 水平加标回收实验,每个水平设置6 个平行样,计算加标回收率,精密度以相对标准偏差表示。如表3所示,3 个加标水平下的平均加标回收率为81.2%~99.1%,相对标准偏差为1.29%~7.86%,符合GB/T 27417—2017《化学分析方法确认和验证指南》要求。
2.7 实际样品检测
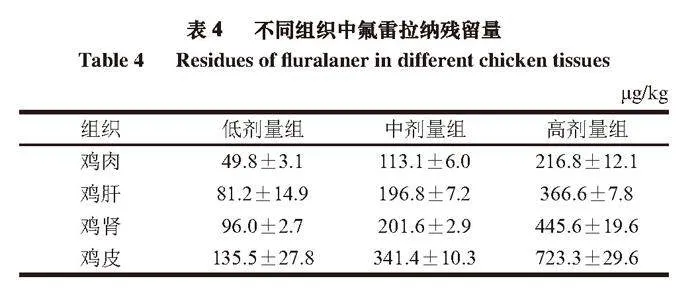
采用本方法对氟雷拉纳兽药贝卫多干预后的阳性动物样品进行氟雷拉纳药物残留检测,以验证该方法在实际样品中的适用性。不同时间、不同组别鸡蛋残留量最小为(7.66±0.63)μg/kg,最大为(512.50±5.44)μg/kg,小于欧盟的最大残留限量规定。由表4可知,鸡皮中氟雷拉纳残留量最高,当给药egf0skdZ0ecBMlKYA9bCgTLLgFCnVkZcN9xgx66Q3q0=剂量为0.50 mg/kg时,残留量超过相关规定;鸡肝和鸡肾中残留量基本一致;鸡肉中的残留量最低,当给药剂量为0.25 mg/kg时,残留量超过相关规定。该药的使用应严格按照《兽药产品委员会关于Exzolt的评估报告》[33]中休药期规定,鸡肉和鸡肾的休药期为14 d,鸡蛋无休药期。
3 结 论
本研究以乙腈为提取剂,样品经PRiME HLB固相萃取小柱净化,采用HPLC-MS/MS检测鸡组织及鸡蛋中氟雷拉纳残留,方法前处理简单、快速、稳定,线性范围、灵敏度、回收率和重复性均满足方法学要求,可为实验室测定氟雷拉纳残留提供方法参考,为我国制定氟雷拉纳最大残留限量提供技术支撑。
参考文献:
[1] Food and Agriculture Organization of the United Nations (FAO). World Food and Agriculture-Statistical Yearbook 2022[EB/OL]. (2022-12-12)[2023-12-03]. https://doi.org/10.4060/cc2211en.
[2] 祁晓晓, 李环, 王铂涵, 等. 螨类化学信息物质及其在鸡皮刺螨防治中的应用现状[J]. 畜牧兽医学报, 2021, 52(11): 3006-3013. DOI:10.11843/j.issn.0366-6964.2021.011.002.
[3] 菅忆晨, 郭庆, 李是衡, 等. 河南省部分地区蛋鸡场螨虫的种类鉴定[J]. 中国家禽, 2023, 45(2): 27-32. DOI:10.16372/j.issn.1004-6364.2023.02.005.
[4] FUJISAWA S, MURATA S, ISEZAKI M, et al. Transcriptome dynamics of blood-fed and starved poultry red mites, Dermanyssus gallinae[J]. Parasitology International, 2020, 78: 102156. DOI:10.1016/j.parint.2020.102156.
[5] WANG F F, WANG M, XU F R, et al. Survey of prevalence and control of ectoparasites in caged poultry in China[J]. Veterinary Record, 2010, 167(24): 934-937. DOI:10.1136/vr.c6212.
[6] SCHIAVONE A, PUGLIESE N, CIRCELLA E, et al. Association between the poultry red mite Dermanyssus gallinae and potential avian pathogenic Escherichia coli (APEC)[J]. Veterinary Parasitology, 2020, 284: 109198. DOI:10.1016/j.vetpar.2020.109198.
[7] FUJISAWA S, MURATA S, ISEZAKI M, et al. Suppressive modulation of host immune responses by Dermanyssus gallinae infestation[J]. Poultry Science, 2023, 102(4): 102532. DOI:10.1016/j.psj.2023.102532.
[8] CHEN D M, PEI X S, WU M R, et al. Development of a networked mass spectral database for veterinary drug residues[J]. International Journal of Mass Spectrometry, 2019, 439: 1-12. DOI:10.1016/j.ijms.2018.11.014.
[9] HVISTENDAHL M. Public health China takes aim at rampant antibiotic resistance[J]. Science, 2012, 336: 795. DOI:10.1126/science.336.6083.795.
[10] LARSON C. Pharmaceuticals China’s lakes of pig manure spawn antibiotic resistance[J]. Science, 2015, 347: 704. DOI:10.1126/science.347.6223.704.
[11] 黄茗鑫, 谢跃, 杨光友. 异恶唑啉类新型广谱杀虫药: 氟雷拉纳[J]. 动物医学进展, 2021, 42(2): 112-117. DOI:10.3969/j.issn.1007-5038.2021.02.021.
[12] GASSEL M, WOLF C, NOACK S, et al. The novel isoxazoline ectoparasiticide fluralaner: selective inhibition of arthropod γ-aminobutyric acid-and L-glutamate-gated chloride channels and insecticidal/acaricidal activity[J]. Insect Biochemistry and Molecular Biology, 2014, 45: 111-124. DOI:10.1016/j.ibmb.2013.11.009.
[13] ZHOU X Y, HOHMAN A E, HSU W H. Current review of isoxazoline ectoparasiticides used in veterinary medicine[J]. Journal of Veterinary Pharmacology and Therapeutics, 2022, 45(1): 1-15. DOI:10.1111/jvp.12959.
[14] SOARES N M, TUCCI E C, PERDONCINI G, et al. Efficacy of fluralaner (Exzolt) for the treatment of natural Allopsoroptoides galli infestations in laying hens[J]. Poultry Science, 2022, 101(10): 102099. DOI:10.1016/j.psj.2022.102099.
[15] THOMAS E, SANDER B, ZSCHIESCHE E, et al. Field efficacy and safety of fluralaner solution for administration in drinking water for the treatment of poultry red mite (Dermanyssus gallinae) infestations in commercial flocks in Europe[J]. Parasite & Vector, 2017, 10(1): 457. DOI:10.1186/s13071-017-2390-3.
[16] PROHACZIK A, HUYGHE B, TRAON G L, et al. Safety of fluralaner oral solution, a novel systemic antiparasitic treatment for chickens, in laying hens after oral administration via drinking water[J]. Parasite & Vector, 2017, 10(1): 363. DOI:10.1186/s13071-017-2291-5.
[17] GAENS D, RUMMEL C, SCHMIDT M, et al. Suspected neurological toxicity after oral application of fluralaner (Bravecto®) in a Kooikerhondje dog[J]. BMC Veterinary Research, 2019, 15(1): 283. DOI:10.1186/s12917-019-2016-4.
[18] European Union. Commission implementing regulation (EU) 2017/201 of 6 February 2017 amending regulation (EU) No 37/2010 to classify the substance fluralaner as regards its maximum residue limit[S]. 2017.
[19] 农业农村部. 中华人民共和国农业农村部第657号[EB/OL]. (2023-03-17)[2024-05-31]. http://www.xmsyj.moa.gov.cn/zcjd/202303/t20230317_6423383.htm.
[20] ZHANG Z X, ZHOU L L, GAO Y Y, et al. Enantioselective detection, bioactivity, and metabolism of the novel chiral insecticide fluralaner[J]. Journal of Agricultural and Food Chemistry, 2020, 68(25): 6802-6810. DOI:10.1021/acs.jafc.9b07907.
[21] 吴梦雅, 武鼎铭, 孙凤楠, 等. 新型异噁唑啉类药物合成研究进展[J].
中国兽药杂志, 2020, 54(11): 72-78. DOI:10.11751/issn.1002-1280.2020.11.11.
[22] 黄道友. 新型兽药Fluralaner的合成工艺研究[D]. 武汉: 湖北工业大学, 2017: 27-32.
[23] 陈晶燕, 陈万勤, 刘柱, 等. HPLC-MS/MS法同时测定鸡肉中40 种糖皮质激素和9 种非甾体抗炎药物残留[J]. 质谱学报, 2019, 40(2): 123-130. DOI:10.7538/zpxb.2018.0022.
[24] 陈冬梅. 动物性食品中兽药残留定量和确证分析关键技术研究[D]. 武汉: 华中农业大学, 2010: 10-15. DOI:10.7666/d.Y2243354.
[25] 陈容, 刘育形, 王泽林, 等. 固相萃取-超高效液相色谱-串联质谱法测定禽蛋中的67 种禁用药物[J]. 食品安全质量检测学报, 2023, 14(7): 226-234. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.07.031.
[26] MOLDOVEANU S, DAVID V. Chapter 7: mobile phases and their properties[M]//MOLDOVEANU S, DAVID V. Essentials in modern HPLC separations. Elsevier, 2013: 363-447. DOI:10.1016/b978-0-12-385013-3.00007-0.
[27] ROSÉS M, SUBIRATS X, BOSCH E. Retention models for ionizable compounds in reversed-phase liquid chromatography: effect of variation of mobile phase composition and temperature[J]. Journal of Chromatography A, 2009, 1216(10): 1756-1775. DOI:10.1016/j.chroma.2008.12.042.
[28] XIE J M, SONG X Q, ZHANG Y X, et al. Rapid determination of nosiheptide in feed based on dispersive SPE coupled with HPLC[J]. Journal of Separation Science, 2019, 42(3): 706-715. DOI:10.1002/jssc.201801036.
[29] 肖陈贵, 沈金灿, 朱萍萍, 等. 固相萃取结合高效液相色谱-串联质谱法测定鸡蛋中那西肽残留[J]. 食品科学, 2022, 43(4): 299-304. DOI:10.7506/spkx1002-6630-20210223-242.
QiwDgKgOu9GiSD8v0oQQf1S0xTs8Ky6rSsqPmTXzsS8=[30] 郭添荣, 万渝平, 孙利, 等. 通过式固相萃取结合超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速筛查畜禽肉中108 种兽药残留[J]. 分析化学, 2022, 50(2): 271-289. DOI:10.19756/j.issn.0253-3820.211059.
[31] NASIRI A, JAHANI R, MOKHTARI S, et al. Overview, consequences, and strategies for overcoming matrix effects in LC-MS analysis: a critical review[J]. Analyst, 2021, 146(20): 6049-6063. DOI:10.1039/d1an01047f.
[32] FREITAS A, BARBOSA J, RAMOS F. Matrix effects in ultra-high-performance liquid chromatography-tandem mass spectrometry antibiotic multi-detection methods in food products with animal origins[J]. Food Analytical Methods, 2016, 9(1): 23-29. DOI:10.3724/SP.J.1123.2022.03039.
[33] European Medicines Agency. CVMP assessment report for Exzolt (EMEA/V/C/004344/0000)[EB/OL]. (2017-10-20) [2023-03-18]. https://www.ema.europa.eu/en/medicines/veterinary/EPAR/exzolt.
收稿日期:2024-07-02
基金项目:四川省市场监督管理局科技计划项目(SCSJ2021017)
第一作者简介:凌艺菡(1999—)(ORCID: 0009-0000-5070-2762),女,硕士研究生,研究方向为营养与食品卫生。E-mail: tparks@163.com
*通信作者简介:王毅(1984—)(ORCID: 0000-0002-1438-0345),男,高级工程师,博士,研究方向为食品安全。E-mail: wangyichem@163.com
