2个枣品种茎段的组织培养快繁技术
2024-11-07尹云双沈兵琪燕世奇李丽莉靳娟杜振涛张欢田嘉郝庆






关键词:枣;茎段;组织培养;快繁
中图分类号:S665.1 文献标志码:A 文章编号:1003—8981(2024)03—0245—10
枣Ziziphus jujuba 为鼠李科Rhamnaceae 枣属Ziziphus 植物。枣属植物在世界上约有100 多个种,主要在亚洲和美洲热带地区分布,在非洲有少量种植[1]。枣原产于中国,是我国重要的经济树种[2],栽培历史悠久,至今已经有3 000 多年的栽培历史[3-4]。新疆地区光热资源丰富,温差大,独特的气候地理条件促进了红枣品质的提升,使新疆地区成为全国优质红枣栽培区[5]。据统计,2023年全国枣栽培面积约120 万hm2,其中新疆红枣面积31.88 万hm2,占全国栽培面积的26.6%,新疆枣总产量161.01 万t,约占全国干枣产量的50%,新疆已逐渐成为我国枣栽培中心。
枣树品种繁多,遗传背景较复杂,杂合度较高,坐果率低。而且枣树花小,较难摘除雄花和人工授粉,难以获得杂交后代,其繁殖育种远远落后于其他果树。‘赛蜜酥’‘伏脆蜜’2 个品种为新疆地区特有的枣树品种,其枣果实可鲜食也可制干,营养物质含量丰富,老少皆宜,深受人们喜爱[6-7]。其中‘赛蜜酥’的鲜果极为甘甜酥脆,遗传性状稳定,具有较强的早期高产性能[8],是优良的鲜食兼制干早熟品种[9]。‘伏脆蜜’的特点是品质优良、易丰产、成熟早,是较优良的鲜食早熟品种[10]。
目前,生产中通常采用嫁接法来进行枣树品种扩繁。但是,嫁接的生产成本较高,对繁殖材料和砧木的需求量较大[11],受环境与气候条件影响较大,不适用于材料有限的新选育优良品种(如‘赛蜜酥’‘伏脆蜜’)的大量繁殖[12]。利用组织培养技术进行繁殖,可克服传统嫁接繁殖方法的缺点,降低生产成本,不受地域、空间、气候条件影响,缩短育苗周期[13],更有利于优良品种的快速繁育、无病毒幼苗繁殖、种质资源的离体保存[14]。
枣组织培养研究开始于20 世纪70 年代。1978 年,石荫坪等[15] 通过培养‘金丝小枣’等的胚乳首次获得枣三倍体植株;1983 年,张福泉等[16] 以枣当年生幼嫩茎段为试材获得了枣再生植株。目前已建立了超过20 个品种的枣再生体系,包括叶片、茎段、胚乳、枣头芽、花药等不同类型的外植体[17-21]。通过诱导茎段(包括茎尖)的主芽或腋芽萌发,再通过诱导丛生芽或不定芽增殖,所培育的组培苗的成活率通常较高[22],而关于‘赛蜜酥’‘伏脆蜜’2 个品种初代培养中诱导茎段直接分化不定芽的研究鲜见报道。
鉴于此,笔者以‘赛蜜酥’‘伏脆蜜’茎段为外植体材料,研究组织培养条件下不定芽诱导培养、增殖继代培养和生根培养过程中,最佳的外植体消毒方式和激素配比,旨在建立快速高效的‘赛蜜酥’‘伏脆蜜’组培快繁技术体系,为‘赛蜜酥’‘伏脆蜜’2 个枣品种的推广和快速大量繁育提供参考。
1 材料和方法
1.1 材料
供试材料取自新疆喀什地区麦盖提县央塔克乡枣综合实验站内(77°75′33″E,38°98′87″N)。该地区气候干燥,降水稀少,昼夜温差大,土壤类型主要为砂壤土。以‘赛蜜酥’‘伏脆蜜’2 个品种为研究对象,2 个品种均是分别取自同一母树枝条嫁接到酸枣砧木上成活的植株。2023 年4—8 月,选择天气晴朗的清晨,取无病虫害、长势健硕的当年生带芽枣头枝茎段为外植体,采后进行标记,并及时带回实验室处理。
1.2 试验方法
1.2.1 外植体消毒
剪去样品的多余叶片和二次枝,用流水冲洗30 ~ 60 min,然后将枣头枝剪成合适长度的带芽茎段。将处理好的材料移至无菌的超净工作台中进行消毒灭菌。选用毒性小、对外植体伤害小的次氯酸钠(NaClO)溶液作为消毒剂。使用75%乙醇处理30 s,无菌水漂洗3 ~ 5 次,然后使用1%、2% 的NaClO 进行消毒(5、10、15 min),无菌水漂洗3 ~ 5 次,共9 种消毒处理组合(表1)。每瓶接种4 个外植体,每处理接种10瓶,重复3次。组织培养条件:MS 培养基,温度(25±2) ℃,光照强度2 500 ~ 3 000 lx,光照时长12 h/d。培养7 d 后统计外植体污染率及成活率。
1.2.2 不定芽诱导培养
以MS 培养基为基本培养基,采用L9(34) 正交试验设计,设置了9 组6-BA、IBA 和TDZ 激素质量浓度配比(表2)的不定芽诱导培养基。培养基中蔗糖含量30 g/L,琼脂含量5.6 g/L,pH 值5.8。其他培养条件:(25±2) ℃,光照强度2 000 lx,光照时长12 h/d。每瓶接种4 个带芽茎段外植体,每处理接种10 瓶,重复3 次。培养30 d 后统计诱导率,筛选最佳不定芽诱导培养基。
1.2.3 增殖继代培养
采用了L(34) 正交试验设计,设置了9 组6-BA、IBA 和TDZ 激素质量浓度配比(表3)的增殖继代培养基。培养基中蔗糖含量30 g/L,琼脂含量5.6 g/L,pH 值5.8。将经初代不定芽诱导培养获得的组培苗剪成1 ~ 2 cm 的茎段,接种至增殖继代培养基中,置于(25±2) ℃、2 000 lx 光照强度和12 h/d 光照条件下培养。每瓶接种4 个茎段,每个处理接种10 瓶,重复3 次。培养20 d 后统计不定芽增殖生长状况,筛选最佳增殖继代培养基。
1.2.4 生根培养
以1/2MS 为基本培养基,设置了加入不同质量浓度IBA、TDZ 和活性炭的6 组生根培养基(表4)。培养基中蔗糖含量30 g/L,琼脂含量5.6 g/L,pH 值5.8。待不定芽伸长生长3 ~ 5 cm 时,选取长势良好、生长健壮、叶片生长良好无卷曲、节间明显的无菌苗,接种至生根培养基中。接种后,先进行7 d 暗培养,再转为光培养,培养条件为(25±2) ℃、光照强度2 000 lx、光照时长12 h/d。每瓶接种1 株,每个处理10 瓶,重复3 次。培养30 d后观察根系生长情况,筛选最适合‘赛蜜酥’‘伏脆蜜’2 个枣品种的生根诱导培养基。
1.2.5 移栽炼苗
在移栽前锻炼组培苗,使其适应外部环境。组培瓶空间小,遇较强的光照容易使其内部温度快速升高,会导致叶片发生灼烧枯干。因此要采取恰当的炼苗措施,炼苗时逐渐打开培养瓶盖,使幼苗逐步适应外部环境。生根40 d 后准备炼苗移栽,在生长室中分别闭瓶炼苗3、7、10 d,再开瓶炼苗3 d。移栽时(室内温度25 ℃)将根系发达、生长健壮的生根苗从组培瓶中取出,清洗去除根部多余的培养基,将其移栽至装有基质(蛭石与营养土体积比3∶1)的小盆(直径10 cm、高度10 cm)中,放入人工气候室培养,温度为(25±2) ℃,空气相对湿度保持在50% ~ 60%。小盆下放置托盘,提前在托盘中浇水,使基质湿润,利于组培苗成活。试验期间保持基质湿润,利于萌发新根。培养60 d 后统计幼苗成活率。
1.3 数据统计与分析
将获得的数据使用Microsoft Excel 2021 软件进行汇总。统计各阶段处理的污染率、褐化率、成活率、诱芽率、增殖系数、生根率、移栽成活率等。采用SPSS 26.0 统计软件进行方差分析。通过单变量方差分析(ANOVO)结合邓肯检验,进行结果差异显著性分析(α=0.05)。
污染率为污染外植体数量占接种外植体总数量的百分比,褐化率为褐化外植体数量占接种外植体总数量的百分比,成活率为接种成活的外植体数量占接种的外植体总数量的百分比,不定芽诱导率为诱导出不定芽的外植体数量占接种成活的外植体总数量的百分比,增殖系数为增殖的不定芽数量占接种的不定芽总数量的百分比,生根率为生根苗数量占接种苗数量的百分比,移栽成活率为移栽成活的植株数量占移栽植株总数量的百分比。
2 结果与分析
2.1 不同处理对枣茎段组织培养效果的影响
在组织培养过程中,‘赛蜜酥’‘伏脆蜜’2个枣品种茎段外植体的生长情况分别如图1 和图2所示。
2.1.1 不同消毒处理对枣茎段消毒效果的影响
不同质量分数NaClO 溶液及不同消毒时间处理的‘赛蜜酥’‘伏脆蜜’2 个品种枣茎段消毒结果见表5。在使用1% NaClO 溶液消毒条件下:消毒5 min 处理的茎段褐化情况较少但污染情况严重,出现白色污染;消毒10 min 处理的茎段保持正常绿色,且污染率较低,褐化的情况相对较少;消毒15 min处理的茎段表皮未出现白色菌丝污染,随着时间延长渐渐出现黄褐色小斑点,切口处韧皮部呈现黄白色。在使用2% NaClO 溶液消毒条件下,消毒5 min 处理的茎段保持正常绿色,因消毒时间较短,污染并未随NaClO 质量分数增高而降低,但褐化率增高;消毒10 min 处理的茎段污染率降低,褐化情况也较少;消毒15 min 处理的茎段表皮逐渐出现褐色斑点,污染率不高,但较嫩茎段整体易褐化。在使用NaClO 溶液对枣茎段进行消毒时,使用2% NaClO 消毒10 min 不但能较好地控制污染率,而且褐化率较相同NaClO 质量分数处理15 min 时无明显上升。总体来看,适宜的消毒方式为75% 乙醇处理30 s 与2% NaClO 溶液处理5 ~ 10 min 组合,NaClO 消毒10 min 是最佳处理(表5,图3)。
2.1.2 不同激素配比对枣茎段不定芽诱导的影响
将‘赛蜜酥’‘伏脆蜜’枣茎段接种至不同激素配比的不定芽诱导培养基中,7 d 左右茎段腋芽开始萌发,芽逐渐伸长生长,叶片逐渐长大舒展,25 d 后不定芽高度可达3 cm 左右。由表6 可知:当6-BA 质量浓度相同时,随着IBA、TDZ 的质量浓度增加,外植体萌芽率先升高后降低,当IBA、TDZ 质量浓度在0.2、0.010 mg/L 时‘赛蜜酥’‘伏脆蜜’2个品种枣茎段的萌芽率均最高,分别为79.19%、87.50%。因此,‘赛蜜酥’‘伏脆蜜’2个品种枣头枝茎段不定芽诱导的适宜培养基为MS+1.0 mg/L 6-BA+0.2 mg/L IBA+0.010 mg/LTDZ+30 g/L 蔗糖+5.6 g/L 琼脂。
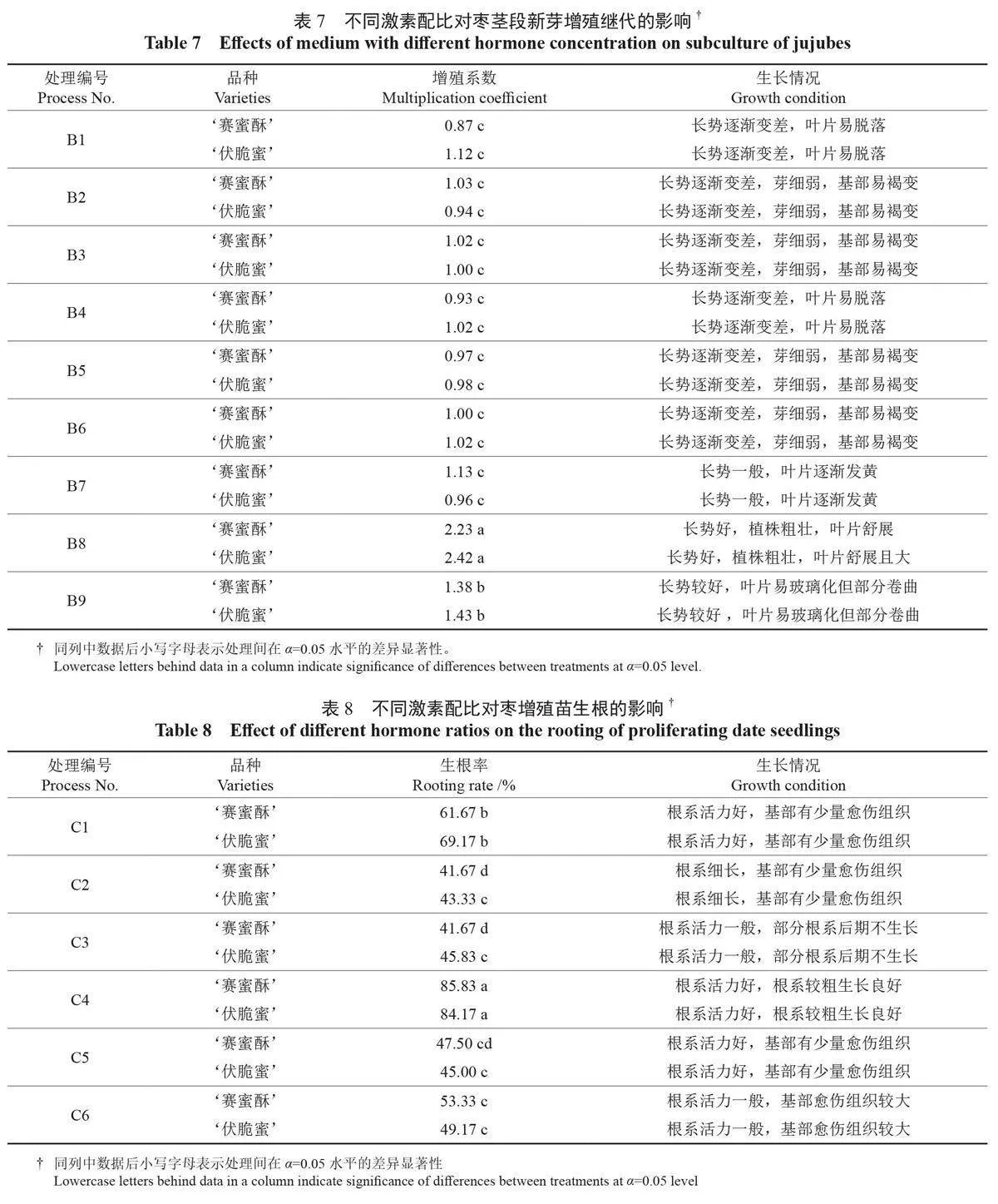
2.1.3 不同激素配比对枣茎段新芽增殖继代的影响
对诱导出的‘赛蜜酥’‘伏脆蜜’2 个品种的新芽进行继代增殖培养,经多次继代增殖后发现不同质量浓度的6-BA、IBA 和TDZ 配比对增殖继代的影响显著(表7)。在9 组处理中,当6-BA质量浓度为0 时:仅加入质量浓度为0.006 mg/L的TDZ,增殖系数不高,新芽长势随时间推移逐渐变差,直至叶片脱落;加入质量浓度为0.2、0.4 mg/L 的IBA 和0.008、0.010 mg/L 的TDZ 时,叶片长势一般,芽细弱,基部逐渐褐化。随6-BA质量浓度增加,增殖系数逐渐增高,植株长势逐渐良好。当6-BA 质量浓度为1.0 mg/L 时,植株叶片舒展,长势良好;当6-BA、TDZ 质量浓度分别为1.0、0.006 mg/L 时,2 个品种均生长良好,其中‘赛蜜酥’的增殖系数普遍较高,增殖能力较强,植株健壮,叶片舒展,节间明显,有利于后期的生根培养。因此,‘赛蜜酥’‘伏脆蜜’2 个品种枣头枝茎段不定芽诱导的适宜培养基为MS+1.0 mg/L6-BA+0.2 mg/L IBA+0.006 mg/L TDZ+30 g/L 蔗糖+5.6 g/L 琼脂。
2.1.4 不同激素配比对枣增殖苗生根培养的影响
以1/2 MS 培养基为基本培养基,对增殖继代的植株进行生根培养,结果见表8。当NAA 质量浓度相同时,加入0.3 g/L 活性炭处理的根系生长情况明显好于不加入活性炭处理;随着IBA 质量浓度增加,根系开始出现愈伤组织,当IBA 质量浓度0.1 mg/L,根系长势最好,无多余愈伤组织出现。因此,‘赛蜜酥’‘伏脆蜜’增殖苗生根的适宜培养基为1/2 MS+0.1 mg/L IBA+0.1 mg/LNAA+0.3 g/L 活性炭+15 g/L 蔗糖+5.6 g/L 琼脂。
2.2 不同闭瓶处理对枣组培苗成活的影响
用于大田生产的枣组培苗要经过从异养状态过渡到主要由光合自养生长状态的驯化过程。组培苗在培养瓶中处于相对封闭的状态,相对湿度高(80% ~ 95%),光照不足(一般容器的光照强度为1 500 ~ 3000 lx,远低于室外的自然光照强度),移栽驯化时组培苗要从较高湿度及弱光照状态慢慢过渡到自然环境状态下。对生根40 d后的组培苗进行3、7、10 d 炼苗3 种闭瓶处理,试验结果表明,闭瓶炼苗7 d,再开瓶炼苗3 d 处理的‘赛蜜酥’‘伏脆蜜’组培苗成活率最高,分别可达53.3%、56.6%。成活的‘赛蜜酥’‘伏脆蜜’组培苗生长情况如图4所示。
3 讨论与结论
以‘赛蜜酥’‘伏脆蜜’当年生枣头枝茎段为外植体材料,对组织培养过程中最佳的外植体消毒方式以及最适合不定芽诱导与伸长、增殖继代、生根的添加物种类与浓度配比进行了研究,初步建立了‘赛蜜酥’‘伏脆蜜’2 个品种枣茎段组织培养快繁体系。外植体最佳消毒方式为75%乙醇处理30 s 加上2%NaClO 溶液处理5 ~ 10 min组合, 最佳不定芽诱导培养基为MS+1.0 mg/L6-BA+0.2 mg/L IBA+0.010 mg/L TDZ+30 g/L 蔗糖+5.6 g/L 琼脂, 最佳增殖培养基为MS+1.0 mg/L6-BA+0.2 mg/L IBA+0.006 mg/L TDZ+30 g/L 蔗糖+5.6 g/L 琼脂,最佳生根培养基为1/2 MS+0.1 mg/LIBA+0.1 mg/L NAA+0.3 g/L 活性炭+15 g/L 蔗糖+5.6 g/L 琼脂。
对外植体的消毒灭菌处理是建立组培快繁体系的重要环节。消毒处理的最佳效果是,消毒彻底,并且外植体组织尽可能不受损伤,细胞仍可旺盛生长和分化。目前,使用乙醇、氯化汞、NaClO进行组合消毒的研究报道较多[23-25]。本研究中采用乙醇、次氯酸钠对外植体进行组合消毒,可以降低对外植体的伤害且安全性较高,对环境的污染较小,最佳的消毒方式为75% 乙醇处理30 s 与2%NaClO 处理10 min 组合。
在不定芽再生体系中,基本培养基、植物激素的种类及浓度均是影响不定芽诱导、生长、增殖、生根的主要因素。培养基包含着植物生长需要的物质,不同枣品种的不同外植体在不同阶段对营养物质的需求各不相同,因此要根据品种、外植体材料来选用最适合的培养基。枣树组织培养中常用的培养基有MS、1/2 MS[26-27]、WPM[28] 等。诱导不定芽再生时一般选用MS 作为基本培养基,例如马牙枣、鲁枣3 号[29] 以MS作为基本培养基时,不定芽的诱芽率较高;在枣外植体增殖继代培养研究中,多选用MS 作为基本培养基;枣组培苗生根培养多选用1/2 MS 为基本培养基。
在木本植物枣树的组织培养研究中,存在严重的褐化现象[30-32]。植物激素可以促进组织和器官的分化、有效调控细胞生长、植株生长发育,防止外植体褐化。在枣树的组织培养研究中,常用的植物激素中生长素有IBA、2,4-D、IAA、NAA,细胞分裂素有6-BA、TDZ 和KT[33]。在诱导出不定芽后,通过增殖继代,可以得到大量不定芽,这是建立完善的枣植物组织培养体系并进行苗木扩繁的重要步骤。在增殖继代研究中,仅添加6-BA 和IBA 的培养基中,2 个品种的组培苗长势一般,增殖率不高,加入适当浓度的TDZ 可以显著促进组培苗不定芽的增殖与生长[34]。增殖继代培养后转入生根培养,生根培养是移栽前的最重要环节,经过生根培养,组培苗长出具有从基质中吸取营养能力的根系。在诱导枣树离体再生过程中,不同阶段、不同品种、不同外植体需要的生长素和细胞分裂素的浓度配比是不同的。因此,在建立枣树组织培养快繁体系过程中,探究适宜的生长素和细胞分裂素浓度配比,对提高不定芽诱导率、增殖率、生根率以及减少褐化等起到十分关键的作用。
目前,已成功建立了较多种类植物的组织培养快繁体系,其中包括多个枣品种。但是不同枣品种、不同外植体的组织培养快速繁殖的效果不同[35],而且枣当年生枝条茎段只能在夏天进行采集,受时间、材料数量的限制较大,下一步将以叶片、花药或其他部位作为外植体探索构建枣组织培养快繁体系。