软枣猕猴桃2个品种(系)果实发育期内源激素含量的变化
2024-11-07张良英刘林梁春莉齐边斌白百一曹润发
关键词:软枣猕猴桃;果实发育;形态指标;内源激素
中图分类号:S663.4 文献标志码:A 文章编号:1003—8981(2024)03—0036—09
作为植物体内合成的微量生理活性物质,内源激素在形态建成、果实发育及逆境生理等方面均具有不可替代的调控作用[1]。在果实发育过程中,细胞的分裂、膨大均与各类激素的协同或拮抗作用密切相关[2]。生长素能促进果实细胞的分裂及体积的增大,研究表明IAA 与黄瓜的纵径生长显著相关[3]。目前,已发现包括顺式玉米素核苷(czR)、反式玉米素(tZ)、反式玉米素核苷(tzR)及异戊烯腺嘌呤核苷(iPR)等[3-4] 的多种细胞分裂素,可刺激细胞分裂,并通过调运同化产物的运输促进细胞膨大[5-7]。赤霉素也对果实的膨大存在重要作用,且与生长素存在协同作用,在枣树等作物[8-9]上的研究发现施用外源GA3 可提高果实IAA 的含量也支持这一观点。此外,在部分植物上的研究表明脱落酸(ABA)、茉莉酸(JA)可能在果实的生长发育方面也具有调控作用[3,10]。
软枣猕猴桃Actinidia arguta,与中华猕猴桃、美味猕猴桃同为猕猴桃科猕猴桃属植物,是一种经济价值较高的特色浆果类果树[11]。目前,果实内源激素含量变化及植物生长调节剂对其影响的研究主要集中于栽培规模相对较大的中华猕猴桃、美味猕猴桃[2,12-14]。对中华猕猴桃‘红阳’的研究从激素、分子水平探讨了CPPU 调控果实发育的可能机制,发现处理后果实的ZT 和GA3 含量明显增加,IAA 和ABA 含量下降[14]。对美味猕猴桃‘贵长’的研究认为,果实发育初期IAA、GA3及ABA 等内源激素的含量异常与分布不均可能是导致畸形果产生的重要原因[2]。关于软枣猕猴桃果实内源激素含量变化的研究则相对较少。黄晗羽等[15] 对软枣猕猴桃‘湘猕’在授粉过程中子房内源激素的动态变化进行了研究。王利新[16] 对‘魁绿’等3 个软枣猕猴桃品种的研究发现,在盛花后45 ~ 60 d IAA、GA 和CTK 的含量较高,ABA和ETH 则在盛花后45 ~ 90 d 较高,且ABA 和ETH 含量与单果质量、纵横侧径显著正相关。
‘龙成2号’与‘海佳’2个软枣猕猴桃品种(系)在辽宁省广泛栽培,二者在果形及采收期等方面存在一定差异。品种‘龙成2号’果实长圆柱形;品系‘海佳’为扁圆柱形,采收期比前者早7 ~ 14 d。因此,选择‘龙成2 号’与‘海佳’为试材,利用超高效液相色谱- 三重四级杆质谱联用技术(LC-QQQ-MS)分析果实发育期间内源激素动态变化及果实发育规律,初步探讨内源激素对果形及果实采收时间的影响,为软枣猕猴桃的科学管理提供理论依据,也为果实发育机理的进一步研究提供参考。
1 材料与方法
1.1试验材料
试验于2023年在辽宁省营口市郭屯软枣猕猴桃种植园进行,栽培品种(系)为5年生‘海佳’‘龙成2 号’,棚架栽培。每个品种(系)设3个小区,每小区2 ~ 3株树。每小区于开花前2~3d选定长势中等的结果枝套授粉袋。开花后用收集的同一雄株的花粉进行授粉,每小区授粉花朵数约为150朵,完毕后继续套袋7d。授粉后25d开始,每隔20 d 取样一次,直至果实可溶性固形物含量达6.2% 以上时采样结束,此时已有少量果实成熟软化后脱落。
1.2 试验方法
1.2.1 果实形态指标的测定
每小区随机选取1 株果树,按东、南、西、北4 个方位分别采集3 ~ 4 个果实,分别称重、计算单果质量的平均值,随后测定果实的纵、横、侧径,重复3 次。上述各项指标的净增长速率计算参照徐臣善等[17],净增长速率=(w2-w1)/(t2-t1);相对增长速率=(ln w2-ln w1)/(t2-t1)[18-19]。其中,w1 和w2 分别为前后2 次样品的观测值,t1、t2 为对应的授粉后天数。最后,切取果肉、液氮速冻研磨,-80 ℃保存,用于内源激素测定。
1.2.2 果实内源激素的测定
称取200 mg 样品,加入1.5 mL 提取液(甲醇︰水︰甲酸=800︰19.9︰0.1),冰水浴超声20 min,于-80 ℃冰冻1.5 h,4 ℃下15 000 rpm 离心10 min。取上清液移至方孔2.2 mL U 型底的96 孔浅孔板中,使用氮吹仪吹干,加100 μL 80% 甲醇(0.1% 甲酸)复溶,0.22 μm 滤膜过滤后移至棕色带衬管上样瓶,所有步骤尽可能避光。
内源激素测定利用Agilent 6470三重四极杆液质联用系统进行,重复3 次。定量分析方法参考Wu 等[20]。
色谱条件: 色谱柱型号为ZORBAX RRHDEclipse Plus C18(2.1×50 mm,1.8 μm),柱温25 ℃。进样盘温度4 ℃,进样量5.0 μL。流动相及流速:A 液为0.1% FA(甲酸)水溶液,B 液0.1% FA 乙腈,流速300 μL/min。相关液相梯度为:0 ~ 7min,A 液维持在80%;7 ~ 8 min,A 液变化为20%;8 ~ 10 min,A 液维持在20%。
质谱条件:采用电喷雾电离正负离子同时扫描检测模式和多反应监测的质谱扫描模式,离子源温度:250 ℃,雾化器压:45 psi,电喷雾电压:3 500 V,正离子模式对应的化合物IAA、tZ 和tzR,负离子模式对应的化合物ABA、GA3。
1.3 数据分析
采用Excel 软件整理数据,利用SPSS 22 软件进行Duncan 多重比较和相关性分析。
2 结果与分析
2.1 2个品种(系)软枣猕猴桃果实发育期间果实形态指标的变化
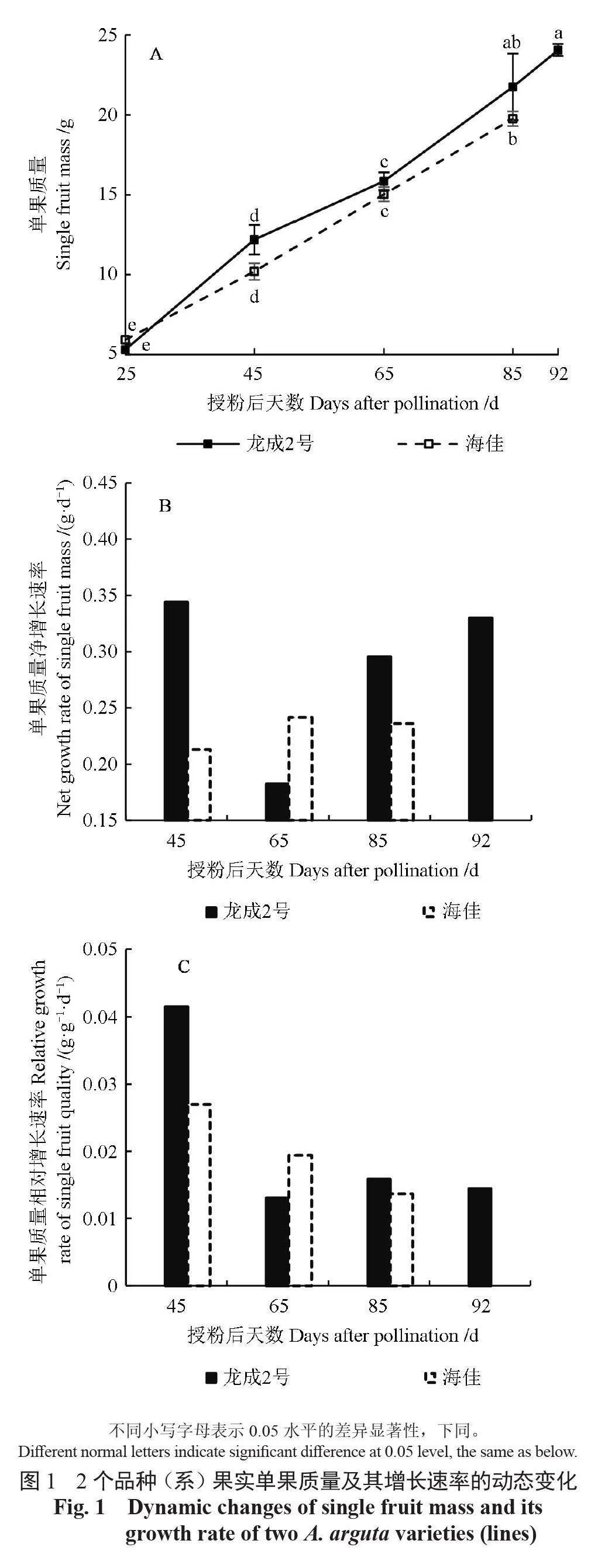
2 个品种(系)果实的单果质量动态变化如图1 所示。在各发育阶段,‘龙成2 号’与‘海佳’的单果质量均无明显区别。‘海佳’的采收期比‘龙成2 号’提前约7 d,但采收时果实的单果质量为19.75 g,明显低于‘龙成2 号’。无论单果质量的净增长速率还是相对增长速率,‘龙成2 号’均存在2 个快速增长期,分别出现在授粉后25 ~ 45 d 及授粉后65 ~ 92 d,而授粉后45 ~65 d 则增长相对缓慢。在整个果实发育期,‘海佳’的单果质量基本保持匀速增长,单果质量净增长速率保持在0.21 ~ 0.25 g·d-1 之间,最高值出现于授粉后45~65 d;而单果质量相对增长速率在授粉后45 d 达到峰值,此后逐步下降。
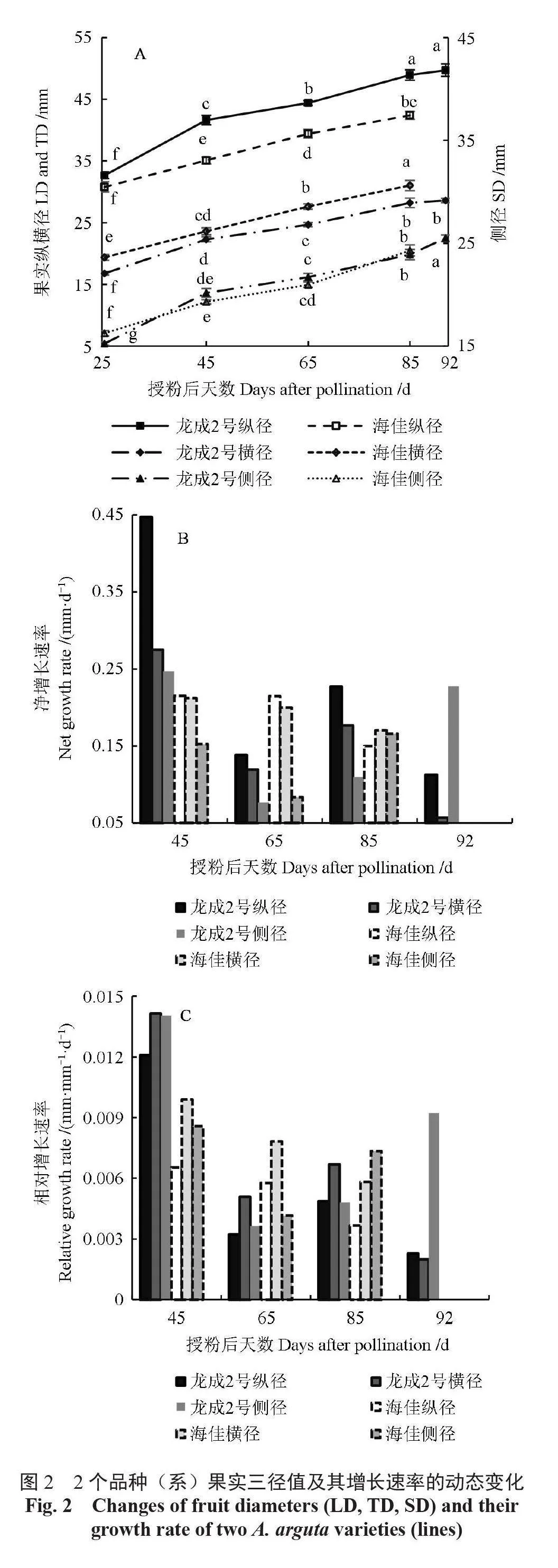
果实纵、横、侧径的动态变化如图2所示。在果实发育各阶段,‘龙成2号’的纵径始终高于‘海佳’,除授粉后25 d 外二者的差异均达到显著水平;在果实横径方面,除授粉后45 d 外,‘龙成2 号’的横径始终显著低于‘海佳’。‘龙成2号’果实的纵、横径生长存在2个高峰期,而‘海佳’则表现出单峰的生长趋势,这与2 个品种(系)的单果质量增长规律基本一致。值得注意的是,2者的侧径发育规律却基本相似,均表现出快- 慢-快的变化规律。2个品种(系)果实的纵、横、侧径相对增长速率与单果质量相对增长速率的变化规律基本一致。
如图3 所示,授粉后25 d 时,‘龙成2 号’和‘海佳’的果形指数分别为1.95、1.59,区别明显。随着果实发育时间的延长,‘龙成2号’与‘海佳’的果形指数均呈现出下降的趋势,至果实发育末期2 者分别下降0.21、0.22,总的下降幅度基本一致。但自果实发育初期开始,‘海佳’的果形指数就已极显著低于‘龙成2 号’,因此果形指数的下降速率并不能准确反映其纵、横径的增长速率。虽然‘龙成2 号’的纵径净增长速率始终高于横径,但在授粉65 d 后纵径与横径净增长速率的差距明显缩小;而‘海佳’的横径与纵径的净增长速率差距不大,甚至在授粉后65 ~ 85 d 超过纵径净增长速率。
2.2 软枣猕猴桃2 个品种(系)果实发育期间内源激素的动态变化
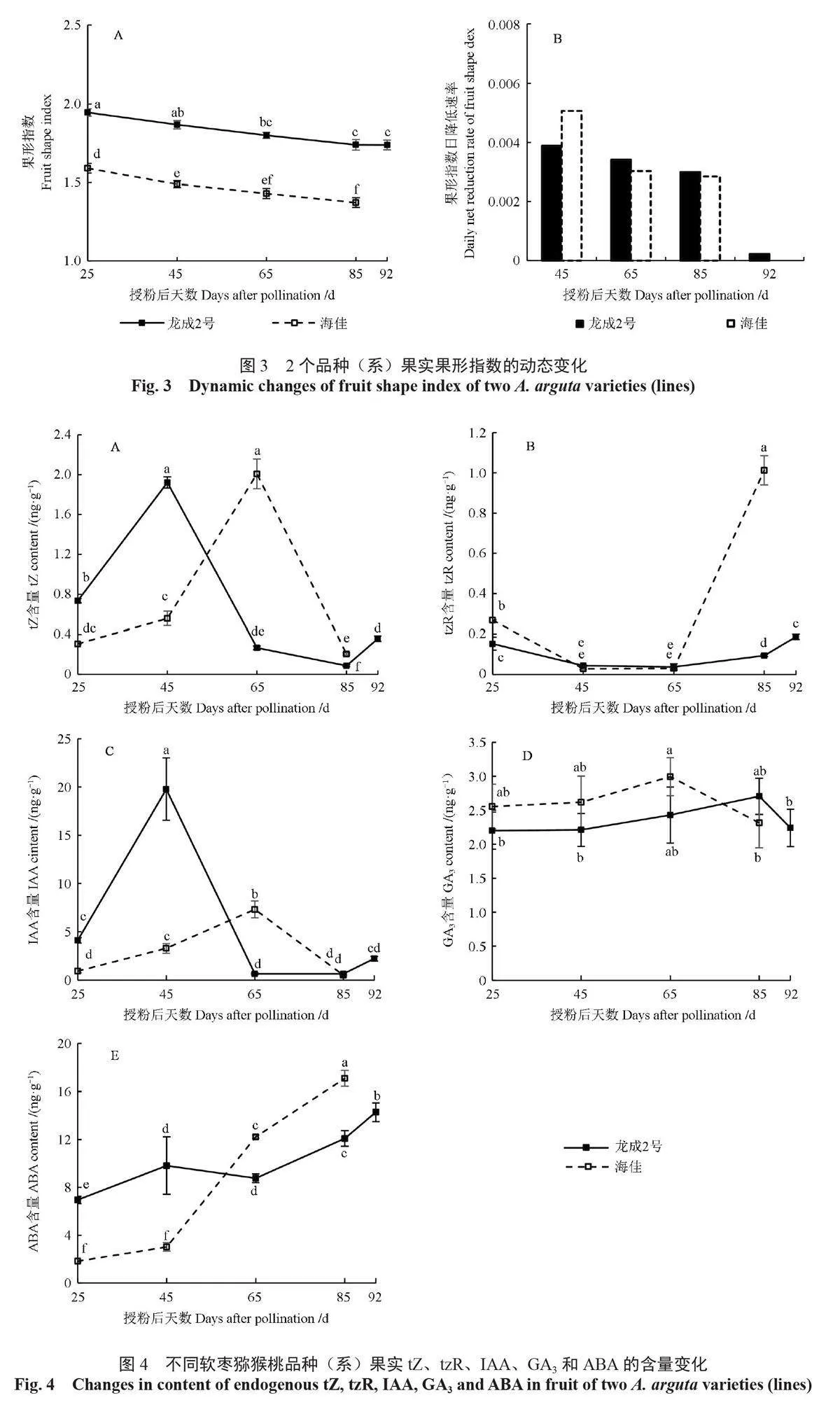
2个品种(系)果实的tZ、tzR 含量动态变化如图4 所示。其中,二者的tZ 含量变化规律存在一定差异。‘龙成2 号’在果实发育前期(授粉后25 ~ 45 d)tZ 含量迅速上升并于授粉后45 d 达到高峰,该时间对应果实的第一次快速增长期。随后,tZ 含量逐步下降,但在授粉后92 d 略有回升。与之相比,‘海佳’tZ 含量的峰值相对滞后,出现于授粉后65 d,但与‘龙成2 号’的最大峰值差异不显著,这与该时期‘海佳’果实生长迅速相一致。而同样属于细胞分裂素类的tzR 在2个品种(系)果实中的含量变化规律则基本相似,均表现为初期下降,于授粉后65 d 开始回升。这2次峰值出现的时间点与‘龙成2 号’果实的2 次快速生长期基本一致,但2 次峰值的tzR 含量却以‘海佳’相对较高,分别为‘龙成2 号’的1.76倍和5.41倍,差异显著。
同一品种(系)果实的IAA 与tZ 含量动态变化规律大体相似。‘龙成2 号’的IAA 峰值同样出现于授粉后45 d,此后保持较低的水平,但授粉后92 d 略有回升。‘海佳’IAA 含量的峰值出现时间相对较晚,与tZ 及GA3 均在授粉后65 d 达到最高值,表现出高度一致性。‘龙成2 号’的IAA 峰值含量为19.78 ng.g-1,为‘海佳’峰值的2.70倍,2 者差异明显。
自授粉后25 d 起,2个品种( 系) 果实的GA3 含量相对较为平稳,在2.1 ~ 3.0 ng·g-1 范围内略有起伏。除授粉85 d 外,‘海佳’的GA3 含量均高于‘龙成2 号’,在授粉后65 d 达到最高值,为2.99 ng·g-1,略高于同时期的‘龙成2 号’。‘龙成2 号’的GA3 含量最高值出现于授粉后85 d,达2.70 ng·g-1。
2个品种(系)果实的ABA 含量均随着果实发育进程的推进呈现出曲折上升的趋势。与‘龙成2 号’相比,在授粉后25 ~ 45 d‘海佳’的ABA 含量处于较低水平,此后迅速上升且显著高于同时期‘龙成2 号’的ABA 含量。‘龙成2 号’与‘海佳’的ABA 含量最大值分别出现于授粉后92 d、85 d,为14.28、17.11 ng·g-1,差异显著。这与二者的采收期基本一致,同时也说明了软枣猕猴桃果实接近成熟时的ABA 含量处于较高水平。
2.3 果实发育期间内源激素与果实生长发育的相关关系
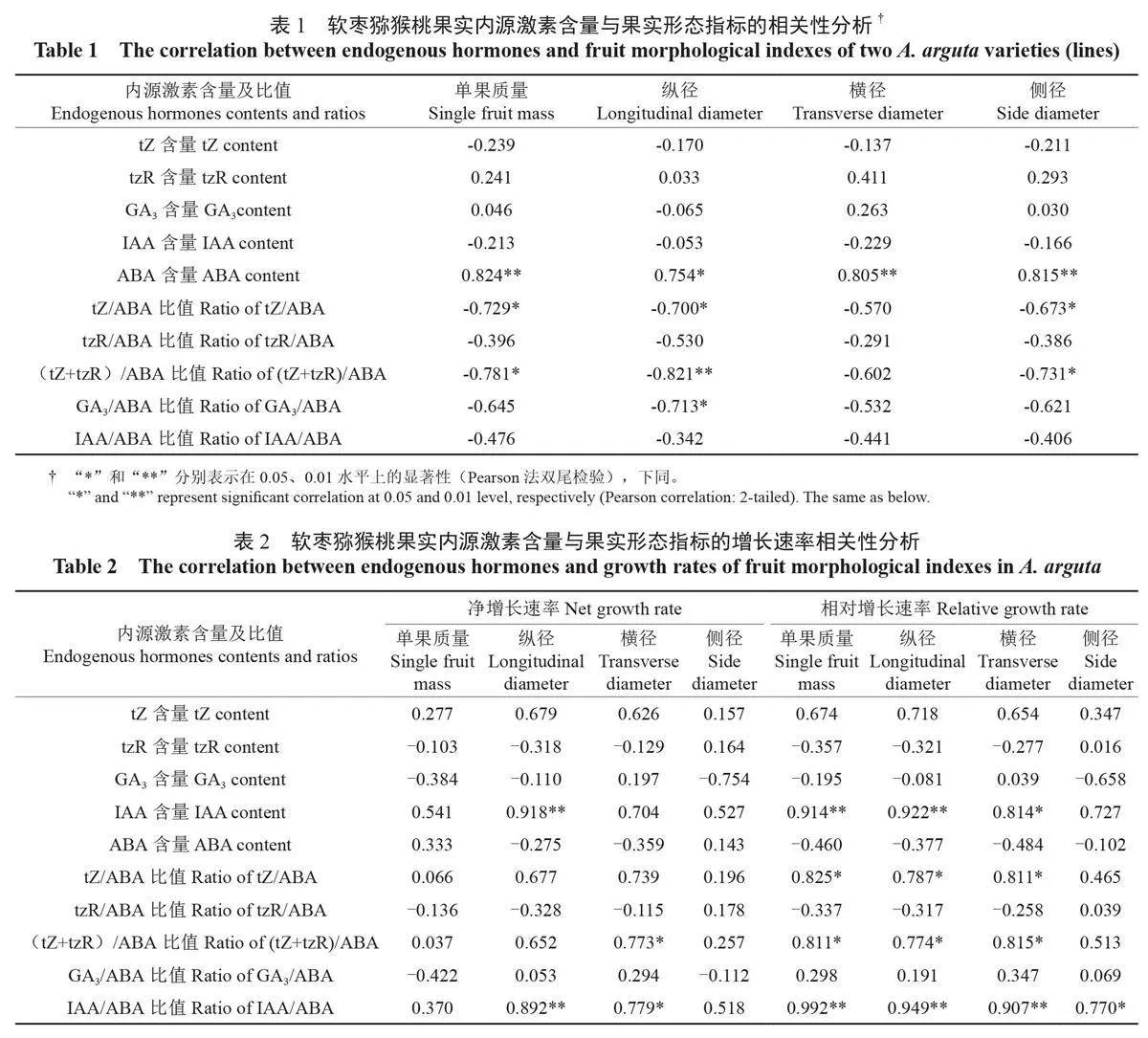
对果实形态指标与内源激素含量进行相关性分析,结果可见表1。在所有内源激素中,仅ABA 含量与2 个品种(系)的单果质量、果实横径、侧径呈极显著正相关,与纵径显著正相关。而tZ/ABA与单果质量、纵径和侧径显著负相关;GA3/ABA 与果实纵径显著负相关;(tZ+tzR)/ABA 与纵径极显著负相关,与单果质量和侧径显著负相关。
同时,采用相关形态指标的净增长速率、相对增长速率分别与激素含量及其比值进行相关性分析(表2)。在所有内源激素中,仅IAA 含量与各指标相关性较强,与纵径的净增长速率、相对增长速率以及单果质量的相对增长速率均呈极显著正相关,与果实横径的相对增长速率为显著正相关。与内源激素绝对含量相比,内源激素的比值表现出了更强的相关性。其中,IAA/ABA 与果实纵径的净增长速率、相对增长速率以及单果质量、横径的相对增长速率均表现出极显著的正相关性;tZ/ABA 与单果质量、纵径、横径的相对增长速率呈显著正相关,与各指标的净增长速率均无明显相关性;(tZ+tzR)/ABA 与单果质量、纵径、横径的相对增长速率均呈显著正相关,但在净增长速率方面仅与横径显著相关。
3 结论与讨论
3.1 2 个品种(系)软枣猕猴桃果实生长发育特点
在果实发育过程中,‘龙成2 号’呈现出相对较明显的“快—慢—快”的双S 曲线,这与对软枣猕猴桃[16,21] 的一些研究结论基本一致。而‘海佳’的果实发育规律则略有区别,除果实侧径外,其单果质量、果实纵横径均未表现出明显的缓慢生长期。在梨、杏等果树上的研究[22-23] 也表明果实的生长发育规律存在一定的品种、种质间差异,初步推测可能与品种的遗传特性或成熟期等有关。
对‘黄金梨’与‘早蜜梨’果实的研究表明,发育初期以纵径生长、后期以横径生长为主[7]。2 个软枣猕猴桃品种(系)的纵横径生长也呈现出类似的趋势,其中‘龙成2 号’的纵径净增长速率虽然始终高于横径,但在果实发育中后期二者差距明显缩小;而‘海佳’的纵径净增长速率在初期仅略高于横径且差异不明显,后期纵径净增长速率甚至低于横径。这一现象也与二者的果实分别为长圆柱形、扁圆柱形相一致。但考虑到早在授粉后25 d 时,2 个品种(系)的果形指数已存在明显区别,因此果实纵、横径之间净增长速率的比值可能并不是造成二者果形差异的主要原因。有研究认为,猕猴桃的果形是在花芽发育期形成的,因此果形差异的产生可能需要追溯到坐果期甚至花芽分化期[2],果形的主要影响因素仍需进一步深入探讨。
3.2 2 个品种(系)软枣猕猴桃果实发育与内源激素的关系
植物激素主要通过直接或间接调节果实细胞分裂和扩展过程调控果实生长,进而影响果实的大小和形状[3]。果实在发育前期通常以细胞分裂为主,而IAA 和ZT 分别促进细胞核和细胞质的分裂,GA主要促进细胞的膨大[7,24]。本研究中,‘龙成2 号’的tZ、IAA 峰值同时出现于果实的第1次快速增长期,在第2 次快速增长期仅略有回升;tzR 含量虽然整体上低于tZ,但2 个峰值与2 个快速增长期相对应;而GA 的峰值仅出现于第2 次快速增长期。由此可见,在‘龙成2 号’果实中,同一种激素出现峰值的时间并不能完全与果实生长曲线相吻合,这说明不同发育阶段起主要调控作用的激素种类可能并不相同。与之相比,‘海佳’的tZ、IAA 和GA峰值出现时间较为集中,均出现于授粉后65 d。总体来看,2 个软枣猕猴桃品种(系)的各类内源激素峰值出现时间存在一定的差异,这可能是导致2个品种(系)果实发育规律存在区别的原因之一。在其他植物上也有类似的发现,如廖明安等[7] 对不同成熟期梨的研究表明果肉中各种内源激素含量及峰值出现时间呈现不同的变化趋势。
通常认为ABA 与植物的休眠、果实成熟及器官脱落等密切相关[10,25]。ABA 对呼吸跃变型和非跃变型果实的成熟都存在至关重要的作用,可通过诱导乙烯的合成调控果实成熟[10]。软枣猕猴桃为跃变型果实,在果实发育中后期‘龙成2 号’与‘海佳’果实的ABA 含量均随着果实发育进程的推进逐步上升,且‘海佳’ABA 含量上升得更早,这可能是其采收期甚至成熟期较早的重要原因之一。与猕猴桃[12-13] 相比,软枣猕猴桃的ABA 含量上升趋势较明显,这也与软枣猕猴桃果实成熟后易脱落的现象相符合。
与王利新[16] 对‘魁绿’等3 种软枣猕猴桃的研究相比,同样采收期较早的‘海佳’在ABA 含量的变化趋势上基本相似;IAA、GA、CTK 的变化规律则存在一定区别,虽然最高峰值出现的时间均基本一致,但峰的数量、激素含量并不完全一致,可能与取样时间、检测方法、具体检测物质种类及品种差异等有关。而采收期较晚的‘龙成2 号’的IAA、tZ 却与美味猕猴桃‘海沃德’的IAA、ZRs 变化规律基本类似[12]。
3.3 软枣猕猴桃内源激素与果实发育的相关关系
采用果实形态指标与内源激素含量进行相关性分析,只有ABA 含量与单果质量、纵横侧径等相关形态指标显著正相关,这与王利新[16] 的研究结果基本一致,仅能说明ABA 含量在果实发育期间呈上升趋势。在果实发育过程中,由于大多数果实形态指标呈不可逆性增长且具有累加效应,而不同种类的内源激素含量则在不同时期表现出下降或上升等可逆性增减,可能是造成上述结果的主要原因之一。因此,初步推测果实形态指标不宜直接用于相关性分析。
在果实发育过程中,经常采用的描述性指标除果实形态外还包括净增长速率、相对增长速率等。其中,相对增长速率多数用于计算样本干重的相对增长速率[18],可代表其净库力活性,但也有一些研究用于株高、鲜质量等相对增长速率[19,26]。因此,尝试结合相关果实形态指标的净增长速率、相对增长速率2 类参数,分析‘龙成2 号’、‘海佳’内源激素含量与果实发育的相关性,以探索内源激素对2 个品种(系)果实发育的共性调控作用。与果实形态指标相比,2类参数显然更适于进行相关性分析。综合认为,IAA 尤其是IAA/ABA 对果实发育的促进作用最明显,这可能与二者间的IAA 峰值差异较大有关,同时也是导致‘龙成2 号’单果质量较高的原因之一。其次,(tZ+tzR)/ABA 也有一定的促进作用。而GA3 与果实发育的相关性相对不明显,可能与GA含量在2 个品种(系)果实中相对比较平稳有关,并不意味着可以忽视GA 在果实发育过程中的作用,其作用有待扩大试验材料深入探讨。
果实生长发育是由多种激素共同参与调控的复杂的生理生化进程,不同激素的作用不尽相同且存在着相互协调或拮抗等多种相互关系[27],在本研究中内源激素的比值与果实生长指标的相关性较强也表明了不同激素间协同或拮抗作用对果实发育存在重要影响。但由于内源激素相互关系及作用方式的复杂性,其具体效应仍有待于进一步深入研究加以验证、确定。