乳酸菌接种发酵对耿马酸肉品质的影响
2024-11-05吴春霞石有权杨雁王琪施丽芬念许若彭婷婷陈韬




摘 要:为提高耿马酸肉的品质和安全性,将植物乳植杆菌(Lactiplantibacillus plantarum)GMSR-4、戊糖乳杆菌(Lactiplantibacillus pentosus)GMSR-20和植物乳植杆菌GMSR-35按体积比1∶2∶2、接种量3%接种到耿马酸肉中,同时设置对照(control check,CK)组,在25 ℃发酵6 d,测定2 组样品理化指标、微生物数量和感官品质的变化。结果表明,接种发酵(inoculated fermentation,IF)组的亚硝酸盐残留量、水分含量、pH值、生物胺总量、腐胺、尸胺、亚精胺、酪胺、苯乙胺和色胺含量显著低于CK组(P<0.05),菌落总数和乳酸菌数显著高于CK组
(P<0.05),大肠菌群数显著低于CK组(P<0.05),IF组的各个感官指标评分均高于CK组。综上,人工接种发酵可提高耿马酸肉的食用品质和安全性。
关键词:耿马酸肉;乳酸菌;微生物;生物胺;安全性
Effects of Inoculated Fermentation with Lactic Acid Bacteria on the Quality of Gengma Sour Meat
WU Chunxia1, SHI Youquan2, YANG Yan1,3, WANG Qi1,4, SHI Lifen1, NIAN Xuruo1, PENG Tingting1, CHEN Tao1,*
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. Yunnan Provincial Light & Textile Design Institute Co. Ltd., Kunming 650041, China; 3. School of Tourism, Kunming University, Kunming 650214, China;
4. College of Wuliangye Technology and Food Engineering, Yibin Vocational and Technical College, Yibin 644003, China)
Abstract: To improve the quality and safety of Gengma sour meat, Lactiplantibacillus plantarum GMSR-4, Lactiplantibacillus pentosus GMSR-20 and L. plantarum GMSR-35 with a ratio of 1:2:2 (V/V) were inoculated at an inoculum size of 3%. Uninoculated samples were used as a control. After 6 days of fermentation at 25 ℃, changes in physicochemical indexes, microbial load and sensory quality were measured between the inoculated fermentation (IF) and control groups. The results indicated that the levels of residualhKU4BLX7qjDb1iTgTWfs6nTOq/1GC2PXGv8Qj3ZYlKU= nitrite, moisture, pH, total biogenic amines, putrescine, cadaverine, spermidine, tyramine, phenethylamine and tryptamine were significantly lower and the counts of total bacteria and lactic acid bacteria were significantly higher in the IF group than in the control group (P < 0.05). Moreover, the number of coliforms was significantly lower (P < 0.05) and sensory scores for various attributes were higher in the IF group than in the control group. In conclusion, inoculated fermentation can improve the eating quality and safety of
Gengma sour meat.
Keywords: Gengma sour meat; lactaria acid bacteria; microorganism; biogenic amines; safety
DOI:10.7506/rlyj1001-8123-20240806-201
中图分类号:TS251.5+1 文献标志码:A 文章编号:1001-8123(2024)11-0018-05
引文格式:
吴春霞, 石有权, 杨雁, 等. 乳酸菌接种发酵对耿马酸肉品质的影响[J]. 肉类研究, 2024, 38(11): 18-22. DOI:10.7506/rlyj1001-8123-20240806-201. http://www.rlyj.net.cn
WU Chunxia, SHI Youquan, YANG Yan, et al. Effects of inoculated fermentation with lactic acid bacteria on the quality of gengma sour meat[J]. Meat Research, 2024, 38(11): 18-22. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240806-201. http://www.rlyj.net.cn
中国传统酸肉是一种熟食、发酵时间较长的发酵肉制品。耿马酸肉是云南省临沧市耿马县当地特色的发酵肉制品,当地居民主要以生食为主,也可蒸熟后食用。耿马酸肉是由剁碎的猪瘦肉、熟猪皮条及辅料混匀后,用新鲜柊叶包裹发酵2~6 d而成。据报道,一些即食发酵肉制品可能存在生物胺中毒和致病菌致病的风险[1-2],某些传统酸肉中也检出较高含量的生物胺和较多数量的致病菌[3-5]。目前,接种发酵是提高酸肉食用品质和安全性常见的方法之一,如Zhang Yunlong等[6]研究表明,湘西酸肉接种弯曲乳杆菌(Lactobacillus curvatus)和戊糖片球菌(Pediococcus pentosaceus)可减少成品中的大肠菌群数、生物胺和总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量。牦牛酸肉接种植物乳植杆菌(Lactiplantibacillus plantarum)M1和异常威克汉姆酵母(Wickerhamomyces anomalus)Y26可提高氨基酸含量,同时降低大肠菌群数、TVB-N含量和亚硝酸盐残留量[7]。上述研究结果均表明,人工接种发酵可提高酸肉的食用品质和安全性,而目前关于乳酸菌对耿马酸肉的食用品质和安全性的影响相关报道较少。因此,本研究选用从传统耿马酸肉中筛选出的3 株乳酸菌经复配后接种于耿马酸肉中进行发酵,并以自然发酵的耿马酸肉为对照,通过分析其理化指标、微生物和感官品质的变化,探究人工接种发酵对耿马酸肉品质和安全性的影响。
1 材料与方法
1.1 材料与试剂
猪瘦肉、猪皮、味精、食盐购于云南省昆明市朗悦湾尚购超市;糯米、新鲜柊叶购于耿马县农贸市场。本研究所采用的菌株(植物乳植杆菌GMSR-4、戊糖乳杆菌(Lactiplantibacillus pentosus)GMSR-20、植物乳植杆菌GMSR-35)由实验室前期从传统耿马酸肉中筛选所得。
8 种生物胺标准品(纯度≥98%) 南通飞宇生物科技有限公司;17 种游离氨基酸标准品(纯度≥99%) 美国Sigma-Aldrich公司;衍生试剂盒 美国沃特世科技有限公司;乙腈、甲醇、甲酸、磺基水杨酸、柠檬酸三钠(均为分析纯) 上海安谱实验科技股份有限公司;四硫磺酸钠亮绿培养基、亚硒酸盐胱氨酸增菌培养基、沙门氏菌显色培养基、赖氨酸脱酸酶肉汤培养基、李斯特氏菌显色培养基 青岛海博生物技术有限公司;结晶紫中性红胆盐琼脂培养基、煌绿乳糖胆盐肉汤培养基、MRS肉汤、MRS培养基、平板计数琼脂 广东环凯微生物科技有限公司。
1.2 仪器与设备
Vanquish超高压液相色谱仪、Q Exactive质谱仪
美国赛默飞世尔科技公司;5430R低温高速离心机
德国艾本德公司;Tissuelyser-48组织破碎仪 上海净信实业发展有限公司;LDZX-75KBS立式压力蒸汽灭菌器 上海博迅实业有限公司;SHP-350生化培养箱 北京中兴伟业仪器有限公司;Biochrom 30+氨基酸自动分析仪 英国柏楉有限公司;HD-3A智能水分活度测定仪 无锡市华科仪器仪表有限公司;U-2910紫外-可见分光光度计 日本日立公司;TA-2XJP细菌浊度计 北京天安联合科技有限公司。
1.3 方法
1.3.1 菌株的活化与制备
将3 株乳酸菌从-80 ℃冰箱取出,在无菌条件下,取200 μL菌液接入MRS肉汤中活化,连续培养3 代,将第3代菌液在4 ℃、10 000×g下离心15 min,沉淀物用无菌生理盐水洗涤3 次,再用无菌生理盐水和细菌浊度计将菌液的浓度调整为107 CFU/mL,备用[8]。
1.3.2 耿马酸肉的制作
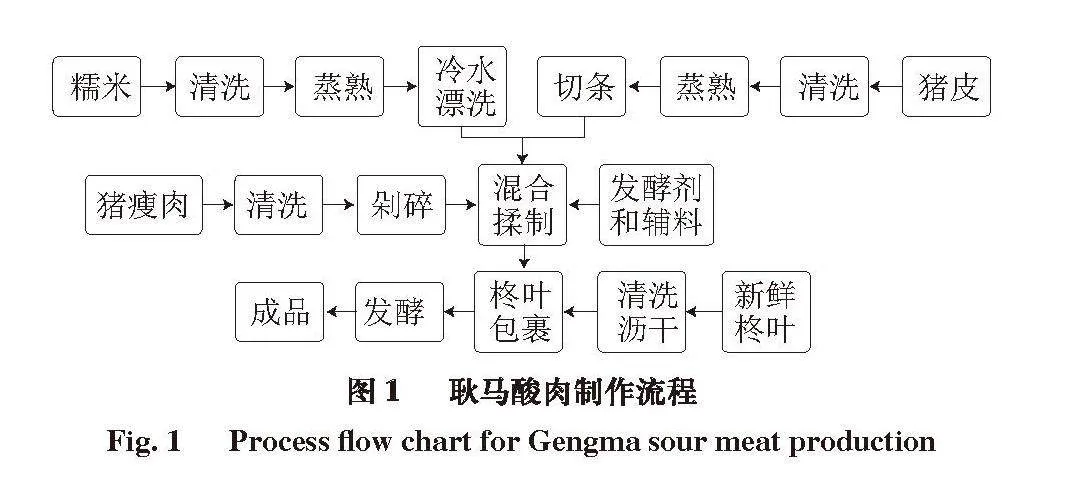
耿马酸肉基本配方:剁碎的猪瘦肉、熟猪皮条质量比7∶3,5%食盐、5%糯米饭、0.01%亚硝酸钠、0.05%味精,均以剁碎的猪瘦肉和熟猪皮条总质量计,新鲜柊叶若干,制作流程见图1。
1.3.3 耿马酸肉的分组与采样
实验分组:1)接种发酵(inoculation fermentation,IF)组:接种3% 107 CFU/mL的复配菌液(植物乳植杆菌GMSR-4、戊糖乳杆菌GMSR-20、植物乳植杆菌GMSR-35
菌液体积比1∶2∶2,该比例由前期实验筛选得出,在此比例下,耿马酸肉的品质和安全性最高);2)对照(control check,CK)组:不接种菌液。2 组均在25 ℃下发酵6 d。
样品采集:选取发酵结束后的耿马酸肉样品进行采样。感官评分和pH值在取样后1 h内测定;用于测定微生物的样品在无菌操作台上取样并置于-80 ℃贮藏,用于其他理化指标、游离氨基酸和生物胺含量测定的样品置于-20 ℃贮藏,备用,所有指标的样品重复数为4。
1.3.4 耿马酸肉理化指标测定
pH值:参照GB 5009.237—2016《食品pH值的测定》;水分含量:参照GB 5009.3—2016《食品中水分的测定》;亚硝酸盐残留量:参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》;TVB-N含量:参照GB 5009.228—2016《食品中挥发性盐基氮的测定》。
1.3.5 耿马酸肉中游离氨基酸含量测定
游离氨基酸:参考Zhong Aiai等[9]的方法,稍作修改。准确称取2.0 g耿马酸肉样品,加20 mL纯水均质后移至50 mL容量瓶,定容至刻度,混匀,4 ℃放置24 h。取20 mL上清液于100 mL离心管中,加入20 mL 5 g/100 mL磺基水杨酸溶液,混匀,4 ℃、6 000×g离心10 min,取20 mL上清液于旋转蒸发仪中蒸干,加入1 mL 0.2 mol/L柠檬酸钠缓冲液溶解后用0.45 μm滤膜过滤,滤液用氨基酸自动分析仪测定。
1.3.6 耿马酸肉中微生物测定
菌落总数:参照GB 4789.2—2022《食品微生物学检验 菌落总数测定》;乳酸菌:参照GB 4789.35—2023《食品微生物学检验 乳酸菌检验》;大肠菌群:参照GB 4789.3—2016《食品微生物学检验 大肠菌群计数》;沙门氏菌:参照GB 4789.4—2016《食品微生物学检验 沙门氏菌检验》;单核细胞增生李斯特氏菌(以下简称李斯特菌):参照GB 4789.30—2016《食品微生物学检验 单核细胞增生李斯特氏菌检验》;金黄色葡萄球菌:参照GB 4789.10—2016《食品微生物学检验 金黄色葡萄球菌检验》。
1.3.7 耿马酸肉中生物胺含量测定
参考Guba[10]、Armenta[11]等的方法,稍作修改。取0.1 g耿马酸肉于离心管中,加入0.5 mL 0.1 mol/L盐酸,涡旋混匀,室温提取1 h;在4 ℃、12 000 r/min下离心10 min,上清液稀释3 倍;取10 μL稀释液到2 mL EP管中,加入70 uL AccQ·Tag Ultra Borate缓冲液和20 μL AccQ·Tag试剂,混匀;将混合物于55 ℃金属加热器上加热10 min,冷却至室温,用超高压液相色谱仪进行检测。仪器参数:Water BEH C18色谱柱(50 mm×2.1 mm,1.7 μm),柱温55 ℃;进样量1 μL,流速0.5 mL/min,流动相A:超纯水(含0.1%甲酸);流动相B:乙腈(含0.1%甲酸)。洗脱程序:0 min,流动相A体积分数95%,0~5.5 min,流动相A体积分数由95%降至90%,5.5~7.5 min,流动相A体积分数由90%降至75%,7.5~8 min,流动相A体积分数由75%降至40%,8~8.5 min,流动相A体积分数由40%升至95%,8.5~9.5 min,流动相A体积分数95%。质谱条件:采用电喷雾离子源;鞘气压力40 arb;辅助气压力10 arb;离子喷雾电压3 000 V;温度350 ℃;离子传输管温度320 ℃;扫描模式为全扫描模式,扫描方式为正离子,扫描范围150~700 Da。
1.3.8 耿马酸肉感官评定
2 组样品用蒸汽锅蒸煮30 min,剥开柊叶切成薄片。评分人员由15 名食品专业在读硕士研究生组成,在进行感官评分时不得相互交谈,更换样品时用矿泉水漱口,满分为10 分,评定标准见表1。
1.4 数据处理
用SPSS 25.0进行方差分析和t检验,Origin 2021进行绘图,数据均以平均值±标准差的形式表示。
2 结果与讨论
2.1 人工接种发酵对耿马酸肉理化指标的影响
由表2可知,发酵结束时,CK组耿马酸肉的pH值显著高于IF组(P<0.05)。CK组中的微生物来源于原料和环境中,发酵较为缓慢,而IF组一开始就接种了大量的乳酸菌,乳酸菌利用碳水化合物快速产生有机酸,因此发酵快,pH值较低。Lü Jing等[12]在发酵的侗族酸肉中接种酿酒酵母(Saccharomyces cerevisiae)LXPSC1,导致pH值显著高于自然发酵,与本研究结果不一致,可能是与所接种的菌不同有关。IF组耿马酸肉的水分质量分数显著低于CK组(P<0.05),可能与IF组的pH值显著低于CK组有关。据报道,新鲜猪肉中的蛋白质结构由氢键、疏水相互作用、静电相互作用及二硫键组成,在发酵过程中,较低的pH值使这几种作用力对蛋白三维结构的贡献比例发生变化,从而改变蛋白质与水的结合能力[13],使耿马酸肉中的水分减少。小鼠实验表明,高剂量的亚硝酸盐可造成胎儿脑损伤、胎儿缺氧和流产等不可逆影响[14]。CK组和IF组耿马酸肉的亚硝酸盐残留量均低于GB 2760—2014《食品添加剂使用标准》中发酵肉制品最大残留量(30 mg/kg),CK组耿马酸肉的亚硝酸盐残留量是IF组的2.38 倍,表明接种乳酸菌可减少亚硝酸盐在耿马酸肉中的积累,这与Hu Xinyu等[15]在发酵泡菜中的研究结果一致。TVB-N含量是评价肉制品新鲜度的指标之一,TVB-N含量越高,表明动物性食品的腐败程度越高[16]。IF组耿马酸肉的TVB-N含量显著低于CK组(P<0.05),较低的pH值和水分含量可抑制腐败菌的生长,从而减少胺和氨类物质的生成量。
2.2 人工接种发酵对耿马酸肉游离氨基酸含量的影响
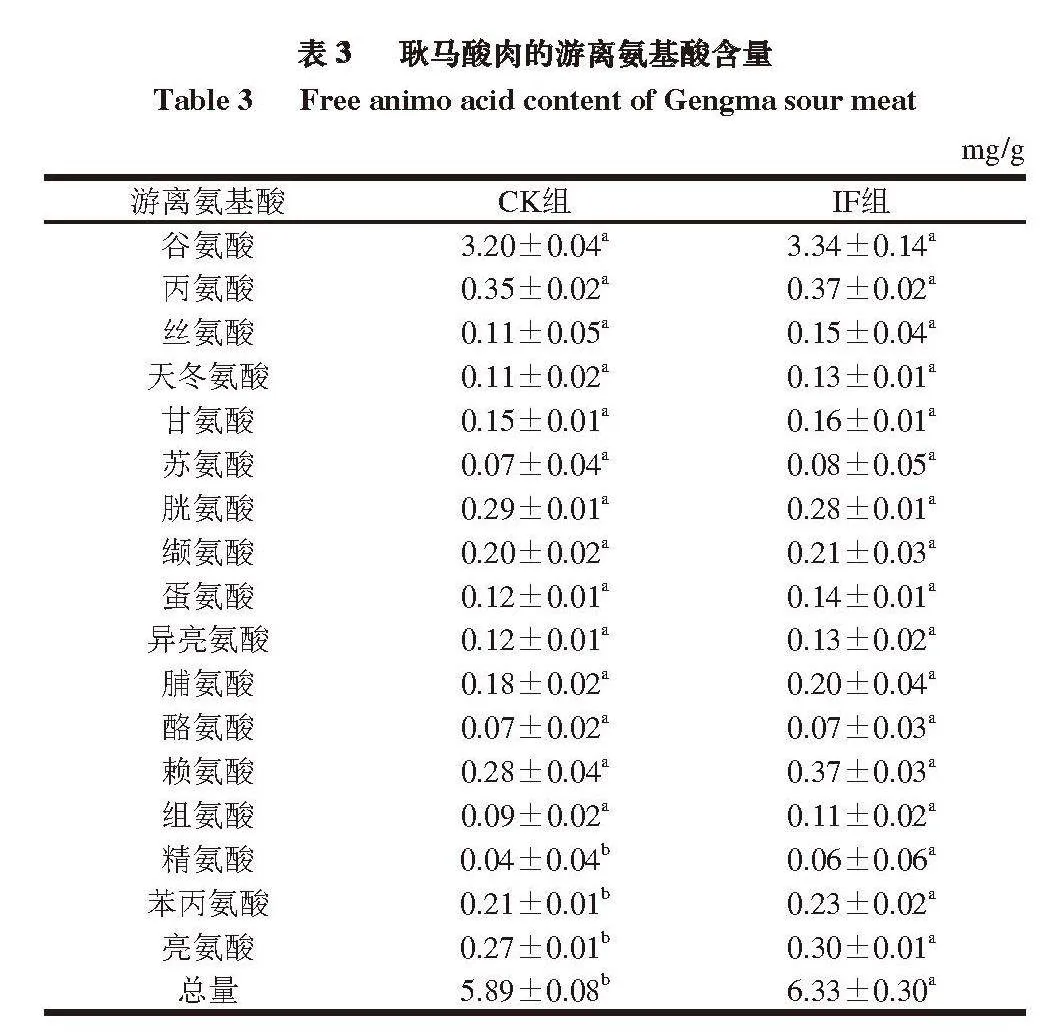
由表3可知,CK组和IF组耿马酸肉均检出17 种游离氨基酸,其中仅CK组中的精氨酸、苯丙氨酸、亮氨酸和游离氨基酸总量显著低于IF组(P<0.05),其余游离氨基酸含量差异不显著。2 组间大部分游离氨基酸含量差异不显著,可能是发酵时间较短(仅为6 d)所致。一般而言,发酵食品的发酵时间越长,产品中的游离氨基酸含量越高,如发酵300 d的三川火腿中的游离氨基酸含量远高于发酵0 d的样品[17]。
2.3 人工接种发酵对耿马酸肉中微生物的影响
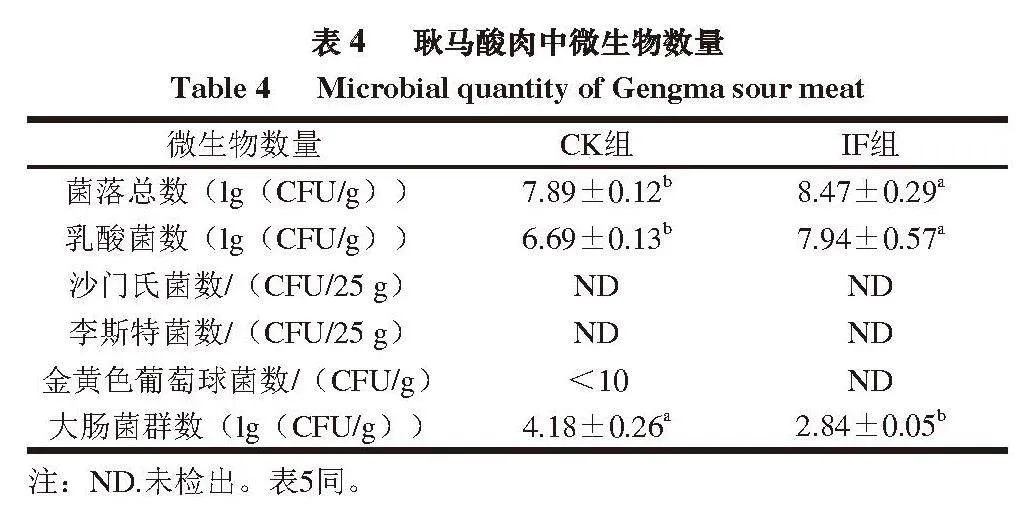
耿马酸肉富含营养物质,有利于微生物的生长繁殖,从而引发腐败,因此微生物指标是衡量耿马酸肉安全性的主要指标之一。由表4可知,CK组耿马酸肉的菌落总数和乳酸菌数显著低于IF组(P<0.05),与Hongthong等[18]接种植物乳杆菌发酵Isan(一种发酵香肠)的结果一致。CK组和IF组均未检测到沙门氏菌和李斯特菌;CK组中检出<10 CFU/g的金黄色葡萄球菌,IF组中未检测到。IF组的大肠菌群数显著低于CK组
(P<0.05),其中,CK组中大肠菌群数是IF组的
1.47 倍。其原因可能是:1)适当的水分含量和pH值是致病菌生长繁殖的重要条件,IF组的水分含量和pH值显著低于CK组(表2),而较低的水分含量和pH值不利于金黄色葡萄球菌和大肠菌群的增殖;2)IF组中的乳酸菌数显著高于CK组,乳酸菌对金黄色葡萄球菌和大肠菌群具有抑制作用。李廷任等[4]的实验结果表明,接种发酵可有效抑制酸肉中大肠菌群的数量。Tangwatcharin等[19]在接种植物乳杆菌发酵的Moo Som中也发现了类似的结果。
2.4 人工接种发酵对耿马酸肉生物胺含量的影响
由表5可知,CK组耿马酸肉可检出组胺、精胺、腐胺、尸胺、亚精胺、酪胺、苯乙胺、色胺8 种生物胺,IF组中可检出7 种生物胺,未检测到组胺。2 组间除精胺外,所有生物胺含量均具有显著差异(P<0.05)。据报道,精胺是发酵肉制品中天然存在的生物胺,其含量不会随环境的变化而变化[20]。CK组的生物胺总量显著高于IF组(P<0.05),大约是IF组的2.6 倍。其原因有二:一是CK组中的乳酸菌数显著低于IF组(P<0.05),乳酸菌产生的细菌素和有机酸可抑制产胺微生物的生长繁殖,从而抑制氨基酸脱羧酶的活性,使生物胺的生成量
减少[21];二是据报道,金黄色葡萄球菌和大肠菌群可产生多种生物胺[22-23],而CK组的大肠菌群数和金黄色葡萄球菌数显著高于IF组(P<0.05),表明接种发酵可以减少生物胺的积累,这与接种发酵可减少泰国发酵肉Moo Som[24]、Nham[25-26]等中生物胺积累的报道结果一致。
2.5 人工接种发酵对耿马酸肉感官品质的影响
由图2可知,IF组耿马酸肉的外观、组织形态、色泽、气味、口感、滋味和整体接受度评分均高于CK组。在接种解脂耶氏酵母(Yarrowia lipolytica)的侗族酸肉中也得出类似的结果,接种发酵的侗族酸肉色泽、组织形态、滋味和总体接受度等感官指标评分均高于自然发酵组[27]。
3 结 论
IF组耿马酸肉产品的pH值、水分含量、亚硝酸盐残留量和TVB-N含量均显著低于CK组(P<0.05);菌落总数和乳酸菌数显著高于CK组(P<0.05),大肠菌群数显著低于CK组(P<0.05),沙门氏菌和李斯特菌在IF组和CK组均未检测到;接种发酵对大多数游离氨基酸含量影响不显著(P<0.05),可明显减少生物胺的含量。综上,人工接种发酵可抑制致病菌的生长,减少生物胺的积累,提高耿马酸肉的食用品质和安全。
参考文献:
[1] SWETWIWATHANA A, VISESSANGUAN W. Potential of bacteriocin-producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J]. Meat Science, 2015, 109: 101-105. DOI:10.1016/j.meatsci.2015.05.030.
[2] SANTIYANONT P, CHANTARASAKHA K, TEPKASIKUL P, et al.
Dynamics of biogenic amines and bacterial communities in a Thai fermented pork product Nham[J]. Food Research International, 2019, 119: 110-118. DOI:10.1016/j.foodres.2019.01.060.
[3] LÜ J, LI C C, LI S J, et al. Effects of temperature on microbial succession and quality of sour meat during fermentation[J]. LWT-Food Science and Technology, 2019, 114: 108391-108398. DOI:10.1016/j.lwt.2019.108391.
[4] 李廷任, 赵金山, 臧金红, 等. 传统发酵与接种发酵酸肉安全品质特性的分析[J]. 食品工业科技, 2022, 43(15): 257-264. DOI:10.13386/j.issn1002-0306.2021100085.
[5] ZENG X, MENG J, ZHANG W, et al. Changes in the microbiological, physicochemical properties of Chinese traditional fermented Suan Rou at ripening fermentation[J]. Food Science & Nutrition, 2021, 9(11): 5899-5913. DOI:10.1002/fsn3.2095.
[6] ZHANG Y L, HU P, XIE Y Y, et al. Co-fermentation with Lactobacillus curvatus LAB26 and Pediococcus pentosaceus SWU73571 for improving quality and safety of sour meat[J]. Meat Science, 2020, 170: 108240-108248. DOI:10.1016/j.meatsci.2020.108240.
[7] 张雨薇. 牦牛酸肉发酵剂的开发及其对牦牛酸肉的品质影响[D]. 雅安: 四川农业大学, 2023. DOI:10.27345/d.cnki.gsnyu.2023.000929.
[8] SUN Y Y, XU Y S, GAO P, et al. Improvement of the quality stability of vacuum-packaged fermented fish (Suanyu) stored at room temperature by irradiation and thermal treatments[J]. International Journal of Food Science & Technology, 2021, 56(1): 224-232. DOI:10.1111/ijfs.14622.
[9] ZHONG A A, CHEN W, DUAN Y F, et al. The potential correlation between microbial communities and flavors in traditional fermented sour meat[J]. LWT-Food Science and Technology, 2021, 149: 111873-111887. DOI:10.1016/j.lwt.2021.111873.
[10] GUBA A, BÁBA O, TŐZSÉR J, et al. Fast and sensitive quantification of AccQ-tag derivatized amino acids and biogenic amines by UHPLC-UV analysis from complex biological samples[J]. Metabolites, 2022, 12(3): 272-287. DOI:10.3390/metabo12030272.
[11] ARMENTA J M, CORTES D F, PISCIOTTA J M, et al. Sensitive and rapid method for amino acid quantitation in malaria biological samples using AccQTag ultra performance liquid chromatography-electrospray ionization-MS/MS with multiple reaction monitoring[J]. Analytical Chemistry, 2010, 82(2): 548-558. DOI:10.1021/ac901790.
[12] LÜ J, LIN X P, LIU M Y, et al. Effect of Saccharomyces cerevisiae LXPSC1 on microorganisms and metabolites of sour meat during the fermentation[J]. Food Chemistry, 2023, 402: 134213. DOI:10.1016/j.foodchem.2022.134213.
[13] 常荣, 韦诚, 段珍珍, 等. 发酵对酸肉蛋白质结构的影响[J]. 食品科学, 2019, 40(12): 182-189. DOI:10.7506/spkx1002-6630-20180710-142.
[14] 孙靖驰. 亚硝酸钠暴露对大鼠子代神经系统的影响及PUFA ω-3保护作用[D]. 长沙: 中南大学, 2023. DOI:10.27661/d.cnki.gzhnu.2022.000240.
[15] HU X Y, WEI W, ZHANG J Y, et al. Nitrite self-degradation process in radish Paocai under the synergistic regulation of prokaryotic microorganisms[J]. Food Bioscience, 2024, 57: 103612. DOI:10.1016/j.fbio.2024.103612.
[16] LI Y H, GENG Y K, SHI D, et al. Impact of Coreopsis tinctoria Nutt. essential oil microcapsules on the formation of biogenic amines and quality of smoked horsemeat sausage during ripening[J]. Meat Science, 2023, 195: 109020. DOI:10.1016/j.meatsci.2022.109020.
[17] CHEN Z A, CHEN H, DU H, et al. Dynamic changes in physicochemical property, biogenic amines content and microbial diversity during the fermentation of Sanchuan ham[J]. Food Science and Human Wellness, 2024, 13(1): 506-516. DOI:10.26599/FSHW.2022.9250044.
[18] HONGTHONG N, CHUMNGOEN W, TAN F J. Influence of sucrose level and inoculation of Lactobacillus plantarum on the physicochemical, textural, microbiological, and sensory characteristics of Isan sausage (Thai fermented pork sausage)[J]. Animal Science Journal, 2020, 91(1): e13312-e13319. DOI:10.1111/asj.13312.
[19] TANGWATCHARIN P, NITHISANTAWAKHUP J, SORAPUKDEE S. Microbiological and physicochemical qualities of Moo Som (traditional Thai fermented meat) inoculated with lactic acid bacteria starter[J]. Walailak Journal of Science and Technology, 2020, 17(8): 788-800. DOI:10.48048/wjst.2020.5222.
[20] GAO X L, LI C, HE R H, et al. Research advances on biogenic amines in traditional fermented foods: emphasis on formation mechanism, detection and control methods[J]. Food Chemistry, 2022, 405: 134911. DOI:10.1016/j.foodchem.2022.134911.
[21] WITTANALAI S, TANRUEAN K, MAPOONG P. Inhibition of coliform bacteria by lactic acid bacteria isolated from Nham hed (fermented mushroom)[J]. Applied Mechanics and Materials, 2019, 886: 56-60. DOI:10.4028/www.scientific.net/AMM.886.56.
[22] KULEY F, RATHOD N B, KULEY E, et al. Inhibition of food-borne pathogen growth and biogenic amine synthesis by spice extracts[J]. Foods, 2024, 13(3): 364-375. DOI:10.3390/foods13030364.
[23] ÖZOGUL Y, ÖZOGUL F. Biogenic amines formation, toxicity, regulations in food[M]//SAAD B, TOFALO R. Biogenic amines in food: analysis, occurrence and toxicity. London: The Royal Society of Chemistry, 2019: 1-17. DOI:10.1039/9781788015813-00001.
[24] TANGWATCHARIN P, NITHISANTAWAKHUP J, SORAPUKDEE S.
Selection of indigenous starter culture for safety and its effect on reduction of biogenic amine content in Moo Som[J]. Asian-Australasian Journal of Animal Sciences, 2019, 32(10): 1580-1590. DOI:10.5713/ajas.18.0596.
[25] KANTACHOTE D, RATANABUREE A, SUKHOOM A, et al. Use of γ-aminobutyric acid producing lactic acid bacteria as starters to reduce biogenic amines and cholesterol in Thai fermented pork sausage (Nham) and their distribution during fermentation[J]. LWT-Food Science and Technology, 2016, 70: 171-177. DOI:10.1016/j.lwt.2016.02.041.
[26] TOSUKHOWONG A, VISESSANGUAN W, PUMPUANG L, et al. Biogenic amine formation in Nham, a Thai fermented sausage, and the reduction by commercial starter culture, Lactobacillus plantarum BCC 9546[J]. Food Chemistry, 2011, 129(3): 846-853. DOI:10.1016/j.foodchem.2011.05.033.
[27] GUO B R, WU Q, JIANG C C, et al. Inoculation of Yarrowia lipolytica promotes the growth of lactic acid bacteria, debaryomyces udenii and the formation of ethyl esters in sour meat[J]. Food Microbiology, 2024, 119: 104447. DOI:10.1016/j.fm.2023.104447.
收稿日期:2024-08-06
基金项目:云南农业大学科研发展基金项目(KX900127000)
第一作者简介:吴春霞(1998—)(ORCID: 0009-0009-3503-5725),女,硕士,研究方向为畜产品加工与质量控制。
E-mail: 3124346853@qq.com
*通信作者简介:陈韬(1963—)(ORCID: 0000-0002-2066-0001),男,教授,博士,研究方向为畜产品加工与质量控制。
E-mail: chentao63@163.com
