蛋白氧化对猪皮明胶乳化性能的影响
2024-11-05徐万军苟浩詹帅张雅琦包玉龙



摘 要:为研究氧化对猪皮明胶乳化性能的影响,将猪皮明胶与不同浓度(0、10、20、30 mmol/L)过氧化氢溶液孵育进行模拟氧化,并利用氧化处理后的明胶制备乳液。结果表明:随着过氧化氢浓度的增加,明胶乳化活性指数从未氧化组的21.1 m2/g增加到30 mmol/L过氧化氢组的34.3 m2/g,乳化稳定性指数随着过氧化氢浓度的增加而下降;此外,氧化程度的增加还导致明胶水接触角的增大,促进明胶在油-水界面的吸附,降低油-水界面的界面张力;氧化后乳液的Zeta电位值从未氧化组的9.61 mV下降到30 mmol/L过氧化氢组的5.94 mV,表明乳液液滴间静电斥力减小;激光扫描共聚焦显微镜观察表明,氧化明胶稳定的乳液液滴表现出较小的尺寸。综上,氧化处理增加了明胶的疏水性,促进了明胶在油-水界面的吸附,降低了油-水界面的界面张力,从而有利于形成较小的液滴尺寸,增强明胶的乳化活性。然而,乳液液滴间静电斥力的降低增加了油滴的絮凝和聚集,降低了乳化稳定性。
关键词:明胶;氧化;乳液;界面张力;乳化性能
Effect of Protein Oxidation on Emulsifying Properties of Porcine Skin Gelatin
XU Wanjun, GOU Hao, ZHAN Shuai, ZHANG Yaqi, BAO Yulong*
(School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China)
Abstract: In order to investigate the effect of oxidation on the emulsifying properties of porcine skin gelatin, porcine skin gelatin was incubated with different concentrations of hydrogen peroxide (0, 10, 20 and 30 mmol/L) for simulated oxidation, and an emulsion was prepared by using the oxidized gelatin. The results showed that with increasing hydrogen peroxide concentration up to 30 mmol/L, the emulsifying activity index (EAI) increased from an initial level of 21.1 m2/g (unoxidized) to 34.3 m2/g. The emulsion stability index (ESI) decreased with the increase in hydrogen peroxide concentration. In addition, increasing oxidation degree led to an increase in the water contact angle of gelatin, which promoted the adsorption of gelatin at the oil-water interface and reduced the interfacial tension at the oil-water interface. Compared with the unoxidized group, the zeta potential value decreased from 9.61 to 5.94 mV after oxidation with 30 mmol/L hydrogen peroxide, indicating that the electrostatic repulsion between emulsion droplets decreased. Confocal laser scanning microscope (CLSM) showed that the emulsion droplets stabilized by oxidized gelatin was smaller in size. In summary, the oxidation treatment increased the hydrophobicity of gelatin, promoted its adsorption at the oil-water interface, and reduced the interfacial tension at the oil-water interface, which was conducive to the formation of smaller droplet size and enhanced the emulsifying activity of gelatin. However, the decrease in electrostatic repulsion between emulsion droplets increased the flocculation and aggregation of oil droplets and weakened the emulsion stability.
Keywords: gelatin; oxidation; emulsion; interfacial tension; emulsifying properties
DOI:10.7506/rlyj1001-8123-20240713-182
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2024)11-0012-06
引文格式:
徐万军, 苟浩, 詹帅, 等. 蛋白氧化对猪皮明胶乳化性能的影响[J]. 肉类研究, 2024, 38(11): 12-17. DOI:10.7506/rlyj1001-8123-20240713-182. http://www.rlyj.net.cn
XU Wanjun, GOU Hao, ZHAN Shuai, et al. Effect of protein oxidation on emulsifying properties of porcine skin gelatin[J]. Meat Research, 2024, 38(11): 12-17. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240713-182. http://www.rlyj.net.cn
明胶因其出色的凝胶特性、乳化特性、发泡特性等在食品、医药等领域得到广泛应用[1-2]。众所周知,蛋白质的结构决定了其功能特性[3]。研究人员已经探索了各种方法来改善蛋白质的乳化性能,包括物理、化学和酶修饰等方法[4-6]。通过对明胶分子的修饰可以提高其乳化性能,并扩大其作为天然乳化剂的使用范围。据报道,蛋白质的乳化性能与其表面疏水性有很大的关系[7]。有研究用氧化亚油酸对墨鱼皮明胶进行改性,发现改性明胶表面疏水性的增加降低了油-水界面的界面张力,增强了改性明胶的乳化性能[8]。Feng Xin等[9]也利用微波技术提取明胶,发现随着微波提取温度的提高会导致其α亚基的降解和明胶三螺旋结构的减少,暴露出更多疏水基团,从而增加蛋白质向油-水界面的迁移并降低油-水界面的界面张力,提高其乳化性能。Yan Huimin等[10]将明胶分别与带正电荷的精氨酸和带负电荷的天冬氨酸混合形成络合物,以期与大豆油混合并产生稳定的水包油乳液。研究发现,精氨酸和天冬氨酸在明胶分子中可以充当氢键的供体和受体,增加其三螺旋结构的比例,从而在连续相中形成更加紧凑的网络结构,提高明胶乳液的稳定性。此外,明胶的乳化性能与乳液液滴的表面电荷也有关联。当界面蛋白分子带高电荷时,由于液滴之间的静电排斥,乳液的稳定性得到提高。相反,液滴之间静电斥力的下降容易发生絮凝[7]。Liu Huihua等[TASxQlHDlA0ih16LtT5uhw==11]通过调节溶液的pH值观察对明胶性能的影响。结果发现,适当的静电排斥可以促进蛋白质分子的去折叠,促进其向界面的迁移,从而提高乳化活性,然而乳液液滴间较弱的静电斥力也引起乳液稳定性的下降。
蛋白质在加工和贮藏过程中可能会发生氧化修饰,引起结构发生改变,从而影响蛋白质的功能特性[12]。Li Helin等[13]从米糠中提取不同酸败程度的米糠蛋白制备乳液。该研究发现,过度氧化降低了米糠蛋白的界面压力、扩散速率和界面膨胀模量,从而增加了米糠蛋白乳液的不稳定性。Chen Nannan等[14]研究氧化对大豆分离蛋白乳化性能的影响,认为氧化引起大豆分离蛋白结构的展开,暴露出更多的疏水基团并形成结构更加灵活的可溶性聚集体,这些可溶性聚集体很容易附着在界面上并形成更厚的吸附层,从而产生更好的乳化性能。目前,有关明胶氧化对其功能特性影响的研究较少。在之前的一项研究中,发现氧化导致明胶凝胶机械强度和持水能力下降。氧化诱导蛋白疏水性增加和净电荷减少,从而促进明胶分子之间的聚集,进一步限制了三螺旋结构的形成,导致松散的网络结构,最终削弱了凝胶强度和持水能力[15]。然而,乳化特性等其他功能特性也受到蛋白质氧化的影响。因此,本研究的目的是探究氧化对猪皮明胶乳化性能的影响,以期为明胶在乳液制备方面的应用提供参考。
1 材料与方法
1.1 材料与试剂
A型猪皮明胶(货号V900863)购自Sigma-Aldrich(上海)贸易有限公司。所有其他化学品均为分析级,购自国药集团化学试剂(上海)有限公司。
1.2 仪器与设备
UW220D电子天平 岛津仪器(苏州)有限公司;HH-6数显恒温水浴锅 金坛市金分仪器有限责任公司;
H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;TGL-16gR高速冷冻离心机 上海安亭科学仪器厂;Marvin激光粒度分析仪 英国Malvern集团;Unique-R10超纯水净化系统 厦门锐思捷水纯化技术有限公司;T10均质器 德国IKA集团;DSA100E液滴形状分析仪 德国Krüss公司;TCS SP6激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM) 德国Cambridge集团。
1.3 方法
1.3.1 明胶样品的制备
将明胶粉与去离子水混合后,在室温下静置30 min,然后放入60 ℃水浴锅中30 min并用玻璃棒搅拌以完全溶解明胶,制得100 mg/mL明胶溶液,室温冷却后用0.1 mol/L NaOH溶液调节pH值至7.0。将明胶溶液(100 mg/mL)与不同浓度的过氧化氢溶液(10、20、30 mmol/L)混合,使明胶最终质量浓度为70 mg/mL,对照组用蒸馏水替代过氧化氢溶液。为了充分氧化,将样品60 ℃水浴90 min,冷却至室温,并在4 ℃下保存24 h,然后测定相关指标。
1.3.2 乳化性能测定
参考Pan Jinfeng等[16]的方法。将1.3.1节制备的明胶溶液稀释至5 mg/mL,然后将8 mL明胶溶液与2 mL玉米油混合,使用均质器在14 000 r/min条件下将混合物均质化,在均质0 min和10 min后分别从试管底部取新鲜制备的乳液(30 μL),并与0.1 g/100 mL十二烷基硫酸钠溶液(3 mL)混合。随后,在500 nm波长处测定混合溶液的吸光度。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按式(1)、(2)计算:
(1)
(2)
式中:A0为均质0 min乳液制得混合溶液在500 nm处的吸光度;n为乳液稀释倍数;ρ为明胶质量浓度/(mg/mL);
φ为乳液中玉米油的体积分数(0.2);I为比色皿厚度(0.01 m);A10为均质10 min乳液制得混合溶液在500 nm处的吸光度;Δt为时间间隔(10 min)。
1.3.3 水接触角测定
在室温下,将1.3.1节制备的明胶溶液150 μL均匀涂抹在显微镜载玻片上,放置1 h后形成明胶膜。随后,用内径为1.823 mm的注射器针吸附一定体积的去离子水,然后将注射器固定,在明胶膜表面加入1 滴去离子水。明胶膜表面的水接触角采用液滴形状分析仪的无柄液滴法测量。用微量注射器将超纯167694b3d64aec5bc3b00e71a11788fc水(5 μL)滴入明胶膜表面,立即记录侧视图并计算水接触角。
1.3.4 明胶吸附率测定
参考Tian Yan等[17]的方法,并稍作改动。将1.3.2节新鲜制备的乳液在20 ℃下以12 000 r/min离心30 min后,将油滴和吸附在油滴上的蛋白质从水相中分离出来。随后,用注射器抽取离心管底部的溶液,并用0.22 μm滤膜过滤。明胶吸附率按式(3)计算:
(3)
式中:ρi为乳液中明胶初始质量浓度/(mg/mL);
ρf为乳液滤液中明胶质量浓度/(mg/mL)。
1.3.5 界面张力测定
使用液滴形状分析仪通过悬滴法测定明胶样品的界面张力[18]。使用内径为1.823 mm的注射器针头吸附一定体积的明胶溶液,然后将注射器针头插入含有玉米油的透明石英比色皿中,通过电动注射装置注入明胶溶液,在针尖形成液滴。通过液滴形状分析确定界面张力。
1.3.6 Zeta电位测定
从试管底部取新鲜制备的乳液30 μL,并与3 mL去离子水混合。乳液的Zeta电位由激光粒度分析仪测定。每个样品重复测定6 次。
1.3.7 乳液微观结构观察
将1 mL新鲜制备的乳液与40 μL荧光染料(0.11 g/L尼罗红和10 g/L尼罗蓝)混合,玉米油和明胶分别用尼罗红和尼罗蓝来标记。将混合物涡旋约30 s,并在黑暗条件下孵育5 min。荧光染料的溶剂为98% 1,2-丙二醇溶液。使用带有63×油物镜的CLSM观察样品。乳液样品分别在480 nm和633 nm处被激发,在600~660 nm(尼罗红)和660~700 nm(尼罗蓝)处被检测到。CLSM的扫描频率为100 Hz,扫描密度为1 024×1 024。玉米油和明胶的CLSM图像分别以绿色和红色呈现。
1.4 数据处理与分析
所有实验数据的统计分析均使用SPSS Statistics 17.0(SPSS Inc.,Chicago,IL,USA)进行,并且结果均以平均值±标准差表示。对数据进行单因素方差分析,采用最小显著性差异检验分析数据间的差异性,显著性水平为P<0.05。
2 结果与分析
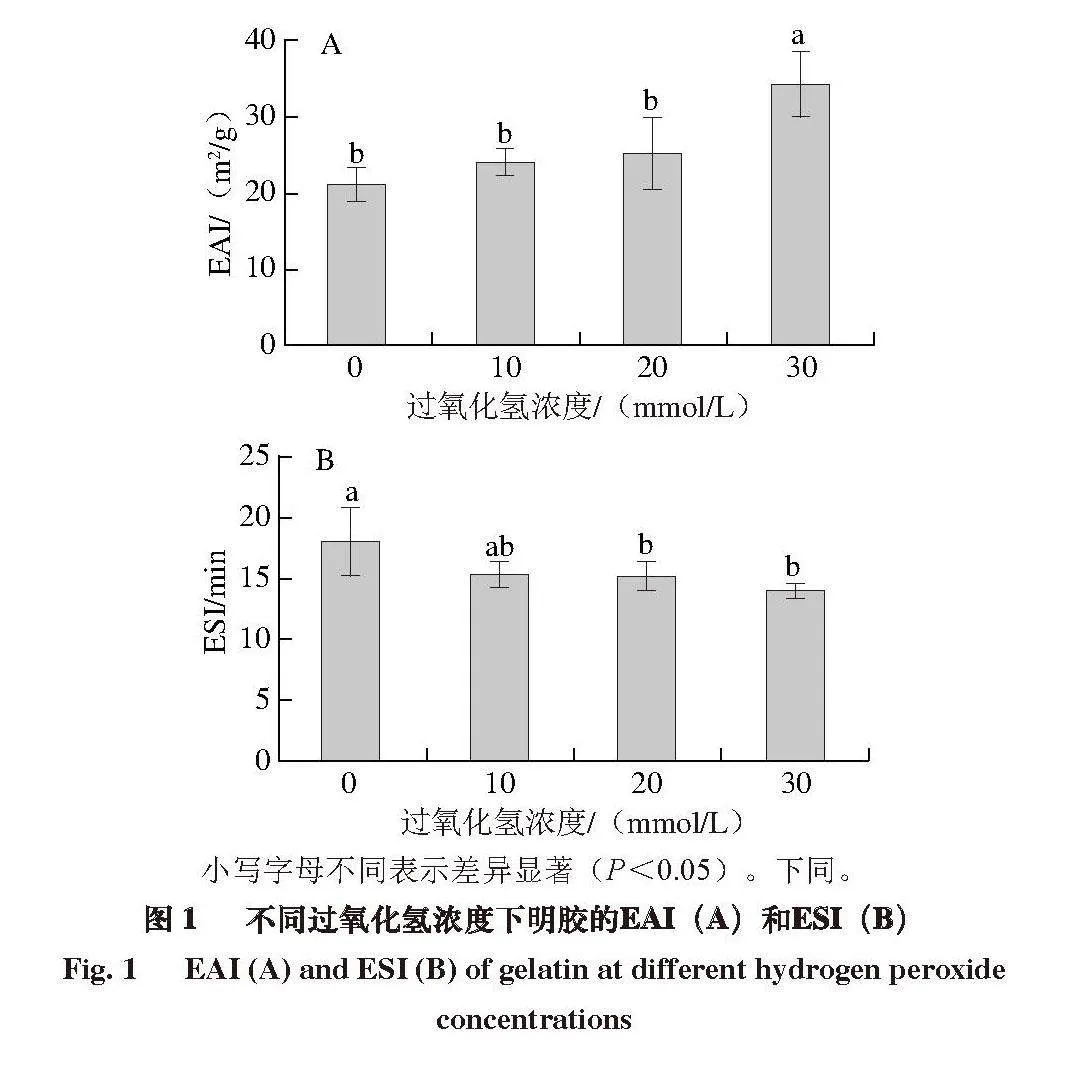
2.1 氧化对明胶乳化性能的影响
明胶的EAI反映蛋白质快速迁移到油-水界面并形成小液滴的能力[14]。如图1A所示,随着过氧化氢浓度的增加,明胶的EAI增加,从未氧化组的21.1 m2/g增加到30 mmol/L过氧化氢组的34.3 m2/g,增加50%左右。有研究[19]表明,肌原纤维蛋白被氧化后,其EAI也会提高。这与本研究中氧化明胶EAI的结果一致。氧化肌原纤维蛋白EAI的提高与氧化诱导蛋白质中更多的疏水基团暴露有关,蛋白质中疏水基团的暴露增强了蛋白质与油滴的相互作用,从而表现出更好的EAI。据报道,米糠酸败诱导米糠蛋白质发生适当氧化后,氧化修饰促进了蛋白质的部分展开,也增加了蛋白质中疏水基团的暴露,从而提高米糠蛋白的EAI[13]。一些研究还发现转谷氨酰胺酶修饰明胶后,转谷氨酰胺酶中ε-(γ-谷氨酰基)-赖氨酸异肽键的插入和ε-氨基的缺失可能会增加明胶的表面疏水性,从而提高明胶的乳化性能[20]。
小写字母不同表示差异显著(P<0.05)。下同。
明胶的ESI可以反映蛋白质吸附到油-水界面后稳定油滴的能力。如图1B所示,随着过氧化氢浓度的增加,明胶的ESI下降,未氧化组的ESI为18.7 min,30 mmol/L过氧化氢组为14.1 min,下降4.6 min。Tian Yang等[21]探究丙二醛的氧化修饰对蛋黄高密度脂蛋白的结构和乳化性能的影响,发现丙二醛会与蛋白质发生席夫碱反应后聚集并形成氧化聚集体,降低蛋白质分子的柔韧性和乳液界面的稳定性,最终导致蛋白质乳化能力下降。这与本研究中氧化明胶乳化稳定性的结果一致。Liu Huihua等[11]
研究不同pH值条件对明胶乳化性能的影响,认为油-水界面层明胶分子之间相互排斥作用随着pH值的增加而降低,油滴之间相互排斥作用的减少有利于它们的聚集,从而表现出较弱的乳化稳定性。
2.2 氧化对明胶水接触角的影响
水接触角可以反映明胶的表面两亲性[21]。如图2所示,随着过氧化氢浓度的增加,明胶水接触角增加,从未氧化组的117°增加到30 mmol/L过氧化氢组的121°。水接触角的增加可能归因于蛋白质疏水性的增强。Feng Xin等[22]支持这一观点,并表示利用喷雾干燥技术提取明胶后,明胶疏水性的增加提高了水接触角。这可能归因于喷雾干燥技术可以暴露出明胶中更多的疏水基团,从而表现出更好的疏水性能并改善明胶的两亲性,并且更有利于改善明胶的界面性能和乳化性能。Wang Jin等[23]将明胶和儿茶素混合制备纳米颗粒,发现蛋白质-多酚纳米颗粒的自组装过程中,明胶的疏水基团暴露于水相,因此蛋白质-多酚纳米颗粒表现出更高的疏水性能,从而牢固吸附在油-水界面上,提高乳液的稳定性。
A~D.过氧化氢浓度分别为0、10、20、30 mmol/L。
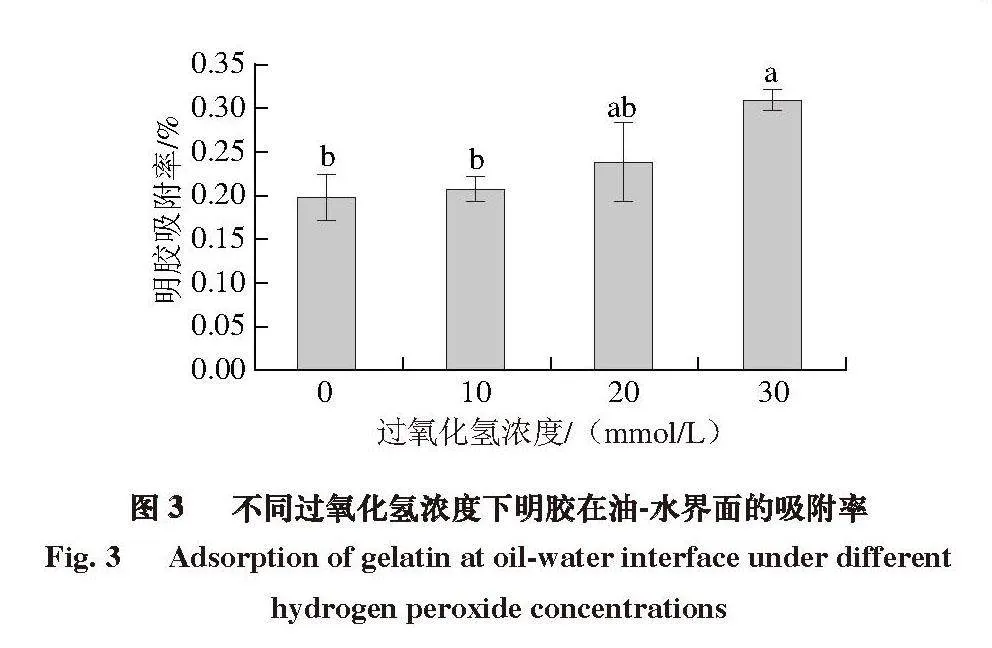
2.3 氧化对明胶在油-水界面处吸附率的影响
如图3所示,乳液中油-水界面的明胶吸附率随着过氧化氢浓度的增加而增加,从对照组的19.8%增加到30 mmol/L过氧化氢组的30.9%,增加1 倍左右,这表明更多氧化明胶分子吸附到油-水界面。Chen Jiahui等[24]对肌原纤维蛋白进行超声处理,发现超声处理改变了肌原纤维蛋白的结构,从而有利于形成尺寸更小、更灵活的聚集体,促进蛋白质在油-水界面的吸附,减少油-水界面的界面张力。在米糠蛋白的氧化中也观察到类似的现象[13]。氧化导致米糠蛋白中暴露出更多的疏水基团,促进了蛋白质在油-水界面的吸附,形成黏弹性膜,降低界面张力,使液滴分裂成更小的尺寸。相似地,Zou Heinan等[25]利用高强度超声处理减小了贻贝肌浆蛋白的尺寸并增强了其表面疏水性,从而增加了蛋白质在油-水界面的吸附。
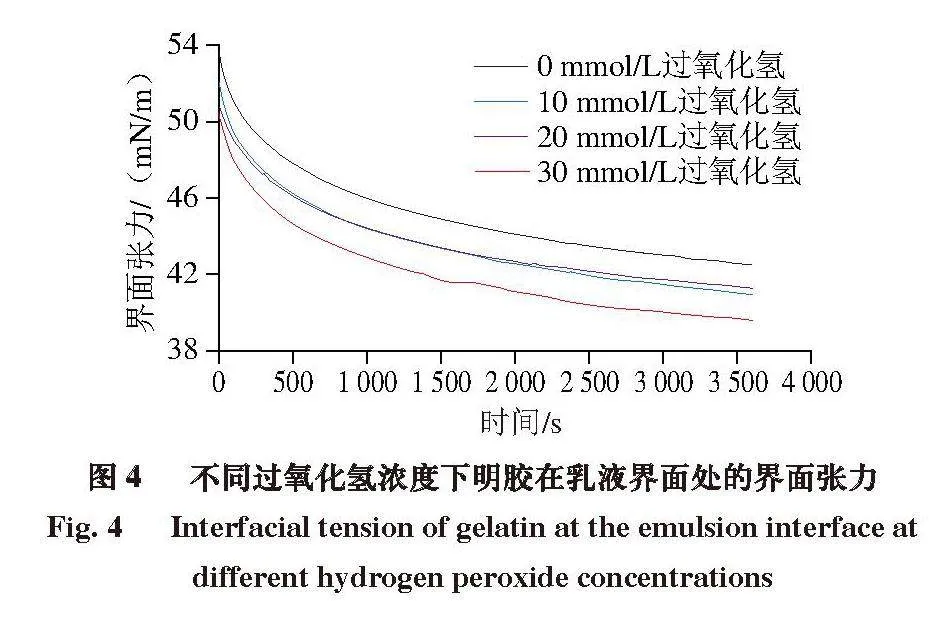
2.4 氧化对明胶乳液油-水界面处张力的影响
两亲性蛋白质促进蛋白质吸附到油-水界面并降低油相和水相之间的界面张力,从而形成稳定的界面层[26]。如图4所示,氧化组的明胶界面张力均低于对照组,这表明所有明胶样品均具有表面活性。明胶在油-水界面处的界面张力随着过氧化氢浓度的增加而降低。不同过氧化氢浓度下明胶的界面张力随时间的延长逐渐降低,从未氧化组的53.8 mN/m下降到30 mmol/L组的50.7 mN/m。界面张力随着吸附时间的延长而降低,下降速率逐渐减小,这反映了蛋白质在界面上的吸附和覆盖[17]。明胶界面张力的下降与其更好的两亲性有关[9]。因此,在本研究中氧化导致明胶水接触角的增加,提高了明胶的疏水性并改善了明胶的两亲性,增加了蛋白质向油-水界面的吸附,这可能引起油-水界面张力的下降。Feng Xin等[27]支持这一观点并报道,在猪皮明胶的提取过程中提高提取温度也会引起界面张力的降低,并认为随着提取温度的升高会破坏明胶原有的三螺旋结构,从而暴露出更多的疏水基团,这促使明胶分子能够更快地吸附到油-水界面上,从而更大程度地降低界面张力。
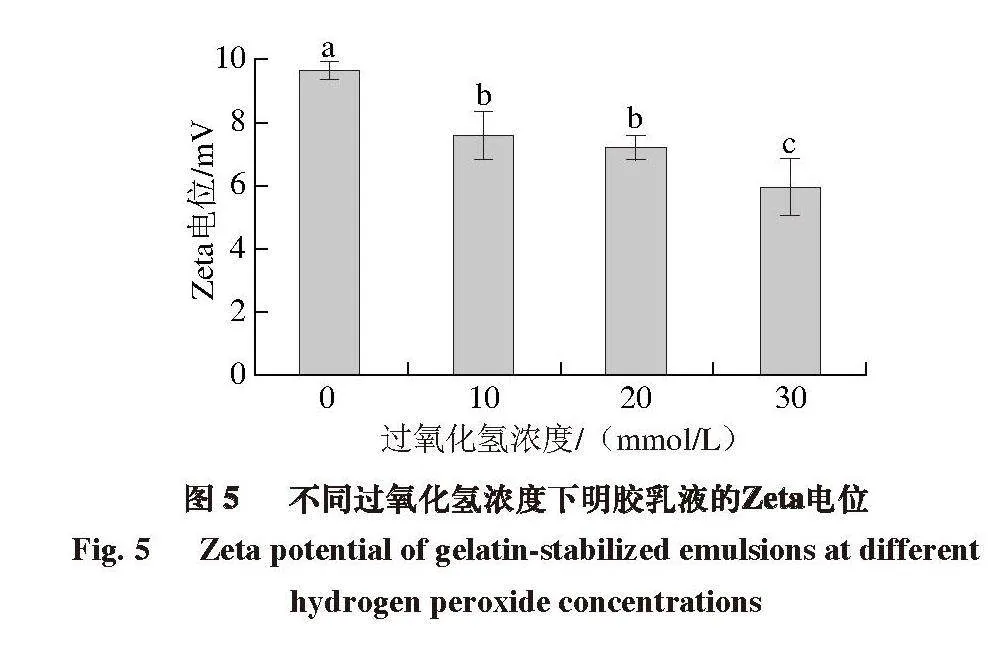
2.5 氧化对明胶乳液Zeta电位的影响
如图5所示,明胶乳液的Zeta电位随过氧化氢浓度的增加而降低,对照组为9.61 mV,随着过氧化氢浓度增加至30 mmol/L,Zeta电位降低至5.94 mV,降低40%。乳液液滴Zeta电位的降低也表现出液滴间较小的静电斥力。据报道,静电和空间稳定是蛋白质乳液液滴稳定的重要机制[28-29]。在本研究中,氧化明胶乳液ESI下降可能也与乳液液滴间静电斥力的下降有关。Yang Yaqin等[30]通过探究pH值对蛋黄、蛋白乳化能力的影响支持这一观点,发现当溶液的pH值接近蛋白质的等电点时,乳液液滴之间的静电斥力会降低,从而加剧油滴的聚集。然而,也有研究[31]表明,虎河豚皮明胶的乳化性能也容易受到pH值的影响。该研究发现,对于pH 6的虎河豚皮明胶,明胶分子之间强静电斥力可能会抑制蛋白质去折叠并阻碍蛋白质分子转移到界面上,从而导致虎河豚皮明胶的EAI较低。而当虎河豚皮明胶pH值为8时,明胶分子之间较弱的静电斥力可以促进蛋白质分子的去折叠并促进其向界面的迁移,从而提高EAI。此外,该研究表明,蛋白质分子间较强的静电斥力还会破坏界面膜的稳定性,导致ESI降低。
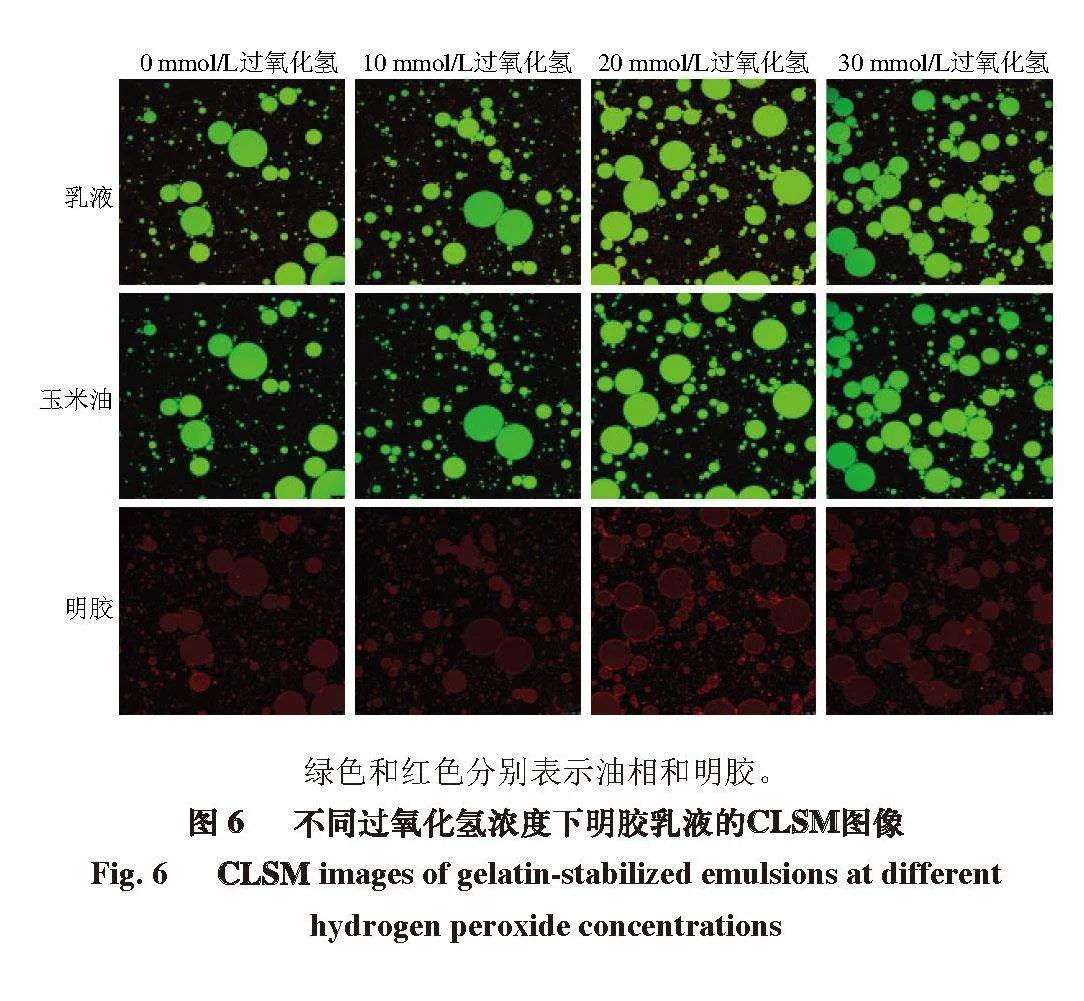
2.6 氧化对明胶乳液微观结构的影响
乳液通常是指将一相作为液滴分散在另一相中[32-33]。
如图6所示,随着过氧化氢浓度的增加,乳液的液滴尺寸减小,这可能与较少的蛋白质吸附到油-水界面层有关。据报道,EAI较高的蛋白质有利于吸附到油-水界面,减少油-水界面的界面张力并表现出更加小而密集的乳液液滴[34]。本研究中明胶吸附率及界面张力的测定结果可以支持氧化明胶更容易吸附到油-水界面这一观点。
绿色和红色分别表示油相和明胶。
3 结 论
探究不同浓度的过氧化氢(0、10、20、30 mmol/L)
模拟氧化对明胶乳化性能的影响。结果表明,猪皮明胶与不同浓度的过氧化氢混合后,随着过氧化氢浓度的增加,猪皮明胶的EAI增加,而ESI降低,从未氧化组的18.1 min下降到30 mmol/L过氧化氢组的14.1 min。氧化导致明胶的水接触角增加并且由氧化明胶稳定的乳液液滴间表现出更小的静电斥力。综上,氧化促进蛋白质在油-水
界面的吸附,降低油-水界面的界面张力,乳液的微观结构也表现出较小的液滴尺寸,从而反映出更好的乳化活性。然而,乳液液滴间静电斥力的降低增加了油滴的絮凝和聚集,也表现为明胶乳化稳定性的下降。因此,通过对上述研究结果的深入了解,可为明胶在食品加工中的改性应用及功能劣化的防控措施提供一定理论依据。
参考文献:
[1] 黄少林, 冯鑫, 缪晶, 等. 喷雾干燥入口温度对大目金枪鱼皮明胶乳化特性的影响[J]. 肉类研究, 2022, 36(6): 23-28. DOI:10.7506/rlyj1001-8123-20220308-013.
[2] ZHANG T, XU J M, ZHANG Y Y, et al. Gelatins as emulsifiers for oil-in-water emulsions: extraction, chemical composition, molecular structure, and molecular modification[J]. Trends in Food Science & Technology, 2020, 106: 113-131. DOI:10.1016/j.tifs.2020.10.005.
[3] 陈紫婷, 陈梦婷, 孙智达. 芬顿反应诱导的肉类蛋白质氧化及干预研究进展[J]. 肉类研究, 2023, 37(5): 72-80. DOI:10.7506/rlyj1001-8123-20230209-012.
[4] 韩柯颖, 杨玉玲. 高速剪切均质对鸡肉肌原纤维蛋白乳化特性和结构的影响[J]. 肉类研究, 2022, 36(12): 1-6. DOI:10.7506/rlyj1001-8123-20220829-101.
[5] 杨琳, 郑华, 江伟烽, 等. 鸡肉蛋白水解物Pickering乳液凝胶制备技术及特性分析[J]. 肉类研究, 2023, 37(7): 8-16. DOI:10.7506/rlyj1001-8123-20230517-043.
[6] LIMA R R, STEPHANI R, PERRONR I T, et al. Plant-based proteins: a review of factors modifying the protein structure and affecting emulsifying properties[J]. Food Chemistry Advances, 2023, 3: 100397. DOI:10.1016/j.focha.2023.100397.
[7] LAM R S H, NICKERSON M T. Food proteins: a review on their emulsifying properties using a structure-function approach[J]. Food Chemistry, 2013, 141(2): 975-984. DOI:10.1016/j.foodchem.2013.04.038.
[8] AEWSIRI T, BENJAKUL S, VISESSANGUAN W, et al. Surface activity and molecular characteristics of cuttlefish skin gelatin modified by oxidized linoleic acid[J]. International Journal of Biological Macromolecules, 2011, 48(4): 650-660. DOI:10.1016/j.ijbiomac.2011.02.006.
[9] FENG X, DAI H J, MA L, et al. Effect of microwave extraction temperature on the chemical structure and oil-water interface properties of fish skin gelatin[J]. Innovative Food Science & Emerging Technologies, 2021, 74: 102835. DOI:10.1016/j.ifset.2021.102835.
[10] YAN H M, SONG Y, YU M M, et al. Aspartic acid/arginine enhance the stability of gelatin emulsions[J]. Journal of Food Engineering, 2024, 361: 111735. DOI:10.1016/j.jfoodeng.2023.111735.
[11] LIU H H, WANG B, BARROW C J, et al. Relating the variation of secondary structure of gelatin at fish oil-water interface to adsorption kinetics, dynamic interfacial tension and emulsion stability[J]. Food Chemistry, 2014, 143: 484-491. DOI:10.1016/j.foodchem.2013.07.130.
[12] NAWAZ A, IRSHAD S, ALI KHAN I, et al. Protein oxidation in muscle-based products: effects on physicochemical properties, quality concerns, and challenges to food industry[J]. Food Research International, 2022, 157: 111322. DOI:10.1016/j.foodres.2022.111322.
[13] LI H L, LI F, WU X J, et al. Effect of rice bran rancidity on the emulsion stability of rice bran protein and structural characteristics of interface protein[J]. Food Hydrocolloids, 2021, 121: 107006. DOI:10.1016/j.foodhyd.2021.107006.
[14] CHEN N N, ZHAO M M, SUN W Z, et al. Effect of oxidation on the emulsifying properties of soy protein isolate[J]. Food Research International, 2013, 52(1): 26-32. DOI:10.1016/j.foodres.2013.02.028.
[15] XU W J, YU Q Q, ZHANG Y Q, et al. Insight into the mechanism of the decrease in mechanical strength and water-holding capacity of gels made from oxidized gelatin[J]. International Journal of Biological Macromolecules, 2024, 258(1): 128842. DOI:10.1016/j.ijbiomac.2023.128842.
[16] PAN J F, LI Q, JIA H, et al. Physiochemical and functional properties of tiger puffer (Takifugu rubripes) skin gelatin as affected by extraction conditions[J]. International Journal of Biological Macromolecules, 2018, 109: 1045-1053. DOI:10.1016/j.ijbiomac.2017.11.080.
[17] TIAN Y, ZHANG Z, ZHANG P P, et al. The role of conformational state of pH-shifted β-conglycinin on the oil/water interfacial properties and emulsifying capacities[J]. Food Hydrocolloids, 2020, 108: 105990. DOI:10.1016/j.foodhyd.2020.105990.
[18] AMINE C, DREHER J, HELGASON T, et al. Investigation of emulsifying properties and emulsion stability of plant and milk proteins using interfacial tension and interfacial elasticity[J]. Food Hydrocolloids, 2014, 39: 180-186. DOI:10.1016/j.foodhyd.2014.01.001.
[19] SUN W, ZHOU F, SUN D W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food and Bioprocess Technology, 2012, 6(7): 1703-1712. DOI:10.1007/s11947-012-0823-8.
[20] XU J M, YANG L L, NIE Y H, et al. Effect of transglutaminase crosslinking on the structural, physicochemical, functional, and emulsion stabilization properties of three types of gelatins[J]. LWT-Food Science and Technology, 2022, 163: 113543. DOI:10.1016/j.lwt.2022.113543.
[21] TIAN Y, LIN S Y, JIANG P F, et al. Oxidative modification of malondialdehyde influences the structure and emulsification properties of egg yolk high-density lipoprotein[J]. Food Bioscience, 2023, 52: 102444. DOI:10.1016/j.fbio.2023.102444.
[22] FENG X, DAI H, MA L, et al. Effect of drying methods on the solubility and amphiphilicity of room temperature soluble gelatin extracted by microwave-rapid freezing-thawing coupling[J]. Food Chemistry, 2021, 351: 129226. DOI:10.1016/j.foodchem.2021.129226.
[23] WANG J, ZHANG L L, TAN C, et al. Pickering emulsions by regulating the molecular interactions between gelatin and catechin for improving the interfacial and antioxidant properties[J]. Food Hydrocolloids, 2022, 126: 107425. DOI:10.1016/j.foodhyd.2021.107425.
[24] CHEN J H, ZHANG X, XUE S, et al. Effects of ultrasound frequency mode on myofibrillar protein structure and emulsifying properties[J]. International Journal of Biological Macromolecules, 2020, 163: 1768-1779. DOI:10.1016/j.ijbiomac.2020.09.114.
[25] ZOU H N, ZHAO N, SUN S, et al. High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oil-in-water emulsion[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020, 589: 124463. DOI:10.1016/j.colsurfa.2020.124463.
[26] JADHAV H B, CHOUDHARY P, GOGATE P, et al. Sonication as a potential tool in the formation of protein-based stable emulsion: concise review[J]. Ultrasonics Sonochemistry, 2024, 107: 106900. DOI:10.1016/j.ultsonch.2024.106900.
[27] FENG X, DAI H, ZHU J C, et al. Improved solubility and interface properties of pigskin gelatin by microwave irradiation[J]. International Journal of Biological Macromolecules, 2020, 171: 1-9. DOI:10.1016/j.ijbiomac.2020.12.215.
[28] SURH J, DECKER E, MCCLEMENTS D. Properties and stability of oil-in-water emulsions stabilized by fish gelatin[J]. Food Hydrocolloids, 2006, 20(5): 596-606. DOI:10.1016/j.foodhyd.2005.06.002.
[29] 李鹤林, 李芳, 吴晓娟, 等. 蛋白质氧化影响乳液稳定性研究进展[J]. 中国粮油学报, 2021, 36(6): 190-196.
[30] YANG Y Q, JIN H B, JIN Y G, et al. A new insight into the influence of pH on the adsorption at oil-water interface and emulsion stability of egg yolk protein[J]. International Journal of Biological Macromolecules, 2023, 246: 125711. DOI:10.1016/j.ijbiomac.2023.125711.
[31] WANG Y, JIA H, HAO R Y, et al. Gelling and emulsifying properties of tiger puffer (Takifugu rubripes) skin gelatin as manipulated by pH[J]. Journal of Molecular Liquids, 2023, 369: 120886. DOI:10.1016/j.molliq.2022.120886.
[32] LIN D, SUN L C, CHEN Y L, et al. Peptide/protein hydrolysate and their derivatives: their role as emulsifying agents for enhancement of physical and oxidative stability of emulsions[J]. Trends in Food Science & Technology, 2022, 129: 11-24. DOI:10.1016/j.tifs.2022.08.012.
[33] 肖志刚, 王可心, 王娜, 等. 谷物蛋白质乳液的研究进展[J]. 沈阳师范大学学报(自然科学版), 2021, 39(1): 64-68. DOI:10.3969/ j.issn.1673 5862.2021.
[34] CHEN L, CHEN J S, REN J Y, et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2600-2609. DOI:10.1021/jf103771x.
收稿日期:2024-07-13
基金项目:江苏省研究生科研与实践创新计划项目(SJCX23_2052)
第一作者简介:徐万军(1999—)(ORCID: 0000-0003-1619-9635),男,硕士研究生,研究方向为肉制品加工。
E-mail: xuwanjun1022@163.com
*通信作者简介:包玉龙(1988—)(ORCID: 0000-0003-2911-7483),男,教授,博士,研究方向为肉制品加工。
E-mail: yulong.bao@ujs.edu.cn
